Ифа тест-системы для дифтерия
Обновлено: 25.04.2024
ГлавнаяHelixbook После вакцинации или перенесенного COVID-19, тест Trimerics, нейтрализующие антитела к трем участкам (в том числе RBD) S-белка коронавируса, IgG, количественно
После вакцинации или перенесенного COVID‑19, тест Trimerics, нейтрализующие антитела к трем участкам (в том числе RBD) S‑белка коронавируса, IgG, количественно
Полностью автоматизированный высокоточный тест для количественного определения специфических антител IgG к тримерному спайковому (S) белку SARS-CoV-2 в сыворотке крови.
Тримерный S-белок SARS-CоV-2 является основной мишенью нейтрализующих антител и ключевой детерминантой в формировании защитного иммунитета. Образуется путем соединения трех идентичных цепей, каждая из которых состоит из двух субъединиц: S1 (включает RBD и NTD) и S2. Тримерный комплекс закреплен на внешней оболочке вируса, отвечает за связывание и слияние вируса с клеткой и играет основную роль в заражении.
Отличительной особенностью тест-системы является использование полноразмерного стабилизированного спайкового (S) белка в его тримерной форме (три идентичные цепи), которая идеально имитирует нативную (естественную) конформацию спайкового белка. Новый тест позволяет с высокой точностью выявлять весь спектр антител против спайкового белка как после вакцинации препаратами на основе S-белка, так и после перенесенной инфекции. При этом новый тест более точно, чем тесты предыдущего поколения, обнаруживает нейтрализующие антитела и позволяет исключить ложноотрицательные результаты.
Синонимы английские
SARS-CoV-2 IgG antibodies, quantitatively, Coronaviridae, Coronavirus.
Метод исследования
Диапазон измерения: 4,81 - 2080 BAU/мл.
Единицы измерения
BAU/мл (единиц, связывающих антител, на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Коронавирусная инфекция COVID-19 – это инфекционное заболевание, вызывается новым штаммом вируса SARS-CoV-2, который был выявлен в декабре 2019 года.
COVID-19 распространяется между людьми воздушно-капельным путем при прямом контакте или по воздуху на расстоянии около полутора метров друг от друга. После инфицирования симптомы COVID-19 могут появиться в течение двух недель, в основном это лихорадка, кашель, одышка. Среди других симптомов отмечают насморк, потерю обоняния, головную боль, слабость, диарею и тошноту. Считается, что пожилые люди, беременные женщины, люди с хроническими заболеваниями, курильщики находятся в группе повышенного риска.
Также встречается бессимптомное носительство вируса, носителями чаще всего становятся дети и молодые взрослые. Они могут передавать вирус другим людям при контакте, при этом у них самих не развиваются симптомы заболевания.
Анализ крови на антитела IgG к вирусу SARS-CoV-2 – исследование, которое помогает проверить наличие антител IgG в крови к возбудителю новой коронавирусной инфекции COVID-19.
Инфекционный процесс сопровождается выработкой антител двух типов: IgM и IgG. IgM-антитела производятся первыми, их уровень быстро нарастает в начале инфекции, достигая максимума в острый период болезни, а затем постепенно снижается, полностью исчезая к моменту выздоровления.
Иммуноглобулины класса G (IgG) начинают появляться в крови примерно через 3-4 недели после инфицирования и могут сохраняться длительное время. Выявление IgG-антител к возбудителю COVID-19 свидетельствует, что человек выздоравливает или уже переболел коронавирусной инфекцией. Качественное исследование отображает наличие или отсутствие антител в крови, но не определяет их количество. Для этого и выполняют количественный тест на IgG, который показывает концентрацию антител, что позволяет определить стадию инфекционного процесса и дает возможность рассчитать напряженность иммунитета, то есть уровень невосприимчивости к данной инфекции.
Данное исследование - инновационный тест следующего поколения для количественного определения специфических антител IgG к тримерному спайковому (S) белку SARS-CoV-2. Анализ предназначен для определения уровня антител IgG к тримерному белку возбудителя COVID-19 после перенесенной инфекции или вакцинации препаратами на основе S-белка. По сравнению с тестами, выявляющими антитела к отдельным участкам S-белка вируса SARS-CoV-2, позволяет с более высокой точностью обнаружить полный спектр антител к спайковому S-белку, в том числе нейтрализующие антитела.
Для чего используется исследование?
- Для выявления переболевших коронавирусной инфекцией COVID-19.
- Для оценки эффективности вакцинации, а также напряженности и длительности иммунитета к COVID-19 после вакцинации.
Когда назначается исследование?
- При диагностике недавно перенесенной коронавирусной инфекции, в том числе бессимптомного течения заболевания.
- При дифференциальной диагностике заболеваний, схожих с течением коронавирусной инфекции COVID-19.
- При оценке антител в динамике.
Что означают результаты?
Компонент
Референсные значения
Концентрация в единицах измерения ВОЗ (Всемирной организации здравоохранения)
Положительный результат не всегда указывает на предыдущее инфицирование SARS-CoV-2. При оценке необходимости второго, но отличного серологического тестирования для подтверждения иммунного ответа нужно учитывать другую информацию, включая анамнез и местную распространенность заболевания.
Результаты, полученные с помощью данного тестирования, должны интерпретироваться только в сочетании с клиническими данными и результатами других лабораторных тестирований и оценок. Это особенно важно в тех случаях, если человек недавно подвергался воздействию COVID-19 или клинические проявления указывают на вероятность инфицирования COVID-19, а результаты диагностических тестирований других причин заболевания (например, других респираторных заболеваний) отрицательны. В таком случае существует необходимость проведения прямого тестирования на вирус SARS-CoV-2 (например, ПЦР-тестирование).
Важные замечания
-
Связь между наличием IgG в крови и формированием стойкого иммунитета к коронавирусной инфекции COVID-19 до сих пор достоверно не установлена.
В настоящее время обнаружение антител IgG против SARS-CoV-2 не гарантирует долгосрочного иммунитета к вирусу или защиты от повторного заражения вирусом.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Дифтерия: причины, симптомы, диагностика и способы лечения.
Дифтерия – одна из самых грозных инфекций, представляющая высокий риск для жизни пациента. Не случайно первая Нобелевская премия по физиологии и медицине была присуждена в 1901 г. Э.А. Берингу за разработку лечебной сыворотки против этого заболевания.
Несмотря на то, что многие считают дифтерию исключительно детской болезнью, она встречается и у взрослых.
Источником инфекции является больной или бактерионоситель, возбудитель передается воздушно-капельным, контактно-бытовым и пищевым путями.
Дифтерия – бактериальная инфекция, возбудителем которой является Corynebacterium diphtheriae (дифтерийная палочка, или бацилла Леффлера).
Этот микроорганизм обладает высокой устойчивостью к воздействию факторов окружающей среды. Это необходимо знать и учитывать при проведении дезинфекции в очаге распространения.
Отрицательное воздействие на С. diphtheriae оказывают прямые солнечные лучи, высокая температура и некоторые химические вещества (дезинфектанты).
Распространение токсина по организму приводит к поражению органов и систем, среди которых наиболее часто страдают сердце, надпочечники, почки и нервные волокна.
Характерным признаком болезни является образование плотных серовато-белых фибриновых пленок на слизистых ротоглотки. Дифтерийный налет покрывает миндалины, а также глотку и гортань, что вызывает сужение их просвета и нарушает прохождение воздуха в нижележащие дыхательные пути. Закупорка дыхательных путей пленкой и отек могут привести к развитию крупа, особенно у детей раннего возраста.
Классификация форм заболевания
Проявления заболевания могут быть связаны с местом проникновения бактерий в организм: дифтерия ротоглотки, гортани, носа, глаз, половых органов, ран и т. д. В зависимости от распространенности поражения выделяют локализованную, распространенную, комбинированную, а также токсическую формы болезни. Токсическая форма протекает тяжелее остальных и характеризуется поражением внутренних органов.
Дифтерия различается по степени тяжести: легкая, среднетяжелая и тяжелая, которая, в свою очередь, также подразделяется на три степени. Для этого заболевания, особенно при тяжелом течеении, характерно развитие осложнений, присоединение вторичной инфекции, а также обострение хронических заболеваний.
Симптомы дифтерии
Наиболее часто встречается дифтерия ротоглотки и гортани. Большинство форм дифтерии сопровождаются лихорадкой (повышением температуры тела с ознобом), отеком и некрозом слизистой оболочки миндалин, увеличением лимфоузлов.
Дифтерия ротоглотки отличается появлением на небных миндалинах пленок беловато-серого цвета, которые могут распространяться на нёбные дужки, язычок, нёбо.
Ощущается болезненность во время глотания. При попытке снять пленки обнажается кровоточащая слизистая. Для дифтерии ротоглотки, особенно у непривитых пациентов, характерно развитие осложнений.
В отличие от дифтерии ротоглотки, при дифтерии гортани (истинном крупе) токсическое поражение внутренних органов нетипично. Опасность в данном случае представляют легко отслаивающиеся от слизистой фибриновые пленки, которые приводят к сужению дыхательных путей вплоть до полной их закупорки и развития асфиксии (удушья).
Необходимо различать истинный круп при дифтерии и ложный круп при острой респираторной вирусной инфекции.
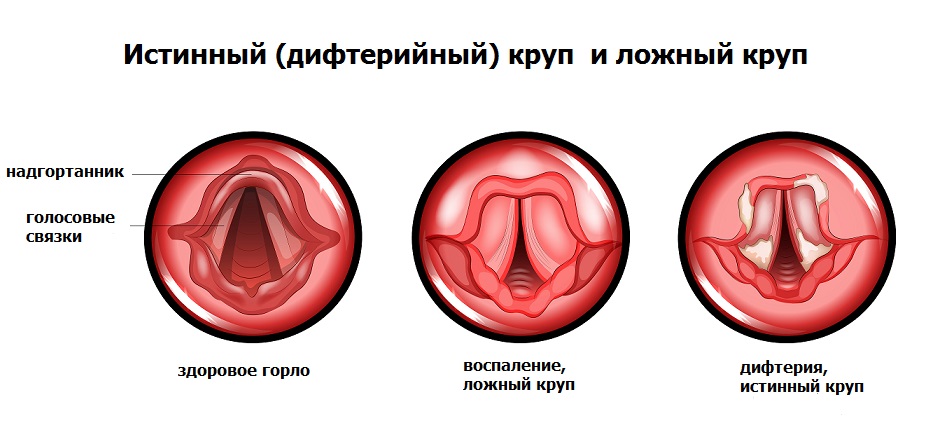
Для истинного крупа характерно постепенное ухудшение состояния больного, появление лающего кашля с изменением голоса иногда до полной афонии. Приступы ложного крупа можно облегчить ингаляциями с глюкокортикостероидными препаратами, что, к сожалению, не действенно при дифтерийном крупе.
Диагностика
Диагностика дифтерии начинается со сбора жалоб, истории заболевания, клинического осмотра пациента.
Врачу важно знать, есть ли у ребенка прививки от дифтерии, а также есть ли в его окружении больные с подозрением на дифтерию.
Основным методом лабораторной диагностики дифтерии является бактериологическое исследование (посев) мазка из зева.
Подтверждение диагноза дифтерии. Дифтерия вызывается Corynebacterium diphtheridae. Это грамположительная, аэробная неподвижная бактерия. У непривитых детей и взрослых возникает сильная интоксикация организма, воспаление горла и дыхательных путей. Возможны тяжёлые осложнения: отёк горла, нар.
Дифтерия - острое инфекционное заболевание, для которого характерно тяжелое течение. Некоторые случаи завершаются летальным исходом. Болеют дифтерией и взрослые, и дети. Вызывает заболевание микроб Corynebacterium diphtheriae, который продуцирует токсин, повреждающий клетки тканей человека. Токсин в значительной степени определяет характер заболевания. Болезнь передается от человека к человеку воздушно-капельным путем. Циркуляция микроба возрастает или, напротив, уменьшается в зависимости от восприимчивости людей к возбудителю. В свою очередь, восприимчивость или невосприимчивость зависит от того, были ли люди привиты специальной вакциной или нет, есть ли у них в крови специфические антитоксические антитела. Поэтому главным методом борьбы с дифтерией является иммунизация детей, а при необходимости и взрослых.
Помимо иммунопрофилактики (вакцинации) для предупреждения распространения заболеваемости дифтерией важными мерами являются своевременная диагностика заболевания, изоляция больных и бактерионосителей. У привитых лиц дифтерия может протекать в легкой форме или вообще скрыто, в виде бактерионосительства, без явных признаков заболевания. Такие лица, не будучи своевременно изолированными, могут стать распространителями болезни. Вот почему после длительного отсутствия в коллективе или при приеме в детский коллектив, а также при выписке из больницы и детей, и взрослых проверяют на бактерионосительство. Берут пробы из носа и зева и исследуют их на наличие токсигенных бактерий. Такой анализ довольно продолжителен: ориентировочный ответ - через 24 часа, окончательный - через 48 часов и более. Это несколько снижает его ценность, особенно в тех случаях, когда речь идет о диагностике заболевания, когда нельзя медлить с началом специфического лечения с введением антитоксической сыворотки, чтобы предотвратить тяжелые последствия.
Вот почему в лаборатории клеточных гибридов НИИ вакцинаций и сывороток имени И.И. Мечникова РАМН (заведующий В.В. Свиридов) был разработан и апробирован на практике экспресс-метод выявления токсичных микробов. Суть его состоит в том, что взятые из зева и носа пробы помещают в жидкую питательную среду и культивируют в течение 6-8 часов. Затем жидкость исследуют на наличие дифтерийного токсина методом иммуноферментного анализа (ИФА). Такой способ высокочувствителен (выявляется 4 нанограмм токсина в 1 мл и более), специфичен, прост, демонстративен и быстр - ответ о наличии токсичного дифтерийного микроба дается через 17-20 часов. В лаборатории получены моноклональные антитела к той части токсина, которая ответственна за связь с клетками тканей и последующее его токсическое действие. Для постановки ИФА используют специальные планшеты с лунками, к поверхности которых прочно прикреплены данные антитела. В эти лунки вносят испытуемые пробы, и если в пробе есть токсин, он прочно связывается с антителами на поверхности планшета. Далее присутствие токсина выявляется с помощью специфических реагентов, дающих цветную реакцию. Интенсивность окраски меняется в зависимости от количества токсина, связавшегося с антителами. Это позволяет давать ответ не только о наличии токсигенных штаммов, но и о степени их токсичности.
Для клиники и эпидемиологической практики важно не только быстро поставить диагноз заболевания. Также важно иметь возможность количественно оценить напряженность иммунитета у отдельного человека или у больших коллективов. В первом случае это позволяет прогнозировать тяжесть течения и исход заболевания, во втором - оценить эффективность вакцинации и определить степень защищенности населения от заболевания. Наиболее распространенным методом является реакция пассивной агглютинации (РПГА). Этот метод основан на том, что в реакции используют эритроциты, на поверхности которых прикреплен анатоксин. При смешивании взвеси таких эритроцитов с испытуемой сывороткой и последующей инкубации на поверхности лунки образуется осадок эритроцитов в виде зонтика, если антитела есть, если же нет - эритроциты оседают в виде точечного плотного осадка. Для постановки такой реакции не требуется сложного оборудования и реактивов, она доступна любой лаборатории. Однако установлено, что эта реакция малочувствительна и часто дает ложно-отрицательные результаты.
Более точные данные о содержании антитоксических антител получают при постановке реакции нейтрализации токсина антителами. Она может быть поставлена на животных (этот метод используется в настоящее время для стандартизации диагностических и лечебных антитоксических сывороток, но он малопригоден для испытания сывороток, полученных от человека) или в культуре прививаемых клеток. К дифтерийному токсину чувствительны многие культуры клеток: Vero - культура клеток обезьян, СНО - культура клеток яичников хомяка и др. Клетки выращивают в специальных средах в планшетах, наблюдают за их состоянием и ростом под микроскопом. Оказалось, что под действием токсина они умирают, и степень поражения пласта клеток зависит от количества внесенного токсина. Оценить действие токсина можно под микроскопом визуально или используя специальные красители, окрашивающие только живые клетки, и судить по интенсивности окраски: интенсивность окраски убывает при увеличении дозы токсина, то есть при увеличении его повреждающего действия. Если в пробе содержится достаточно много защитных антитоксических антител, то клетки оказываются полностью защищенными и не умирают, так как антитела полностью блокируют, нейтрализуют токсин. При меньших дозах антител возможно частичное разрушение пласта клеток. При использовании серии разведений сыворотки можно найти то разведение, которое и обеспечивает полную защиту, то есть титр токсин-нейтрализующих антител.
И зарубежный, и наш опыт показал, что преимущества способа использования культур клеток для определения активности токсина и для постановки реакции нейтрализации в том, что он более прост, стандартен и позволяет давать более точную количественную оценку. Однако и этот метод имеет существенный недостаток, так как может быть использован только в специальных лабораториях, имеющих соответствующее оборудование для работы с живыми клетками. Вот почему возник вопрос о разработке такого метода оценки, который был бы доступен большинству практических лабораторий. Такой метод был разработан в нашей лаборатории. В лаборатории получены моноклональные антитела к той части дифтерийного токсина, который определяет его связь с клеткой. Полистироловый планшет, покрытый такими антителами (они прочно связаны с поверхностью лунок), будет так же связывать токсин из испытуемой пробы, как и клетка. Поэтому можно измерить количество связывающегося токсина, как при простом титровании токсина, так и при постановке реакции нейтрализации. В этих случаях количество связавшегося токсина определяется с помощью реактивов, дающих цветную реакцию, и может быть измерено.
Для оценки эффективности вакцинации и для прогнозирования течения болезни очень важно исследовать напряженность иммунитета. По данным ВОЗ, разное содержание антитоксических антител обеспечивает разный уровень защищенности человека: меньше 0,01 ME/ мл - человек восприимчив к дифтерии; 0,01 МЕ/мл - минимальная степень защищенности; 0,01-0,09 МЕ/мл - некоторая степень защиты; 0,1 МЕ/мл - защитный уровень антител; более 1,0 МЕ/мл - стойкая, длительная невосприимчивость к дифтерии.
В сравнительных исследованиях при постановке реакции нейтрализации в культуре клеток или при постановке ИФА с использованием моноклональных антител к токсину нами было показано, что имеется полная корреляция находимых уровней антител в обоих случаях. Этот метод прост, доступен любой лаборатории, точен и позволяет быстро (за 5-6 часов) получить результат.
Нина ТИТОВА, ведущий научный сотрудник лаборатории клеточных гибридов НИИ вакцин и сывороток им. И.И. Мечникова РАМН
Регистрационное удостоверение № РЗН 2019/8718 от 06 августа 2019 года.
Назначение
Потенциальными потребителями набора реагентов являются специалисты учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (центры гигиены и эпидемиологии в субъектах Российской Федерации, противочумные учреждения, научные организации, санитарно-эпидемиологические службы министерств и ведомств), а также специалисты медицинских учреждений, имеющие специальность врача клинической лабораторной диагностики или биолога согласно требованиям Приказов Минздравсоцразвития №415н от 7.07.2009 г. и №541н от 23.07.2010 г.
Состав набора
Набор рассчитан на исследование 93 образцов сывороток крови в варианте скрининга, включая контроли (табл. № 1).
Таблица № 1. Состав набора.
| Наименование реагента | Описание | Количество в наборе |
|---|---|---|
| Сыворотка крови, содержащая IgG-антитела к коксиеллам Бернета (К+) | Прозрачная жидкость красного цвета | 1,2 мл – 1 пр. |
| Сыворотка крови, не содержащая IgG-антитела к коксиеллам Бернета (К–) | Прозрачная жидкость зелёного цвета | 1,2 мл – 1 пр. |
| Концентрат моноклональных антител к IgG человека, меченных пероксидазой хрена (концентрат конъюгата) | Прозрачная жидкость синего цвета | 0,6 мл – 1 пр. |
| Фосфатно-солевой буферный раствор с твином (ФСРТ, концентрат) | Прозрачная бесцветная жидкость | 20 мл – 1 фл. |
| Цитратный буферный раствор с перекисью водорода (ЦБП) | Прозрачная бесцветная жидкость | 10 мл – 1 фл. |
| Раствор для разведения конъюгата (РРК) | Прозрачная бесцветная жидкость | 11 мл – 1 фл. |
| Раствор для разведения исследуемых проб (РИП) | Прозрачная жидкость сине-фиолетового цвета | 10 мл – 2 фл. |
| Раствор тетраметилбензидина (ТМБ) | Прозрачная жидкость слегка голубоватого цвета | 2,5 мл – 1 фл. |
| Раствор серной кислоты (Стоп-реагент) | Прозрачная бесцветная жидкость | 5 мл – 1 фл. |
| Иммуносорбент | 96-луночный планшет, цельный или разборный с прозрачными лунками, с иммобилизованными антигенами коксиелл Бернета | 1 шт. |
| Хлорид натрия | Кристаллы белого цвета | 10 г – 1 уп. |
Анализируемые образцы
Исследуемые образцы сыворотки крови хранят при температуре от 2 до 8 ºС не более 3 суток от момента взятия крови. Допускается хранение сыворотки в замороженном состоянии при температуре не выше минус 18 ºС не более 1 года. Перед использованием образцы размораживают при температуре от 16 до 25 ºС и перемешивают встряхиванием. Образцы проб сывороток, содержащие агрегаты и осадок, необходимо осветлять центрифугированием 10 мин. при 6000 об./мин.
Не допускается использование исследуемого материала, прошедшего термообработку, консервированного азидом натрия, с выраженным гемолизом, гиперлипидемией и бактериальным проростом ввиду возможной интерференции гемоглобина, липидов и бактериальных продуктов с коксиеллезными антителами, что может привести к ложноположительным результатам. Обязательным условием является разбавление анализируемой сыворотки перед использованием в 400 раз, что гарантирует нивелирование действия возможных интерферентов, присутствующих в следовых количествах.
Повторное замораживание сыворотки не допускается.
Проведение анализа
Подготовка сывороток
Провести предварительное разведение (1:20), смешав 5 мкл исследуемой сыворотки с 95 мкл РИП (разведение – 1:20). Для этого используют дополнительный 96-луночный планшет. В случае необходимости титрования сывороток разводить их раствором РИП с шагом 2. Разведённые сыворотки хранению не подлежат.
Подготовка раствора ФСРТ
Для получения рабочего раствора ФСРТ содержимое флакона с концентратом ФСРТ перенести в мерную колбу ёмкостью 500 мл и довести объём до метки дистиллированной водой. Перелить содержимое колбы в стакан, добавить содержимое пакета с хлоридом натрия и перемешивать до полного растворения последнего. Полученный раствор следует хранить не более 5 суток при температуре от 16 до 25 ºС и не более 30 суток при температуре от 2 до 8 ºС.
Подготовка раствора конъюгата
Концентрат конъюгата развести на растворе РРК 1:20. Необходимый объём раствора конъюгата определяется числом используемых стрипов (см. табл. № 2). Полученный раствор следует хранить не более 4 ч при температуре 4 — 6 °С.
Подготовка субстратного раствора
В зависимости от количества используемых стрипов готовят необходимый объем субстратного раствора путем смешивания соответствующих объемов реагента ТМБ и ЦБП перед проведением ферментативной реакции. Полученный субстратный раствор должен оставаться бесцветным или слегка голубоватым. Необходимый объём раствора субстрата определяется числом используемых стрипов (табл. № 2). Полученный субстратный раствор хранению не подлежит.
Таблица № 2. Расход компонентов тест-системы.
| Количество стрипов | Концентрат конъюгата (мл) | РРК (мл) | ТМБ (мл) | ЦБП (мл) |
|---|---|---|---|---|
| 1 | 0,05 | 0,95 | 0,05 | 0,95 |
| 2 | 0,10 | 1,90 | 0,10 | 1,90 |
| 3 | 0,13 | 2,47 | 0,13 | 2,47 |
| 4 | 0,17 | 3,23 | 0,17 | 3,23 |
| 5 | 0,21 | 3,99 | 0,21 | 3,99 |
| 6 | 0,25 | 4,75 | 0,25 | 4,75 |
| 7 | 0,29 | 5,51 | 0,29 | 5,51 |
| 8 | 0,33 | 6,27 | 0,33 | 6,27 |
| 9 | 0,37 | 7,03 | 0,37 | 7,03 |
| 10 | 0,44 | 8,37 | 0,44 | 8,37 |
| 11 | 0,46 | 8,74 | 0,46 | 8,74 |
| 12 | 0,50 | 9,50 | 0,50 | 9,50 |
Проведение иммуноферментного анализа
Регидратация сорбированного Ку-антигена. Перед использованием иммуносорбент промыть раствором ФСРТ: в лунки внести по 250 мкл раствора ФСРТ и выдержать в течение 5 мин. при температуре 20 ± 2 °С. Затем раствор из лунок удалить с помощью автоматического промывателя (вошера) или вытряхнуть.
Одну из лунок (А1) оставить незаполненной в качестве контроля субстрата, другую (В1) оставить незаполненной для контроля конъюгата, в две лунки (А2 и В2) внести по 100 мкл раствора К+, в две другие (А3 и В3) – по 100 мкл раствора К–. В остальные лунки внести по 95 мкл раствора ФСРТ и по 5 мкл предварительно разведённой в РИП в 20 раз исследуемой сыворотки. Таким образом, исследуемая сыворотка в лунке разбавляется, в конечном счёте, в 400 раз. Планшет закрыть крышкой и выдержать во влажной камере при температуре 37 ± 1 °С в течение 1 ч. После инкубации содержимое лунок удалить автоматическим отсасывателем в сосуд, заполненный до половины 6 % раствором перекиси водорода, затем лунки промыть, внося в каждую не менее 250 мкл раствора ФСРТ и удаляя раствор автоматическим отсасывателем. Промывать 3 раза. После последней промывки удалить остаточную влагу постукиванием перевернутым планшетом по фильтровальной бумаге.
Связывание конъюгата. Во все лунки, за исключением А1, внести по 100 мкл рабочего раствора конъюгата. Планшет закрыть крышкой или поместить во влажный полиэтиленовый пакет и инкубировать при температуре 37 ± 1 °С в течение 1 ч во влажной камере. Затем содержимое лунок удалить автоматическим отсасывателем и промыть 5 раз.
Проведение ферментативной реакции. Перед проведением ферментативной реакции планшет промыть дистиллированной водой для удаления остатков ФСРТ. Для этого во все лунки внести по 250 мкл дистиллированной воды и выдержать 5 мин. при температуре 20 ± 2 °С, затем воду удалить автоматическим отсасывателем. Во все лунки планшета внести по 100 мкл субстратного раствора. Планшет поместить в защищенное от света место и выдержать 20 ± 2 мин. при 15 – 25 °С.
Остановка ферментативной реакции. Во все лунки внести по 50 мкл Стоп-реагента.
Учет и интерпретация результатов
Оценка результатов производится следующим образом. Если отношение среднего значения ОП (ОПср) исследуемой сыворотки к ОПср К– ≥ 3, и при этом ОПср исследуемой сыворотки имеет значение выше 0,50 о.е., то этот результат следует оценивать как положительный, и сыворотка содержит антитела класса IgG к антигену коксиелл Бернета. Если отношение ОПср исследуемой сыворотки к ОПср К– меньше 3 или ОПср исследуемой сыворотки ≤ 0,50 о.е., то этот результат следует оценивать как отрицательный, и сыворотка не содержит антител класса IgG к антигену коксиелл Бернета.
Положительный результат ИФА, то есть выявление антител к C . burnetii , может свидетельствовать как о текущем заболевании Ку-лихорадкой, так и об инфицированности (или иммунизации) C . burnetii в прошлом.
Для дифференциации положительных результатов ИФА анамнестического характера от текущего заболевания следует сравнить титры сывороточных антител к коксиеллезным антигенам в динамике болезни с интервалом 10 – 12 дней в ранний период её клинических проявлений.
Титром антител считают наибольшее разведение сыворотки, при котором результаты ИФА оцениваются как положительные. Нарастание титров в 4 и более раз подтверждает наличие текущей коксиеллёзной инфекции. В случае отсутствия возможности исследования парных сывороток, обнаружение коксиеллёзных антител при значительных разведениях сыворотки (1:3200 и выше) может свидетельствовать в пользу недавно перенесённой Ку-лихорадки.
Для постановки окончательного диагноза Ку-лихорадки необходим комплекс серологических, клинических и эпидемиологических данных.
Условия хранения и эксплуатации
Хранение
Набор ИФА-анти-Ку-G следует хранить в упаковке предприятия-изготовителя при температуре от 2 до 8 °С в течение всего срока годности. Допускается кратковременное (до 10 суток) хранение и транспортирование набора реагентов при температуре до 25 °С.
В случае дробного использования (независимо от кратности) после вскрытия первичной упаковки компоненты набора необходимо хранить следующим образом:
При необходимости возможно использование компонентов ЦБП, ТМБ, РРК, РИП, Стоп-реагент из других серий набора реагентов.
Срок годности набора реагентов
Гарантийный срок годности составляет 6 месяцев с даты утверждения ОБТК и указан на этикетке набора реагентов. По истечению срока годности набор реагентов использованию не подлежит.

Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на высокоспецифической иммунологической реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. В результате реакции фермента с хромогенным субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Любой вариант ИФА содержит 3 обязательные стадии:
- Стадия узнавания исследуемого соединения специфическим антителом;
- Стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
- Стадия превращения ферментной метки в регистрируемый сигнал.
В реакции участвуют:
- Твердая фаза;
- АГ и АТ;
- Конъюгат (антиген или антитело, меченые ферментом);
- Ферментный маркер;
- Субстрат;
- Стоп-реагент (чаще всего применяют серную кислоту).
Твердая фаза
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Антигены и антитела
АГ и AT, используемые в ИФА, должны быть высокоочищенными и высокоактивными. АГ должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант.
Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые АТ могут быть поли- или моноклональными, различного класса (IgG или IgM) и подкласса (IgG1, IgG2).
Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации АГ (AT) в образцах.
Ферментные маркеры: наибольшее применение нашли пероксидаза хрена (ПХ), щелочная фосфатаза (ЩФ) и β-D-галактозидаза.
Субстраты
- Для ПХ в качестве субстрата используют 3,3’,5,5’-тетраметилбензидин (ТМБ хромоген). Происходит цветная реакция, интенсивность которой зависит от количества связанного определяемого вещества;
- Для ЩФ субстратом является 4-нитрофенилфосфат;
- β-D-галактозидаза катализирует гидролиз лактозы с образованием глюкозы и галактозы.
Классификация ИФА
В основу классификации методов ИФА положено несколько подходов:
1 — по типу реагентов, присутствующих на первой стадии ИФА:
- В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментом и конкурирующий за центры специфического связывания с ним;
- Для неконкурентных методов характерно присутствие на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2 — по принципу определения исследуемого вещества:
- Прямое определение концентрации вещества (АГ или АТ). Используют антитела к исследуемому веществу, соединенные со специфической меткой. В этом случае метка будет находиться в образовавшемся специфическом комплексе АГ-АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу;
- Непрямое определение концентрации вещества – по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
3 — по типу результатов:
Конкурентный ИФА
- На твердой фазе иммобилизованы специфические моноклональные антитела;
- В лунки панелей вносят в известной концентрации антиген, меченный ферментом, и исследуемый образец. Параллельно в соседних лунках ставят положительный и отрицательный контроли. Для построения калибровки используют стандартный немеченый антиген в различных разведениях. Проводят инкубацию и отмывку;
- Добавляют субстрат, инкубируют, останавливают реакцию при развитии оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества обратно пропорциональна оптической плотности.
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Основным достоинством метода является высокая чувствительность, превосходящая возможности других схем ИФА.
- На твердой фазе иммобилизованы моноклональные антитела или аффинно-очищенные поликлональные антитела;
- В лунки панелей вносят исследуемый образец, параллельно ставят положительный контрольный образец и отрицательный контрольный образец в различных разведениях. Инкубируют и отмывают;
- В лунки вносят меченные ферментом моноклональные или поликлональные антитела —конъюгат. После инкубации проводят отмывку для удаления несвязавшихся антител;
- Вносят субстрат, инкубируют. Реакцию останавливают при достижении оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества прямо пропорциональна оптической плотности.
Для полуколичественного варианта проведения методики рассчитывают отношение между средней оптической плотностью образца и оптической плотностью Cut-off.
Образцы рассматриваются как:
- положительные, если отношение более 1,1;
- сомнительные, если отношение 0,9–1,1;
- отрицательные, если отношение менее 0,9.
Сомнительные результаты анализа нельзя однозначно интерпретировать и для уточнения результата необходимо повторить обследование через 1–2 недели.
Читайте также:

