Ифа тест-системы на туляремию
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Антитела к ВИЧ-1/2 и антиген ВИЧ-1/2 (HIV Ag/Ab Combo): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
ВИЧ-инфекция - инфекционная болезнь, развивающаяся в результате многолетнего персистирования (постоянного пребывания) в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее - ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (далее - СПИД).
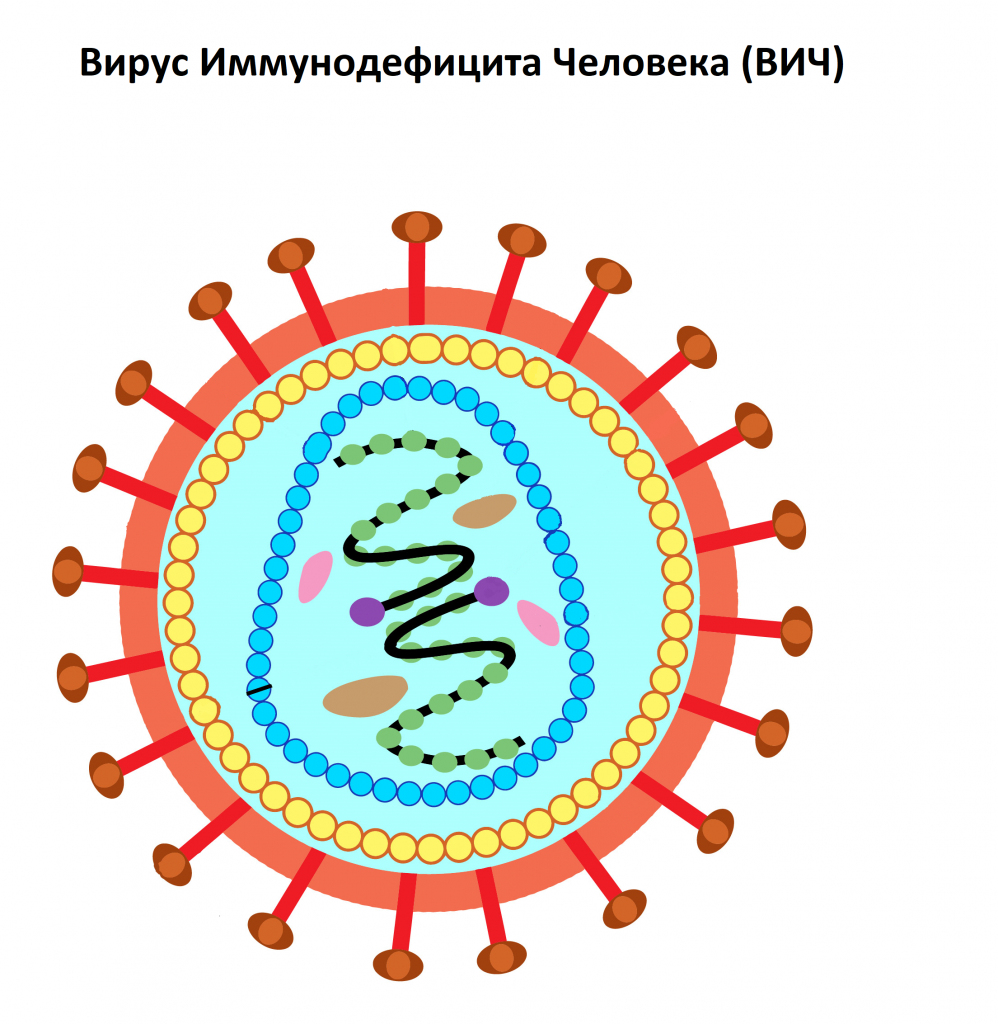
ВИЧ (Вирус Иммунодефицита Человека) – вирус, относящийся к семейству ретровирусов (семейство РНК-содержащих вирусов, заражающих преимущественно позвоночных), который поражает клетки иммунной системы человека. Через несколько недель с момента заражения начинают вырабатываться антитела к ВИЧ.
Показания на проведение исследования
Показаниями для назначения анализа является подготовка к госпитализации и плановому оперативному вмешательству. В профилактических целях следует провести исследование при подозрении на заражение при половом контакте. В первую очередь это касается лиц групп риска: употребляющих наркотики, вводимые внутривенно, часто меняющих половых партнеров и не использующих средств защиты.
Вирус иммунодефицита человека размножается в организме человека достаточно медленно, и количественный результат в отношении антигенов и антител к вирусу можно получить, как правило, не ранее чем через 3-6 недель после инфицирования. При этом клинические симптомы заболевания еще отсутствуют.
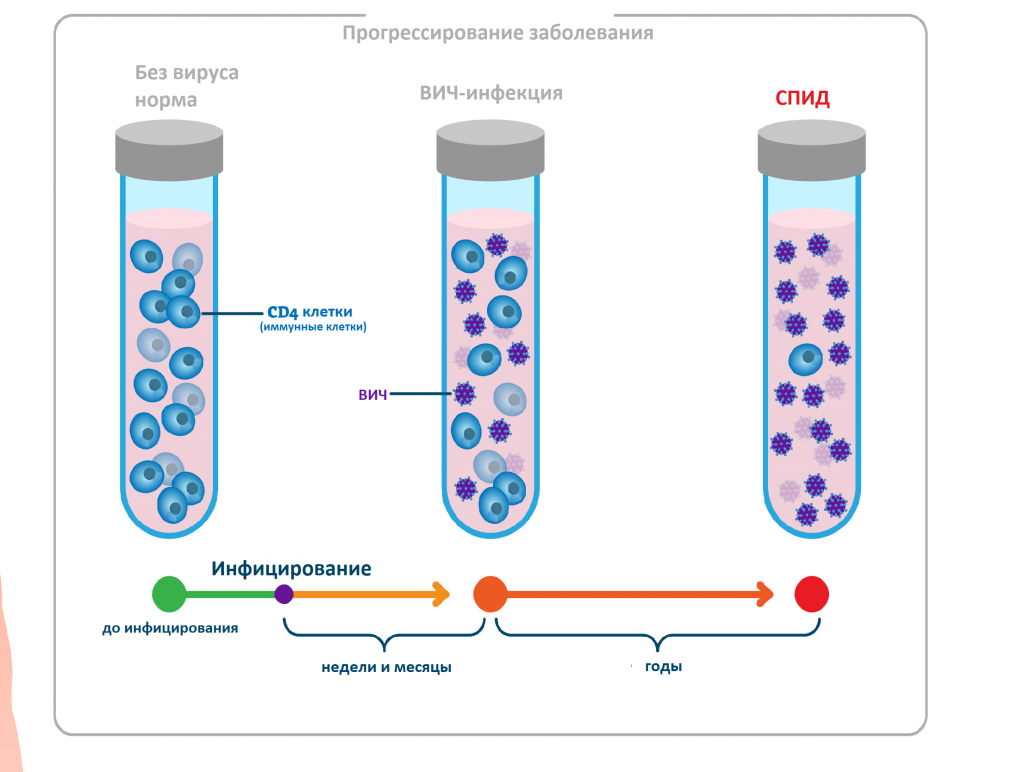
Через три месяца антигены ВИЧ и антитела к вирусу определяются практически у всех заболевших. Благодаря появлению новых комбинированных тест-систем четвертого поколения получение точного результата качественного анализа на ВИЧ-инфекцию возможно уже через две недели с момента попадания вируса в организм. При этом исследовании выявляют антиген р24 ВИЧ – белок вирусного капсида (внешней оболочки вируса).
Анализ на антитела к ВИЧ 1/2 и антиген ВИЧ 1/2 назначают на этапе планирования и при ведении беременности, когда возможна передача вируса плоду. Анализ проводят и после родов, поскольку ребенок ВИЧ-положительной матери может быть инфицирован во время прохождения через родовые пути и при кормлении грудью.

Лихорадка, потеря веса без объективных причин, повышенная утомляемость, увеличение регионарных лимфатических узлов, потливость, особенно в ночное время, длительный кашель, диарея – эти устойчивые клинические симптомы неясного происхождения, отмечаемые в течение 2-3 недель, также служат показанием к проведению исследования на антитела к ВИЧ 1/2 и антиген ВИЧ 1/2.
Кожные проявления также могут быть симптомом ВИЧ-инфекции, поскольку развиваются на фоне ослабления иммунитета. К их числу относится рецидивирующая герпетическая сыпь, поражающая обширные участки кожи, полость рта, половые органы. Герпес поражает и глубокие слои кожи с развитием язвенно-некротической формы. Образуются язвы и эрозии с последующим образованием рубцов, которых не бывает при обычном герпесе.
Еще один характерный симптом ВИЧ-инфекции – волосатая лейкоплакия, которая связана с активацией латентной инфекции, вызванной вирусом Эпштейна-Барр (что свидетельствует об иммуносупрессии). Заболевание проявляется нитевидными образованиями белого цвета с дальнейшим ороговением пораженных участков языка и слизистой оболочки рта.
Обширные грибковые поражения (в первую очередь дрожжевыми грибками рода Candida) также служат типичным признаком, сопровождающим ВИЧ-инфекцию. Сначала кандидоз поражает слизистую оболочку рта и пищевода, затем распространяется на слизистые желудочно-кишечного и мочеполового тракта. При этом формируются обширные очаги, характеризующиеся болезненностью и склонностью к изъязвлению.
ВИЧ-инфекция может сопровождаться развитием обширного папилломатоза. У ВИЧ-инфицированных женщин папилломы цервикального канала склонны быстро вызывать рак шейки матки.
СПИД-индикаторным заболеванием служит саркома Капоши – многоочаговая сосудистая опухоль, которая поражает кожные покровы и слизистые оболочки. Ее очаги в виде красноватых или буроватых узелков и бляшек сливаются, быстро распространяясь по всему телу. Со временем они образуют опухолевые поля, которые изъязвляются и нагнаиваются.
К числу патологических состояний, которые почти у всех пациентов сопровождают ВИЧ-инфекцию, относят полиаденопатию (увеличение лимфатических узлов). Как правило, в первую очередь увеличиваются под- и надключичные, подбородочные, околоушные и шейные лимфоузлы. В дальнейшем к ним может присоединяться увеличение паховых и бедренных лимфатических узлов. Они могут быть мягкими или плотными на ощупь, безболезненными и подвижными. Иногда несколько лимфоузлов сливаются, образуя своеобразный конгломерат. Воспаление двух и более групп лимфоузлов считают признаком генерализованной лимфаденопатии. Поражение лимфатических узлов может наблюдаться в течение нескольких лет, при этом периоды обострения сменяются ремиссией.
К легочным заболеваниям, сопровождающим ВИЧ-инфекцию, относят туберкулез и пневмонию.
Анализ на антигены и антитела к ВИЧ рекомендуют сделать, если у пациента выявлены заболевания, передаваемые половым путем (сифилис, хламидиоз, гонорея, генитальный герпес, бактериальный вагиноз).
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Терешкина Н. Е., Терехова И. В., Сырова Н. А., Девдариани З. Л., Ляшова О. Ю.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Терешкина Н. Е., Терехова И. В., Сырова Н. А., Девдариани З. Л., Ляшова О. Ю.
Конструирование и медицинские испытания моноклональной иммуноферментной тест-системы для выявления капсулосодержащих штаммов чумного микроба "ИФА пестф1-м"
Разработка иммуноферментной и иммунохроматографической моноклональных тест-систем для выявления возбудителя туляремии
Оценка возможности использования экспериментальных иммунодиагностических препаратов в лабораторной диагностике чумы и туляремии
Constructing and Medical Trials of a Monoclonal Dot-Immuno-Enzyme Test-System “DIATul-M” for Tularemia Microbe Detection
Using monoclonal antibodies to Francisella tularensis lipopolysaccharide, designed is a dot-blot immune-enzyme test-system “DIATul-M” for tularemia microbe detection. Its specificity has been tested on 17 strains of tularemia microbe, 78 strains of heterologous bacteria, infected blood plasma samples, human blood sera, suspensions obtained from laboratory mice organs, and soil and water samples. This test system has turned out to be highly specific. “Negative” reaction has been registered even with highly concentrated heterologous bacteria microbial cells – 1·10 9 mc/ml. Sensitivity of the diagnosticum is 1–5·10 6 mc/ml. Additionally, this test-system has been proving for acquisition of sustainable results after 6 months of storing (the observation period). Medical trials of the panel of reagents “Monoclonal dot-immuno-enzyme test-system for tularemia microbe detection” have shown it to be a prospective preparation for implementation into the national healthcare practices both under stationary and field conditions.
Н.Е.Терешкина1, И.В.Терехова1, Н.А.Сырова1, З.Л.Девдариани1, О.Ю.Ляшова1, Г.В.Григорьева1, О.А.Лобовикова1, И.В.Шульгина1, И.Л.Иваненко2, Н.Б.Захарова2, Г.А.Безрукова3, В.Ф.Спирин3
КОНСТРУИРОВАНИЕ И МЕДИЦИНСКИЕ ИСПЫТАНИЯ МОНОКЛОНАЛЬНОЙ ДОТ-ИММУНОФЕРМЕНТНОЙ ТЕСТ-СИСТЕМЫ ДЛЯ ДЕТЕКЦИИ ТУЛЯРЕМИЙНОГО МИКРОБА
Ключевые слова: Francisella tularensis, моноклональные антитела, дот-иммуноанализ, иммунодиагностика.
N.E.Tereshkina1, LV.Terekhova1, N.A.SyrovaJ, Z.L.Devdariani1, O.Yu.Lyashova1, G.V.Grigor’eva1, O.A.Lobovikova1, LV.Shul’gina1, I.L.Ivanenko2, N.B.Zakharova2, G.A.Bezrukova3, V.F.Spirin3
Constructing and Medical Trials of a Monoclonal Dot-Immuno-Enzyme Test-System “DIATul-M” for Tularemia Microbe Detection
Russian Research Anti-Plague Institute “Microbe”, Saratov, Russian Federation; 2Central Research Laboratory at the Saratov Razumovsky State Medical University, Saratov, Russian Federation; 3Saratov Research Institute of Rural Hygiene, Saratov, Russian Federation
Using monoclonal antibodies to Francisella tularensis lipopolysaccharide, designed is a dot-blot immune-enzyme test-system “DIATul-M” for tularemia microbe detection. Its specificity has been tested on 17 strains of tularemia microbe, 78 strains of heterologous bacteria, infected blood plasma samples, human blood sera, suspensions obtained from laboratory mice organs, and soil and water samples. This test system has turned out to be highly specific. “Negative” reaction has been registered even with highly concentrated heterologous bacteria microbial cells - 1109 mc/ml. Sensitivity of the diagnosticum is 1—5106 mc/ml. Additionally, this test-system has been proving for acquisition of sustainable results after 6 months of storing (the observation period). Medical trials of the panel of reagents “Monoclonal dot-immuno-enzyme test-system for tularemia microbe detection” have shown it to be a prospective preparation for implementation into the national healthcare practices both under stationary and field conditions.
Key words: Francisella tularensis, monoclonal antibodies, dot immune-enzyme assay, immunodiagnostics.
Несмотря на значительные успехи, достигнутые в области лабораторной диагностики туляремии, создание новых препаратов для детекции Francisella Ш-larensis, в том числе на основе иммуноферментного анализа (ИФА), не утрачивает актуальности [4].
терес. Так, дот-вариант иммуноферментного анализа (ДИА), отличающийся от твердофазного ИФА на по-листироловых планшетах большей экспрессностью, экономичностью в отношении расхода реагентов, простотой постановки и учета результатов, является весьма эффективным и удобным диагностическим методом.
Важный аспект конструирования современных диагностических препаратов - замена поликлональных иммунореагентов моноклональными, которые можно получить в виде стандартного чистого химического реагента и в практически нелимитированном количестве [3, 8]. Тест-системы на основе моноклональных антител (МКА) приобретают особую ценность в связи со способностью последних вступать
во взаимодействие с уникальным диагностически значимым эпитопом поверхностно расположенного бактериального антигена, что обеспечивает строгую специфичность моноклональных препаратов [3].
Материалы и методы
Образцы материала, содержащего микробные клетки F. tularensis и других бактерий, наносили на ФMHЦ в объеме 2 мкл и инкубировали во влажной камере при температуре 37 °C в течение 30 мин. В качестве положительного контрольного образца (ПКО-TM) использовали взвесь F. tularensis 15 HИИЭГ в концентрации 1-109 м.к./мл, а в качестве отрицательного контроля - 2 мкл фосфатно-солевого буферного раствора (ФCБР).
При постановке ДИЛ были использованы инактивированные микробные взвеси 17 штаммов F. tularensis и 78 штаммов гетерологичных бактерий (Brucella, Yersinia, Salmonella, Shigella, Vibrio chol-erae, Escherichia coli). Для приготовления смешанных культур бактерий использовали взвеси Yersinia enterocolitica 480, Yersinia pestis EV HИИЭГ, Yersinia pseudotuberculosis II, Brucella abortus 19 ВA, Vibrio cholerae О139 Р16064 в концентрации 1-109 м.к./мл и F. tularensis M-S0 (природный вирулентный штамм, подвид holarctica) в концентрациях 1 • 10б, 5-10б и
Биологическими пробами служили образцы плазмы крови человека, сыворотки крови человека и органов (печени и селезенки) мыши линии BALB/с, объектами окружающей среды - пробы почвы и воды из открытых водоемов. Приготовленные разведения образцов контаминировали F. tularensis M-S0 в концентрациях 1 • 10б, 5-10б и 1-107 м.к./мл и гетерологич-
ными бактериями в концентрации 1-109 м.к./мл. В качестве отрицательного контроля был использован соответствующий неконтаминированный материал.
Mоноклонaльный туляремийный конъюгат и ПKО-TM высушивали под вакуумом с использованием центрифуги-концентратора CentriVap 7310030 (Labconco, COA) при температуре 4 °C, скорости вращения ротора 1425 об/мин и давлении 1 • 10-4 торр. В качестве стабилизатора к препаратам добавляли 3 % сахарозы. Aктивность конъюгата до и после высушивания, а также в процессе хранения контролировали постановкой прямого ИФA, а ПKО-TM -сэндвич-ДИД.
Все виды материала тестировали с применением экспериментальных серий тест-системы приготовленных ex tempore, а также хранившихся в течение 3 и б мес.
Результаты и обсуждение
Рис. 1. Исследование в сэндвич-варианте ДИА на основе ЫКА к ЛЖ туляремийного микроба инактивированных чистых культур Francisella tularensis 15 НИИЭГ (1), M-80 (2), M-113 (3), M-498 (4), M-157 (5), А-179 (6), А-61 (7), В-300 (8), Е-261 (9), И-281 (10), И-328 (11), О-328 (12), KF (13), 38 (14), 74 (15), Kosho (16), Utah 112 (17) в концентрации 1107 (столбец a), 5-106 (столбец b), 1 • 106 (столбец c) и 5105 (столбец d) м.к./мл; положительный контроль - ПКО^ (18), отрицательный контроль - ФCБР (19)
ется от подвида novicida структурой О-антигена [7]. С микробными клетками гетерологичных бактерий регистрировалась отрицательная реакция.
На следующем этапе исследования изучали стабильность скомпонованной тест-системы при хранении. Результаты тестирования проб, аналогичных вышеописанным, с использованием экспериментальных серий тест-систем, хранившихся в течение 3 и 6 мес., полностью коррелировали с таковыми, полученными при применении ФМНЦ и реагентов, приготовленных непосредственно перед постановкой ДИА, что указывало на стабильность препарата в течение срока наблюдения.
В ходе медицинских испытаний было установлено, что «Тест-система дот-иммуноферментная для детекции туляремийного микроба моноклональная
1. Книрель Ю.А., Кочетков Н.К. Строение липопо-лисахаридов грамотрицательных бактерий. III. Структура О-специфических полисахаридов (Обзор). Биохимия. 1994; 59(12):1784-851.
2. Курманова Л.В., Ермолин Г.А., Эткин А.Ф., Цветков В.С. Получение специфических иммуноферментных конъюгатов против иммуноглобулинов классов А, G, М человека. Лаб. дело. 1984; 7:402-6.
3. Кэтти Д., редактор. Антитела. Методы. В 2-х кн. Т. 1. М.: Мир; 1991. 287 с.
4. Сырова Н.А., Терешкина Н.Е., Девдариани З.Л. Современное состояние иммунодиагностики туляремии. Пробл. особо опасных инф. 2008; 3(97):12-5.
5. Фримель Г., редактор. Иммунологические методы. М.: Медицина; 1987. 472 с.
6. Abdul-Fattah A.M., Kalonia D.S., PikalM.J. The Challenge of drying method selection for protein pharmaceuticals: product quality implication. J. Pharm. Sci. 2007; 96(8):1886-916.
7. Gunn J.S.,ErnstR.K. The structure and function ofFrancisella lipopolysaccharide. Ann. N.Y. Acad. Sci. 2007; 1105:202-18.
8. Peruski A.H., Peruski L.F Jr. Immunological methods for detection and identification of infectious disease and biological warfare agents. Clin. Diagn. Lab. Immunol. 2003; 10(4):506-13.
1. Knirel’ Yu.A., Kochetkov N.K. [Gram-negative bacteria lipopolysaccharide morphology. III. O-specific polysaccharide structure (Review)]. Biokhimia. 1994; 59(12):1784-851.
2. Kurmanova L.V., Ermolin G.A., Etkin A.F., Tsvetkov VS. [Preparation of the specific immune-enzyme conjugates against human immunoglobulins -class A, G, M]. Lab. Delo. 1984; 7:402-6.
3. Ketti D., editor. [Antibodies. Methods]. Two volume book. Vol. I. M.: Mir; 1991. 287 p.
4. Syrova N.A., Tereshkina N.E., Devdariani Z.L. [Current state of tularemia immunodiagnostics]. Probl. Osobo Opasn. Infek. 2008; (97):12-5.
5. Frimel'G., editor. [Immunological Methods]. M.: Meditsina; 1987.
6. Abdul-Fattah A.M., Kalonia D.S., Pikal MJ. The Challenge of drying method selection for protein pharmaceuticals: product quality implication. J. Pharm. Sci. 2007; 96(8):1886-916.
7. Gunn J.S., Ernst R.K. The structure and function of Francisella lipo-polysaccharide. Ann. N.Y. Acad. Sci. 2007; 1105:202-18.
8. Peruski A.H., Peruski L.F. Jr. Immunological methods for detection and identification of infectious disease and biological warfare agents. Clin. Diagn. Lab. Immunol. 2003; 10(4):506-13.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Осина Н.А., Сеничкина А.М., Бугоркова Т.В., Щербакова С.А.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Осина Н.А., Сеничкина А.М., Бугоркова Т.В., Щербакова С.А.
Определение диагностической эффективности пцр с использованием наборов реагентов "Ген Francisella tularensis - РЭФ" и "Ген Francisella tularensis - РГФ" при исследовании биологического материала от животных с экспериментальной туляремией
Первая молекулярно-генетическая идентификация возбудителя туляремии у клещей Ixodes trianguliceps Bir. В России
Апробация новых генодиагностических препаратов при эпизоотологическом мониторинге территорий Российской Федерации на наличие возбудителя туляремии
Development of Amplification Test-Systems for Tularemia Agent Detection
Developed is the method for tularemia microbe DNA detection using PCR with electrophoretic and hybridization-fluorescent registration of results. iglBC genes have been chosen as DNA-matrixes, being species-specific ones for tularemia agent. Based on the results obtained constructed have been preparations for tularemia microbe DNA detection in biological material and environmental samples applying PCR with electrophoretic registration of results and real-time PCR : “Gene Francisella tularensis REP” and “Gene Francisella tularensis RHF”, respectively. Identified are the package contents to be included into the test-systems. Sensitivity and specificity of the designed panels are validated through investigations of tularemia agent bacterial emulsions and suspensions from small mammals’ organs, from ticks, fleas and mosquitoes, as well as through studies of soil and surface water samples, sputum and human blood probes, experimentally contaminated with tularemia agent. Test-systems demonstrate high sensitivity (1·10 3 microbe cells/ml) and specificity (100 %), irrespective of the type of test material.
Н.А.Осина, А.М.Сеничкина, Т.В.Бугоркова, С.А.Щербакова
разработка амплификационных тест-систем для выявления возбудителя туляремии
Ключевые слова: Francisella tularensis, ДНК, ПЦР в режиме реального времени, детекция, наборы реагентов.
N.A.Osina, A.M.Senichkina, T.V.Bugorkova, S.A.Shcherbakova Development of Amplification Test-Systems for Tularemia Agent Detection
Russian Research Anti-Plague Institute "Microbe", Saratov, Russian Federation
Developed is the method for tularemia microbe DNA detection using PCR with electrophoretic and hybridization-fluorescent registration of results. iglBC genes have been chosen as DNA-matrixes, being species-specific ones for tularemia agent. Based on the results obtained constructed have been preparations for tularemia microbe DNA detection in biological material and environmental samples applying PCR with electrophoretic registration of results and real-time PCR: "Gene Francisella tularensis - REP" and "Gene Francisella tularensis RHF", respectively. Identified are the package contents to be included into the test-systems. Sensitivity and specificity of the designed panels are validated through investigations of tularemia agent bacterial emulsions and suspensions from small mammals' organs, from ticks, fleas and mosquitoes, as well as through studies of soil and surface water samples, sputum and human blood probes, experimentally contaminated with tularemia agent. Test-systems demonstrate high sensitivity (1103 microbe cells/ ml) and specificity (100 %), irrespective of the type of test material.
Key words: Francisella tularensis, DNA, real-time PCR, detection, reagent panels.
Поэтому крайне важным остается своевременное выявление патогена в биологическом материале и объектах окружающей среды. Одним из наиболее перспективных подходов для индикации туляремий-ного микроба представляется полимеразная цепная реакция. Получены многочисленные подтверждения эффективности применения данного приема для выявления возбудителя туляремии в пробах крови, суспензиях клещей, органов мелких млекопитающих, а также для идентификации выделенных культур туля-ремийного микроба [3, 5, 6].
В отечественных и зарубежных документах по ла-
Целью работы является разработка диагностических препаратов для выявления ДНК F. tularensis методом ПЦР c гибридизационно-флуоресцентным и электрофоретическим учетом результатов.
Материалы и методы
Штаммы микроорганизмов выращивали на питательных средах: F tularensis - на среде питательной для выделения возбудителя туляремии FT (ФБУН ГНЦ ПМБ, Оболенск), рН 7,2.; Brucella spp. - на эритрит-агаре (НИИ им. Мечникова, Москва), рН 7,2 при температуре (37±1) °С в течение 48 ч; Yersinia spp., Escherichia spp. и Bacillus spp. - на среде Хоттингера, рН 7,2; Vibrio spp. - на агаре из сердечной мышцы, рН 7,6 при температуре (37±1) °С в течение 24 ч.
1102 м.к./мл, гетерологичных микроорганизмов 1104 м.к./мл. Количество клеток в приготовленных разведениях проверяли путем высева 0,1 мл микробной взвеси каждого тест-штамма из разведений
1103 м.к./мл на соответствующие плотные питательные среды.
пробы суспензий печени и селезенки мыши, клещей, блох и комаров, крови и мокроты человека, почвы и воды открытых водоемов искусственно кон-таминировали F. tularensis 15 НИИЭГ до конечной концентрации 1 104, 1 103 м.к./мл. Дополнительно исследовали нативные образцы указанного биологического материала и объектов окружающей среды.
Результаты и обсуждение
процесс конструирования амплификационных тест-систем включает в себя определение способа выявления ДНК патогена методом ПЦР, оценку специфичности и чувствительности реакции при исследовании чистых культур микроорганизмов, а также проб био-
логического материала и объектов окружающей среды, искусственно контаминированных возбудителем, комплектацию экспериментальных серий препарата и изучение его диагностической ценности и сроков годности. Поэтому первым этапом нашей работы стала разработка ПЦР с гибридизационно-флуоресцентным и электрофоретическим учетом результатов для выявления ДНК туляремийного микроба.
Отличительной особенностью представителей рода Francisella (F. tularensis, F. philomiragia, F. noa-tunensis, F. hispaniensis, F. halioticida) является их высокая степень генетического сходства. Так, гены 16S рДНК характеризуются высокой гомологией как между отдельными видами (F. tularensis и F. philo-miragia), так и между близкородственными возбудителю туляремии микроорганизмами (Wolbachia persica и др. эндосимбионты клещей родов Amblyomma, Ornithodorus и Dermacentor) [4, 7]. Использованный ранее в качестве Днк-мишени при выявлении туля-ремийного микроба методом ПЦР ген lpnA, кодирующий синтез предшественника мембранного белка 17 кДа (Tul4), обнаружен у штаммов F. philomiragia, а его последовательность схожа с участками генома эндосимбионтов клещей рода Dermacentor [2, 3, 5, 6]. Все это не позволяет рассматривать эти локусы как специфичные для F. tularensis.
Установлена возможность обнаружения ДНК F. tularensis методом ПЦР на основании амплификации фрагмента генаfopA, кодирующего белок внешней мембраны, и генов iglBC, отвечающих за синтез белков, необходимых для внутриклеточного роста патогена [2, 7]. Анализ нуклеотидных последовательностей данных локусов с помощью алгоритма BLAST и базы данных GenBank NCBI показал, что ген fopA у разных штаммов туляремийного микроба идентичен на 90 % и имеет мозаичную структуру, в которой гомологичные участки протяженностью 200-300 п.н. чередуются с аналогичными по размеру вариабельными. В то же время полиморфизм генов iglBC составляет всего 1 % и затрагивает 21 нуклеотид у всех подвидов. Поэтому в качестве ДНК-матрицы нами для дальнейшей работы выбраны iglBC гены.
Подобранные праймеры YFtls-YFtla обеспечивают амплификацию фрагмента iglBC генов размером 268 п.н., а для образования флуоресцентного сигнала в состав зонда с 5'-конца введена флуоресцентная метка ROX, а с З'-конца - BHQ2.
В ходе последующих экспериментов определены оптимальные условия ПЦР с выбранными праймерами и зондом с электрофоретическим и гибридизационно-флуоресцентным учетом результатов. из данных табл. 1 видно, что нуклеотидная последовательность праймеров и зондов имеет высокое сходство с ДНК человека и мыши, поэтому особое внимание уделено определению специфичности реакции при исследова-
Характеристика праймеров и зонда, подобранных на основе iglBC генов туляремийного микроба
Наименование Размер, % GC Температура Гомология с ДНК Гомология с ДНК Гомология с ДНК
праймера п.н. отжига, °С F tularensis всех подвидов, % F philomiragia/ F. noatunensis, % человека/мыши, %
нии нативных проб биологического материала, не содержащих ДНК возбудителя туляремии.
Однако чувствительность реакции с некоторыми из этих ферментов не всегда составляла 1103 м.к./мл. На основании полученных результатов для дальнейшей работы выбраны Hot-Start Taq ДНК-полимераза и Syn Taq ДНК-полимераза.
В дальнейших экспериментах варьировали концентрации праймеров от 8 до 15 пМоль, зонда - от 4 до 8 пМоль, ионов Mg2+ - от 2 до 3 мМоль, фермента - 1-2 ед. Установлено, что для проведения пцР с учетом результатов методом электрофореза в составе реакционной смеси должно быть не менее 10 пМоль каждого праймера, а при гибридизационно-флуоресцентной детекции - содержание праймеров и зонда составляет 8 и 4 пМоль соответственно.
вне зависимости от способа учета результатов оптимальная концентрация ионов магния составляет 2 мМоль, фермента - 1 ед. Высокую чувствительность и специфичность реакции обеспечивает не только подобранный состав реакционной смеси, но и программа амплификации. В данном случае разработаны условия проведения реакции с электрофо-ретическим учетом результатов на амплификаторах с матричным и активным режимом термоциклирова-ния и в режиме реального времени на приборах типа RotorGene (табл. 3).
Эффективность ПЦР с подобранными праймерами и зондом при использовании различных ферментов
Наименование проб Концентрация, м.к./мл Кол-во Наличие амплификации фрагмента iglBC генов размером 268 п.н./специфичной флуоресценции по каналу ROX при проведении реакции с ферментом
I II III IV V VI VII
Суспензия печени и селезенки белой мыши
1104 10 10/10 10/10 10/10 10/10 10/10 10/10 10/10
1103 10 7/8 6/6 9/10 9/10 10/10 8/9 10/10
1102 10 0/5 0/5 0/5 1/6 3/6 0/2 2/5
1104 10 0/0 0/0 0/0 0/0 0/0 0/0 0/0
н/и 10 1/1 0/1 0/0 1/1 0/0 0/0 0/0
н/и 10 1/2 1/2 0/0 2/2 0/0 0/0 0/0
Программа амплификации с использованием подобранных праймеров и зонда
ПЦР-ЭФ 95 °С - пауза, 95 °С - 5/5 мин, 5 циклов: 95 °С - 40/10 с, 62 °С - 40/10 с, 72 °С - 40/10 с, 30 циклов: 95 °С - 30/7 с, 60 °С - 30/7 с,
72 °С - 30/7 с, 72 °С - 5 мин
пцр-рв 95 °с - 5 мин, 10 циклов: 95 °С - 30 с, 60 °С - 30 с, 72 °С - 30 с, 35 циклов: 95 °С - 20 с, 56 °С - 20 с, 72 °С - 20 с
Детекция флуоресцентного сигнала при температуре 56 °С во втором блоке циклирования по каналу Orange/ROX
Примечание. Через дробь указаны данные продолжительности этапа при использовании активного и матричного режимов термоциклиро-
Чувствительность и специфичность разработанных ПЦР вне зависимости от условий регистрации результатов составила 1103 м.к./мл и 100 % соответственно как при исследовании чистых культур, так и проб биологического материала.
На следующем этапе нами определена чувствительность и специфичность разработанных наборов реагентов. Для этого исследовали бактериальные суспензии 101 штамма туляремийного микроба (tularensis - 10 , holarctica - 87, mediasiatica - 2 и novicida - 2), 72 штаммов гетерологичных микроорганизмов (представителей родов Yersinia spp., Brucella spp., Bacillus spp., Escherichia spp., Vibrio spp.) и 100 проб суспензий внутренних органов мелких млекопитающих, клещей, блох, комаров, крови человека, искусственно контаминированных F. tularensis. Во всех случаях вне зависимости от вида материала подтверждена чувствительность, специфичность и воспроизводимость сконструированных наборов реагентов.
Таким образом, нами разработан способ выявления ДНК туляремийного микроба методом ПЦР с электрофоретическим и гибридизационно-флуорес-центным учетом результатов, где в качестве ДНК-матрицы использованы видоспецифичные гены iglBC, специфичные для вида F. tularensis, созданы наборы реагентов для его осуществления. Показана высокая чувствительность (1103 м.к./мл) и специфичность (100 %) созданных амплификационных тест-систем как при исследовании чистых культур микроорганизмов, так и проб биологического материала и объектов окружающей среды, искусственно инфицированных возбудителем туляремии.
Авторы подтверждают отсутствие конфликта финансовых/нефинансовых интересов, связанных с написанием статьи.
1. Воробьев А.А., Боев Б.В., Бондаренко В.М., Гинзбург А.Л. Проблема биотерроризма в современных условиях. Журн. микробиол., эпидемиол. и иммунобиол. 2002; 3:3-12.
2. Emanuel P.A., Bell R., Dang J.L., McClanahan R., David J.C., Burgess R.J., Thompson J., Collins L., Hadfield T. Detection of Francisella tularensis within infected mouse tissues by using a handheld PCR thermocycler. J. Clin. Microbiol. 2003; 41(2):689-93.
4. Kugeler K.J. Discrimination between Francisella tularensis and Francisella-like endosymbionts when screening ticks by PCR. Appl. Environ. Microbiol. 2005; 7(11):7594-7.
5. Long G.W., Oprandy J.J., Narayanan R.B., Fortier A.H Porter K.R., Nacy C.A. Detection of Francisella tularensis in blood by polymerase chain reaction. J. Clin. Microbiol. 1993; 31(1):152-4.
6. Sjostedt A., Eriksson U., Berglund L., Tarnvik A. Detection of Francisella tularensis in ulcers of patients with tularemia by PCR. J. Clin. Microbiol. 1997; 35(5):1045-8.
7. Versage J.L., Severin D.D., Chu M.C., Petersen J.H. Development of a multitarget real-time TaqMan PCR assay for enhanced detection of Francisella tularensis in complex. J. Clin. Microbiol. 2003; 41:5492-9.
1. Vorob'ev A.A., Boev B.V., Bondarenko V.M., Ginzburg A.L. [Bioterrorism issue under current conditions]. Zh. Mikrobiol. Epidemiol. Immunobiol. 2002; 3:3-12.
2. Emanuel P.A., Bell R., Dang J.L., McClanahan R., David J.C., Burgess R.J., Thompson J., Collins L., Hadfield T. Detection of Francisella tularensis within infected mouse tissues by using a hand-held PCR thermocycler. J. Clin. Microbiol. 2003; 41(2):689-93.
4. Kugeler K.J. Discrimination between Francisella tularensis and Francisella-like endosymbionts when screening ticks by PCR. Appl. Environ. Microbiol. 2005; 7(11):7594-7.
5. Long G.W., Oprandy J.J., Narayanan R.B., Fortier A.H., Porter K.R., Nacy C.A. Detection of Francisella tularensis in blood by polymerase chain reaction. J. Clin. Microbiol. 1993; 31(1):152-4.
6. Sjostedt A., Eriksson U., Berglund L., Tarnvik A. Detection of Francisella tularensis in ulcers of patients with tularemia by PCR. J. Clin. Microbiol. 1997; 35(5):1045-8.
7. Versage J.L., Severin D.D., Chu M.C., Petersen J.H. Development of a multitarget real-time TaqMan PCR assay for enhanced detection of Francisella tularensis in complex. J. Clin. Microbiol. 2003; 41:5492-9.
Туляремия – это острое зоонозное природно-очаговое инфекционное заболевание характеризующееся многообразием путей заражения, соответственно механизму заражения развитием лихорадки, интоксикации, первичных очагов поражения на кожных покровах, конъюнктиве глаз, слизистой ротоглотки, в легких и кишечнике сопровождающихся развитием региональных лимфаденитов и различной степени генерализации процесса (гематогенная диссеминация).
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| А21.0 | Язвенная (кожная) форма туляремии |
| А21.1 | Глазная (глазобубонная) форма |
| А21.2 | Легочная форма туляремии |
| А21.3 | Абдоминальная (кишечная) форма |
| А21.7 | Генерализованная форма туляремии |
| А21.8 | Другие формы туляремии |
| А21.9 | Туляремия неуточненная |
Дата разработки протокола: 2017 год.
Сокращения, используемые в протоколе:
| АД | – | артериальное давление |
| АлТ | – | Аланинаминотрансфераза |
| АсТ | – | Аспартатаминотрансфераза |
| АЧТВ | – | активированное частичное тромбопластиновое время |
| в/в | – | Внутривенно |
| в/м | – | Внутримышечно |
| ВГ | – | вирусный гепатит |
| ВОП | – | врач общей практики |
| ВР | – | время рекальцификации |
| ВКА | - | Вторичный кожный аффект |
| ДВС | – | диссеминированное внутрисосудистое свертывание |
| ИВЛ | – | искусственная вентиляция легких |
| ИТШ | – | инфекционно-токсический шок |
| ИФА | – | иммуноферментный анализ |
| КИЗ | – | кабинет инфекционных заболеваний |
| КТ | – | компьютерная томография |
| КЩР | – | кислотно-щелочное равновесие |
| МНО | – | международное нормализованное отношение |
| МРТ | – | магнитно-резонансная томография |
| ОАК | – | общий анализ крови |
| ОАМ | – | общий анализ мочи |
| ОРИТ | – | отделение реанимации и интенсивной терапии |
| ОПП | – | острое повреждение почек |
| ОППН | – | острая печеночно-почечная недостаточность |
| ОЦК | – | объем циркулирующей крови |
| ПМСП | – | первичная медико-санитарная помощь |
| ПЦР | – | полимеразная цепная реакция |
| ПКА | - | Первичный кожный аффект |
| РТГА | – | реакция торможения гемагглютинации |
| РПГА | – | реакция пассивной гемагглютинации |
| УПФ | - | Условно-патогенная флора |
| СЗП | – | свежезамороженная плазма |
| СМЖ | – | спинномозговая жидкость |
| СОЭ | – | скорость оседания эритроцитов |
| СПОН | – | синдром полиорганной недостаточности |
| УЗИ | – | ультразвуковое исследование |
| ЦВД | – | центральное венозное давление |
| ЭКГ | – | Электрокардиография |
Пользователи протокола: врачи скорой неотложной помощи, фельдшеры, врачи общей практики, терапевты, инфекционисты, пульмонологи, хирурги, офтальмологи, дерматовенерологи, анестезиологи-реаниматологи, организаторы здравоохранения.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Классификация
Классификация [6- 18]
Классификация клинико-патогенетическая [18]:
Первично-очаговые формы:
· Язвенная (син. кожная, кожно-бубонная);
· Бубонная;
· Ангинозная (ангинозно-бубонная, ротоглоточная, фарингеальная);
· Коньюнктивальная (син. глазная, глазо-бубонная);
· Легочная (син. пневмоническая);
· Абдоминальная (син. кишечная);
· Смешанная.
Генерализованные формы:
· Первично-генерализованная (син. лихорадочная, первично-септическая, тифоидная);
· Вторично-генерализованная.
Вторично-очаговые формы (развитие вторично-очаговых форм нехарактерно для штаммов туляремии, циркулирующих в Евразии (тип B или holarctica), такое течение характерно для штаммов циркулирующих в Северной Америке (тип А или tularensis)).
· Ангинозная;
· Бубонная;
· Пневмоническая;
· Абдоминальная (кишечная);
· Менингоэнцефалитическая;
· Смешанная;
· Вторично-септическая.
Примечание: в скобках указаны синонимы клинических форм, встречающиеся в литературе.
Классификация клинических форм туляремии основана на патогенезе заболевания с учетом механизма и пути передачи инфекции (Таблица 1):
· первично-очаговые формы протекают как регионарная инфекция (воспалительный процесс) в месте внедрения возбудителя (входных ворот);
· первично-генерализованная форма – протекает в виде генерализованной инфекции (бактериемии) без эпизода первично-очаговых проявлений, когда возбудитель сразу попадает в кровь (при массивном инфицировании и/или иммунодефицитном состоянии);
· вторичная генерализация – в виде генерализованной инфекции (бактериемии) развивается на фоне любой из первично-очаговых форм;
· вторично-очаговые формы развиваются вслед за и как результат генерализации инфекции с формированием вторичных очагов в органах и тканях.
Таблица 1. Клинико-патогенетическая классификация туляремии [18]:
Ангинозная
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 20
Диагностические критерии [19]
Жалобы и анамнез:
· Инкубационный период при туляремии длится в среднем 3 — 7 дней, но может удлиняться до 2 — 3 недель.
Для всех форм туляремии характерно повышение температуры и симптомы интоксикации разной степени выраженности.
· острое начало заболевания;
· повышение температуры тела;
· головная боль;
· общая слабость;
· отсутствие аппетита.
При развитии очаговых форм присоединяются клинические симптомы поражения соответствующих органов и систем, которые носят неспецифический характер. Поэтому диагностика предположительного случая, основанная на клинических проявлениях туляремии затруднена.
Для подтверждения подозрения на туляремию необходимо наличие соответствующего эпидемиологического анамнеза – пребывание или проживание на эндемичной территории (для родного очага) туляремии в течение максимального инкубационного периода (трех недель) перед заболеванием.
Стандартное определение случая туляремии [20]:
Предположительный диагноз (случай) язвенной (кожной, язвенно-бубонной) и бубонной форм туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с одним или обоими из следующих синдромов:
Бубон (лимфаденит без периаденита) в одной из групп периферических лимфоузлов, характеризующийся как минимум тремя из следующих признаков:
− увеличение отдельного лимфоузла (лимфоузлов);
− умеренная болезненность;
− мягко-эластическая консистенция;
− подвижность при пальпации.
Первичный кожный аффект, болезненный, находящийся на одном из следующих этапов развития:
− папула;
− везикула;
− пустула (гнойная);
− язва (глубокая, сочная, с гнойно-геморрагическим отделяемым, на инфильтрированном основании, окруженная венчиком гиперемии).
Предположительный диагноз (случай) глазной (глазо-бубонной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с первичным аффектом на конъюнктиве (в виде папулы – пустулы – язвочки), выраженного конъюнктивита, одностороннего отека лица, периорбитального отека и регионального шейного (подчелюстного) лимфаденита, характеризующегося всеми свойствами туляремийного лимфаденита.
Предположительный диагноз (случай) ангинозной (ангинозно-бубонной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с первичным аффектом, проявляющимся выраженной односторонней гнойно-некротической ангиной и регионального шейного (подчелюстного) или заглоточного лимфаденита, характеризующимися всеми свойствами туляремийного бубона [21].
Предположительный диагноз (случай) легочной (пневмонической) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого тяжелого заболевания без альтернативного диагноза, сопровождающегося лихорадкой, увеличением печени и/или селезенки и увеличением (на рентггенограмме) прикорневых, паратрахеальных или медиастенальных лимфоузлов [21].
Предположительный диагноз (случай) абдоминальной (кишечной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого тяжелого заболевания, сопровождающегося лихорадкой, увеличением печени и/или селезенки и болями в области мезентериальных лимфоузлов (правая подвздошная область).
Вероятный диагноз (случай) для всех форм туляремии ставится при соответствии определению предположительного случая и наличия как минимум одного из следующего [20]:
· употребление сырого мяса животных, возможных носителей туляремии;
· употребление сырой воды из ручьев, колодцев, других открытых водоисточников;
· участие в сельскохозяйственных работах, связанных с сеном, соломой;
· укус клещей, или других кровососущих насекомых;
· охота, добыча и разделка диких и сельскохозяйственных животных, возможных носителей туляремии;
· прямой или опосредованный контакт с животными, возможными носителями туляремии;
· эпидемиологическая связь с подтвержденным случаем туляремии;
· менее чем четырехкратное увеличение титра антител к F. tularensis в сыворотке крови;
· положительная кожная аллергическая проба у не привитых лиц.
Подтвержденный диагноз (случай) для всех форм туляремии ставится при наличии как минимум одного из нижеследующего [20]:
· выделение культуры Francisella tularensis из отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений или крови;
· положительный результат ПЦР при исследовании материала от больного;
· обнаружение IgM или нарастание титра IgG к F. tularensis в ИФА [23];
· четырехкратное нарастание титров антител к F. tularensis в агглютинационных тестах при исследовании парных сывороток;
· подтверждение однократного положительного результата в агглютинационном тесте другим подтверждающим тестом.
Лабораторно-этиологические исследования:
· Бактериологическое исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· Биологическое исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ПЦР исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ИФА на антиген – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ИФА на антитела (IgM и IgG) - крови;
· Серологические агглютинационные тесты на антитела (РА, РПГА) - крови.
· Коагулограмма – при развитии ИТШ и ДВС синдрома;
· Биохимическое исследование крови (глюкоза, общий белок, мочевина, креатинин, электролиты) – при развитии ИТШ и ДВС синдрома.
Следует учесть, что в крови у больного может находиться высококонтагиозный возбудитель, поэтому работа с выделениями больного, прежде всего с кровью, проводится в соответствующих средствах индивидуальной защиты, с последующим обеззараживанием объектов, соприкасавшихся с материалами от больного.
Инструментальные исследования:
· Рентгенологическое исследование и/или компьютерная томография грудной клетки – при наличии у больного легочной формы туляремии.
· Компьютерная томография брюшной полости – при наличии у больного абдоминальной формы туляремии.
· УЗИ лимфоузлов – при развитии лимфаденитов разной локализации.
· ЭКГ – при развитии явлений выраженной интоксикации и миокардита.
Показания для консультации специалистов:
При возникновении подозрения на наличии у больного туляремии, возможно провести консультацию с инфекционистом КИЗ, если такая возможность имеется, однако при использовании стандартного определения случая, можно направлять больного в региональное инфекционное отделение или больницу без дополнительной консультации инфекциониста.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Туляремия: причины появления, симптомы, диагностика и способы лечения.
Определение
Туляремия – это природно-очаговое острое инфекционное заболевание, поражающее лимфатические узлы, кожу, иногда слизистые оболочки глаз, зев, легкие и кишечник.
Причины появления туляремии
Заболевание вызывает бактерия Francisella tularensis. Основными источниками инфекции являются грызуны: полевки, водяные крысы и домовые мыши, а также некоторые млекопитающие и определенные виды птиц.
Механизмов передачи туляремии существует несколько:
- контактный — инфекция проникает через слизистые оболочки рта, глаз и через поврежденную кожу (при соприкосновении с зараженной водой, трупами грызунов и других зараженных животных или птиц);
- трансмиссивный — через укус животного (чаще грызуна) или мух, комаров, клещей, слепней, оленьих кровососок;
- фекально-оральный — бактерии попадают в организм с инфицированной пищей или водой;
- воздушно-пылевой или воздушно-капельный — при вдыхании пыли или воздуха, в которых содержатся бактерии.
От человека к человеку заболевание не передается, т. е. больной для окружающих опасности не представляет.
Классификация заболевания
В зависимости от локализации патологического процесса выделяют: бубонную, язвенно-бубонную, ангинозно-бубонную, абдоминальную, легочную и генерализованную туляремию.
По продолжительности: острая туляремия – до 3 месяцев, затяжная – до 6 месяцев, рецидивирующая.
По степени тяжести туляремия может иметь легкое, среднетяжелое и тяжелое течение.
Симптомы туляремии
Инкубационный период заболевания может продолжаться от трех дней до трех недель, но в среднем составляет около семи суток.
Начальные симптомы, которые продолжаются 2-3 дня, одинаковы для всех форм заболевания: туляремия манифестирует остро: температура тела повышается до 38–40°С, артериальное давление снижается, наблюдается относительная брадикардия. Пациенты жалуются на нарастающую слабость, головную боль, ломоту в теле, тошноту, отсутствие аппетита и нарушение сон. Появляются выраженные мышечные боли и сильная потливость.
В тяжелых случаях человек может испытывать эйфорию, редко наблюдаются бред и галлюцинации. У больного начинаются сильные головные боли и рвота.
Характерными признаками тяжелого течения туляремии считаются отечность и синюшно-багровый цвет лица (особенно мочек ушей, век и губ), покраснение белков глаз с возможным развитием конъюнктивита, носовые кровотечения.
Затем следует период разгара, во время которого сохраняются лихорадка, симптомы интоксикации и присоединяются типичные для каждой конкретной формы проявления болезни.
Если входными воротами инфекции стал кожный покров, развивается бубонная форма, представляющая собой регионарный лимфаденит. Поражаться могут подмышечные, паховые, бедренные лимфатические узлы, при дальнейшем распространении отмечаются вторичные бубоны. Пораженные лимфоузлы увеличены (иногда достигают размера куриного яйца), имеют отчетливые контуры, первоначально болезненны, затем боль уменьшается и стихает. Постепенно бубоны рассасываются (зачастую в течение нескольких месяцев), рубцуются либо нагнаиваются, формируя абсцессы, которые затем вскрываются с образованием свища.
Язвенно-бубонная форма обычно развивается при трансмиссивном заражении. На коже в месте внедрения микроорганизмов появляется сначала пятно, затем папула, превращающаяся в везикулу и пустулу, последняя вскрывается, обнажая небольшую (5-7 мм) малоболезненную язвочку, которую больные нередко вовсе не замечают. Язвочка имеет приподнятые края и покрытое темной корочкой дно, заживает крайне медленно. Параллельно развивается регионарный лимфаденит.
При проникновении возбудителя через конъюнктиву манифестирует язвенно-гнойный конъюнктивит с регионарным лимфаденитом.
Конъюнктивит проявляется покраснением, отеком, болезненностью, ощущением песка в глазах, затем формируются папулезные образования, прогрессирующие в эрозии и язвочки с гнойным отделяемым. Роговица обычно не поражается. Такая форма туляремии часто протекает весьма тяжело и длительно, осложняясь дакриоциститом – воспалением слезного мешка вплоть до флегмоны, но, к счастью, встречается достаточно редко.
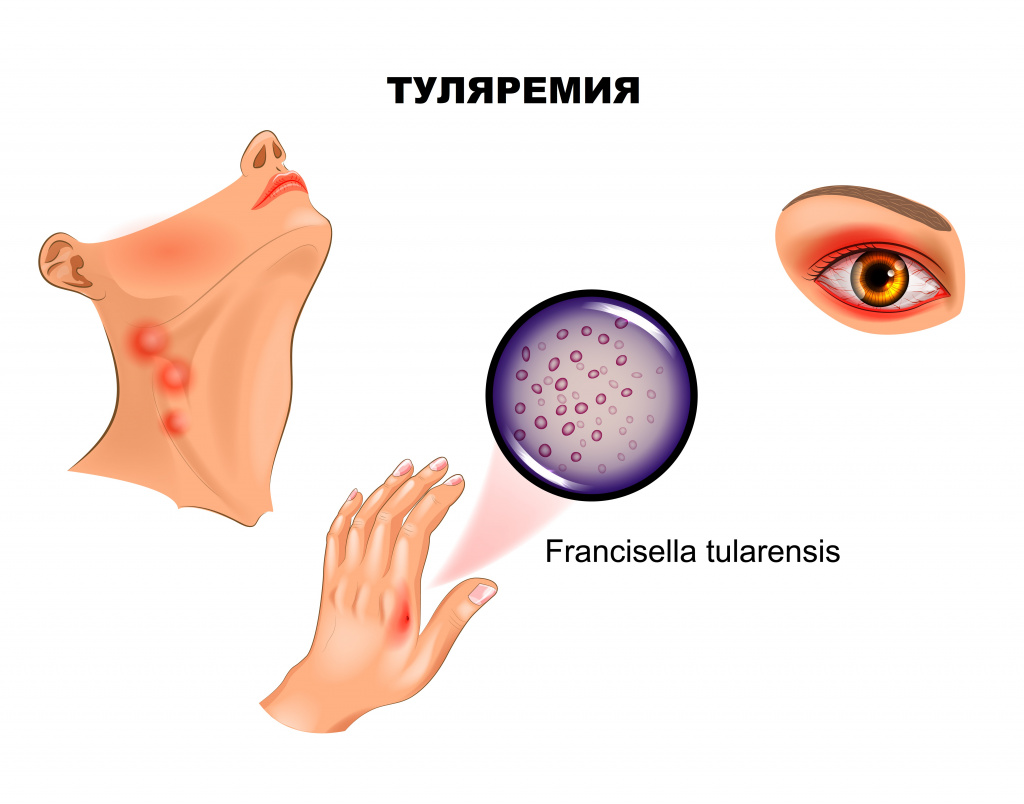
Ангинозно-бубонную форму регистрируют, если воротами инфекции служит слизистая глотки. Клинически проявляется болью в горле, дисфагией (затруднением глотания), при осмотре отмечают гиперемию и отечность миндалин. На поверхности увеличенных, спаянных с окружающей тканью миндалин зачастую виден сероватый, с трудом удаляемый некротический налет. С прогрессированием заболевания на миндалинах формируются язвы, а позднее – рубцы. Лимфаденит при этой форме туляремии развивается в околоушных, шейных и подчелюстных узлах.
При проникновении возбудителя с пищей или водой возникает абдоминальная форма. Для нее характерна боль в животе, тошнота (иногда рвота), отказ от пищи, диарея. Болезненность локализуется в области пупка, отмечается гепатоспленомегалия (увеличение печени и селезенки).
Легочная форма туляремии развивается при вдыхании пыли или аэрозоли, содержащих бактерии, и встречается в двух клинических вариантах: бронхитическом и пневмоническом. Бронхитический вариант (при поражении бронхиальных, паратрахеальных, средостенных лимфатических узлов) характеризуется сухим кашлем, умеренной болью за грудиной и общей интоксикацией, протекает довольно легко, выздоровление обычно наступает через 10-12 дней. Пневмоническая форма имеет длительное, изнуряющее течение и признаки очаговой пневмонии. Пневмоническая туляремия часто осложняется бронхоэктазами (стойким расширением просвета бронхов), плевритом, абсцессами, вплоть до легочной гангрены.
При любой форме туляремии лихорадка держится не более 2-3 недель, и лишь в отдельных случаях – до нескольких месяцев.
В период выздоровления температура тела редко превышает 38°С, но присутствует астенический синдром (отсутствие сил).
Диагностика туляремии
Диагностические мероприятия начинаются с осмотра пациента. Внимание обращают на воспаленные лимфоузлы, повышенную температуру тела, пятна или язвы на коже или слизистых. При обнаружении этих симптомов врач собирает эпидемиологический анамнез: возможный контакт с грызунами, укусы насекомых, купание в открытых водоемах, употребление из них сырой воды.
-
Общий анализ крови. В начале болезни обычно определяется лейкопения (снижение количества лейкоцитов), а затем лейкоцитоз (увеличение количества лейкоцитов). Также отмечается палочкоядерный нейтрофильный сдвиг формулы крови, значительная токсическая зернистость нейтрофилов, взрастает уровень моноцитов и лимфоцитов, снижается количество эозинофилов и повышается СОЭ.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

