Иммунитет при туберкулезе стерильный или нестерильный
Обновлено: 24.04.2024
Приобретённый иммунитет. Естественно приобретённый иммунитет. Инфекционный ( нестерильный ) иммунитет. Активно приобретённый иммунитет. Пассивно приобретённый иммунитет.
Приобретённый иммунитет формируется в течение жизни индивидуума и не передаётся по наследству; может быть естественным или искусственным.
Естественно приобретённый иммунитет развивается после перенесённого инфекционного заболевания, протекавшего в клинически выраженной форме, либо после скрытых контактов с микробными Аг (так называемая бытовая иммунизация). В зависимости от свойств возбудителя и состояния иммунной системы организма невосприимчивость может быть пожизненной (например, после кори), длительной (после брюшного тифа) или сравнительно кратковременной (после гриппа).
Инфекционный ( нестерильный ) иммунитет — особая форма приобретённой невосприимчивости; не является следствием перенесённой инфекции, обусловлен наличием инфекционного агента в организме. Невосприимчивость исчезает сразу после элиминации возбудителя из орга низма (например, туберкулёз; вероятно, малярия).
Искусственно приобретённый иммунитет
Состояние невосприимчивости развивается в результате вакцинации, серопрофилактики (введения сывороток) и других манипуляций.
• Активно приобретённый иммунитет развивается после иммунизации ослабленными или убитыми микроорганизмами либо их Аг. В обоих случаях организм активно участвует в созда-нии невосприимчивости, отвечая развитием иммунного ответа и формированием пула клеток памяти. Как правило, активно приобретённая невосприимчивость устанавливается через не- сколько недель после иммунизации, сохраняется годами, десятилетиями или пожизненно; по наследству не передаётся. Вакцино- или иммунопрофилактика — важнейший инструмент в борьбе с инфекционными заболеваниями — преследует создание активно приобретённой невосприимчивости.
• Пассивно приобретённый иммунитет достигается введением готовых AT или, реже, сенсибилизированных лимфоцитов. В таких ситуациях иммунная система реагирует пассивно, не участвуя в своевременном развитии соответствующих иммунных реакций. Готовые AT получают иммунизацией животных (лошадей, коров) или людей-доноров. Препараты представлены чужеродным белком, и их введение нередко сопровождается развитием неблагоприятных побочных реакций. По этой причине подобные препараты применяют только с лечебными целями и не используют для плановой иммунопрофилактики. Б целях экстренной профилактики применяют столбнячный антитоксин, антирабический Ig и др. Широкое распространение нашли антитоксины — AT, нейтрализующие токсины микроорганизмов.
Пассивно приобретённая невосприимчивость развивается быстро, обычно через несколько часов после введения препарата; сохраняется недолго и исчезает по мере удаления донорских AT из кровотока.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
У животных иммунитет определяется генетически обусловленными факторами. Иммунная реакция бывает как к инфекционным, так и неинфекционным факторам. В создании иммунитета принимает участие весь организм, все защитные механизмы которого тесно между собой взаимосвязаны. При иммунитете наряду с факторами специфической защиты (антитела, аллергия) принимают участие многочисленные неспецифические факторы (слизистые, кожа, лимфатическая система, ферменты крови, секреты, выделяемые пищеварительной системой и другие средства защиты). Все защитные реакции в организме осуществляются под воздействием нейро-гормональной регуляции.
Виды иммунитета.
Принято различать два вида иммунитета: видовой (наследственный) и приобретенный. При видовом иммунитете происходит передача иммунитета по наследству, от одного поколения другому, является весьма стойким в естественных условиях. При данном виде иммунитета животные одного вида не болеют инфекционными заболеваниями другого вида (крупный рогатый скот не болеет африканской чумой свиней, а свиньи не болеют чумой крупного рогатого скота). Приобретенный иммунитет возникает у животных в результате естественного переболевания – естественно приобретенный иммунитет или в результате искусственной иммунизации – искусственно приобретенный. Приобретенный иммунитет в свою очередь может быть активным или пассивным. Активным он будет в случае естественного переболевания той или иной инфекционной болезнью, по наследству не передается и длится месяцы и более.
В некоторых случаях он может быть пожизненным (оспа у человека, чума у собак). Искусственно приобретенный иммунитет мы получаем при вакцинации животных, когда подкожно или внутримышечно вводим ослабленных или инактивированных возбудителей инфекционных болезней или продуктов их жизнедеятельности; наступает через две недели после вакцинации и продолжается, если вакцина была живая, от нескольких месяцев до года.
Искусственно приобретенный иммунитет может быть пассивным — это когда животному вводят в кровь или подкожно иммунную или гипериммунную сыворотку, которая содержит готовые антитела против определенных возбудителей инфекционной болезни. Такой иммунитет длиться у животного 2-3 недели, причем применением гамма-глобулина длительность пассивного иммунитета можно увеличить. Этим видом иммунитета обладают и новорожденные животные, получающие готовые антитела с молозивом и молоком матери (колостральный иммунитет), он длиться несколько месяцев.
Стерильный и нестерильный иммунитет.
При некоторых инфекционных заболеваниях, когда состояние невосприимчивости связано с присутствием в организме возбудителя (туберкулез, бруцеллез и т.д.), устойчивость к новому заражению продолжается до тех пор, пока в организме животного сохраняется возбудитель данной инфекции. Такой иммунитет называется инфекционным, нестерильным или премуницией.
Данное положение используется в практике при вакцинации организма маловирулентными живыми возбудителями против туберкулеза (вакцина БЦЖ), бруцеллеза (штамм 19) и др. Состояние нестерильного иммунитета длиться иногда годами.
Иммунитет, образующийся после переболевания или вакцинации и сохраняющийся при отсутствии в организме возбудителя болезни называют стерильным.
У специалистов принято различать иммунитет в зависимости от того, на что направлено действие защитных механизмов организма – непосредственно на микробы или на их продукты. При антимикробном иммунитете происходит обезвреживание (разрушение или ингибиция) возбудителя. При антитоксическом иммунитете бактерии не разрушаются, а идет активная нейтрализация вырабатываемых ими токсинов (столбняк, ботулизм). Бывает иммунитет противогельминтный и неинфекционный.
Антимикробный иммунитет включает в себя невосприимчивость к бактериям, вирусам, риккетсиям, микоплазмам, грибам и простейшим. При антибактериальном иммунитете введенные в неиммунизированый организм авирулентные или слабовирулентные бактерии захватываются клетками ретикулоэндотелиальной системы, а также лейкоцитами крови, в результате чего организм быстро очищается от них, при введении же вирулентных бактерий в иммунный организм происходит заметная задержка в проникновении их в кровь и лимфатическую систему с места внедрения.
Противовирусный иммунитет основан, как и противобактериальный и антитоксический, на тех же механизмах защиты, но имеет ряд особенностей. При таких вирусных болезнях, как оспа, чума собак, приобретается длительный и напряженный иммунитет, однако, например, при гриппе человека или гриппе лошадей и др. вирусных болезнях иммунитет бывает непродолжительным и недостаточно напряженным.
Неспецифические факторы иммунитета.
Они многочисленны и взаимосвязанно действуют в целостной системе организма. В естественных условиях заражению организма препятствуют следующие группы защитных приспособлений:
1. Кожные и слизистые барьеры. Неповрежденные кожа и слизистые оболочки непроходимы для большинства микроорганизмов. Кожа и слизистые оболочки являются не только механическим барьером, но и стерилизующим в отношении многих микробов. Бактерицидные свойства кожи обусловлены молочной и жирной кислотами, содержащимися в секрете потовых и сальных желез. Антимикробным действием обладает секрет желез слизистых оболочек, содержащийся в слюне, слезах, носовом секрете, молоке ( лизим-белковое вещество типа энзима, растворяет бактерии, преимущественно из группы кокков). Секреты желез пищеварительного тракта оказывают бактерицидное действие на бактерии. Высокую бактерицидность имеет слюна и желудочный сок, а также желчь, обладающая способностью обезвреживать ряд вирусов.
2. Лимфатические барьеры. Те микробы, которые сумели пройти кожу и слизистые оболочки, встречаются с новым барьером — лимфатическими узлами (при попадании микробов через глотку барьером становится окологлоточное лимфатическое кольцо). Попав в лимфатические узлы, микробы захватываются клетками ретикулоэндотелиальной системы и подвергаются фагоцитозу. Барьерная функция лимфоузлов возрастает после проведенной вакцинации.
3. Фагоцитоз и воспаление. Борьба с проникшими в организм микробами, в месте внедрения которых организм отвечает воспалением, проводиться лейкоцитами (макрофагами), которые поглощают микробные клетки и своими ферментами разрушают их.
4. Гуморальные факторы. Попав в кровь, микробы встречаются с рядом защитных механизмов. Кровь и ее сыворотка обладает бактерицидной и бактериостатической активностью в отношении многих микробов (сибирской язвы, рожи свиней, стафилококков), имеющимся в ней бактериолизином. К гуморальным факторам относиться также комплемент, пропердин, термостабильный β-лизин, лизоцим и лейкины.
Все явления иммунитета регулируются нейро-гуморальным путем. При этом особое значение имеют гормоны, снижающие реактивность соединительной ткани — противовоспалительные и повышающие ее реактивность воспалительные. К противовоспалительным относятся адренокортикотропный гормон и кортизон, к воспалительным -соматотропный и гормон типа дезоксикортикостерона. Противовоспалительные гормоны угнетают выработку антител, воспалительные гормоны усиливают.
Тканевой иммунитет.
В процессе взаимодействия вируса с клеткой, наряду с гибелью одних клеток, в других происходит образование противовирусных антител -интерферона, происходит перестройка метаболизма клеток организма, не позволяющая вирусным частицам и дальше проникать в клетки и размножаться в них. Нейтрализующие вирус антитела в клетках появляются на второй день, как попал вирус в организм. В результате появления внутриклеточных антител, происходит нейтрализация вируса, без развития патологических изменений в органах.
Функциональный иммунитет.
Защитные реакции организма на действие возбудителя инфекционной болезни возникает не изолированно, а во взаимосвязи всех систем и органов. Взаимосвязь в организме осуществляет нервная система, и от типа нервной системы и ее тонуса целиком зависит уровень и качество защитных механизмов. Центральная нервная система во время болезни обеспечивает восстановление функций, нарушенных попавшим в организм возбудителем инфекции. Лихорадка, являющаяся характерным клиническим симптомом инфекционной болезни, является результатом реакции организма в целом. Она носит неспецифический, но в то же время защитный характер. Повышением температуры тела организм усиливает окислительные процессы, губительно действует на микроорганизмы, разрушая их. Проявлением данного вида иммунитета является усиление выделительной функции кишечника, почек, дыхательных путей на токсические продукты микробов и вирусов попавших в организм.
Аллергия.
При инфекционной болезни происходит повышение чувствительности организма к попавшему возбудителю и продуктам его жизнедеятельности. Такое состояние организма называется инфекционной аллергией. Она легко выявляется при хронических инфекционных болезнях, сопровождающихся премуницией (сап, туберкулез, бруцеллез и др.).
Данный факт широко используется в практической деятельности при проведении диагностических исследований на сап, туберкулез, бруцеллез.
Большое значение в регулирование иммунитета имеет нервная система. Тяжесть течения инфекционной болезни определяется функциональным состоянием высших отделов нервной системы. Перенапряжение нервной системы ослабляет противомикробную защиту организма животного. Длительный медикаментозный сон в определенных условиях резко снижает реактивность организма на некоторые токсины и виды микроорганизмов, в то же время при сибирской язве, столбняке, когда охранительное торможение отсутствует, течение болезни ухудшается.
Новорожденные животные в молозивный период обладают чувствительностью к ряду инфекционных болезней, несвойственных в дальнейшем для данного вида. Так, молодняк сельскохозяйственных животных часто переболевает колибактериозом, ягнята особенно чувствительны к столбняку и оспе. В то же время в раннем возрасте телята не болеют эмфизематозным карбункулом, поросята до 2-3 месяцев редко болеют рожей, щенята в молозивный период — чумой. Ряд инфекционных болезней поражают животных в определенном возрастном диапазоне(эмфизематозный карбункул у КРС бывает в возрасте от 3мес. до 4лет, рожа у свиней от 3 до 12месяцев и т.д.).
У взрослых животных возможен иммунитет в результате скрытой иммунизации. Если в организм систематически попадают дозы возбудителя инфекции меньше той, которая может вызвать заболевание, то происходит малозаметная иммунизация (так называемая иммунизирующая субинфекция, например отсутствие заболеваемости эмкаром у животных старше 4лет). Иммунологическая реактивность организма (антителообразование и аллергия) с возрастом нарастает.
Неинфекционный иммунитет.
Первооткрываетелем неинфекционного иммунитета является великий русский ученый И.И.Мечников, установивший общебиологический характер реакций иммунитета против клеток любой категории. Группа крови животных является постоянной генетической характеристикой организма, используется в племенной работе при селекции, генетическом контроле, в ветеринарии при переливании крови, пересадке тканей и органов, применении тканевых препаратов, биопрепаратов и др. В медицине особо актуальное значение имеют вопросы трансплантационного иммунитета и т.д.
Иммунитет при паразитарных болезнях.
К настоящему времени данный вид иммунитета находиться в стадии активного изучения. Иммунопрофилактика при паразитарных болезнях находиться в стадии разработки. Так, идет активный поиск иммунопрофилактики заболеваний, вызываемых клещами – бабезиоз, пироплазмоз. Разработан и применяется для профилактики пироплазмоза у собак ряд вакцин – Нобивак Piro, Pirodog.
Условия кормления и содержания.
Особенно данные факторы важны для малышей. Полноценное кормление и создание оптимальных условий содержания ведет к повышению общей и специфической резистентности организма. В результате неполноценного кормления (недостаток белков, авитаминоз и др.) снижается устойчивость животных к заболеваниям, уменьшается синтез в организме белков, иммунных глобулинов, ослабляется лейкоцитарная реакция. При неполноценном кормлении и нарушении зоогигиенических условий содержания, при проведении вакцинации у животных наблюдаются поствакцинальные осложнения, иммунитет у таких животных не будет достаточно напряженным.
Иммунитет — специфическая реактивность, способ защиты организма от живых тел и веществ, несущих признаки генетической чужеродности; способность высших организмов распознавать, обезвреживать и элиминировать генетически чужеродные вещества; функция специализированной системы генетического наблюдения организма — иммунной системы (Р. В. Петров).
Иммунитет при туберкулезе существенно отличается от иммунитета при других инфекциях. Инфицирования микобактериями туберкулеза не всегда сопровождается развитием заболевания, свидетельствует о наличии естественной устойчивости к ним (естественный иммунитет). Она основывается на способности организма ликвидировать возбудителя заболевания и предотвратить болезни. Природный противотуберкулезный иммунитет неодинаково выражен у разных видов животных. Среди млекопитающих слабую резистентность имеют морские свинки, кролики, обезьяны; относительно устойчивые белые мыши, человек; всего устойчивые крысы и собаки.
Следствие инфицирования МБТ у животных с относительной естественной устойчивостью зависит от многих факторов: дозы и вирулентности МБТ, пути их проникновения, а главное — от степени резистентности. Доказательством наличия естественной резистентности у человека есть секционные данные, свидетельствующие о почти 100%-ную инфицированность МБТ взрослого населения, но известно, что заболевшие составляют всего доли процента. Это свидетельствует о том, что организм человека восприимчив к туберкулезной инфекции, но, в то же время, сравнительно устойчив. Существует естественная резистентность многих тканей организма человека к туберкулезной инфекции. Это подтверждается тем, что в ранний период инфицирования происходит генерализация МБТ по всему организму, однако первичное туберкулезное очаг развивается преимущественно в легких.

В основе естественной резистентности лежат неиммунологические феномены: защитное действие неповрежденной кожи и слизистых оболочек, физико-химические особенности тканей, антимикробные гуморальные факторы (лизоцим, плазмин, (3-лизин и др.). В механизме естественной резистентности особая роль отводится фагоцитирующим клеткам, особенно макрофагам. Для туберкулеза характерно внутриклеточное паразитирование возбудителя, но взаимодействие МБТ и макрофагов не всегда заканчивается разрушением микроба.
Роль макрофагов
Установлено, что в условиях макроорганизма только около 5% МБТ уничтожаются макрофагами, другие разрушаются частично или распространяются в организме макрофагами. Эта неспособность фагоцитоза способствует привлечению в процессе иммунизации большого количества лимфоидных клеток, но с другой стороны ведет к диссеминации МБТ. Следует отметить и тот факт, что МБТ могут разрушить макрофаги и затем подвергнуться повторному фагоцитированию. Макрофаги, сливаясь друг с другом, образуют гигантские клетки Пирогова-Лангханса, что является проявлением защиты организма против МБТ.
Итак, фагоцитоз является эффективным фактором противотуберкулезной защиты. Фагоцитарная активность неоднозначная у животных с разной природной устойчивостью: у резистентных лиц происходит более выраженное угнетение размножения МБТ, чем у чувствительных видов. Неспецифические по своей сути фагоцитарные клетки осуществляют и специфические функции: захватывают и переносят антиген к иммунокомпетентным клеткам и органам.
В ответ на вторжение МБТ в организме развиваются и специфические иммунологические изменения, определяющие приобретенный противотуберкулезный иммунитет. Доказательством развития иммунитета является эффективность применения вакцины БЦЖ, предложенной Кальмет и Гереном. Исследованиями многочисленных авторов доказано, что массовая вакцинация резко уменьшила заболеваемость туберкулезом. Приобретенный иммунитет возникает не только в результате вакцинации, но и в результате естественного инфицирования. Продолжается поствакцинальный иммунитет 5-6 лет. В механизме приобретенного иммунитета играют роль три основных феномена: повышенная чувствительность замедленного типа (ПЧСТ), антителообразования и фагоцитоз.
Повышенная чувствительность замедленного типа рассматривается большинством исследователей как основное звено в механизме противотуберкулезного иммунитета. ПЧСТ или туберкулиновая аллергия — классический пример инфекционной аллергии. Она заключается в повышенной чувствительности организма к повторному введению МБТ или продуктов их жизнедеятельности (туберкулин). ПЧСТ развивается не сразу после вакцинации или инфицирования, а через определенный период инкубации (аллергический период), продолжительность которого может колебаться от нескольких дней до нескольких месяцев и зависит от вида животных, способа заражения, дозы и вирулентности МБТ. У человека этот период составляет в среднем 2-3 месяца.
Аллергия при туберкулезе
Сущность аллергии при туберкулезе давно интересует исследователей. Еще в 1891 году Р. Кох описал отличие реакций организма на первичное и повторное проникновение микобактерий туберкулеза. Это различие стала основой классического феномена Коха. Сущность феномена: у здоровых морских свинок подкожное введение МБТ вызывает местную воспалительную реакцию, которая сопровождается генерализацией инфекции; у инфицированных животных повторное введение МБТ уже через несколько часов вызывает местное воспаление, быструю язву, заживает через несколько дней. Ткани инфицированного животного создают своеобразный барьер, который защищает организм. Эта барьерно-фиксирующая способность тканей инфицированного организма является проявлением аллергии, защищающий организм от повторного проникновения МБТ.
Следствие реакции зависит от степени повышенной чувствительности, которая определяется как дозой первичного инфекта, так и продолжительностью периода между первичным и повторным инфицированием. Имеет значение и количество МБТ при повторном инфицировании.
ПЧСТ при туберкулезе — тимус зависимый иммунологический феномен, который является специфическим. Главными клетками-эффекторами ПЧСТ являются Т-лимфоциты, кооперируются с В-клетками и макрофагами. Доказательством роли Т-лимфоцитов в реализации устойчивости к МБТ есть возможность пассивного переноса ПЧСТ от сенсибилизированных животных интактным. Считают, что развитие иммунитета при туберкулезе соединенный с функцией Т-хелперов 1-го типа и синтезом определенного профиля цитокинов — интерлейкин-2 (ИЛ), интерферон-у, ИЛ-12. Это определяет главную роль в иммунитете ПЧСТ. Однако нельзя отрицать и роли Т-хелперов 2-го типа, синтезирующих другие цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13) и усиливают антителообразования (синтез специфических антител). Эти типы иммунного ответа находятся во взаимной конкуренции, но не исключено их совместное участие в реализации специфического ответа на МБТ.
Выявление ПЧСТ возможно при проведении внутрикожной туберкулиновой пробы Манту. Она и сейчас не утратила своего диагностического значения, особенно для выявления поствакцинальных аллергии и виража, однако в настоящее время появились новые методы выявления ПЧСТ, основанные на определении реакции имунокомпетентных клеток на туберкулин: реакция бластной трансформации лимфоцитов (РБТЛ), ингибирования миграции лейкоцитов (НМЛ), цитотоксический эффект сенсибилизированных лимфоцитов на клетки-мишени (ЦТЛ).
Реакции, отражающие интенсивность ПЧСТ, наиболее выраженные на высоте вакцинного иммунитета как в эксперименте, так и у вакцинированных БЦЖ людей. ПЧСТ может быть подавлена применением препаратов, действующих на Т-лимфоциты. Преднизолон, имуран и другие приводят к резкому угнетению ПЧСТ и в свою очередь к ослаблению противотуберкулезного иммунитета и прогрессирования туберкулезной инфекции.
Гуморальные реакции. Также развиваются в организме человека в результате инфицирования МБТ.
Широкий спектр противотуберкулезных антител обусловлен сложностью антигенной структуры МБТ. При этом следует отметить низкий уровень антител при туберкулезе, несмотря на выраженные антигенные свойства МБТ. Считают, что ПЧСТ индуцируется белковыми компонентами, а антителообразования — как белковыми, так и липополисахаридный фракциями. Это является причиной разнообразия специфических противотуберкулезных антител. До сих пор не определена сущность антителообразования в механизме противотуберкулезной устойчивости. Четко установлено, что антителам не свойственный защитный эффект, то есть предварительное введение их здоровому животному не предотвращает развития туберкулезной инфекции.
Установлено, что специфические противотуберкулезные антитела способны усиливать фагоцитоз. Таким образом, преимущественно клеточный характер противотуберкулезного иммунитета дополняется гуморальным звеном, которая определяет кооперацию Т-, В-лимфоцитов и фагоцитирующих клеток.
Высокий уровень антител, который имеет место при хронических формах туберкулеза, может неблагоприятно влиять на течение туберкулезного процесса. Кроме того, доказано, что антитела участвуют в комплексообразовании, высокий уровень которого нарушает трофику тканей и способствует их некротизуванию. Существует зависимость частоты выявления антител в продолжительности туберкулезного процесса. Антитела определяются чаще всего у больных с фиброзно-кавернозной формой процесса, и значительно реже — у лиц с "малыми" формами. На основании этих данных можно сделать вывод, что антитела при туберкулезе свидетельствуют о продолжительности антигенного воздействия.
Фагоцитоз
В противотуберкулезной защите очень велика роль фагоцитов, особенно макрофагов, тесно взаимодействуют с лимфоцитами. Сенсибилизированные лимфоциты осуществляют специфическое влияние на макрофаги с помощью синтезируемых ими цитокинов, благодаря чему макрофаги и другие фагоцитирные клетки привлекаются в очаг повторного вторжения МБТ, усиливается их способность к перевариванию гиоглиненю МБТ, подавляется рост МБТ в очаге воспаления. Этот эффект лимфоцитов специфический.
В свою очередь контакт фагоцитирующих клеток с МБТ сопровождается синтезом цитокинов (провоспалительного, противовоспалительного действия), которые обеспечивают клеточную взаимодействие при развитии реакций противотуберкулезного иммунитета. В макрофагах резко усиливаются метаболические процессы, ферментативная активность (гидролазы, протеазы, фосфолипазы и др.). Макрофаги неоднородны по своей значимости. Некоторые осуществляют активный фагоцитоз или выполняют синтетическую функцию, обеспечивающую межклеточное взаимодействие. Существенная роль уделяется их способности к выводу иммунных комплексов из организма.
Результат взаимодействия между МБТ и макрофагами зависит от функционального состояния последних, а именно от их способности синтезировать гидролитические ферменты, цитокины, метаболиты кислорода. Угнетение фагоцитарной и секреторной способности макрофагов, еще может иметь место при иммунодефицитных состояниях различного генеза (облучение, интоксикация, иммуносупрессивная терапия и т.д.), способствует персистенции МБТ.
Клетки эндотелия кровеносных сосудов
В развитии иммунного ответа на МБ1 участвуют и клетки эндотелия кровеносных сосудов, выделяют биологически активные вещества: адгезивные молекулы, различные цитокины факторы роста. Они обеспечивают взаимодействие эндотелия с другими клеточными элементами (Т-лимфоциты, макрофаги, нейтрофилоциты, тромбоциты). В последние годы клеткам эндотелия отводится существенная роль как в реализации защитных реакций, так и в иммунопатологических процессах.
Состояние, возникающее после вакцинации БЦЖ или после первичного инфицирования, не определяет абсолютной устойчивости против МБТ. Интенсивность противотуберкулезной защиты зависит как от характера антигенного воздействия (вид возбудителя, вирулентность, массивность) так и от состояния макроорганизма, в первую очередь от состояния иммунной системы (наличия врожденного иммунодефицита), а также факторов, которые могут вызвать вторичную ее дефектность: облучение, употребление имуноденресантов, интоксикация. Играют роль другие факторы: состояние нервной, эндокринной систем, характер обменных процессов и др.
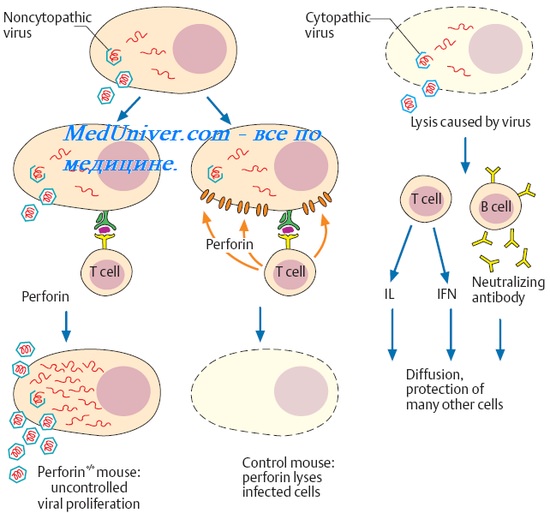
Долгое время считалось, что иммунитет при туберкулезе носит "нестерильный" характер. Это основывалось на том, что для поддержания иммунитета необходимо обязательные наличие в организме МБТ или их субстанций. Однако исследования многих авторов к вели, что для поддержания иммунитета наличие живых микроорганизмов не нужно.
Иммунологическая память
Это сохранение антигенных детерминант на клеточных элементах крови и в сыворотке крови (М. М. Авербах). В механизме поддержки иммунитета этот феномен играет большую роль.
Серьезной проблемой фтизиатрии является широкое инфицирование практически здорового населения; большинство лиц туберкулинпозитивные, что свидетельствует о наличии персистирующей туберкулезной инфекции. Очень важное значение имеет выявление среди них групп риска, в которых возможно развитие заболевания. Нужны критерии определения активации старых очагов, в которых могут храниться МБТ в той или иной форме.
Многие авторы связывают заболевания туберкулезом и реактивации туберкулезной инфекции со снижением естественной сопротивляемости и приобретенного противотуберкулезного иммунитета. В клинике нет возможности оценить состояние иммунной системы к заболеванию, поэтому нельзя с полной достоверностью совместить развитие патологии с начальными нарушениями иммунной системы.
Однако известно, что более высокая заболеваемость туберкулезом встречается у больных диабетом, у переболевших корью, у ВИЧ-инфицированных, то есть у лиц с нарушениями в иммунной системе. Проблема иммунодефицита актуальна также потому, что значительно увеличивается число больных туберкулезом среди лиц, злоупотребляющих наркотиками.
Различная степень естественной устойчивости к туберкулезной инфекции различных видов животных и человека связана с генетическими факторами, определяющими разную склонность к заболеваемости разных людей. Выполнено достаточно много исследований, доказавших ассоциации генов НLА-системы с устойчивостью к туберкулезу. Показано, что неблагоприятное течение туберкулезного процесса чаще встречается у лиц с БК-2 антигенами, благоприятный — с ОК.-3. Гены НLА-комплекса I и II классов являются важными факторами, определяющими патогенез туберкулеза, контролируя устойчивость и восприимчивость к туберкулезной инфекции.
Иммунитет - это "личный телохранитель" человека, защищающий его от влияния агрессивных факторов внешней среды. В медицинской науке описаны несколько видов иммунитета и способы его регуляции и профилактики.
Иммунитет (от латинского Immunitas – освобождение) – невосприимчивость, сопротивляемость организма инфекциям и вторжению чужеродных организмов (в том числе — болезнетворных микроорганизмов) и относительная устойчивость к вредным веществам.
В более широком смысле это - способность организма противостоять изменению его нормального функционирования под воздействием внешних факторов. Главная функция иммунной системы - сохранять "свое" и устранять чужеродное.
Различают несколько видов иммунитета:
Специфический и неспецифический иммунитет
Неспецифический (врожденный) иммунитет – это однотипные реакции организма на любые чужеродные антигены.
Главным клеточным компонентом системы неспецифического иммунитета служат фагоциты, основная функция которых - захватывать и переваривать проникающие извне агенты.
Для возникновения подобной реакции чужеродный агент должен иметь поверхность, т.е. быть частицей (например, заноза).
Если же вещество молекулярно-дисперсное (например, белок, полисахарид, вирус), не токсичное и не обладает физиологической активностью, оно не может быть нейтрализовано и выведено организмом по вышеописанной схеме.
В этом случае срабатывает специфический иммунитет. Он приобретается в результате контакта организма с антигеном и характеризуется формированием иммунологической памяти. Его клеточными носителями служат лимфоциты, а растворимыми - иммуноглобулины (
Первичный и вторичный иммунный ответ
Специфические антитела продуцируются специальными клетками - лимфоцитами. Причем для каждого вида антител существует свой тип лимфоцитов (клон).
Первое взаимодействие антигена (бактерии или вируса) с лимфоцитом вызывает реакцию, названную первичным иммунным ответом, в ходе которого лимфоциты начинают развиваться в виде клонов. Затем некоторые из них становятся клетками памяти, другие превращаются в зрелые клетки, продуцирующие антитела. Главные особенности первичного иммунного ответа - существование латентного периода до появления антител, затем выработка их лишь в небольшом количестве.
Вторичный иммунный ответ развивается при последующем контакте с тем же самым антигеном. Основная особенность – быстрое развитие лимфоцитов с дифференцировкой их в зрелые клетки и быстрая выработка большого количества антител, которые высвобождаются в кровь и тканевую жидкость, где могут встретиться с антигеном и эффективно побороть болезнь.
Естественный и искусственный иммунитет
К факторам естественного иммунитета относят иммунные (система комплемента, лизоцим и др. белки) и неиммунные механизмы (кожа, слизистая, секрет потовых, сальных, слюнных желез, желез желудка, нормальная микрофлора).
Искусственный иммунитет вырабатывается при введении в организм вакцины или иммуноглобулина.
Активный и пассивный иммунитет
Активная иммунизация стимулирует собственный иммунитет человека, вызывая выработку собственных антител. После инфекции в организме остаются "клетки памяти", и в случае последующих столкновений с возбудителем они начинают снова (уже быстрее) продуцировать антитела.
При пассивной иммунизации в организм вводятся уже готовые антитела (гаммаглобулин). Введенные антитела при столкновении с возбудителем "расходуются" (связываются с возбудителем в комплекс "антиген-антитело").
Пассивная иммунизация показана, когда необходимо в короткие сроки создать иммунитет на непродолжительное время (например, после контакта с больным).
Стерильный и нестерильный иммунитет
После некоторых заболеваний иммунитет сохраняется пожизненно, например, при кори или ветряной оспе. Это так называемый стерильный иммунитет. А в некоторых случаях он сохраняется только до тех пор, пока в организме есть возбудитель (туберкулез, сифилис) - это нестерильный иммунитет.
Регуляция иммунитета
Работа иммунитета во многом определяется состоянием нервной и эндокринной систем организма. Стресс, депрессии угнетают иммунитет, что сопровождается не только повышенной восприимчивостью к различным заболеваниям, но и создает благоприятные условия для развития злокачественных новообразований.

Обзор
Автор
Редакторы

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Тем не менее диагностика — это еще не диагноз, и результат любого теста не является истиной в последней инстанции. Диагноз же по-прежнему ставят, исходя из нескольких составляющих:
- клинической картины;
- наличия контакта с туберкулезным больным;
- рентгенографии легких, флюорографии или компьютерной томографии;
- результатов диагностических тестов.
Однако большинство этих методов диагностируют туберкулез постфактум — только скрининговые тесты помогают выделить лиц с высоким риском развития заболевания или с только зарождающимся процессом. И уже более 100 лет основным методом массовой диагностики туберкулеза является туберкулиновая проба Манту 2 ТЕ (содержащая 2 туберкулиновые единицы). Тест спорный, со множеством ложноположительных результатов, но именно его используют во всем мире и отказываться пока не собираются.
Проба Манту
В мире используют 3 вида туберкулина (рис. 1): датский препарат PPD (purified protein derivative) RT 23, американский PPD-S и российский — PPD-L. Различаются они видами микобактерий, из которых были получены: при производстве датского и американского препаратов используют только M. tuberculosis, а при производстве российского — смесь из M. tuberculosis и M. bovis (микобактерии, вызывающей туберкулез у крупного рогатого скота; на основе этого штамма была разработана вакцина БЦЖ). Различие в составах туберкулина обусловливает разные границы положительного результата: 15 мм для детей, привитых БЦЖ, и не более 10 мм для непривитых детей до 5 лет у датского препарата, не более 10 мм у американского и 5 мм у российского [4].

Рисунок 1. Препараты туберкулина
Диагностику с помощью пробы Манту проводят следующим образом: небольшое количество туберкулина вводят под кожу чуть выше запястья и через 72 часа оценивают реакцию, которую считают положительной, если в месте введения появляется припухлость (папула) более 5 мм в диаметре. В зависимости от ее размера, различают степень реакции от отрицательной (0–1 мм) до резковыраженной, или гиперергической (17 мм и более у детей и подростков, 21 мм и более у взрослых) [5]. И тут начинаются трудности, потому что у привитых БЦЖ реакция Манту положительна [6]! Мало того, чем больше поствакцинальный рубец, тем выше чувствительность к туберкулину [7]. Поэтому у привитых БЦЖ оценивают не только диаметр папулы, но и размер поствакцинального рубчика (табл. 1).
| Срок, прошедший с момента вакцинации БЦЖ | Размер рубчика после БЦЖ | Привитый иммунитет (мм) | Неясная причина | Подозрение на инфицирование |
|---|---|---|---|---|
| 1 год | 6–10 мм | 5–15 мм | 16 мм | Более 17 мм |
| 2–5 мм | 5–11 мм | 12–15 мм | Более 16 мм | |
| 0 мм | 2–4 мм | 5–11 мм | Более 12 мм | |
| 2 года | Вне зависимости от размера | Уменьшение размера папулы или прежний ее размер | Увеличение размера на 2–5 мм от предыдущего положительного результата | Реакция изменяется на положительную или папула увеличивается более чем на 5 мм |
| 3–5 лет | Вне зависимости от размера | 5–8 мм либо уменьшение размера папулы | Увеличение размера на 2–5 мм за последний год или отсутствие тенденции к уменьшению | Изменение на положительную (5 мм) реакцию или увеличение папулы на 6 мм; 12 мм при впервые поставленной пробе; изменение предыдущего размера на 2–4 мм или размер в 12 мм |
| 6–7 лет | Вне зависимости от размера | 0–4 мм | 5 мм | 6 мм и более |
| 7–9 лет | Если в 7 лет ребенку была сделана ревакцинация БЦЖ, реакция Манту вновь становится положительной и нормы повторяются | 0–4 мм | 5 мм | 6 мм и более |
| Взрослые | Отрицательная реакция, покраснение любого диаметра; папула до 4 мм | Более 5 мм |
Безусловно, метод оценки результата довольно субъективный. Но главное, папулу надо еще правильно измерить, зафиксировав только размер выпуклой части и игнорируя покраснение вокруг нее (рис. 2).

Рисунок 2. Правильная и неправильная оценки диаметра папулы
Еще одна трудность с диагностическими возможностями пробы Манту связана с тем, что они зависят от нижней границы положительного результата: чем ниже граница, тем больше будет наблюдаться ложноположительных реакций. К примеру, в России пороговым значением является папула в 5 мм. Это приводит к гипердиагностике — большому количеству зафиксированных реакций, но в итоге к низкому проценту реально выявленных случаев инфицирования [4].
В общем, не удивительно, что в последнее время информативность туберкулиновой пробы постоянно ставится под сомнение. Мало того, она может вызывать не связанные с туберкулезом аллергические реакции, поэтому все больше здоровых, но склонных к аллергии детей вынуждены идти в тубдиспансер в надежде выяснить причину положительной реакции. И наконец, на результат пробы может влиять множество факторов: недавно перенесенные инфекции, хронические заболевания, прием медикаментов, изменение гормонального фона или иммунитет к нетуберкулезным микобактериям [7].
Если говорить о достоинствах пробы Манту, то кроме низкой себестоимости, ими будут возможность выявления туберкулеза на ранних стадиях развития (за исключением лиц с иммуносупрессией и маленьких детей до двух лет [7]) и более высокая диагностическая ценность у непривитых БЦЖ по сравнению с привитыми (от 50% и ниже против 65,4% [6], [9]).
Мифы о пробе Манту

Рисунок 3. Антигены ESAT-6 и CFP-10
Что нужно знать о кожных пробах?
Анализы крови на туберкулез: плюсы и минусы
- в ранние сроки инфицирования;
- при иммунодефицитных состояниях;
- при неправильном заборе крови или ее транспортировке;
- из-за ошибок во время расшифровки результатов.
Добавлю, что тесты IGRA требуют наличия качественного оборудования, специальных реактивов и квалифицированного персонала, поэтому себестоимость у них довольно высока.
Кроме того, по сравнению с кожными тестами существенным недостатком этих анализов является определение in vitro только образования гамма-интерферона или активности Т-клеток. Поэтому в странах с высокой заболеваемостью (а Россия, несомненно, в их числе с показателем более 50 больных на 100 000 населения [13]) у IGRA-анализов нет никаких дополнительных преимуществ [12]. Тем более что их способность диагностировать туберкулезный процесс колеблется в районе 42–90% для разных возрастных групп, к тому же они не маркируют латентное носительство [12]. Другими словами, для жителей нашей страны анализы крови на туберкулез в общем-то напрасная трата денег, хотя в странах с низкой заболеваемостью (США, Канада, Западная Европа) они более информативны и рекомендованы к замене туберкулиновых проб для привитых БЦЖ [14].
В мире живет более полумиллиарда латентных носителей M. tuberculosis. Причем, далеко не каждый из них в итоге заболевает, потому что размножение микобактерии сдерживает иммунная система. Например, из 100 инфицированных палочкой Коха детей, лишь у одного развивается активная форма туберкулеза, поэтому диагностические тесты направлены не только на выявление латентных носителей, но и на оценку риска развития заболевания [15].
Анализы крови vs кожные тесты: сравнение эффективности
При оценке эффективности тестов для диагностики туберкулеза чаще всего учитывают два параметра: чувствительность (sensitivity) и специфичность (specificity). Под чувствительностью понимают способность метода выявлять лиц с заболеванием или носителей с высоким риском развития туберкулеза. Под специфичностью — способность теста правильно идентифицировать людей, у которых нет туберкулеза (то есть этот параметр характеризует риск появления ошибочных ложноположительных результатов) [12].
Какой тест все-таки выбрать?
Как говорится, при всем богатстве выбора альтернатив немного. К сожалению, при выборе теста многие руководствуются не его диагностическими характеристиками, а безвредностью для здоровья, потому что фенол в составе кожных проб пугает многих. И существует даже движение против пробы Манту, группа поддержки которого периодически предлагает заменить ее анализами крови IGRA. Но, как было отмечено выше, у подобных страхов нет никаких оснований. В придачу, являясь продуктом жизнедеятельности организма, фенол не накапливается, а выводится вместе с мочой. Поэтому главными критериями все-таки являются чувствительность и специфичность тестов.
Читайте также:

