Иммунология борьба с вич
Обновлено: 18.04.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.

Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.

Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
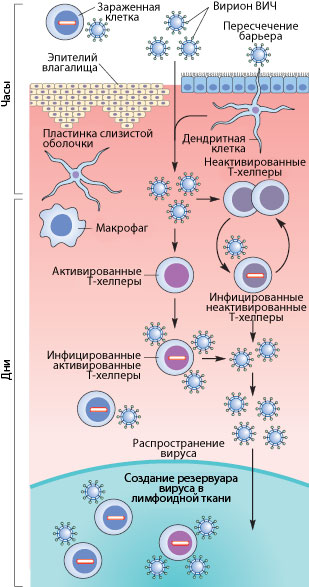
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.

Новость
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.
Автор
Редактор

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.

Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.

Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).

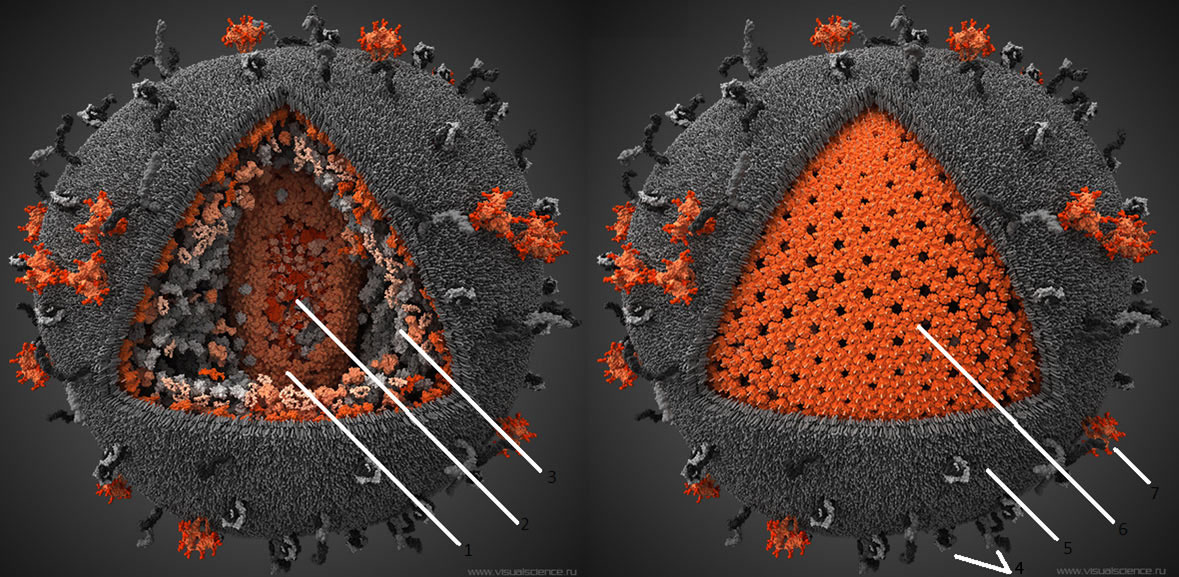
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.

Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).

Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.

Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.

Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
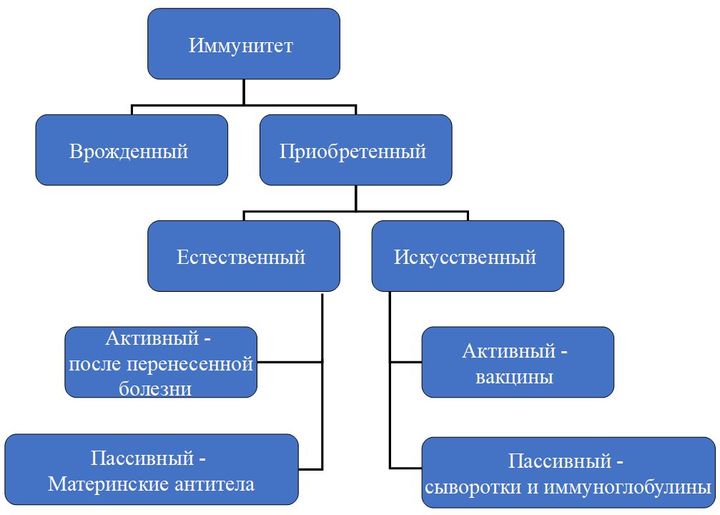
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
по теме
Лечение
Как устроен иммунитет: Объясняем по пунктам
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.
Иммунный ответ: как это все работает?
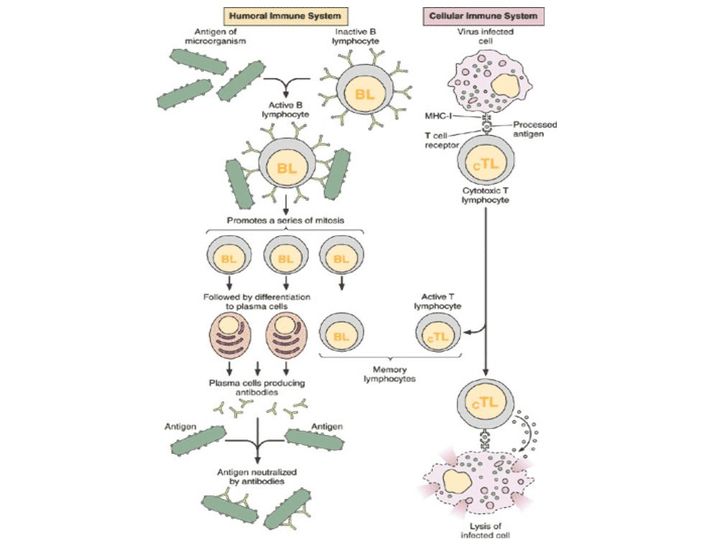
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
по теме

Лечение
Гид по вакцинам. Когда и какую прививку сделать? А главное: надо ли вообще прививаться? (Спойлер: конечно, надо)
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.
Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?
Читайте также:

