Иммунорегуляторный индекс при вич
Обновлено: 19.04.2024

ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Иммунологическое исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Т-лимфоциты (CD3+ клетки)
Повышенное количество CD3+ клеток свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки)
Снижение В - лимфоцитов ( CD19 + клеток ) наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, при новообразованиях иммунной системы, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+
Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+
Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+
Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Соотношение CD4+/CD8+
Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7). Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе. Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+
Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Рецептор CD95+ –
Рецептор CD95 + - один из рецепторов апоптоза. Апоптоз – сложный биологический процесс, необходимый для удаления из организма поврежденных, старых и инфицированных клеток. Рецептор CD95 экспрессируется на всех клетках иммунной системы. Он играет важную роль в контроле функционирования иммунной системы, так как является одним из рецепторов апоптоза. Его экспрессия на клетках определяет готовность клеток к апоптозу.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к IL2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.

Антиретровирусное лечение (АРТ) превратило вирус иммунодефицита человека (ВИЧ) из смертельной болезни в хроническое заболевание, которое потенциально мало влияет на продолжительность жизни. Современная АРТ может устранить виремию и снизить риск передачи. Национальные данные из США показывают, что у 81% инфицированных людей, получающих АРТ, вирусная супрессия подавлена. При доступном лечении заболеваемость и смертность от ВИЧ определяются не оппортунистическими инфекциями или заболеваниями, определяющими к СПИДу, а скорее состояниями, не связанными со СПИДом, включая сердечно-сосудистые заболевания, заболевания печени, заболевания почек, злокачественные новообразования, нейрокогнитивные расстройства и даже аутоиммунные заболевания. Некоторых врачей может удивить сосуществование аутоиммунитета с ВИЧ; однако его присутствие показывает, что иммунопатология ВИЧ больше соответствует иммунной дисфункции, чем одному только подавлению иммунитета.
Вирусная нагрузка ВИЧ и связанное с этим снижение абсолютного количества Т-лимфоцитов CD4 исторически служили биомаркерами иммуносупрессии ВИЧ и ответа на лечение. Однако при успешной современной АРТ и вирусной супрессии абсолютное количество CD4 и вирусная нагрузка ВИЧ могут неточно отражать риски, с которыми сталкиваются пациенты, поскольку иммунная дисфункция сохраняется, несмотря на нормализацию количества CD4. Одно из объяснений состоит в том, что эти маркеры не могут правильно описать общую иммунную дисфункцию ВИЧ, которая способствует сегодняшней заболеваемости и смертности..
Иммунорегуляторный индекс ( CD4/CD8)
Отношение CD4 / CD8 более точно описывает эту общую иммунную дисфункцию и может быть лучшим биомаркером прогрессирования заболевания, ответа на лечение, заболеваемости и смертности для подавленных вирусом пациентов . Нормальное соотношение CD4 / CD8 у здоровых хозяев плохо определено. Обычно нормальным считается соотношение от 1,5 до 2,5; Однако, широкая гетерогенность существует потому , что ол, возраст, этническая принадлежность, генетика, внешние воздействия и инфекции могут повлиять на всем соотношение. Нормальные соотношения могут инвертироваться посредством изолированной апоптотической или целевой гибели циркулирующих клеток CD4, размножения клеток CD8 или комбинации обоих явлений. Низкий индекс или инвертированное отношение CD4 / CD8 является иммунным фенотипом риска и связан с измененной иммунной функцией, иммунным старением, и хроническим воспалением в обеих ВИЧ-инфицированных и неинфицированные популяциях.
Распространенность инвертированного соотношения CD4 / CD8 увеличивается с возрастом. Обратное соотношение наблюдается у 8% людей в возрасте от 20 до 59 лет и у 16% в возрасте от 60 до 94 лет. У женщин всех возрастных групп меньше шансов иметь обратное соотношение, чем у их коллег-мужчин. Предполагается, что возрастная и гормональная атрофия тимуса объясняет различия между популяциями. Гормональное влияние на соотношение подтверждается корреляцией между низким уровнем эстрадиола в плазме, высоким циркулирующим CD8 и низким соотношением CD4 / CD8 у женщин с преждевременной недостаточностью яичников. Мышиные модели дополнительно подчеркивают важность возраста и эстрогена для соотношения CD4 / CD8, поскольку более низкие соотношения наблюдаются у мышей после естественной менопаузы и овариэктомии . Сохранение тимуса связано с лучшим коэффициентом восстановления при лечении ВИЧ
В условиях иммунной дисфункции может возникнуть ненормальное соотношение CD4 / CD8. Кроме того, в то время как ненормальное отношение не равномерно присутствует при всех аутоиммунных заболеваний, пониженное соотношение CD4 / CD8 последовательно видно на системной красной волчанки. Низкое соотношение CD4 / CD8 отражает разрушение β-клеток и может прогнозировать диагноз диабета у родственников первой степени родства пробандов с диабетом 1 типа. В популяционном исследовании солидных новообразований инвертированное соотношение CD4 / CD8 ассоциировано с метастатическим заболеванием по сравнению с онкологическими пациентами без метастазов. Более того, после острого инфаркта миокарда и сердечно-легочной реанимации фиксированное низкое соотношение CD4 / CD8 является плохим прогностическим признаком. Несмотря на эти ассоциации, важно признать, что наличие низкого отношения CD4 / CD8 не является однозначно причиной или следствием вышеуказанной патологии. Это признание дополнительно подчеркивается наличием низкого коэффициента в условиях, выходящих за рамки традиционной органической патологии, включая связь между низким коэффициентом и пессимистами
Исследования в Испании и Великобритании показали, что, хотя низкое соотношение CD4 / CD8 было связано со временем до смерти в нескорректированных анализах, никакой связи между этим соотношением и заболеваемостью не было обнаружено в многомерных анализах . Более того, недавнее перекрестное исследование дряхлости и проспективное когортное исследование заболеваемости жителей канадских домов престарелых показало, что больший процент CD8 + Т-клеток центральной памяти был более предсказуемым для повышенной хрупкости, чем другие иммунные фенотипы, включая инвертированный CD4 / CD8. соотношение. Таким образом, соотношение CD4 / CD8 не может быть маркером заболеваемости и / или смертности во всех популяции
ВИЧ - инфекцию без лечением и с лечением
Без лечения ВИЧ-инфекция снижает соотношение CD4 / CD8. В некоторых группах населения начало АРТ может увеличить это соотношение; однако необходимо раннее и непрерывное лечение. Если АРТ начинают во время первичной ВИЧ-инфекции, у 90% пациентов соотношение CD4 / CD8 нормализуется в течение 6 лет противовирусной терапии, и почти у всех нормализуется в течение десятилетия И наоборот, если АРТ начинают во время хронической ВИЧ-инфекции, то у большинства пациентов не удастся нормализовать это соотношение даже после 14 лет подавления вируса и восстановления уровня CD4 до > 500 . Прерывание лечения также отрицательно сказывается на соотношении, поэтому следует подчеркнуть раннее начало АРТ и постоянное соблюдение режима терапии.
Оптимальная схема лечения для нормализации соотношения неизвестна. Предполагается, что режимы на основе ингибитора интегразы, а не ненуклеозидного ингибитора обратной транскриптазы или ингибитора протеазы лучше всего улучшают иммунную дисфункцию. Более быстрая нормализация соотношения CD4 / CD8 при использовании режимов на основе ралтегравира и эфавиренца подтверждает заявление о превосходстве ингибиторов интегразы . Влияние новых ингибиторов интегразы, таких как долутегравир и элвитегравир, неизвестно.
Цитомегаловирусная (ЦМВ) инфекция оказывает значительное влияние на соотношение CD4 / CD8 как в ВИЧ-положительных, так и в отрицательных популяциях за счет увеличения количества CMV-специфических клеток CD8. Такое накопление CMV-специфических клеток CD8 снижает соотношение CD4 / CD8, что приводит к фенотипу иммунного риска. В популяциях, не инфицированных ВИЧ, эти клональные экспансии очевидны у пожилых людей; однако в ВИЧ-инфицированной популяции эти CMV-специфические клональные экспансии CD8 наблюдаются в более молодом возрасте. Коинфекция ЦМВ может представлять собой потенциальную терапевтическую цель для изменения соотношения. При коинфекции ВИЧ и ЦМВ стойкие низкие уровни репликации ЦМВ связаны с более низким соотношением CD4 / CD8 как при постановке диагноза, так и во время АРТ .
Более того, снижение активированных CD8 Т-клеток наблюдается в условиях краткосрочного лечения ЦМВ валганцикловиром у коинфицированных пациентов.
Раннее, эффективное и непрерывное АРТ улучшает соотношение CD4 / CD8. Также показано, что раннее начало АРТ уменьшает размер резервуара ВИЧ. Следовательно, использование соотношения CD4 / CD8 в качестве периферического суррогата резервуара ВИЧ является гипотезой, заслуживающей исследования. Исследователи связали соотношение CD4 / CD8 с интегрированными уровнями ДНК ВИЧ в клетках периферической крови . Точно так же показана обратная корреляция между соотношением CD4 / CD8 и частотой CD4 Т-клеток, несущих ВИЧ-провирусную ДНК . Более того, более низкие соотношения во время АРТ также связаны со стойким повышением уровня ДНК ВИЧ, несмотря на измеримое подавление РНК ВИЧ
Приводят ли другие хронические инфекции, такие как туберкулез, диморфные грибы, токсоплазмоз или лейшманиоз, к увеличению CD8 с измененными соотношениями, менее хорошо изучено, но, вероятно, чаще встречается у ВИЧ-инфицированных, чем у неинфицированных людей.
Иммунорегуляторный индекс , как индикатор прогноза
Низкое соотношение ( CD4/CD8 ) а не абсолютное количество CD4, является основным фактором, связанным с отсутствием желаемого ответа после вакцинации против гепатита В и желтой лихорадки. Низкие коэффициенты связаны с ВИЧ и развитием нейрокогнитивных расстройств, рака легких и хронической обструктивной болезни легких, тогда как повышение уровня активированных клеток CD8 связано с инфарктом миокарда. Это соотношение независимо связано с маркерами возрастного заболевания, включая толщину интима-медиа сонных артерий, жесткость артерий, скорость клубочковой фильтрации и саркопению/ Эти исследования демонстрируют аналогичные доказательства измененной иммунной функции и хронического воспаления, наблюдаемые в когортах неинфицированных пожилых людей; однако у ВИЧ-позитивных людей активация иммунной системы и старение наблюдаются в гораздо более молодом возрасте/

Вирус Эпштейн - Барр - это широко распространенный вирус герпеса человека, который обладает уникальной способностью инфицировать, активировать и латентно сохраняться в В-лимфоцитах на протяжении всей жизни инфицированного человека. Во время первичной инфекции EBV , передаваемый через слюну, поражает нативные В-клетки в миндалинах путем связывания поверхностного гликопротеина вируса gp350 с рецептором комплемента 2 (также известным как CD21), который экспрессируется зрелыми В-клетками и фолликулярными дендритными клетками .
В развивающихся странах большинство детей инфицируются в течение первых трех лет жизни, и серопозитивность по EBV достигает 100% в течение первого десятилетия. Эти ранние первичные инфекции почти всегда протекают бессимптомно. Напротив, в развитых странах до половины детей все еще остаются серонегативными по EBV в конце своего первого десятилетия жизни и впоследствии заражаются при интимном оральном контакте в подростковом или юношеском возрасте. До 50% этих отсроченных первичных инфекций носят симптоматический характер и проявляются как острый инфекционный мононуклеоз. Когда первичная инфекция EBV возникает в раннем детстве, как это обычно бывает в развивающихся странах, она протекает бессимптомно, но когда она откладывается до подросткового возраста или позже, как в развитом мире, она обычно проявляется. как инфекционный мононуклеоз, при котором количество латентно инфицированных В-клеток памяти может возрасти до половины, а возможно, даже выше, от компартмента периферических В-клеток памяти. Неясно, почему следует инфицировать более высокую долю В-клеток, если первичная инфекция откладывается от детства до подросткового возраста или позже. Возможные объяснения включают более высокую дозу вирусного инокулята, полученного при интимном оральном контакте, и пониженную способность вызывать быстрый эффективный CD8 + Т-клеточный ответ у подростков / взрослых по сравнению с маленькими детьми.
Диагностика инфекции вирусом Эпштейн - Барр
Золотым стандартом для обнаружения EBV-инфицированных B-клеток в гистологическом материале является гибридизация in situ для кодируемой EBV малой РНК (EBER-ISH) , что позволяет определять частоту В-клеток, инфицированных вирусом гепатита В, в инфильтратах В-клеток. Однако, если вирусная нагрузка ткани определяется как общее количество копий генома EBV, определенное с помощью полимеразной цепной реакции (ПЦР), то невозможно определить, является ли значительное увеличение вирусной нагрузки результатом большого увеличения частоты латентно инфицированные В-клетки, которые экспрессируют от двух до пяти копий вирусного генома на клетку, или очень небольшого увеличения доли инфицированных клеток, реплицирующих вирус, которые содержат тысячи геномов на клетку. На вероятность обнаружения EBV в органе-мишени также влияет размер образца ткани, при этом вероятность обнаружения при биопсии ниже, чем при исследовании всего органа
Исследования с использованием EBER-ISH выявили повышенную частоту EBV-инфицированных В-клеток в слюнных железах при синдроме Шегрена , толстой кишке при язвенном колите и болезни Крона , головном мозге при рассеянном склерозе , тимусе при миастении и щитовидной железе при болезни Грейвса. Исследования с использованием только ПЦР показали повышенные уровни ДНК EBV в печени при первичном билиарном циррозе , почках при IgA-нефропатии и мембранозной нефропатии и легких при идиопатическом фиброзе легких. В то время как концепция органа-мишени ясна для органоспецифического аутоиммунитета, это менее ясно для системного аутоиммунитета. При системной красной волчанке например, повреждение ткани может быть опосредовано либо аутоантителами, продуцируемыми в лимфоидных органах, удаленных от ткани-мишени, либо прямой лимфоцитарной инфильтрацией нелимфоидных органов, таких как почки.
Абсолютный размер популяции CD8 + Т-клеток у здоровых людей уменьшается в три раза в возрасте от 2 до 16 лет Здесь предполагается, что генетически детерминированный дефицит Т-лимфоцитов CD8 + не ведет к нарушению контроля над EBV , когда первичная инфекция происходит в раннем детстве, если дефицит не является серьезным, но когда первичная инфекция происходит в подростковом или взрослом возрасте после нормального возраста - связанное с этим резкое снижение количества CD8 + Т-клеток и тот же генетический дефицит CD8 + Т-клеток с большей вероятностью ухудшит контроль над инфекцией EBV.
Вирус Эпштейн - Барр и В - клетки
EBV выводит инфицированную В-клетку из состояния покоя и превращает ее в активированный В-бласт, а затем использует нормальные пути дифференцировки В-клеток, так что В-бласт дифференцируется в зародышевом центре и становится латентно инфицированной В-клеткой памяти покоя, которая выходит из зародышевого центра и циркулирует в крови. Латентно инфицированные В-клетки памяти, возвращающиеся в миндалины, могут окончательно дифференцироваться в плазматические клетки, которые инициируют литический (репликативный) цикл с образованием инфекционного вируса. Полученные в результате свободные вирионы инфицируют эпителиальные клетки миндалин, где вирус реплицируется с высокой скоростью и постоянно выделяется в слюну для передачи новым хозяевам. Новообразованный вирус также может инфицировать дополнительные нативные В-клетки у того же хозяина.
Латентно инфицированные В-клетки памяти обнаруживают молекулярные признаки классических антиген-отобранных В-клеток памяти, а именно соматическую гипермутацию и рекомбинацию их иммуноглобулиновых (Ig) генов с переключением классов. При нормальной дифференцировке B-клеток нативные B-клетки активируются антигеном через B-клеточный рецептор (BCR) и с помощью T-клеток через рецептор CD40, так что они пролиферируют и прогрессируют через реакцию зародышевого центра. Примечательно, что EBV экспрессирует два белка, латентный мембранный белок 2A (LMP2A) и LMP1, которые имитируют активированный антигеном BCR и активированный рецептор CD40 соответственно. В миндалинах LMP2A и LMP1, по-видимому, работают синергетически с передачей сигналов BCR и CD40, соответственно
Экспансия моноклональных или олигоклональных B-клеток происходит в щитовидной железе при тиреоидите Хашимото , слюнных железах при синдроме Шегрена , синовиальной оболочке при ревматоидном артрите , спинномозговой жидкости при рассеянном склерозе , печени при первичном билиарный цирроз, мышцы при дерматомиозите и полимиозите и кровь при системной красной волчанке. Эти клонально размноженные В-клетки демонстрируют молекулярные признаки реакции зародышевого центра, управляемой антигеном, а именно соматическую гипермутацию и высокое соотношение мутаций замещения к молчащим мутациям в определяющих комплементарность областях генов вариабельной (V) области Ig.
Вирус Эпштейн - Барр и Т - клетки
Вирус Эпштейн - Барр и аутоиммунные заболевания
Вирус Эпштейна-Барра (EBV) подозревался в участии в патогенезе различных хронических аутоиммунных заболеваний с момента обнаружения повышенных уровней антител к этому вирусу при системной красной волчанке (СКВ) в 1971 году. Обычно эффект инфекции EBV объясняется иммунологической перекрестной реактивностью между EBV и аутоантигенами. Однако в 2003 г. гипотеза аутоиммунных заболеваний, связанных с инфицированием EBV, была предложена в качестве основы для этиопатогенеза хронических аутоиммунных заболеваний человек. Эта гипотеза предполагает, что у генетически предрасположенных индивидуумов аутореактивные В-клетки, инфицированные EBV , засевают орган-мишень, где они вырабатывают патогенные аутоантитела и обеспечивают костимулирующие сигналы выживания аутореактивным Т-клеткам, которые в противном случае умерли бы в органе-мишени в результате индуцированного активацией апоптоза. Вероятно, предрасположенность к развитию хронических аутоиммунных заболеваний после инфицирования EBV зависит от генетически детерминированного количественного дефицита цитотоксических CD8 + Т-клеток, которые обычно держат инфекцию EBV под жестким контролем.
С 1980 годом было признано , что доля и количество CD8 + Т - клеток в периферической крови уменьшаются , и что отношение CD4 / CD8 увеличивается у пациентов с аутоиммунными заболеваниями, в том числе при рассеянном склерозе (MS), ревматоидном артрите , системной красной волчанке , синдроме Шегрена , системном склерозе , дерматомиозите , первичном билиарном циррозе , первичном склерозирующем холангите , язвенном колите , болезни Крона, псориазе, витилиго , буллезном пемфигоиде , очаговой алопеции , идиопатической дилатационной кардиомиопатии , сахарном диабете 1 типа, болезни Грейвса , тиреоидите Хашимото , миастении, нефропатии IgA , мембранозной нефропатии (или мембранозном гломерулонефрите) и пернициозной анемии.
Профилактика аутоиммунных заболеваний
Вакцинация здоровых ВИЧ-серонегативных молодых людей рекомбинантным gp350 эффективна для предотвращения развития инфекционного мононуклеоза, вызванного EBV-инфекцией, хотя и не предотвращает бессимптомную EBV-инфекцию, но вакцинированные субъекты показали сероконверсию к антителам против gp350, которые сохранялись> 18 месяцев и, вероятно, были ответственны за защитный эффект, поскольку антитело против gp350 нейтрализует инфекционность EBV Вакцинация gp350 может снизить частоту хронических аутоиммунных заболеваний за счет уменьшения количества В-клеток, инфицированных EBV , и тем самым уменьшения вероятности инфицирования аутореактивных В-клеток во время первичной инфекции.
Лечение аутоиммунных заболеваний
Потенциально существует три способа лечения хронических аутоиммунных заболеваний путем борьбы с инфекцией EBV: (1) истощение В-клеток моноклональными антителами; (2) повышение иммунитета к EBV; (3) противовирусные препараты. Истощение В-клеток ритуксимабом уничтожает не только В-клетки, инфицированные EBV , но и неинфицированные В-клетки, которые обычно обеспечивают защитный иммунитет против инфекционных агентов. Улучшение nтечения аутоиммунного заболевания с помощью терапии ритуксимабом согласуется с важной ролью EBV в развитии заболевания, но не является доказательством, поскольку положительный эффект может быть опосредован элиминацией аутореактивных B-клеток, не инфицированных EBV. Более убедительным доказательством важной роли EBV может быть искоренение аутоиммунных заболеваний путем повышения иммунитета к EBV или лечения противовирусными препаратами. Гуморальный иммунитет к EBV может быть усилен вакцинацией gp350 или введением гуманизированного или человеческого моноклонального антитела против gp350. CD8 + Т-клеточный иммунитет может быть усилен внутривенной инфузией аутологичных EBV-специфических цитотоксических CD8 + Т-клеток после размножения in vitro или введением таких агентов, как интерлейкин-7, который увеличивает популяцию функциональных вирус-специфических CD8 + Т-клеток при хронической вирусной инфекции.
Что касается противовирусных препаратов, лечение ацикловиром и родственными ему препаратами, которые ингибируют ДНК-полимеразу герпесвируса, вероятно, будет иметь лишь ограниченный положительный эффект при хронических аутоиммунных заболеваниях, потому что эти препараты действуют на EBV только тогда, когда он использует свою собственную ДНК-полимеразу для репликации своей ДНК. Это применимо только к литически инфицированным клеткам, но не к латентно инфицированным, которые реплицируют ДНК EBV за счет использования ядерного антигена 1 EBV (EBNA1) для взаимодействия с ДНК-полимеразой клетки-хозяина. Одна из стратегий преодоления этого - сначала введение ритуксимаба для уничтожения как можно большего количества В-клеток, инфицированных EBV , и последующая длительная противовирусная лекарственная терапия. Альтернативный подход - нацеливаться на LMP1 , LMP2A или EBNA1 для подавления EBV в латентно инфицированных клетках. Было также высказано предположение, что ингибиторы ретровирусной интегразы могут быть эффективными против EBV при аутоиммунных заболеваниях.
Генетические аспекты иммунорегуляторного индекса
Соотношение CD4 / CD8 Т-клеток у человека контролируется генетически , при этом по крайней мере некоторые ответственные гены расположены в комплексе HLA. Дефицит CD8 + Т-клеток и повышенное соотношение CD4 / CD8 при аутоиммунных заболеваниях также присутствуют у здоровых кровных родственников пациентов с этими заболеваниями, что указывает на то, что отклонения являются генетически детерминированными, а не вторичными по отношению к ним.
Гормональные аспекты иммунорегуляторного индекса
Интересно, что у женщин обычно более низкие пропорции и количество CD8 + Т-клеток, более высокие пропорции и количество CD4 + Т-клеток и более высокое соотношение CD4 / CD8, чем у мужчин. Эти гендерные различия, по-видимому, опосредованы гормонами, потому что дефицит эстрогенов существенно увеличивает долю и количество CD8 + Т-клеток и снижает соотношение CD4 / CD8, причем это соотношение напрямую коррелирует с уровнем эстрадиола в сыворотке. Более низкое количество CD8 + Т-клеток у женщин может способствовать более высокой частоте аутоиммунных заболеваний у женщин, чем у мужчин.
Возрастные аспекты иммунорегуляторного индекса
Поскольку количество CD8 + Т-лимфоцитов обычно снижается с возрастом, особенно в детстве , но также и в зрелом возрасте , первичный дефицит CD8 + Т-клеток будет усугубляться с возрастом каждого человека, как это происходит у пациентов. с рассеянным склерозом.
Экологические факторы , витамин D и иммунорегуляторный индекс
Воздействие естественного солнечного света или лечение в солярии увеличивает долю CD8 + Т-клеток и снижает соотношение CD4 / CD8 Т-клеток в периферической крови. Неясно, как именно солнечный свет увеличивает количество CD8 + T-клеток, но эффект, вероятно, опосредован, по крайней мере частично, витамином D, потому что (1) среди клеток иммунной системы активированные CD8 + T-клетки экспрессируют самые высокие концентрации рецептора витамина D. (2) витамин D увеличивает индуцированную митогеном пролиферацию CD8 + Т-клеток и снижает соотношение CD4 / CD8 в мононуклеарных клетках периферической крови крупного рогатого скота in vitrо. (3) прием витамина D увеличивает количество CD8 + Т-лимфоцитов. (4) дефицит витамина D связан со снижением доли CD8 + Т-клеток и повышенным соотношением CD4 / CD8. Здесь предполагается, что лишение солнечного света и витамина D усугубляет генетически обусловленный дефицит Т-лимфоцитов CD8 + и нарушает контроль инфекции EBV и тем самым способствует высокой распространенности аутоиммунных заболеваний, таких как рассеянный склероз , диабет 1 типа и ревматоидный артрит , в высоких широтах и что защитный эффект витамина D против аутоиммунных заболеваний , по крайней мере частично, опосредуется увеличением количества CD8 + Т-клеток, доступных для контроля EBV. Более высокая частота поздней первичной инфекции EBV на более высоких широтах также может вносить вклад в широтный градиент
Вирусная нагрузка – важный показатель состояния организма ВИЧ-положительного пациента. Она рассчитывается путем подсчета количества копий РНК ВИЧ (вирусных частиц) в 1 миллилитре плазмы крови. Полученные показатели указывают на степень тяжести вирусной инфекции. Благодаря им можно оценить эффективность проводимой ВААРТ, и прогнозировать дальнейшее развитие заболевания. Для создания более полной картины болезни, анализ на вирусную нагрузку проводится вместе с тестом на уровень CD4-лимфоцитов – антигены иммунной системы, отображающие ее состояние.
Без приёма терапии со временем снижается уровень СД4 клеток.
Как можно узнать уровень вирусной нагрузки на организм?
По сути, вирусная нагрузка отображает количество ВИЧ в крови. В то время как количество CD4 клеток демонстрирует состояние иммунной системы. Регулярный мониторинг этих двух показателей позволяет своевременно принимать решения – назначать ВААРТ и корректировать лечение, тем самым сдерживая прогрессирование ВИЧ-инфекции.
Анализ на вирусную нагрузку необходимо делать в следующих случаях.
- При подозрении на ВИЧ-инфекцию.
- При постановке диагноза ВИЧ.
- До начала антиретровирусной терапии – каждые 3-6-12 месяцев.
- Через 1 и 3 месяца после начала ВААРТ и далее каждые 3-4 месяца в ходе ее проведения.
Именно оценивая динамику вирусной нагрузки, лечащий инфекционист может сделать заключение об эффективности лечения и при необходимости корректировать ВААРТ.
Для определения вирусной нагрузки проводятся лабораторные исследования, с применением одного из нижеследующих методов.
- ПЦР (полимеразная цепная реакция) – обнаруживает вирус, начиная с 20 - 40 копий в 1 мл крови.
- Метод разветвленной ДНК – менее чувствительный и обнаруживает большое количество копий.
- NASBA (метод транскрипционной амплификации) – очень чувствительная методика, способная увеличивать белки вируса, для того чтобы определить его количество. Однако в России NASBA пока не получил широкое распространение.
Принципиальное различие методов и степень их чувствительности могут стать причиной недостоверного результата. Поэтому специалисты рекомендуют для определения вирусной нагрузки выбрать какой-нибудь один метод и использовать его на постоянной основе.
Расшифровка результатов исследований на ВИЧ
Полученные в ходе исследования вирусной нагрузки результаты расшифровываются следующим образом.
- До 10 000 копий вируса – низкая вирусная нагрузка.
- Свыше 100 000 копий – высокая вирусная нагрузка.
- 0 копий – вируса в организме нет, что считается нормой для здорового человека и указывает на необходимость повторного исследования для ВИЧ-инфицированных пациентов.
Неопределяемая вирусная нагрузка – минимальное количество копий, наличие которых невозможно зафиксировать с помощью выбранного метода исследования.
Таким образом, неопределяемая вирусная нагрузка – это показатель, к которому стремятся все ВИЧ-инфицированные пациенты. Такой результат указывает на то, что вирус в организме есть, но его количество ничтожно мало и на данный момент человеку ничего не угрожает. Одна при этом обязательно необходимо оценить общее состояние иммунной системы. Для этого нужно определить количество CD4+антигенов Т-лимфоцитов. Норма клеток и возможные отклонения приведены в нижеследующей таблице.
| Количество CD4 | Возможные действия пациента |
|---|---|
| 1500 – 500 кл/мл | норма |
| 500 - 350 кл/мл | необходимо начать ВААРТ |
| 200 кл/мл и ниже | проводят ВААРТ |
| Менее 100 кл/мл | проводят ВААРТ и симптоматическую терапию |
Оценивая показатели вирусной нагрузки и CD4 можно сделать достоверное заключение о состоянии здоровья пациента. Если зафиксирована низкая вирусная нагрузка, например, 4000 копий и показатели CD4 в норме, то ВААРТ эффективна. И наоборот – высокая вирусная нагрузка при снижении показателей CD4 свидетельствуют о низкой эффективности лечения.
Как уменьшить вирусную нагрузку?
Тест на вирусную нагрузку отражает степень тяжести ВИЧ-инфекции и состояние организма. Естественно, что столкнувшись с высокими показателями нагрузки, пациенты стремятся ее снизить. Нередко для этой цели они прибегают к альтернативным методам лечения. Но проблема в том, что единственный способ снизить вирусную нагрузку – это эффективная ВААРТ. Иммуностимуляторы, иммуномодуляторы, витаминные комплексы, отвары трав и прочие средства, не оказывают никакого влияния на развитие ВИЧ-инфекции. Снизить нагрузку можно только с помощью антиретровирусной терапии.
Преимущества неопределяемой низкой нагрузки
Низкая или неопределяемая вирусная нагрузка желательна по нескольким причинам.
- Минимальный риск прогрессирования инфекции.
- Минимальный риск развития резистентности к препаратам ВААРТ.
- Минимальный риск передачи инфекции во время незащищенного полового контакта.
- Максимальный шанс родить здорового ребенка (для женщин).
Ранняя диагностика заболеваний – залог успешного лечения. Ставшее крылатым выражение, особенно актуально для ВИЧ-инфекции. Ведь заболевание неизлечимо полностью, и только своевременная диагностика позволяет взять течение болезни под контроль и выбрать тактику лечения, чтобы жить полноценной жизнью.

Ранний срок диагностики ВИЧ – со 2 недели от предположительного заражения.
Важность клинической диагностики ВИЧ
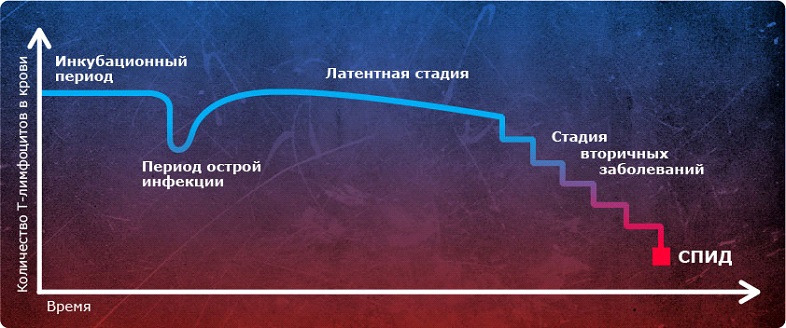
В понимании многих людей ВИЧ-инфицированный человек выглядит болезненно, изнеможенно. Он кашляет, чихает, чешется, стонет, у него все болит… На самом деле это не так! Проблема в том, что после инфицирования ВИЧ и в последующий инкубационный период симптомы полностью отсутствуют. Затем наступает острая фаза, на протяжении которой присутствуют симптомы, напоминающие ОРВИ или грипп. Но и они вскоре проходят, и наступает, так называемый, латентный период – продолжительный промежуток времени, когда ВИЧ-инфекция себя ничем не выдает. С момента инфицирования и до стадии пред-СПИДа может пройти порядка 10 лет, в течение которых, ни сам пациент, ни его окружение, даже и не подозревают о болезни. А когда она уже на полную мощность заявляет о себе, контролировать ее очень трудно. Сложно противостоять осложнениям ВИЧ, поддерживать практически разрушенную иммунную систему человека.
Очень важно понимать, что, хотя и есть группы риска – гомосексуалисты, наркозависимые и девушки легкого поведения – в основной массе, пациенты с ВИЧ-инфекцией – это обычные люди. Они учатся, ходят на работу, посещают общественные места, знакомятся в интернете – в общем, живут как все. К сожалению, но от ВИЧ никто не застрахован. Незащищенный половой контакт в порыве страсти, заветное тату без соблюдения стерильности, маникюр за полцены у начинающего мастера, уличная драка – все эти и множество других житейских ситуаций могут обернуться инфицированием ВИЧ.
Благоприятные сроки для диагностики ВИЧ
Факт возможного инфицирования и плохое самочувствие без видимых причин – два веских основания для обращения к специалистам. Но отрицательный результат тестирования на антитела не всегда означает, что человек не инфицирован, так как существует период “серонегативного окна” (время между заражением и появлением антител), который составляет около трех месяцев. Поэтому лучше повторить их спустя 3 месяца с момента возможного инфицирования. Если же ответ опять будет отрицательным, но ваша тревога не проходит, и вы уверены в заражении ВИЧ, тогда лабораторную диагностику необходимо повторить спустя 6 месяцев после факта заражения.
Что касается плохого самочувствия, то поводом провериться на ВИЧ может быть сочетание следующих симптомов:
- увеличение лимфатических узлов на шее, в паху, в области подмышек;
- лихорадка;
- мышечные или головные боли;
- молочница и грибковые поражения, в том числе кандидоз полости рта;
- воспаление слизистой носа, рта или глотки;
- ночная потливость;
- ломота в суставах;
- длительная диарея;
- тошнота, рвота;
- резкое снижение массы тела;
- высыпания на коже.
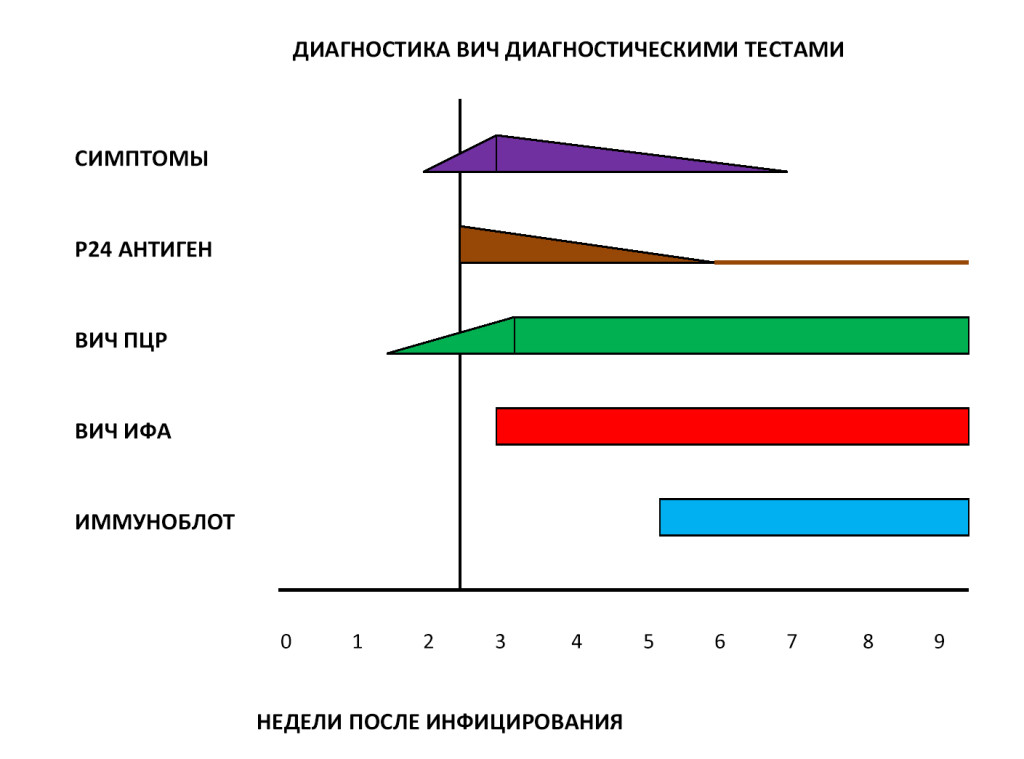
Современные методы диагностики ВИЧ
В настоящее время в диагностике ВИЧ используется двухуровневый подход – косвенные и прямые тесты. Косвенные тесты позволяют обнаружить в крови пациента специфические антитела к ВИЧ, а прямые тесты помогают выявить собственно сам ВИЧ и определить степень вирусной нагрузки на организм. В России стандартная диагностика ВИЧ включает следующие методы лабораторных исследований:
- ИФА (иммуноферментный анализ).
- Иммуноблот (иммунный блоттинг).
Также могут быть применены следующие методики:
- Экспресс-тест ИХА (иммунохроматография).
- ПЦР (полимеразная цепная реакция).
Диагностические принципы лабораторных исследований и степень их достоверности приведены в нижеследующей таблице.
Читайте также:

