Иммунозаместительная терапия при сепсисе
Обновлено: 25.04.2024
Резюме
Несмотря на многочисленные усилия проникнуть в суть воспалительных реакций, лежащих в основе патогенеза сепсиса, ряд клинических исследований по модулированию иммунного ответа с использованием антиэндотоксиновых антител, антител к фактору некроза опухоли-α (ФНО-α) и растворимых ФНО-рецепторов не смогли продемонстрировать клинические преимущества. Аналогичные результаты наблюдали при использовании гидрокортизона или интенсивном контроле уровня глюкозы путем постоянной инфузии инсулина.
Иммуномодулирующий эффект макролидов был продемонстрирован у больных хроническими легочными заболеваниями - диффузным панбронхиолитом и муковисцидозом. Благоприятные клинические исходы внебольничной пневмонии при лечении β-лактамными антибиотиками в комбинации с макролидами также объясняются иммуномодулирующим действием последних. Эффективность макролидов в отношении грамотрицательных микроорганизмов в экспериментальных моделях сепсиса послужила основанием для инициации клинического исследования иммуномодулирующего действия кларитромицина у 200 больных вентилятор-ассоциированной пневмонией и сепсисом.
Сепсис занимает 10-е место в списке ведущих причин смерти в США. Сепсис развивается у 11-12% больных отделений интенсивной терапии (ОИТ) с показателями смертности 48,4-55,2% (в ОИТ и госпитальной). Несмотря на своевременную постановку диагноза и раннее начало антибиотикотерапии, смертность у больных сепсисом по-прежнему высока. Очевидно, это объясняется вовлечением других механизмов, в частности избыточного иммунного ответа, которые приводят к развитию полиорганной недостаточности (ПОН) с неблагоприятным исходом для больного. Поэтому одним из ключевых направлений в лечении сепсиса является воздействие на иммунный ответ.
Индукторами септической реакции считаются определенные компоненты/метаболиты микробной клетки - эндотоксины (липополисахарид - ЛПС), липотейхоевая кислота, зимозан и бактериальная ДНК, которые активируют моноциты, прикрепляясь к толл-рецепторам клеточной стенки, и таким образом стимулируют внутриклеточные сигнальные пути. Это приводит к активации ядерного фактора NF-κΒ, генной экспрессии про- и противовоспалительных цитокинов, среди которых наиболее изученными являются ФНО-α и интерлейкины (ИЛ) - ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10. Гиперпродукция этих цитокинов может привести к развитию ПОН, синдрому диссеминированного внутрисосудистого свертывания и гипергликемии.
В эксперименте показано подавление кларитромицином высвобождения ИЛ-8 клеточной культурой человеческих моноцитов после их предварительной стимуляции клеточными лизатами P. aeruginosa и Escherichia coli благодаря ингибированию транскрипции ядерного фактора NF-κΒ и активатора протеина 1. Иммуномодулирующее действие макролидов при остром воспалении подтверждается данными ретроспективного анализа результатов лечения внебольничной пневмонии у 1518 больных в Испании: смертность 6,9% - при лечении комбинацией β-лактама и макролида, 13,3%- при лечении только β-лактамом. Анализ 409 случаев пневмонии, вызванной S.pneumoniae, показал снижение макролидами риска смерти в 2,5 раза, исключив влияние макролидов на исход за счет подавления атипичных патогенов. Эти данные подтвердились в ретроспективном анализе 2349 больных пневмонией.
Предпочтение кларитромицину отдано в силу того, что азитромицин не обеспечивает достаточные сывороточные концентрации, необходимые для подавления продукции провоспалительных цитокинов моноцитами. В экспериментальной модели сепсиса, вызванного полирезистентными штаммами P. aeruginosa, Klebsiella pneumoniae и E. coli (не относящимися к спектру активности кларитромицина), кларитромицин вводили внутривенно одновременно с инокуляцией бактерий либо уже после появления симптомов сепсиса (для максимального приближения к клиническим условиям). При отсутствии подавления роста бактерий кларитромицин в значительной мере ослабил воспалительную реакцию, что подтверждалось меньшей инфильтрацией тканей нейтрофилами и лимфоцитами, снижением сывороточной концентрации ФНО-α и сывороточного оксидантного стресса, а также повысил выживаемость. Максимальные сывороточные концентрации кларитромицина в этом исследовании варьировали в диапазоне 5-10 мкг/мл и достигались через 30 мин после введения.
Клиническая эффективность кларитромицина у больных сепсисом и вентилятор-ассоциированной пневмонией (ВАП)
Двести больных ВАП, осложненной нозокомиальным сепсисом, были рандомизированы в группы лечения кларитромицином и плацебо (100 пациентов в каждой группе), кларитромицин вводили в дозе 1 г/сут в виде внутривенной 1-часовой инфузии в течение 3 дней подряд с намерением достичь сывороточных концентраций 5-10 мкг/мл. Дополнительная антибактериальная терапия назначалась по усмотрению лечащего врача. В исследовании использовались международные критерии сепсиса, тяжелого сепсиса и септического шока.
Группы кларитромицина и плацебо были сопоставимы по возрасту, половой принадлежности, сопутствующим заболеваниям, тяжести сепсиса и степени органной недостаточности у пациентов, равно как и степени респираторной дисфункции (значению отношения парциального давления кислорода к фракции вдыхаемого кислорода -рО2/FiO2) и спектру используемых дополнительно иммуномодулирующих препаратов (низких доз гидрокортизона и инфузии инсулина для поддержания уровня глюкозы в пределах 80-110 мг/дл).
Этиологию сепсиса определяли посевом трахеобронхиального секрета с последующим бактериологическим исследованием до начала лечения кларитромицином, а затем на 5 и 10-е сутки. В группах плацебо и кларитромицина культуры грамотрицательных патогенов (10 5 КОЕ) выделены у 68 и 66% пациентов соответственно (разница статистически незначима), в том числе Acinetibacter baumannii (63,2%), P. aeruginosa (17,6%), K. pneumoniae (8,8%). Частота выделения указанных возбудителей в группе кларитромицина составила 54,5, 25,8 и 7,6% соответственно.
Для исключения влияния других антибактериальных препаратов на интерпретацию эффектов кларитромицина и клинических исходов среди выделенных патогенов определили пропорцию чувствительных микроорганизмов к одному или более используемым в группе антибиотикам. Таковых оказалось 62,5% в группе плацебо и 75,4% - в группе кларитромицина (р=0,44). Эрадикация патогена к 5-му дню была достигнута у 37,3% пациентов из группы плацебо и 42,6% пациентов из группы кларитромицина (р=0,31), а к 10-му дню - у 41,4 и 46,2% соответственно (р=0,82).
Обе группы сравнивали по следующим клиническим исходам/параметрам: резолюция ВАП, время до отключения от аппарата искусственной вентиляции легких (ИВЛ) (экстубации), риск смерти. Среднее время резолюции ВАП составило 15,5 сут в группе плацебо и 10,0 сут в группе кларитромицина (р=0,011). Средний период времени до экстубации составил 22,5 и 16,0 сут соответственно (р=0,047). Полученные данные согласовались с результатами оценки по шкале легочной инфекции CPIS (Clinical Pulmonary Infection Score): исходные значения составили 7,92 и 7,62 балла в группах плацебо и кларитромицина соответственно (р=0,29), на 5-е сутки - 6,10 и 5,23 балла, на 10-е - 5,88 и 5,09 (р=0,032).
Показатель выживаемости зависел от развития у пациентов септического шока в сочетании с ПОН -основной причины смерти. В группе плацебо относительный риск смерти ввиду указанных причин составил 19,0, а в группе кларитромицина он был снижен до 3,78 (р=0,043).
В целом, ПОН развилась у 22 пациентов, не имевших симптомов органной недостаточности на момент включения в исследование. Средний период времени до проявления симптомов органной недостаточности составил 3,38 сут в группе плацебо и 5,78 - в группе кларитромицина (р=0,006).
В группе кларитромицина не выявили риска развития каких-либо серьезных побочных эффектов в связи с введением препарата.
Полученные результаты могут послужить основанием для назначения кларитромицина внутривенно больным сепсисом и ВАП. Предлагаемые показания к применению кларитромицина: 1) ВАП - ввиду обеспечения кларитромицином более раннего разрешения пневмонии и более раннего отключения от ИВЛ; 2) септический шок с ПОН -ввиду существенного снижения риска смерти.
Могут рассматриваться разные гипотезы о механизме действия кларитромицина. Исходя из накопленных данных (у больных с хроническими воспалительными заболеваниями дыхательных путей и в модели экспериментального сепсиса), механизм действия кларитромицина включает модулирование иммунного ответа хозяина и инструмента общения бактерий - quоrum sensing, о чем свидетельствует пролонгирование кларитромицином промежутка времени до развития ПОН у септических больных.
Заключение
Сепсис и септический шок остаются одной из основных причин гибели больных в ОИТ. Попытки использовать ряд препаратов с разным механизмом действия с целью модулирования иммунного ответа хозяина практически не изменили показатели смертности у этой категории больных (см. рисунок).
Наблюдаемые в двойном слепом рандомизированном клиническом исследовании эффекты внутривенного лечения кларитромицином больных ВАП и сепсисом позволяют смотреть в будущее с оптимизмом. Необходимы дополнительные клинические исследования для четкого определения показаний к применению кларитромицина в качестве иммуномодулятора при сепсисе.
Иммунозаместительная терапия сепсиса - эффективность иммуноглобулина
Активация генерализованного воспаления способна приводить к развитию иммуносупрессии у больных тяжелым сепсисом. Супрессия иммунной системы может быть одним из проявлений защитных реакций организма, направленных на ограничение аутоповреждений, с другой стороны — приводить к недостаточности эрадикации возбудителей инфекции и создавать условия для развития нозокомиальных инфекций.
Обычно к препаратам, обладающим иммунокоррегирующим действием или носящим характер заместительной терапии, относят поливалентные иммуноглобулины (полиглобулины), интерфероны (а), колониестимулирующие факторы (фактор, стимулирующий рост гранулоцитов).
Иммуноглобулины для внутривенного введения при сепсисе. Препараты, содержащие повышенное количество иммуноглобулинов (гипериммунные сыворотки), применяются в медицинской практике более 100 лет. Особенно активно их использовали для лечения различных инфекционных заболеваний и сепсиса до внедрения в клиническую практику антибиотиков. Первые попытки выделения специфических иммуноглобулинов из гипериммунной сыворотки привели к резкому снижению активности препаратов, что было связано с технологическим несовершенством метода выделения иммуноглобулинов.
С середины 60-х годов XX в. вплоть до настоящего времени достаточно широко стали применять препараты, содержащие специфические IgG, сначала для внутримышечного, а затем и внутривенного введения.
Препараты, содержащие антитела определенной специфичности IgG, обычно готовят из крови доноров, предварительно иммунизированных определенным антигеном. Такие препараты обычно называются гипериммунными, т. е. содержащими высокую концентрацию специфических антител (против стафилококков, синегнойной палочки) или некоторых экзотоксинов (возбудителя столбняка, ботулизма). Механизм действия этих препаратов направлен на опсонизацию и активацию фагоцитоза определенных возбудителей инфекционных заболеваний или связывание и блокирование биологической активности экзотоксинов. Применение этих иммуноглобулинов ограничено связыванием только конкретных возбудителей или токсинов, что предполагает до их применения наличие достоверных данных, позволяющих диагностировать конкретную инфекцию.
При наличии яркой клинической картины инфекции, например столбняка или ботулизма, обоснованность применения специфического иммуноглобулина не вызывает сомнения и обладает высокой клинической эффективностью. Однако при бактериальных инфекциях, не имеющих клинических признаков, указывающих на наличие конкретного возбудителя, использование иммуноглобулиновых препаратов обычно обосновывается данными, указывающими на снижение количества IgG или выделения возбудителя из тех локусов, которые в норме должны быть стерильными (кровь, плевральная и брюшная полость, полость сустава и др.).
С середины 70-х годов XX в. были начаты исследования по созданию препаратов, содержащих иммуноглобулины различной специфичности и различных классов. В основе этого подхода лежала идея о необходимости возможно более раннего применения иммуноглобулинов до получения данных о концентрации иммуноглобулинов или микробиологических данных о возбудителе инфекции. Источником иммуноглобулинов является пул крови, полученной от тысяч доноров, который теоретически содержит широкий спектр иммуноглобулинов различной специфичности. Появление технологии стабилизации иммуноглобулинов классов М и А позволило сделать следующий шаг — повысить в препарате содержание не только IgG, но и IgM и IgA.
Насыщение иммуноглобулинами классов М и А привело к существенному расширению терапевтического действия препаратов. Одна молекула IgM теоретически способна связывать в 5 раз больше молекул антигенов, чем молекула IgG, следовательно, обладает способностью к более мощной активации фагоцитоза. Кроме того, за счет более высокой плотности рецепторов молекула IgM обладает способностью связывать антигены с менее высокой аффинностью и широкий спектр токсинов, в том числе липополисахаридов грамотрицательных бактерий. Роль IgA, кроме специфического связывания с антигенами, заключается в его способности связываться с активированными компонентами системы комплемента (С3а, С3в, С5а) и таким образом снижать активность генерализованного воспаления и, вероятно, степень аутоиммунного повреждения эндотелия сосудов мембранатакующим комплексом комплемента.
Итак, к настоящему времени имеется несколько типов иммуноглобулиновых препаратов: нормальные человеческие иммуноглобулины (содержат обычное количество иммуноглобулинов), специфические иммуноглобулины (содержащие повышенную концентрацию IgG, активных в отношении определенных возбудителей или токсинов) и насыщенные иммуноглобулиновые препараты (содержащие повышенную концентрацию иммуноглобулинов классов G, М и А). Последнюю группу еще называют полиглобулинами или полиглобулинами, насыщенными IgM.
В отношении роли иммуноглобулинов в лечении тяжелого сепсиса и септического шока имеются две точки зрения. Согласно первой, из всех иммуноглобулинов для внутривенного введения только полиглобулины, насыщенные IgM, рекомендуются для применения у больных тяжелым сепсисом и в ранней фазе септического шока, так как многочисленные сравнительные исследования и два метанализа исследований применения этих иммуноглобулинов указывают на снижение летальности у пациентов, получавших полиглобулины. Другая точка зрения отражает противоположное мнение — иммуноглобулины для внутривенного введения не должны использоваться для лечения тяжелого сепсиса у взрослых и детей, так как доказательная база их эффективности остается недостаточной.
В метанализах применения иммуноглобулинов для лечения сепсиса показано, что среди всех иммуноглобулинов эффективными в плане снижения летальности оказались только полиглобулины, насыщенные IgM. До настоящего времени единственным препаратом, отвечающим этим требованиям, является пентаглобин (Biotest). Если рассматривать доказательную базу, то с позиций современной медицины результаты метанализов считаются доказательствами высокого уровня. Следовательно, применение пентаглобина для лечения тяжелого сепсиса и ранней фазы септического шока является рациональным.
Результаты этих метанализов указывают на существенно более низкую эффективность иммуноглобулинов, содержащих только IgG, и отсутствие эффекта от применения моноклональных антител, направленных на связывание микробных токсинов (антител против липополисахарида) и медиаторов воспаления (антител к фактору некроза опухолей, растворимых антител к ИЛ-1) в лечении сепсиса и септического шока.
Гранулоцитколониестимулирующий фактор при сепсисе. Применение этого препарата у пациентов без нейтропении не рекомендуется. Несмотря на наличие результатов экспериментальных исследований по лечению абдоминального сепсиса, клинических исследований по лечению больных сепсисом без нейтропении недостаточно для рекомендаций по его клиническому использованию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Иммуноглобулины и иммуномодуляторы при сепсисе.
При септическом шоке происходит интенсивное потребление факторов клеточного и гуморального иммунитета с развитием вторичного иммунодефицита. С целью коррекции недостающего звена иммунной защиты показаны пассивная (заместительная) терапия иммуноглобулинами и введение иммуномодуляторов.
Пентаглобин (IgG и IgM), обладающий способностью связывать избыток эндотоксина в крови, образно называют "ловушкой для эндотоксина". В первые сутки развития септического шока пентаглобин вводится внутривенно по 5-8 мл/кг, затем двое суток по 4 мл/кг массы тела больного. Длительность инфузии пентаглобина должна составлять не мецее 12 часов.
Интраглобин (IgG) способствует элиминации циркулирующих иммунных комплексов, снижению образования аутоантител, активизирует Т-супрессорные клетки. Препарат вводится внутривенно в дозе 2~ 5 мл/кг на протяжении 2-3 суток.
Ронлейкин. Рекомбинантный интерлейкин-2 (ронлейкин) стимулирует пролиферацию Т-лимфоцитов, активирует их, в результате чего Т-лимфоциты становятся цитотоксическими, киллерными клетками. При этом спектр лизирующего действия клеток, активированных ронлейкином, расширяется, и они становятся способными к уничтожению патогенных микроорганизмов, Кроме того, препарат усиливает образование иммуноглобулинов В-клетками, активирует функции моноцитов и тканевых макрофагов.
Ронлейкин при септическом шоке вводится однократно внутривенно в дозе 1-2 млн. ME в сочетании с 4-8 мл 10% раствора альбумина (для стабилизации препарата), растворенным в 400 мл изотонического раствора хлорида натрия, со скоростью 80-120 мл/ч. Длительность инфузии составляет 4-5 часов.
Галавит - иммуномодулятор, влияющий на функционально-метаболическую активность макрофагов. Препарат обратимо (на 6-8 часов) ингибирует избыточный синтез факторов некроза опухоли, интерлейкина - 1, активных форм кислорода и других цитокинов. Нормализация функционального состояния макрофагов способствует восстановлению антиген-представляющей и регулирующей функции последних и восстановлению функции Т-лимфоцитов. Кроме того, галавит стимулирует нейтрофильные гранулоциты, усиливая фагоцитоз и повышая резистентность организма к инфекции.
Галавит вводится внутримышечно в дозе 200 мг, после чего препарат назначается по 100 мг 2-3 раза в сутки в течение 7 дней.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Респираторная поддержка при сепсисе - показания к ИВЛ
Дыхательные нарушения у больных сепсисом имеют сложный комплексный характер. По современным представлениям, спектр дыхательных нарушений при сепсисе является очень широким — от острого легочного повреждения (ОЛП) до острого респираторного дистресс-синдрома (ОРДС). ОЛП развивается примерно у 40 % больных сепсисом, ОРДС — у 25—42 %, причем частота возрастает при развитии артериальной гипотензии. В 1994 г. на согласительной евро-американской конференции по ОРДС было разработано унифицированное определение ОЛП и ОРДС.
Именно снижение величины дыхательного коэффициента положено в основу разделения респираторного дистресс-синдрома и острого легочного повреждения.
Эти критерии позволяют производить более точную эпидемиологическую оценку, несмотря на варьирование абсолютного количества случаев в пределах от 5 до 71 на 100 000 населения.
В 1988 г. была опубликована шкала легочных повреждений, которая позволяет не только разделить пациентов по тяжести повреждения, но и имеет прогностическое значение. Первоначальная оценка более 3,5 балла коррелировала с выживанием только 18 % пациентов, 2,5—3,5 — 30 %, 1,1— 2,4 - 59 %, а оценка ниже 1,1 балла — 66 %.
Критерии ОЛП и ОРДС
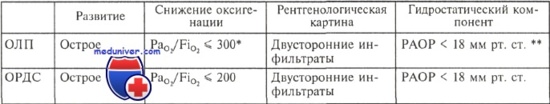
* PaО2/FiО2 — дыхательный коэффициент: отношение давления кислорода в артериальной крови к концентрации кислорода во вдыхаемом воздухе.
** РАОР —давление заклинивания в легочной артерии.
Дыхательная недостаточность является ведущим компонентом полиорганной дисфункции и недостаточности у больных сепсисом. Потребность в респираторной поддержке возникает у больных тяжелым сепсисом и септическим шоком. Сложность проблемы заключается в развитии тяжелого интерстициального отека и последующего повреждения легочной ткани, которые приводят к снижению эффективности переноса газов через альвеолярную мембрану легких.
Инсуфляция кислорода в дыхательные пути с помощью носовых катетеров или маски оказывает положительное влияние только на начальных стадиях острого легочного повреждения. Нарастание интерстициального отека легких приводит к тому, что обычно функционирующий объем альвеол оказывается недостаточным, и возникает необходимость в проведении ИВЛ с созданием положительного давления в дыхательных путях для увеличения объема участвующих в дыхании альвеол, однако создание высокого давления опасно развитием баротравмы легких.
Повышение содержания кислорода во вдыхаемом воздухе также имеет свои пределы из-за токсического действия кислорода на альвеолярную мембрану, нарушения синтеза сурфактанта (белок, поверхностно активное вещество, предупреждающее спадение альвеол) и возникновение других проблем. В тяжелых случаях респираторного дистресс-синдрома для обеспечения жизненнонеобходимых параметров вентиляции приходится прибегать к методам ИВЛ, которые находятся далеко за параметрами физиологического дыхания, требуют применения специального оборудования и тщательного многофакторного контроля.
Балльные шкалы острого легочного повреждения, респираторного дистресс-синдрома, степени легочного повреждения служат объективными показателями, на основании которых определяется тактика лечения и прогноз исхода заболевания у больных с наличием острой дыхательной недостаточности, развившейся в результате сепсиса. Рандомизированные исследования являются основой доказательной медицины. Однако проведение достаточных по репрезентативности рандомизированных исследований требует жесткой систематизации медицинских знаний. До получения данных рандомизированных исследований во многих областях медицины практические рекомендации могут содержать разделы, которые отражают мнение экспертов в определенной области, как правило, основанных на современных данных. Следование этим рекомендациям является хорошим тоном, но не обязательным с точки зрения доказательной медицины. Настоящий раздел содержит рекомендации по особенностям лечения острой дыхательной недостаточности больных сепсисом, основанные на данных нерандомизированных исследований.
Шкала легочного повреждения (общая сумма баллов делится на количество выявленных компонентов)
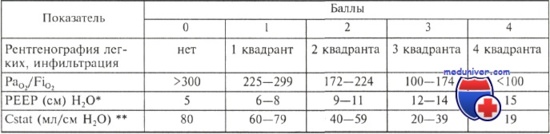
* PEEP — положительное давление в дыхательных путях в конце выдоха (произвольный параметр проведения ИВЛ).
** Cstat — растяжимость легочной ткани при определенных параметрах тестирования.
Адекватная респираторная поддержка улучшает оксигенацию и результаты лечения больных сепсисом
В некоторых случаях адекватная оксигенация (показатель сатурации О2 выше 90 %) может быть достигнута с помощью инсуфляции кислорода через назальную канюлю или лицевую маску. Эндотрахеальная интубация применяется для создания постоянного положительного давления в конце выдоха (PEEP), повышения среднего давления в дыхательных путях и снижения концентрации кислорода во вдыхаемом воздухе (FiО2
Целью респираторной терапии является достижение адекватной доставки кислорода в ткани, испытывающие гипоксию, в условиях нарушенной микроциркуляции.
При проведении ИВЛ изменением различных параметров можно добиваться различного давления на вдохе и достигать различных результатов лечения. Показатели измерения ок-сигенации методом пульоксиметрии (определение насыщения кислорода в крови с помощью специального датчика, надеваемого на ногтевое ложе пальцев рук) обычно хорошо коррелируют с насыщением артериальной крови кислородом.
Однако у 7 % пациентов такой корреляции не наблюдается из-за выраженной тахикардии, низкого сердечного индекса или высокого давления заклинивания легочной артерии (определяемого с помощью катетера Сван-Ганса, установленного в устье легочной артерии).
У таких больных необходимо проводить мониторинг оксигенации артериальной крови и поддерживать сатурацию на уровне 88—90 % (что соответствует насыщению артериальной крови кислородом на уровне 60 мм рт. ст.) с концентрацией кислорода во вдыхаемой смеси (FiО2) ниже 60 %.
Необходимо избегать применения неинвазивной вентиляции с положительным давлением у больных сепсисом
Метод неинвазивной вентиляции легких с положительным давлением заключается в применении специальной герметичной лицевой маски, позволяющей точно дозировать концентрацию кислорода во вдыхаемом воздухе и создавать положительное давление в дыхательных путях. Этот метод является эффективным у небольшой группы пациентов в сознании без увеличения бронхиальной секреции на ранних этапах развития дыхательной недостаточности (менее 72 ч), что редко бывает при ОЛП/ОРДС. Задержка дыхания с началом ИВЛ может быть причиной развития осложнений, поэтому применение этого метода не рекомендуется для больных сепсисом.
Интубация трахеи не влияет на исход лечения больных сепсисом, в то время как проведение ИВЛ достоверно улучшает результаты лечения больных с сепсисом и дыхательной недостаточностью. Показания к интубации трахеи и началу проведения ИВЛ у больных с сепсисом основаны на стандартных клинических признаках дыхательной недостаточности. Показанием для начала ИВЛ являются: тахипноэ (частота дыхания более 40 в минуту), включение в акт дыхания дополнительной мускулатуры, нарушение сознания, тяжелая гипоксемия, которая не может быть компенсирована инсуфляцией кислорода.
При ОЛП/ОРДС поддержание нормального уровня рН и содержания углекислоты в артериальной крови (Расо2) необязательно. Применение умеренной гиперкапнии позволяет снижать дыхательный объем у пациентов с ОЛП/ОРДС, которым проводится ИВЛ, что позволяет снизить высокое давление на воохе, риск баро-и волюмотравмы легких. Выбор параметров ИВЛ, который позволяет снизить дыхательный объем и объем минутной вентиляции для предотвращения чрезмерного растяжения альвеол и повреждения легочной ткани у больных сепсисом, приводит к повышению концентрации углекислоты в артериальной крови (Расо2). Безопасность и эффективность применения ИВЛ с гиперкапнией были показаны в серии некрупных исследований.
До настоящего времени допустимый верхний предел концентрации углекислоты в артериальной крови точно не определен. Накопление углекислоты приводит к пропорциональному снижению рН артериальной крови. Считается необходимым поддерживать параметры ИВЛ, которые бы обеспечивали адекватную оксигенацию крови и не способствовали снижению рН крови ниже 7,2. Применение таких параметров ИВЛ не сопровождалось развитием осложнений и приводило к снижению летальности больных сепсисом.
Применение низкого дыхательного объема улучшает результаты лечения ОЛП, а вентиляция с ограничением по давлению не способствует улучшению результатов лечения ОЛП. При применении ИВЛ у больных с ОЛП необходимо использовать небольшие дыхательные объемы (примерно 6 мл/кг идеальной массы тела) для поддержания плато давления в конце выдоха ниже 30 см Н2О. Крупные исследования по сравнению влияния разных дыхательных объемов на уровень инспираторного давления дали различные результаты, причем причина этих различий до настоящего времени непонятна. В недавнем крупном исследовании больных с ОЛП было показано, что общая летальность снизилась на 10 % в группе пациентов, которым проводилась ИВЛ с дыхательным объемом 6 мл/кг идеальной массы тела. Эта методика недавно была поддержана группой международных экспертов.
Применение ИВЛ в положении на животе позволяет улучшить газообмен пациентов с ОЛП, однако не доказано его положительного влияния на исходы лечения больных сепсисом. Применение ИВЛ в положении пациента на животе способствует дополнительному включению в дыхание задненижних отделов легких. Показанием к применению этого метода является тяжелый ОРДС с необходимостью применения высоких концентраций кислорода во вдыхаемой смеси (FiО2 > 60 %). Ограничением для его применения являются наличие противопоказаний и отсутствие опыта проведения ИВЛ в этом положении у персонала ОРИТ. В некрупных рандомизированных исследованиях были доказаны физиологические преимущества этого метода ИВЛ, заключавшиеся в повышении оксигенации крови у 65 % больных с ОЛП/ОРДС.
Улучшение газообмена наблюдалось даже спустя 18 ч после перекладывания пациента на спину. Однако ограниченное количество пациентов и отсутствие четких показаний, методики применения и оценки эффективности снижают его привлекательность.
Ингаляция оксида азота влияет на оксигенацию, но не влияет на результаты лечения больных с ОЛП/ОРДС. Оксид азота (NО) является физиологическим регулятором базального тонуса сосудов. Известно, что физиологическим ответом на гипоксию является спазм сосудов легких. Вдыхание оксида азота может оказывать мощное сосудорасширяющее действие на легочные сосуды и улучшать оксигенацию. Именно поэтому были проведены исследования, которые подтвердили, что ингаляция оксида азота улучшала оксигенацию и способствовала снижению отека легких у больных с ОЛП/ОРДС путем влияния на гидростатическое давление.
Однако улучшение оксигенации и снижение отека легких не приводило к достоверному снижению летальности, поэтому рекомендуется ограничить применение оксида азота у пациентов с тяжелой гипоксемией, представляющей угрозу для жизни, которая не может быть компенсирована применением обычных методов ИВЛ. До настоящего времени нет определенных рекомендаций по рациональному применению инфузионной терапии у больных ОЛП/ОРДС. Из-за отсутствия данных сравнительных исследований, посвященных инфузионной терапии, нет жестких правил применения кристаллоидных и коллоидных препаратов. У больных с ОЛП/ОРДС и синдромом высокой сосудистой проницаемости следует комбинировать применение кристаллоидных и коллоидных растворов во избежание избыточной гидратации легких. Коллоидные растворы рационально назначать пациентам с низким онкотическим давлением крови. Нет рекомендаций по оптимальному объему инфузионной терапии несмотря на то, что с момента открытия этого синдрома дискуссии в отношении инфузионной терапии были очень острыми. Имеются противоречивые мнения экспертов относительно пользы коллоидных и кристаллоидных растворов.
Считается, что для разрешения актуальных вопросов требуется более пристальное внимание специалистов и проведение крупных исследований в этой области.
Применение кортикостероидных гормонов не показано для профилактики и лечения ранней (экссудативной) фазы ОРДС. В отношении лечения поздней (фибропролиферативной) фазы ОРДС данных пока недостаточно. Не рекомендуется применять кортикостероидные гормоны пациентам с высоким риском или наличием критериев ОЛП/ОРДС. Не получено данных, подтверждающих пользу применения кортикостероидных гормонов для профилактики и раннего лечения ОРДС. Эффективность применения кортикостероидов в более поздней фазе ОРДС в настоящее время изучается.
Ежедневная тренировка спонтанного дыхания и следование протоколу отлучения пациентов от ИВЛ снижает продолжительность ИВЛ. Всем пациентам с приемлемым уровнем респираторной поддержки и стабильным состоянием рекомендуется ежедневно производить оценку возможности самостоятельного дыхания. Для выявления пациентов, способных к самостоятельному дыханию, необходимо проводить короткий скрининг и тренировать самостоятельное дыхание. Из процесса скрининга исключаются пациенты, нуждающиеся в проведении ИВЛ. Основными критериями, указывающими на возможность начала отлучения от ИВЛ, являются: снижение потребности в концентрации кислорода во вдыхаемом воздухе ниже 50 % (FiО2
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиническое значение тяжелого сепсиса определяется его распространенностью и высокой летальностью. Несмотря на существенные достижения в развитии медицинских технологий, в частности, расширение диагностических и терапевтических возможностей, существенного снижения летальности не достигнуто. В значительной степени это связано с недостаточной изученностью механизмов иммунологических нарушений, возникающих в процессе развития инфекции и полиорганной недостаточности, и отсутствием эффективных методов их коррекции.
К настоящему времени в качестве иммунной коррекции в лечении сепсиса клиническими исследованиями доказана эффективность только заместительной терапии иммуноглобулинами (lg) для внутривенного введения. Показано снижение летальности при применении иммуноглобулинов, содержащих в своем составе иммуноглобулины классов G, М и A (IgGMA), в отличие от иммуноглобулинов класса G (IgG) и специфических моноклональных антител против фактора некроза опухолей (ФНО-α) и растворимых рецепторов интерлейкина-1 (ИЛ-1). В современных рекомендациях имеются показания только для IgGMA.
Клеточные повреждения, связанные с медиаторами воспаления
Около 30 лет назад были проведены первые экспериментальные и клинические исследования, показавшие ключевую роль медиаторов в процессе развития сепсиса. Грамположительные и грамотрицательные бактерии способны быть причиной синтеза и выделения провоспалительных медиаторов (в том числе, цитокинов). Цитокины играют важнейшую роль в развитии сепсиса и септического шока. Компонентами клеточной стенки, которые способствуют образованию цитокинов, являются липополисахарид (ЛПС - грамотрицательные бактерии), пептидогликан (грамположительные и грамотрицательные бактерии) и липотейхоевая кислота (грамположительные бактерии). Кроме того, грамположительные бактерии способны к секреции суперантигена — белковой субстанции, которая связывается напрямую с рецепторами главного комплекса гистосовместимости и Т-рецепторами, что приводит к массивной продукции цитокинов.
На начальных этапах активации врожденного иммунитета происходит синтез небольших пептидов (провоспалительных цитокинов), которые являются активаторами многих типов клеток: от иммунных эффекторных клеток до клеток гладкой мускулатуры сосудов и клеток паренхимы различных органов.
Некоторые цитокины (фактор некроза опухолей — ФНО-α и интерлейкин-1 — ИЛ-1) сами являются стимуляторами выделения других цитокинов. ФНО-α и ИЛ-1 способствуют ограничению распространения инфекции, однако в случае ее генерализации их эффект может становиться негативным.
Уровень другого провоспалительного цитокина (ИЛ-6) коррелирует с исходом генерализованной инфекции. Высокий уровень ИЛ-6 связан с высокой летальностью, однако до настоящего времени не ясно, принимает ли он участие в танатогенезе?
ИЛ-8 является важным регулятором функции нейтрофилов, синтезируется и выделяется в процессе развития сепсиса. Его активацию связывают с поражением легких и дисфункцией других органов.
Некоторые хемокины (хемоаттрактантный белок-1 моноцитов) регулируют процесс миграции лейкоцитов. Менее важную роль в процессе генерализованного воспаления играют другие цитокины (ИЛ-10, ИЛ-12, фактор ингибирования миграции макрофагов, гранулоцит-колониестимулирущий фактор).
Активация системы комплемента ответственна за клиренс возбудителей. В условиях высокой концентрации циркулирующей ЛПС в крови и связывания его компонента — липида А с эндотелием сосудов, на поверхности эндотелия формируется множество мембранатакующих комплексов комплемента (МАК). Это приводит к образованию пор на поверхности эндотелиальных клеток и их повреждению. Одновременное поражение обширных полей эндотелиальных клеток приводит к образованию тромбов на их поверхности и нарушению трансмембранного обмена, что является причиной снижения или прекращения доставки кислорода и нутриентов клеткам органов, кровоснабжаемых этими сосудами. Другой стороной активации системы комплемента является выделение брадикинина, который участвует в индукции выделения оксида азота. Последний играет важнейшую роль в гемодинамических нарушениях, характерных для септического шока, которые вначале имеют гипердинамический характер.
Нейтрофилы при сепсисе являются важнейшей системой, ограничивающей распространение возбудителей инфекции в органах и тканях. Их роль заключается в поиске и разрушении живых возбудителей с помощью механизма фагоцитоза. С другой стороны, переваренные и выброшенные во внешнюю среду фрагменты бактерий являются, по своей сути, дополнительной нагрузкой, т.к. представляют собой липополисахариды, липотейхоевые кислоты и пептидогликан, которые способствуют дальнейшей активации макрофагов и усилению генерализованного воспаления, способствуют повреждению тканей и органной дисфункции.
Кроме того, при сепсисе происходит выделение других биологически активных веществ: липидных медиаторов (эйкозаноидов), фактора активации тромбоцитов, фосфолипазы А2, однако их роль в патогенезе сепсиса остается недостаточно установленной.
Тканевые повреждения в результате активации системы свертывания
Дисбаланс гомеостатических механизмов в результате генерализованного воспаления приводит к диссеминированному внутрисосудистому свертыванию и возникновению тромбов в микрососудах, что является причиной органной дисфункции, полиорганной недостаточности и гибели пациентов. Активаторы воспаления способны приводить к прямому повреждению сосудистого эндотелия и выделению из эндотелиальных клеток тканевого фактора, который запускает коагуляционный каскад и усиливает продукцию тромбина, который превращает растворимый фибриноген в фибрин, который вместе с агрегированными тромбоцитами образуют внутрисосудистые тромбы.
Провоспалительные цитокины (ИЛ-1, ФНО-α) активируют тканевой фактор и запускают процесс коагуляции. Этот феномен при сепсисе подтверждается наличием высокого уровня комлексов тромбин-антитромбин, наличием D-димеров в плазме, что указывает на активацию системы свертывания и фибринолиза. Появление тканевого активатора плазминогена приводит к превращению плазминогена в плазмин, который является мощным фибринолитиком.
Эндотоксин увеличивает активность ингибиторов фибринолиза за счет активатора ингибитора плазминогена-1 и ингибитора фибринолиза активированного тромбином. Уровень протеина С и эндогенно активированного протеина С при сепсисе снижается. Эндогенный активированный протеин С является мощным протеолитическим ингибитором коагуляции. Тромбин посредством тромбомодулина активирует протеин С, который работает в качестве антитромболитика в микрососудах. Эндогенный активированный протеин С повышает фибринолиз, нейтрализуя активатор ингибитора плазминогена-1 и усиливая лизис сгустков. Дисбаланс между воспалением, коагуляцией и фибринолизом приводит к распространенной коагулопатии, тромбозу в микрососудистом ложе и подавлению фибринолиза — основным причинам, приводящим к полиорганной дисфункции и гибели пациентов.
Тканевые повреждения в результате других причин
Очень трудно представить совокупность причин тканевых повреждений у конкретного пациента в определенный момент течения сепсиса. Синдром полиорганной недостаточности связан с распространенным поражением эндотелиальных и паренхиматозных клеток. Нарушение микроциркуляции и обширные тромбозы на поверхности поврежденного эндотелия нарушают доставку кислорода и метаболитов, создавая условия для формирования органной дисфункции. Выделение атомарного кислорода, литических ферментов, вазоактивных веществ (оксид азота) и факторов роста эндотелиальных клеток создают условия для формирования микроциркуляторных повреждений и нарушения нормальной циркуляции эритроцитов.
Эндотоксин, ФНО-α и оксид азота могут обладать прямым цитоксическим эффектом, быть причиной повреждения транспорта электронов в митохондриях и нарушениях энергетического метаболизма. Этот процесс называют цитопатической или гистотоксической аноксией, когда даже при наличии кислорода нарушается его утилизация.
Апоптоз (программированная клеточная смерть) является важным механизмом нормальной элиминации клеток, имеющих функциональные нарушения. Провоспалительные цитокины способны тормозить апоптоз активированных макрофагов и нейтрофилов. Однако в других тканях, таких как эпителий кишечника, процессы апоптоза могут усиливаться. Поэтому нарушения регуляции апоптоза рассматриваются как важный механизм тканевых повреждений у пациентов с сепсисом.
Клинические рекомендации по иммунотерапии сепсиса
Обоснованность клинических рекомендаций.
Метаанализ клинических исследований считается одним из доказательств наиболее высокого уровня целесообразности применения препаратов или методов лечения. Самый последний метаанализ, посвященный эффективности применения иммуноглобулинов для внутривенного введения (ИГВВ), был опубликован в 2007 году [2]. В него были включены 14 рандомизированных клинических исследований (РКИ), опубликованных с 1988 по 2006 год. Большинство из них не являются крупными, в которых применялись низкие дозы ИГВВ, большинство пациентов имели хирургические инфекции, вызванные грамотрицательной флорой. Основным результатом метаанализа было достоверное снижение летальности, связанной с применением IgGAM с отношением рисков 0,66 (95% CI 0,53-0,83; р <0,0005). Было отмечено, что более высокий эффект лечения наблюдался в исследованиях с невысоким методическим качеством, в исследованиях с применением высоких доз ИГВВ, в которых в качестве контроля не применяли альбумин.
Исследования, включенные в метаанализ, обладали достоверной гетерогенностью (χ 2 = 0,009), что подтверждалось уровнем L² (53,8%). При оценке только исследований высокого качества, отношение рисков летальности составило 0,96 (95% confidence interval 0,71-1,3; р = 0,78), т.е. отсутствовало достоверное снижение летальности.
При проведении систематического обзора литературы отмечается достоверное снижение летальности у взрослых пациентов в критическом состоянии с тяжелым сепсисом и септическим шоком, которым применяли поликлональные IgGAM. Это заключение основано на результатах 14 опубликованных и неопубликованных рандомизированных клинических исследований, которые различались по качеству методического проведения.
Достоверная гетерогенность исследований была связана только с одним исследованием высокого качества, кроме того в метаанализе были использованы неопубликованные ранее исследования, которые также оказывали достоверное влияние на результаты в целом. Данные регрессионного анализа показали, что на гетерогенность оказывают влияние такие показатели, как год публикации, качество исследования и общая доза ИГВВ.
При графическом сравнении результатов исследований была выявлена асимметрия показателей, обычно такая асимметрия не бывает связанной с одной причиной [3]. Ее причинами могут быть гетерогенность и небольшое количество пациентов, включенных в исследования. Имеются подтверждения того, что почти всегда исследования, включенные в метаанализ, обладают определенной гетерогенностью [4]. Гетерогенность данного исследования была подтверждена статистически с помощью исследования L² Это свидетельствует о том, что реальное влияние ИГВВ на летальность может быть различным в разных популяциях пациентов с разными источниками инфекции, разными возбудителями или разной степенью иммунных нарушений. Кроме того, свой вклад в гетерогенность могут вносить различия в определении тяжелого сепсиса. Риск летального исхода, связанный с хронической патологией, также может оказывать эффект и модифицировать результаты лечения, однако провести точную оценку таких влияний очень сложно [5].
Другой проблемой исследований является качество методической мощности клинического исследования. Имеются общепринятые правила оценки мощности исследований, однако они не описывают все аспекты проведения рандомизированных клинических исследований, что может оказывать влияние на надежность полученных результатов [6]. Некоторые работы, включенные в метаанализ, хотя и считаются исследованиями высокого качества, однако включали неопубликованные исследования с коротким периодом последующего наблюдения (9 суток), что затрудняет оценку их доказательности [7, 8]. При выделении исследований только высокого качества не было получено достоверного эффекта применения ИГВВ, что в определенном плане противоречит выявленному снижению летальности, связанной с применением ИГВВ в этой группе. Данные метаанализа описывают определенную популяцию пациентов, и в целом его результаты соответствуют описанным в предшествующих обзорах 11.
Публикация рекомендаций по лечению тяжелого сепсиса и септического шока, основанных на принципах доказательной медицины, резко повысила интерес к доказательствам высокого уровня, одним из которых является метаанализ 19. Широко известные рекомендации включают разделы, касающиеся применения кортикостероидов, инсулина, ранней целенаправленной терапии, активированного протеина С на основании результатов однократно проведенных исследований 25. ИГВВ обладают сходным, если не сказать, более высоким эффектом в отношении исхода тяжелого сепсиса и септического шока, десятилетиями доказана безопасность их применения при различных заболеваниях [26]. Сегодня выглядит аномальным, что в широко распространенных международных рекомендациях недостаточно обсуждается применение ИГВВ, поэтому они редко включаются в национальные рекомендации и, следовательно, применяется во многих странах для лечения пациентов с тяжелым сепсисом и септическим шоком [19, 26].
Метаанализ сам по себе не направлен на оценку качества РКИ. Появление информации о сложностях, которые испытали исследователи при проведении методически несложных исследований (SAFE и CRASH), посвященных важным проблемам интенсивной терапии, становится понятным, что и метаанализ может не дать надежных рекомендаций 29. Для окончательного решения об эффективности ИГВВ в лечении сепсиса и септического шока было бы хорошо иметь результаты статистически мощного, хорошо спланированного прозрачного клинического исследования у взрослых.
Таким образом, метаанализ выявил общее снижение летальности при применении ИГВВ в качестве дополнительного метода лечения тяжелого сепсиса и септического шока у взрослых. Однако ввиду определенной гетерогенности включенных в него исследований не получено статистического подтверждения снижения летальности в подгруппе исследований высокого качества. Эффективность ИГВВ существенно повышалась при увеличении дозы препарата (> 1 г/кг) и при сравнении препарата с плацебо.
Заключение
Тяжелый сепсис и, особенно, септический шок до настоящего времени остаются одной из актуальных проблем медицины критических состояний. Принятие согласительной классификации сепсиса в 1991 году и ее быстрое клиническое внедрение оказало существенное влияние на возможности получения актуальных данных по эпидемиологии, этиологической структуре, летальности и экономическим затратам. Описательная классификация способна только в общих чертах создать портрет пациента с сепсисом и не способствует индивидуализации лечения. Дополнительную информацию состояния пациентов могут давать системы балльной оценки (APACHE и SAPS). Однако ни один из этих методов не предполагает оценки иммунологического состояния пациента. Широко бытует мнение о том, что в основе сепсиса лежат иммунологические проблемы, однако степень доказательств таких утверждений не очень высока. Это связано с тем, что иммунная система при сепсисе испытывает те же самые влияния, что и другие системы и органы, и умирает вместе с ними. Поэтому степень обратимости иммунологических нарушений на разных стадиях септического процесса еще предстоит выяснить.
Однако методы получения доказательств далеки от совершенства. Невозможно встать на формальную точку зрения и применять в интенсивной терапии только те препараты и методы, которые имеют высокую доказательную базу, т.к. таковых до настоящего времени крайне недостаточно.
Читайте также:

