Инфаркт пневмония и сепсис
Обновлено: 18.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Отек легких: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Отек легких определяется как жизнеугрожающее состояние, для которого характерен процесс накопления внесосудистой жидкости в легких. Отек может развиться внезапно при большой и разнообразной по своей природе группе заболеваний и нарастать стремительно.
Функции легочного кровообращения – газообмен и фильтрация крови, регуляция водного и электролитного баланса, участие в метаболических процессах. Транспорту крови способствует низкое давление в системе малого круга кровообращения и относительно низкие показатели сопротивления сосудов току крови.
Жидкость из кровеносных сосудов просачивается за их пределы в окружающие ткани либо из-за слишком высокого давления в кровеносных сосудах, либо из-за недостаточного количества белков в кровотоке, чтобы удерживать жидкость в плазме крови.
Непосредственно за пределами мелких кровеносных сосудов в легких находятся крошечные воздушные мешочки – альвеолы. Альвеолы разделены тонкими эластичными стенками (мембранами), внутри которых проходят мельчайшие кровеносные сосуды (капилляры), позволяющие молекулам кислорода и углекислого газа перемещаться через мембраны. Жидкость попадает в альвеолы в том случае, если мембраны теряют свою целостность, что приводит к затруднению дыхания и плохому насыщению крови кислородом.
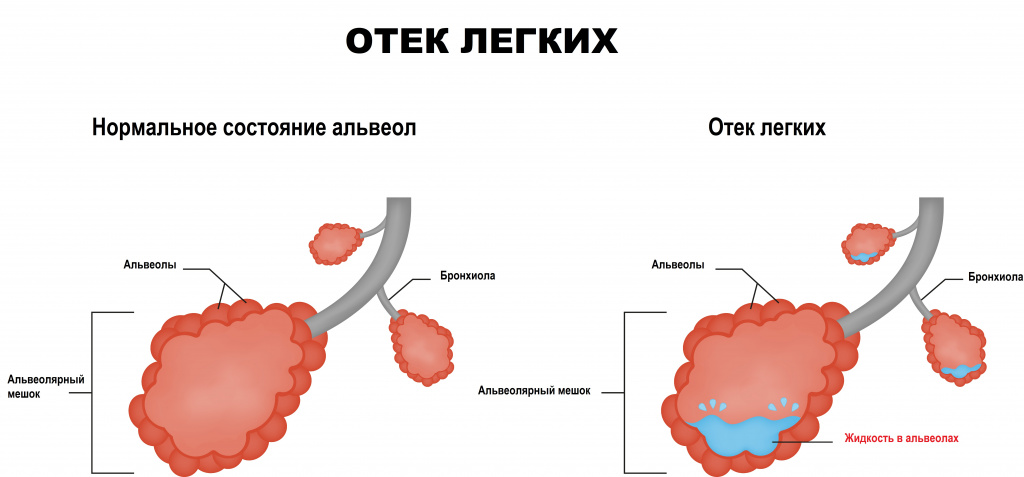
Выделяют два патогенетических процесса, с которыми связывают развитие отека легких:
Первый обусловлен повышением гидростатического давления в микрососудах малого круга кровообращения. Жидкость, электролиты и белки выходят за пределы сосудистой стенки и аккумулируются в интерстициальном (межсосудистом) пространстве легкого. На следующем этапе накопление жидкости происходит на поверхности альвеол, что становится причиной резкого ухудшения функции газообмена в легких и приводит к развитию гипоксемии.
Второй процесс связан с нарушением проницаемости альвеолярно-капиллярной мембраны из-за острого повреждения легочной ткани, которое может происходить при сепсисе, травме, пневмонии и некоторых других заболеваниях. Этот процесс также сопровождается гипоксемией и одышкой различной степени выраженности. В конечной фазе развития отека легких происходит аномальное накопление белков, в первую очередь альбуминов, в альвеолярной жидкости.
Разновидности отека легких
Кардиогенный отек легких встречается преимущественно при заболеваниях сердца или сосудов как осложнение острой сердечной недостаточности и связан с повышением гидростатического давления. У больного человека можно наблюдать тахикардию, кашель и одышку, которые возникают вследствие систолической или диастолической дисфункций левого желудочка.
Некардиогенный отек легких развивается вследствие повышенной проницаемости сосудистой стенки альвеолярных капилляров. Основным клиническим проявлением является развитие острого респираторного дистресс-синдрома.
По варианту течения выделяют следующие виды отека легких:
- Молниеносный – развивается в течение нескольких минут, в большинстве случаев приводит к летальному исходу.
- Острый – отмечается быстрое (на протяжении 4 часов) нарастание выраженности клинических симптомов. Вероятность летального исхода довольно высока и возникает на фоне инфаркта, черепно-мозговой травмы, анафилактического шока.
- Подострый – имеет волнообразное течение, характеризуется чередованием активных и спокойных периодов. Причиной часто является печеночная недостаточность. Имеет достаточно благоприятный прогноз, особенно при своевременном начале мероприятий неотложной помощи.
- Затяжной – симптомы нарастают в течение 12 часов со стертой клинической картиной, что значительно затрудняет диагностику. Основой являются хроническая сердечная недостаточность или заболевания бронхолегочной системы.
К основным причинам развития кардиогенного отека легких относятся:
- инфаркт миокарда с подъемом сегмента ST электрокардиограммы;
- гипертонический криз;
- пароксизм мерцательной аритмии (эпизод, длящийся от 30 секунд до семи дней, проходит самостоятельно или при помощи лечения).
- недостаточность митрального клапана (отрыв хорды сосочковой мышцы).
- постинфарктный и атеросклеротический кардиосклероз с систолической сердечной недостаточностью;
- диастолическая дисфункция миокарда у пожилых больных;
- систолическая и диастолическая дисфункция миокарда у больных с кардимиопатией или миокардитом;
- постоянная форма мерцательной аритмии;
- врожденные и приобретенные пороки левых отделов сердца;
- поражения клапанного аппарата, особенно митрального клапана, вследствие ревмокардита, инфекционного эндокардита, атеросклероза.
Основные легочные причины и факторы риска острого респираторного дистресс-синдрома:
- пневмония,
- вирус COVID-19,
- тромбоэмболия легочной артерии,
- ингаляционная травма,
- аспирационный синдром,
- травма грудной клетки,
- респираторные вирусные заболевания,
- эмфизема легких,
- бронхиальная астма,
- туберкулез легких,
- рак легких или метастазы в легкие.
- тяжелый сепсис и септический шок,
- переливание крови и кровезаменителей,
- большая кровопотеря,
- черепно-мозговые травмы, множественные и обширные травмы, ожоги,
- острое нарушение мозгового кровообращения,
- менингит, энцефалит,
- панкреонекроз,
- острая почечная недостаточность, острый гломерулонефрит,
- отравление химическими веществами, лекарственными средствами, алкоголем, наркотическими веществами,
- инфекционные заболевания, протекающие с тяжелой интоксикацией (грипп, корь, дифтерия, скарлатина, коклюш, столбняк, брюшной тиф),
- цирроз печени,
- патология беременных (эклампсия, синдром гиперстимуляции яичников),
- анафилактический шок,
- иммерсионный отек легких, вызванный плаванием на глубине.
В детском возрасте проблемы с сердцем наблюдаются намного реже, чем во взрослом. Поэтому основными причинами отека легких становятся заболевания дыхательной системы или серьезные травмы.
К каким врачам обращаться при отеке легких
Диагностика и обследования при отеке легких
Для установления диагноза обычно достаточно проведения клинического обследования и рентгенографии грудной клетки.
Рентгенологическое исследование структуры легких с целью диагностики различных патологий.
Инфаркт легкого – ишемия участка легочной ткани, вызванная тромбозом или эмболией ветвей легочной артерии. Клиническими признаками данной патологии могут служить резкая боль в груди, одышка, кашель с кровянистой мокротой, гипертермия, тахикардия, коллапс. Для выявления инфаркта легкого информативны рентгенография, КТ и сцинтиграфия легких, ангиопульмонография, ЭхоКГ, исследование газового состава крови. Лечение начинают с назначения антикоагулянтов и фибринолитиков, кислородотерапии; при необходимости производится эмболэктомия. В случае развития инфаркт-пневмонии показана антибиотикотерапия.
МКБ-10
Общие сведения
Инфаркт легкого (легочная эмболия) – нарушение кровообращения на ограниченном участке легочной паренхимы, развивающееся в результате закупорки долевых, сегментарных и более мелких артерий легкого тромбом или эмболом. По имеющимся в пульмонологии данным, инфаркт легкого составляет 10-25% всех случаев ТЭЛА. Диагноз тромбоэмболии легких нередко не устанавливается прижизненно, что приводит к большому количеству нераспознанных эпизодов инфаркта легкого. При этом летальный исход от легочной эмболии регистрируется у 5%-30% больных. Отсутствие лечения, рецидивирующие тромбозы, наличие фоновой патологии являются основными факторами, повышающими риск фатальных случаев легочной эмболии. Инфаркт правого легкого встречается в 2 раза чаще, чем левого, при этом нижние доли легких поражаются в 4 раза чаще, чем верхние.
Причины инфаркта легкого
Инфаркт легкого чаще всего развивается у больных, страдающих сердечно-сосудистой патологией: мерцательной аритмией, митральным стенозом, ИБС и инфарктом миокарда, кардиомиопатией, инфекционным эндокардитом, миксомой предсердия, сердечной недостаточностью, васкулитами и др. При этом тромбы обычно образуются в ушке правого предсердия и при определенных условиях с током крови заносятся в артерии малого круга. Нередко причиной легочной эмболии становятся тромбозы вен нижних конечностей, тромбофлебиты глубоких вен таза. В этих случаях наибольшую опасность представляют флотирующие тромбы, имеющие одну точку фиксации в дистальном отделе венозного сосуда.
Множественные жировые эмболии легких нередко становятся осложнением переломов трубчатых костей. Известно, что постельный режим или иммобилизация конечностей даже на одну неделю существенно повышают риск эмбологенного тромбоза. Инфаркт легкого может развиться в послеродовом и послеоперационном периоде - чаще после кесарева сечения, обширных абдоминальных, торакальных и гинекологических операций, геморроидэктомии.
К вторичным предрасполагающим к легочной тромбоэмболии факторам относятся рецидивирующие венозные тромбозы в анамнезе, наследственная отягощенность по ТЭЛА, возраст старше 60 лет, гормональная контрацепция, ожирение, опухоли поджелудочной железы, легочная гипертензия и др. Потенциально опасными фоновыми болезнями крови служат серповидно-клеточная анемия, полицитемия, ДВС-синдром, гепарин-индуцированная тромбоцитопения.
Инфаркт легкого развивается в период от несколько часов до суток после обтурации долевых и сегментарных ветвей легочной артерии тромбоэмболом; полная организация инфаркта занимает примерно 7 суток. Ишемизированный участок имеет форму клина (пирамиды) различной величины с основанием, направленным в сторону периферии, а верхушкой, обращенной к корню легкого. Пораженная зона характеризуется темно-вишневым цветом, плотной консистенцией, выступает над поверхностью здоровой ткани легкого. Плевра приобретает тусклый, матовый оттенок; в ее полости часто скапливается геморрагическое содержимое. Исходами инфаркта легкого могут быть: полная резорбция, уплотнение, рубцевание, деструктивные изменения в легком (абсцесс, гангрена).
Классификация инфаркта легкого
Инфаркт легкого представляет собой один из клинических вариантов ТЭЛА, наряду с внезапной одышкой неизвестного генеза и острым легочным сердцем. В зависимости от уровня обтурации легочной артерии тромбоэмболом различают:
- массивную тромбоэмболию (эмболизация основного ствола или же главных ветвей легочной артерии)
- субмассивную тромбоэмболию (закупорка на уровне долевых и сегментарных ветвей)
- тромбоэмболию мелких легочных артерий.
Инфаркт легкого может быть первичным (с неизвестным источником отрыва тромбоэмбола) и вторичным (осложнение тромбофлебита вен); ограниченным (при обтурации субсегментарных ветвей легочной артерии) и обширным (зона поражения распространяется на большую площадь); неосложненным и осложненным (кровохарканьем, абсцедированием, эмпиемой плевры, сепсисом).
Тромбоэмболия ветвей легочных артерий вызывает ишемизацию участка легочной паренхимы с последующим переполнением поврежденной ткани легкого кровью, которая поступает в него из областей с нормальной васкуляризацией. При таком механизме развивается геморрагическая форма инфаркта легкого. В пораженной зоне создаются условия для развития инфекции, что приводит к возникновению инфаркт-пневмонии. В других случаях ветвь легочной артерии перекрывается инфицированным эмболом – в этом случае происходят деструкция паренхимы и формирование абсцесса легкого.
Симптомы инфаркта легкого
Диагностика инфаркта легкого
Диагностика инфаркта легкого требует координации усилий пульмонолога и кардиолога. Физикальные исследования при инфаркте легкого выявляют ослабленное дыхание, мелкопузырчатые хрипы, шум трения плевры; укорочение перкуторного звука; систолический шум, ритм галопа, акцент и расщепление II тона на аорте. При пальпации живота может обнаруживаться увеличение печени, ее болезненность.
В лабораторных анализах (ОАК, биохимическом исследовании крови, анализе газового состава крови) отмечается умеренный лейкоцитоз, повышение активности лактатдегидрогеназы, общего билирубина (при нормальных значениях трансаминаз), признаки артериальной гипоксемии. По данным ЭКГ возможно выявление признаков перегрузки правых отделов сердца, неполная блокада правой ножки пучка Гиса. ЭхоКГ-маркеры инфаркта легкого могут включать расширение и гипокинезию правого желудочка, повышение давления в легочной артерии, наличие тромба в правых отделах сердца и др. УЗДГ вен нижних конечностей часто позволяет диагностировать тромбозы глубоких вен.
Рентгенография легких в прямой и боковой проекциях (равно как КТ или МСКТ легких) обнаруживает расширение и деформацию корня легкого, участок снижения прозрачности в виде клина, наличие выпота в полости плевры. Ангиопульмонография выявляет обструкцию ветвей легочной артерии за счет внутриартериальных дефектов наполнения. Сцинтиграфия легких используется для подтверждения наличия участков снижения перфузии легких.
На основании анализа клинической картины и лабораторно-инструментальных данных инфаркт легкого приходится дифференцировать с крупозной пневмонией, спонтанным пневмотораксом, ателектазом легкого, инфарктом миокарда, перикардитом, миокардитом, переломом ребер и др.
Лечение инфаркта легкого
Первая помощь при инфаркте легкого должна быть оказана как можно раньше. Прежде всего, необходимо купировать болевой синдром с помощью ненаркотических либо наркотических анальгетиков и незамедлительно госпитализировать пациента в ОРИТ.
С целью предотвращения дальнейшего тромбообразования и препятствия увеличению уже сформировавшегося тромба используются прямые (гепарин, фраксипарин) и непрямые антикоагулянты (фениндион, варфарин) под контролем показателей коагулограммы. Антикоагулянтная терапия противопоказана при кровотечении, геморрагических диатезах, язвенной болезни желудка и ДПК, злокачественных новообразованиях. Для растворения тромбов назначается фибринолитическая терапия стрептокиназой, урокиназой, тканевым активатором плазминогена.
При легочной эмболии, осложненной артериальной гипотонией, внутривенно капельно вводятся вазопрессоры (норадреналин, допамин), реополиглюкин. В случае возникновении признаков инфаркт-пневмонии проводится антибиотикотерапия. Больные с инфарктом легкого нуждаются в ингаляциях кислорода через назальный катетер. При отсутствии положительной динамики от консервативного лечения, возможно проведение тромбоэмболэктомии из легочной артерии с установкой кава-фильтра в систему нижней полой вены. Для оценки показаний к хирургическому лечению пациент должен быть своевременно осмотрен сосудистым или торакальным хирургом.
Прогноз и профилактика инфаркта легкого
При правильно и своевременно организованной терапии инфаркт легкого не представляет большой угрозы для жизни. В редких случаях он может привести к внезапной смерти. Риск неблагоприятного исхода повышается при наличии тяжелой сердечной недостаточности, рецидивах ТЭЛА, развитии различных осложнений (постинфарктной пневмонии, отека легких, нагноительных процессов).
С учетом причин инфаркта легкого, профилактика может включать своевременное лечение тромбофлебитов, лечебную гимнастику и ранний подъем после оперативных вмешательств, ношение компрессионного трикотажа при заболеваниях вен нижних конечностей, соблюдение сроков использования внутривенных катетеров для инфузионной терапии.
1. Инфаркт легкого как хирургическая патология: морфология и дифференциальная диагностика/ Лискина И.В., Загаба Л.М., Дорофеева С.И.// Патология. – 2015 - №1 (33).
2. Клинические рекомендации (протокол) по оказанию скорой медицинской помощи при тромбоэмболии легочной артерии/ Костенко В.А., Сорока В.В., Андрейчук К.А. – 2014.
3. О возможности диагностики инфарктных пневмоний без проведения МСКТ с контрастированием сосудов / Бачурина М.А., Мазур В.В., Поспелова А.М., Мазур Е.С.// Верхневолжский медицинский журнал. – 2013 – Т.11 (2).
Внутрибольничная пневмония – это легочная инфекция, развившаяся спустя двое и более суток после поступления больного в стационар, при отсутствии признаков заболевания на момент госпитализации. Проявления внутрибольничной пневмонии аналогичны таковым при других формах воспаления легких: лихорадка, кашель с мокротой, тахипноэ, лейкоцитоз, инфильтративные изменения в легких и т. п., однако могут быть слабо выраженными, стертыми. Диагноз основывается на клинических, физикальных, рентгенологических и лабораторных критериях. Лечение внутрибольничной пневмонии включает адекватную антибиотикотерапию, санацию дыхательных путей (лаваж, ингаляции, физиометоды), инфузионную терапию.
МКБ-10
Общие сведения
Внутрибольничная (нозокомиальная, госпитальная) пневмония – приобретенная в стационаре инфекция нижних дыхательных путей, признаки которой развиваются не ранее 48 часов после поступления больного в лечебное учреждение. Нозокомиальная пневмония входит в тройку самых распространенных внутрибольничных инфекций, уступая по распространенности лишь раневым инфекциям и инфекциям мочевыводящих путей. Внутрибольничная пневмония развивается у 0,5-1% больных, проходящих лечение в стационарах, а у пациентов отделений реанимации и интенсивной терапии встречается в 5-10 раз чаще. Летальность при внутрибольничной пневмонии чрезвычайно высока – от 10-20% до 70-80% (в зависимости от вида возбудителя и тяжести фонового состояния пациента).
Причины
Основная роль в этиологии внутрибольничной бактериальной пневмонии принадлежит грамотрицательной флоре (синегнойной палочке, клебсиелле, кишечной палочке, протею, серрациям и др.) – эти бактерии обнаруживаются в секрете дыхательных путей в 50-70% случаев. У 15-30% пациентов ведущим возбудителем выступает метициллинрезистентный золотистый стафилококк. За счет различных приспособительных механизмов названные бактерии вырабатывают устойчивость к большинству известных антибактериальных средств. Анаэробы (бактериоды, фузобактерии и др.) являются этиологическими агентами 10-30% внутрибольничных пневмоний. Примерно у 4% пациентов развивается легионеллезная пневмония – как правило, она протекает по типу массовых вспышек в стационарах, причиной которых служит контаминация легионеллами систем кондиционирования и водоснабжения.
Значительно реже, чем бактериальные пневмонии, диагностируются нозокомиальные инфекции нижних дыхательных путей, вызванные вирусами. Среди возбудителей внутрибольничных вирусных пневмоний ведущая роль принадлежит вирусам гриппа А и В, РС-вирусу, у больных с ослабленным иммунитетом – цитомегаловирусу.
Общими факторами риска инфекционных осложнений со стороны дыхательных путей служат длительная госпитализация, гипокинезия, бесконтрольная антибиотикотерапия, пожилой и старческий возраст. Существенное значение имеет тяжесть состояния больного, обусловленная сопутствующими ХНЗЛ, послеоперационным периодом, травмами, кровопотерей, шоком, иммуносупрессией, комой и пр. Способствовать колонизации нижних дыхательных путей микробной флорой могут медицинские манипуляции: эндотрахеальная интубация и реинтубация, трахеостомия, бронхоскопия, бронхография и пр. Основными путями попадания патогенной микрофлоры в дыхательные пути служат аспирация секрета ротоносоглотки или содержимого желудка, гематогенное распространение инфекции из отдаленных очагов.
Вентилятор-ассоциированная пневмония возникает у больных, находящихся на ИВЛ; при этом каждый день, проведенный на аппаратном дыхании, увеличивает риск развития внутрибольничной пневмонии на 1%. Послеоперационная, или застойная пневмония, развивается у обездвиженных больных, перенесших тяжелые оперативные вмешательства, главным образом, на грудной и брюшной полости. В этом случае фоном для развития легочной инфекции служит нарушение дренажной функции бронхов и гиповентиляция. Аспирационный механизм возникновения внутрибольничной пневмонии характерен для больных с цереброваскулярными расстройствами, у которых отмечаются нарушения кашлевого и глотательного рефлексов; в этом случае патогенное действие оказывают не только инфекционные агенты, но и агрессивный характер желудочного аспирата.
Классификация
По срокам возникновения госпитальная инфекция подразделяется на раннюю и позднюю. Ранней считается внутрибольничная пневмония, возникшая в первые 5 суток после поступления в стационар. Как правило, она вызывается возбудителями, присутствовавшими в организме пациента еще до госпитализации (St. аureus, St. pneumoniae, H. influenzae и др. представителями микрофлоры верхних дыхательных путей). Обычно эти возбудители проявляют чувствительность к традиционным антибиотикам, а сама пневмония протекает более благоприятно.
Поздняя внутрибольничная пневмония манифестирует через 5 и более дней стационарного лечения. Ее развитие обусловлено собственно госпитальными штаммами (метициллинрезистентным St. аureus, Acinetobacter spp., P. аeruginosa, Enterobacteriaceae и др.), проявляющими высоковирулентные свойства и полирезистентность к противомикробным препаратам. Течение и прогноз поздней внутрибольничной пневмонии весьма серьезны.
С учетом причинных факторов выделяют 3 формы нозокомиальной инфекции дыхательных путей:
При этом довольно часто различные формы наслаиваются друг на друга, еще в большей степени утяжеляя течение внутрибольничной пневмонии и увеличивая риск летального исхода.
Симптомы внутрибольничной пневмонии
Особенностью течения внутрибольничной пневмонии является стертость симптомов, из-за чего распознавание легочной инфекции бывает затруднительным. В первую очередь, это объясняется общей тяжестью состояния больных, связанной с основным заболеванием, хирургическим вмешательством, пожилым возрастом, коматозным состоянием и т. п.
Тем не менее, в ряде случаев заподозрить внутрибольничную пневмонию можно на основании клинических данных: нового эпизода лихорадки, увеличения количества мокроты/трахеального аспирата или изменение их характера (вязкости, цвета, запаха и пр.). Больные могут предъявлять жалобы на появление или усиление кашля, одышки, болей в грудной клетке. У пациентов, находящихся в тяжелом или бессознательном состоянии следует обратить внимание на гипертермию, увеличение ЧСС, тахикардию, признаки гипоксемии. Критериями тяжелого инфекционного процесса в легких служат признаки выраженной дыхательной (ЧД > 30/мин.) и сердечно-сосудистой недостаточности (ЧСС > 125/мин., АД < 100/60 мм рт. ст.), нарушение сознания, двустороннее или мультилобарное поражение легких и др. При этом необходимо исключить возможные неинфекционные причины кардиопульмональных расстройств: пневмоторакс, острый респираторный дистресс-синдром, отек легких, ТЭЛА, инфаркт легкого и др. Осложнениями внутрибольничной пневмонии чаще всего становятся абсцесс легкого, эмпиема плевры, сепсис.
Диагностика
Полное диагностическое обследование при подозрении на внутрибольничную пневмонию строится на сочетании клинических, физикальных, инструментальных (рентгенография легких, КТ грудной клетки), лабораторных методов (ОАК, биохимический и газовый состав крови, бакпосев мокроты).
Для выставления соответствующего диагноза пульмонологи руководствуются рекомендуемыми критериями, включающими в себя: лихорадку выше 38,3°С, усиление бронхиальной секреции, гнойный характер мокроты или бронхиального секрета, кашель, тахипноэ, бронхиальное дыхание, влажные хрипы, инспираторную крепитацию. Факт внутрибольничной пневмонии подтверждается рентгенологическими признаками (появлением свежих инфильтратов в легочной ткани) и лабораторными данными (лейкоцитозом >12,0х10 9 /л, палочкоядерным сдвигом >10%, артериальной гипоксемией Ра02< 60 мм рт. ст., Sa02 < 90%.).
С целью верификации вероятных возбудителей внутрибольничной пневмонии и определения антибиотикочувствительности производится микробиологическое исследование секрета трахеобронхиального дерева. Для этого используются не только образцы свободно откашливаемой мокроты, но и трахеальный аспират, промывные воды бронхов. Наряду с культуральным выделение возбудителя, широко применяется ПЦР-исследование.
Лечение внутрибольничной пневмонии
Сложность лечения внутрибольничной пневмонии заключается в полирезистентности возбудителей к противомикробным препаратам и тяжести общего состояния больных. Практически во всех случаях первоначальная антибиотикотерапия является эмпирической, т. е. начинается еще до микробиологической идентификации возбудителя. После установления этиологии внутрибольничной пневмонии может быть произведена замена препарата на более действенный в отношении выявленного микроорганизма.
Препаратами выбора при внутрибольничной пневмонии, вызванной E.Coli и K. pneumoniae, служат цефалоспорины III-IV поколения, ингибиторзащищенные пенициллины, фторхинолоны. Синегнойная палочка чувствительна к сочетанию цефалоспоринов III-IV поколения (или карбапенемов) с аминогликозидами. Если госпитальные штаммы представлены St. аureus, требуется назначение цефазолина, оксациллина, амоксициллина с клавулановой кислотой и т. д. Для терапии аспергиллеза легких используется вориконазол или каспофунгин.
В начальном периоде предпочтителен внутривенный путь введения препарата, в дальнейшем при положительной динамике возможен переход на внутримышечные инъекции либо пероральный прием. Продолжительность курса антибиотикотерапии у пациентов с нозокомиальной пневмонией составляет 14-21 день. Оценка эффективности этиотропной терапии проводится по динамике клинических, лабораторных и рентгенологических показателей.
Кроме системной антибиотикотерапии, при внутрибольничной пневмонии важное внимание уделяется санации дыхательных путей: проведению бронхоальвеолярного лаважа, ингаляционной терапии, трахеальной аспирации. Больным показан активный двигательный режим: частая смена положения и присаживание в постели, ЛФК, дыхательные упражнения и т. п. Дополнительно проводится дезинтоксикационная и симптоматическая терапия (инфузии растворов, введение и прием бронхолитиков, муколитиков, жаропонижающих препаратов). Для профилактики тромбозов глубоких вен назначается гепарин или ношение компрессионного трикотажа; с целью предупреждения стрессовых язв желудка используются Н2-блокаторы, ингибиторы протонной помпы. Пациентам с тяжелыми септическими проявлениями может быть показано введение внутривенных иммуноглобулинов.
Прогноз и профилактика
Клиническими исходами внутрибольничной пневмонии могут быть разрешение, улучшение, неэффективность терапии, рецидив и летальный исход. Внутрибольничная пневмония является главной причиной смертности в структуре внутрибольничных инфекций. Это объясняется сложностью ее своевременной диагностики, особенно у пожилых, ослабленных больных, пациентов, пребывающих в коматозном состоянии.
Профилактика внутрибольничной пневмонии базируется на комплексе медицинских и эпидемиологических мероприятий: лечении сопутствующих очагов инфекции, соблюдении санитарно-гигиенического режима и инфекционного контроля в ЛПУ, предупреждении переноса возбудителей медперсоналом при проведении эндоскопических манипуляций. Чрезвычайно важна ранняя послеоперационная активизация пациентов, стимуляция откашливания мокроты; тяжелые больные нуждаются в адекватном туалете ротоглотки, постоянной аспирации трахеального секрета.
1. Нозокомиальная пневмония у взрослых (Национальные рекомендации)/ под ред. Чучалина А.Г., Гельфанда Б.Р.//Клиническая микробиология и антимикробная химиотерапия. - 2009 - Т.11, №2.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
С-реактивный белок (СРБ, CRP): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
С-реактивный белок (СРБ) – наиболее высокочувствительный показатель повреждения тканей при воспалении, некрозе, травме. В крови здорового человека СРБ отсутствует или выявляется в минимальных количествах. Вырабатывается он преимущественно клетками печени (гепатоцитами), как реакция на попадание в организм человека возбудителей инфекций, на травму, а также при системных заболеваниях соединительной ткани (ревматических заболеваниях).
Еще одним показателем острого воспаления является СОЭ (скорость оседания эритроцитов).
СОЭ – неспецифичный маркер воспаления. Синонимы: Реакция оседания эритроцитов; РОЭ. Westergren sedimentation rate; Erythrocyte Sedimentation Rate; ESR; Sed Rate; Sedimentation Rate. Краткое описание исследования СОЭ Неспецифический показатель, отражающий изм.
Уровень СРБ при вирусных заболеваниях повышается незначительно, поэтому его существенный рост в сочетании с повышенной температурой тела с большой долей вероятности свидетельствует о наличии бактериальной инфекции.
На короткое время С-реактивный белок может повышаться после оперативных вмешательств из-за повреждения тканей, но при отсутствии бактериального воспаления в послеоперационном периоде быстро снижается.
Тогда как присоединение бактериальной инфекции, будь то локальный процесс или сепсис, сопровождается ростом СРБ или отсутствием его снижения.
Существует высокочувствительный метод определения СРБ – высокочувствительный С-реактивный белок (кардио). Исследование позволяет выявить повышение СРБ при вялотекущем, низкой степени активности воспалении внутренней поверхности сосудистой стенки, которое чревато образованием атеросклеротических бляшек. Анализ назначают только в отсутствии острых заболеваний и травм (при них повышение СРБ выявляется стандартным методом). Увеличение значений высокочувствительного С-реактивного белка может свидетельствовать о риске сердечно-сосудистых заболеваний: инфаркта миокарда, инсульта.

Таким образом, анализ на С-реактивный белок в комплексе с исследованием некоторых показателей клинического анализа крови (уровня лейкоцитов, лейкоцитарной формулы и СОЭ) обычно назначают в случае повышения температуры тела, чтобы по степени их увеличения предположить вирусное или бактериальное воспаление.
СРБ определяют при болях в суставах, не связанных с травмой, для дифференциальной диагностики дегенеративных и воспалительных заболеваний – артроза и артрита. При ревматических заболеваниях СРБ исследуют для оценки активности процесса и контроля эффективности лечения.
Подготовка к процедуре
При необходимости можно сдавать анализ на СРБ через 4-6 часов после легкого приема пищи.
За 2-3 дня до исследования следует исключить физические нагрузки.
Не следует курить минимум за 30 минут до забора крови.
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также:

