Инфекции ассоциированные с биопленками
Обновлено: 24.04.2024
Н.А. Вознесенский Николай Арнольдович Вознесенский – канд. мед. наук, зав. лабораторией НИИ пульмонологии ФМБА России.
Более 150 лет назад Роберт Кох разработал метод чистой культуры для выделения индивидуальных штаммов бактерий. Эти подходы и по сей день широко используются в микробиологии, однако рост отдельных клеток планктонных (свободно плавающих) бактерий в среде, богатой питательными веществами, существенно отличается от их существования в естественных условиях, в том числе в организме человека. Обычно планктонный фенотип бактерий встречается лишь транзиторно и в минимальном количестве, тогда как преимущественно бактериальные популяции представляют собой биопленки – полимикробные фиксированные сообщества микроорганизмов, внедренные в синтезированный ими полимерный матрикс. Такая форма существования предоставляет бактериям массу преимуществ в условиях воздействия неблагоприятных факторов внешней среды и организма-хозяина. Представления о биопленках, подтвержденные с помощью современных методов визуализации, изменили взгляды на инфекционные заболевания. Всё новые данные свидетельствуют о том, что хронические инфекции принципиально отличаются от острых, а существование биопленок при хронических инфекциях требует совершенно новых подходов к их диагностике и лечению [1].
Биопленкой называют тонкий слой микроорганизмов с секретированными ими полимерами, который адгезирован к органической или неорганической поверхности. Впервые свойства биопленок исследовали Costerton J.W. et al., изучив внеклеточные полимерные вещества, удерживающие вместе сообщество бактерий [2]. Биопленки – это основной фенотип почти всех бактерий в естественных условиях обитания, как во внешней среде, так и в организме человека при патологии. Биопленки предоставляют защиту от факторов внешней среды и могут включать микроорганизмы разных царств (например, бактерии и грибы). Благодаря существованию в виде биопленок популяция бактерий усиливает свою защиту от фагоцитоза, ультрафиолетового излучения, вирусов и дегидратации, а также от антибиотиков и факторов иммунной защиты макроорганизма. В частности, биопленки оказались способными выдерживать концентрации антибиотиков в 100-1000 раз больше, чем подавляющие планктонные клетки [3]. Аналогичным образом, фагоциты макроорганизма неспособны поглощать биопленки в отличие от отдельных бактериальных клеток. Повышает устойчивость биопленок к вредным факторам присущее им генетическое и фенотипическое разнообразие, которое позволяет им переносить большинство терапевтических воздействий [4].
Всё больше накапливается доказательств, что выделенная чистая культура бактерий совпадает с биопленкой только по небольшому числу свойств. Когда бактерии переходят от планктонного фенотипа к формированию биопленки, процессы их биосинтеза радикально меняются. Клетки начинают синтезировать полимеры, защищающие их и связывающие между собой и с подлежащей поверхностью. Кроме того, клетки (даже разных видов) обмениваются между собой информацией с помощью феромонов и других сигнальных молекул. Скоординированная активность сообщества микробов делает биопленки малоуязвимыми для факторов защиты макроорганизма [1].
Представления о планктонном существовании бактерий накладывают ограничения на диагностические и терапевтические возможности современной медицины. Поскольку планктонные клетки хуже защищены, чем биопленки, то антибиотик, высокоактивный in vitro при тестировании в чистой культуре, при испытаниях in vivo (когда преобладает фенотип биопленок) может оказаться неэффективным. Этим может объясняться по крайней мере часть различий в результатах испытаний антибиотиков in vitro и в клинических условиях [5, 6].
Кроме того, традиционные бактериологические методы не выявляют большинство бактерий, участвующих в инфекционном процессе [7, 8]. Новейшие молекулярные, геномные, транскрипционные и протеомные методы позволили определить, что при выделении чистой культуры определяется лишь около 1% клеток патогенного микробиоценоза. В результате лечение нацелено лишь на 1-2 вида бактерий из множества штаммов, присутствующих в составе биопленки (в том числе, возможно, и грибов).
Наконец, ограниченные возможности культуральных методов приводят в ряде случаев к ошибочному или неполному диагнозу. Поскольку эти методы не выявляют те бактерии в составе биопленок, которые жизнеспособны, но не культивируются, то зачастую делается заключение о "стерильном воспалении" или вирусной инфекции (например, при среднем отите или простатите) [9].
Сейчас не вызывает сомнений необходимость пересмотреть концепцию патогенеза различных хронических инфекций, внедрив в нее имеющиеся данные о биопленках. В практическом отношении это требует использования новых методов диагностики и лечения. Среди методов, которые позволяют идентифицировать микроорганизмы в составе биопленок, можно назвать современные молекулярные методы (электрофорез в геле и высокоэффективная жидкостная хроматография с флюоресцентной гибридизацией in situ). В клинических лабораториях всё шире используются полимеразная цепная реакция (ПЦР), ПЦР с обратной транскриптазой, быстрое секвенирование и другие исследования [7].
Терапевтическое воздействие на биопленки может быть направлено на механизмы первоначальной адгезии бактерий к поверхности, блокирование синтеза или разрушение полимерного матрикса, нарушение межклеточного обмена информацией, а также оно может сочетаться с собственно бактерицидными агентами. Подобное лечение, действующее на структуру или функции биопленок, может оказаться более эффективным, чем стандартная антибактериальная терапия [4].
Концепция биопленок затрагивает инфекционные поражения большинства органов (верхних дыхательных путей, легких, сердца, почек, кожи, костей, системы пищеварения) и практически всех искусственных имплантатов. Среди всех инфекционных поражений около 65-80% вызываются бактериями, формирующими биопленки [1, 11]. При таких, на первый взгляд, совершенно различных заболеваниях, как пневмония, цистит и инфицированный протез коленного сустава, благодаря общности патогенеза могут использоваться сходные стратегии лечения, сфокусированные на подавление биопленок.
Активностью в отношении биопленок обладает N-ацетилцистеин (Флуимуцил). Этот препарат, известный как муколитик и антиоксидант, оказался способен противостоять формированию и даже разрушать биопленки. В опытах in vitro N-ацетилцистеин подавлял способность Staphylococcus epidermidis образовывать биопленки, этот эффект зависел от концентрации препарата и был подтвержден данными электронной микроскопии [12]. N-ацетилцистеин не только самостоятельно подавляет образование и разрушает уже сформированные биопленки Escherichia coli, но и значительно усиливает бактерицидную активность фосфомицина [13]. В клинических условиях влияние N-ацетилцистеина в сочетании с тиамфениколом (Флуимуцил-антибиотик) на инфекцию, сопровождающуюся формированием биопленок, изучали у больных (n = 102) с рецидивирующими инфекциями верхних дыхательных путей [14]. Флуимуцил-антибиотик в 1-й день вводили внутримышечно, а затем – ингаляционно в течение 10 дней. Формирование биопленок in vivo было подтверждено результатами сканирующей электронной микроскопии у 24 пациентов, у которых были выделены штаммы Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae и Haemophilus influenzae. Среди этих пациентов клиническое и бактериологическое излечение при терапии Флуимуцил-антибиотиком было достигнуто у 21 (87,5%), а неудача в 3 случаях была обусловлена присутствием штаммов S. aureus (in vitro чувствительных к тиамфениколу). Предположительно, механизмы активности N-ацетилцистеина против биопленок связаны с тем, что он нарушает адгезию бактерий к поверхности, разрушает внеклеточные полисахариды биопленок и даже тормозит их синтез бактериями [15]. По-видимому, исследования активности Флуимуцила против бактерий, образующих биопленки, будут продолжаться, а одним из наиболее перспективных направлений исследования следует считать инфекцию Pseudomonas aeruginosa у больных муковисцидозом, бронхоэктазией и другими легочными заболеваниями.
Итак, лечение хронических инфекций в настоящее время уже не может основываться на планктонной концепции микробиологии. Представление о биопленках изменяет подходы к диагностике и лечению инфекционных поражений в самых различных областях медицины. Этому способствует разработка соответствующих методов молекулярной диагностики, а также стратегий лечения, воздействующих на механизмы формирования и функционирования бактериальных сообществ в виде биопленок.
Бузолева Л.С. 1, 2 Пузь А.В. 3 Синебрюхов С.Л. 3 Гнеденков С.В. 3 Ким А.В. 2 Еськова А.И. 1 Пономарева А.Л. 1
В обзоре представлены материалы, касающиеся проблем имплантат-ассоциированных инфекций, возникающих в результате возникновения микробных биопленок на поверхностях имплантатов. Показан спектр различных материалов и их покрытий, используемых в имплантационной хирургии, с учетом их совместимости с биологическими тканями и степени совместимости с продуктами возможного износа и определены наиболее перспективные из них. Приведен перечень основных видов имплантатов, заражение которых может привести к имплант-ассоциированным инфекциям. Обсуждена проблема возникновения инфекционных заболеваний в постоперационный период имплантации и приведены известные на сегодняшний день возбудители этих инфекций, лидирующими из которых являются Staphylococcus aureus и S. epidermidis. Выделены четыре стадии процесса биопленкообразования у бактерий на поверхности имплантатов. В связи с тем что в имплантационной хирургии применяются все новые и новые материалы, необходимы исследования в направлении изучения биопленкообразующих свойств как известных патогенных и условно-патогенных бактерий, так и тех, которые могут являться потенциально опасными в этом отношении, в частности возбудителей, вызывающих генерализованные инфекции.

1. Афиногентова А.Г., Даровская Е.Н. Микробные биопленки ран: состояние вопроса // Травматология и ортопедия России. — 2011. — № 3 (61). — С. 119-125.
3. Бережанский Б.В., Жевнерев А.А. Катетер-ассоциированные инфекции кровотока // Клин. микробиол. Антимикроб. химиотер. – 2006. - № 2. – С. 130-145.
6. Голуб А.В. Бактериальные биопленки – новая цель терапии? // Клиническая микробиологическая антимикробная химиотерапия. – 2012. - № 1. – С. 23-29.
8. Гнеденков С.В., Синебрюхов С.Л., Хрисанфова О.А., Егоркин В.С., Машталяр Д.В., Сидорова М.В., Гнеденков А.С., Волкова Е.Ф. Свойства покрытий, сформированных на магниевом сплаве МА8 методом плазменного электролитического оксидирования // Вестник ДВО РАН. - 2010. - № 5. - С. 35-46.
9. Гнеденков С.В., Шаркеев Ю.П., Синебрюхов С.Л., Хрисанфова О.А., Легостаева Е.В., Завидная А.Г., Пузь А.В., Хлусов И.А. Функциональные покрытия для имплантационных материалов // Тихоокеанский медицинский журнал. - 2012. - № 1. - С. 12-19.
11. Манцуров А.А., Гороховский А.В., Бурмистров И.Н., Третьяченко Е.В. Строение и свойства биосовместимых поверхностных слоев, полученных при химической обработке титановых имплантов // Фундаментальные исследования. – 2014. – № 11–2. – С. 311-315.
12. Попков А.В. Биосовместимые имплантаты в травматологии и ортопедии // Гений ортопедии. – 2014. - № 3. – С. 94-99.
13. Серегина Н.В. Обзор биофизических особенностей микробной адгезии // Вестник новых медицинских технологий. – 2008. – XV (3). - С. 7-9.
16. Черный В.Н. Перспективы применения биодеградирующих сплавов на основе магния в остеосинтезе // Запорожский медицинский журнал. – 2013. - № 6 (81). – С. 76-79.
18. Шкодкин С.В., Жернакова Н.И., Идашкин Ю.Б. Некоторые аспекты нозокомиальной инфекции // Научные ведомости Белгородского государственного университета. – 2013. - № 4 (147). – С. 5-11.
19. Arciola C.R. Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials // Biomaterials. – 2012. – Vol. 33 (26). - P. 5967–5982.
21. Christensen G.D., Simpson W.A., Younger J.J. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices // J. Clin. Microbiology. – 1985. - Vol. 22 (6). – Р. 996-1006.
22. Costerton J.W., Stewart P.S. Bacterial biofilms: a common cause of persistent infections // Science. - 1999. - Vol. 284 – Р. 1318–1322.
23. Dunne M.W. Bacterial Adhesion: Seen Any Good Biofilms Lately? // Clinical microbiology reviews. – 2002. - Vol. 12. - Р. 155–166.
24. Gbejuade H.O., Lovering A.M., Webb J.C. The role of microbial biofilms in prosthetic joint infections // Acta Orthop. – 2015. - Vol. 86 (2). – Р. 147–158.
25. Lebeaux D., Ghigo J.-M., Beloin C. Biofilm-Related Infections: Bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics // Microbiology and Molecular Biology Reviews. – 2014. - Vol. 78. - № 3. - Р. 510–543.
26. Marrie T.J., Nelligan J., Costerton J.W. A scanning and transmission electron microscopic study of an infected endocardial pacemaker lead // Circulation. - 1982. - Vol. 66. – Р. 1339–1341.
27. Miller M.B., Bassler B.L. Quorum sensing in bacteria // Annu. Rev. Microbiol. – 2001. - Vol. 55 (1). - P. 165-199.
28. Henk J.B. Biomaterial-Associated Infection: Locating the Finish Line in the Race for the Surface // Science Translational Medicine. – 2012. – № l. 4. - Р. 1–10.
29. Rodney M.D. Boifilms: Microbial life on surfaces // Emerging Infectious Diseases. – 2002. - Vol. 8. - № 9. – Р. 881-890.
30. Reid G. Biofilms in infectious disease and on medical devices // Int J Antimicrob Agents. – 1999. – Vol. 11 (3-4). – Р. 223-226.
31. Ribeiro М. Infection of orthopedic implants with emphasis on bacterial adhesion process and techniques used in studying bacterial-material interactions // Biomatter. – 2012. - Vol. 2(4). – Р. 176–194.
32. Trampuz A., Widmer A.F. Iinfections associated with orthopedic implants // Curr. Opin. Infect. Dis. – 2006. – Vol. 19, № 4. – P. 349-356.
Первое десятилетие нового, XXI века было объявлено ВОЗ Всемирной декадой костей и суставов. Это обусловлено постоянным увеличением числа больных среди населения ведущих стран мира, у которых регистрируются заболевания и травматические повреждения костно-суставного аппарата. В связи с увеличением случаев травматизма, количества посттравматических и постоперационных осложнений увеличилась и потребность в пластическом материале для замещения различных дефектов [20].
В европейских странах число инфекций, вызванных заражением имплантационного устройства, превышает 100 тыс. случаев в год. В США и Западной Европе каждый год фиксируется до 500 тыс. случаев катетер-ассоциированных инфекций (Бережанский, Жевнерев, 2006) [3]. В целом около 5% имплантируемых фиксирующих устройств заражаются. Частота инфицирования после внутренней фиксации закрытых переломов низкая и составляет 0,5-2%, в то время как инфицирование вследствие фиксации открытых переломов может превышать 30% [32].
Образование биопленок при этом ведет к возникновению тяжелых имплантат-ассоциированных инфекционных осложнений, сепсисов. Это серьезная проблема в медицинской практике, поскольку в хирургических и реанимационных отделениях клиник широко используются различные инвазивные материалы [10].
Накопление микроорганизмов на поверхности имплантатов в виде биопленок и их дальнейшее распространение по организму может служить причиной развития хронического воспаления, имплантат-ассоциированной инфекции, что в свою очередь приводит к необходимости удаления зараженного устройства. С медицинской и экономической точки зрения их постоянная замена является неэффективной и вызывает трудности [30].
Первое свидетельство причастности биопленкообразования на поверхности имплантатов к инфекционным заболеваниям представлено в 1982 году при электронно-микроскопическом исследовании кардиостимуляторов у пациентов с рецидивирующей инфекцией, вызванной Staphylococcus aureus [26]. В своих исследованиях J.W. Costerton с сотрудниками (1999) первыми выявили взаимосвязь между развитием биопленок и хронических инфекций. В последующие десятилетия подтвердили неоспоримое участие биопленок в развитии патологических процессов в инфицированных тканях. Более того, было признано, что использование различных медицинских устройств, имплантируемых в организм человека, благоприятствует развитию инфекций [30].
К настоящему времени доказано, что 72-91% случаев нозокомиальной инфекции ассоциированы с использованием катетеров, имплантов, стентов и т.д., что сопровождается контаминацией поверхности вирулентной флорой с образованием биопленок и L-форм бактерий, которые практически не чувствительны к проводимой антибактериальной терапии [18].
Основные виды имплантатов, заражение которых может привести к имплантат-ассоциированным инфекциям - центральные венозные катетеры, сердечные клапаны, искусственные желудочки сердца, коронарные стенты, имплантируемые нейростимуляторы, желудочковые шунты, суставные протезы, устройства для фиксации переломов, грудные имплантаты, контактные линзы, зубные имплантаты, кохлеарные имплантаты.
Большие ортопедические операции, как правило, связаны с установкой металлоконструкций. Установка постоянного имплантата приводит к возникновению пожизненного риска развития инфекции, которая может привести к хроническому постимплантационному остеомиелиту и инвалидизации больного, а в самых тяжелых случаях при генерализации процесса с развитием синдрома системной воспалительной реакции или сепсиса – к летальному исходу [2].
Биопленка может быть охарактеризована как структурированное скопление микроорганизмов одного или нескольких видов, заключенное в выделенный ими экзополимерный матрикс и прикрепленное к абиотическим или биотическим поверхностям. Матрикс биопленки состоит из экзополисахаридов, белков, тейхоевых кислот, липидов, внеклеточной ДНК [6; 19].
Биопленкообразование на имплантатах можно разделить на 4 стадии: клеточная адгезия, обратимая стадия, созревание и дисперсия биопленки [24].
Бактериальная адгезия определяется физико-химическими свойствами прикрепляющихся клеток, субстрата и окружающей среды. Большая часть факторов среды, такие как её состав, гидродинамические условия, температура, время контакта, концентрация бактерий или присутствие антибиотиков и дезинфектантов, могут влиять на бактериальную адгезию. К факторам, которые могут влиять на адгезию бактерий к твердой поверхности, можно также отнести химический состав материала, поверхностный заряд, гидрофобность и свободную энергию поверхности, а также шероховатость поверхности [13].
На втором этапе бактериальные клетки начинают пролиферировать и слипаться друг с другом, что приводит к образованию микроколоний. Затем эти организованные структуры погружаются в собственно продуцированный внеклеточный матрикс. Таким образом, биопленки постепенно колонизируют поверхность инвазивного устройства [23].
На стадии созревания микроколонии разрастаются и сливаются, образуя макроколонию. Также формируются специфические структуры биопленки: каналы, полости, поры и выросты. Благодаря данным формированиям осуществляется движение питательных веществ, удаляются метаболические отходы [6]. В основном на данном этапе регуляция осуществляется при помощи системы Quorum sensing [27].
В определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Благодаря этому патогенные бактерии захватывают новые места обитания, приводя к распространению инфекции. Открепление планктонных клеток может происходить как под действием внешних сил (давление жидкости, механическое воздействие), так и из-за внутренних (энзиматическая деградация протеазами, альгинатлиазами и др.) [6; 17].
Считается, что вода является главным компонентом матрикса биопленки, на долю которого приходится до 97%. Тогда как содержание бактерий составляет 10–50% от общего объема биопленки. Количество внеклеточных полимерных веществ колеблется в пределах 50–90% от общего количества органического углерода в биопленках. Кроме полисахаридов, белков, нуклеиновых кислот или фосфолипидов в матриксе биопленок также могут быть обнаружены другие неклеточные материалы, такие как кристаллы минеральных соединений или компоненты крови, присутствие которых зависит от окружающей среды, в которой развивалось это сообщество.
Имплантат-ассоциированные инфекции случаются из-за инфицирования во время операции или сразу после нее благодаря микробному распространению по кровотоку из отдаленного очага инфекции либо из-за прямого или лимфогенного распространения из инфекционного очага или проникающей травмы [28].
Анализ литературных данных позволил выявить микроорганизмы, которые чаще всего образуют биопленки на имплантатах. Почти все виды являются представителями нормальной микрофлоры организма человека. Так, ведущие позиции занимают два вида стафилококков Staphylococcus aureus и S. epidermidis – 49,9%, в том числе и метициллинрезистентные штаммы (MRSE), далее следуют Enterococcus faecalis – 6,4% представители неферментирующих грамотрицательных бактерий (Acinetobacter spp. и P. aeruginosa) – 11% и представители семейства энтеробактерий (E. cloacae, Klebsiella pneumoniae, Escherichia coli) – 4,1% (рисунок) [2].
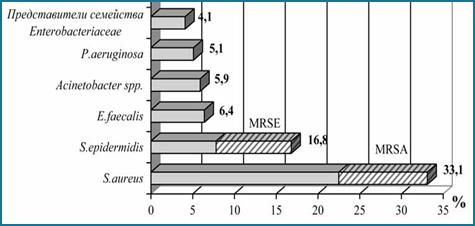
Ведущие виды микроорганизмов, образующих биопленки на имплантатах
Эти и другие биопленкопродуцирующие микроорганизмы проникают в организм в процессе имплантации или еще до операции колонизируют поверхности имплантата. Заражение имплантационных поверхностей может приводить к развитию септического шока, некроза тканей вследствие хронического воспаления вокруг имплантата и дальнейшему распространению инфекции внутри организма. Оксиданты, вырабатываемые иммунными клетками для борьбы с биопленками, не способны проникнуть сквозь экзополимерный матрикс; это приводит к накоплению этих веществ и повреждению собственных клеток [29].
Из-за высокой устойчивости к антибиотикам возникающие хронические инфекции трудно поддаются лечению и подвергают пациента риску рецидива. В течение биопленочной инфекции планктонные формы бактерий могут отделяться от биопленки и распространяться локально вокруг источника заражения или по кровотоку по всему организму. В большинстве случаев удаление зараженного устройства или хирургическое удаление пораженной ткани является единственным эффективным способом борьбы с биопленочными инфекциями [1].
Лечение хронических инфекций в настоящее время уже не может основываться на планктонной концепции микробиологии. Представление о биопленках изменяет подходы к диагностике и лечению инфекционных поражений в самых различных областях медицины. Этому способствует разработка соответствующих методов молекулярной диагностики, а также стратегий лечения, воздействующих на механизмы формирования и функционирования бактериальных сообществ в виде биопленок [25].
Таким образом, на сегодняшний день имплантат-ассоциированные инфекции, чаще всего вызванные образованием микробных биопленок на поверхности имплантатов, являются актуальными. Для борьбы с ними необходимо учитывать материалы, из которых изготовлены имплантаты, а также исследовать особенности образования биопленок всех известных возбудителей с целью их разрушения. Кроме того, необходимо обратить внимание на возбудителей сапрозоонозов, способных вызывать генерализованные инфекции и практически не исследованных в отношении взаимодействия с имплантатами.
Работа выполнена при поддержке Российского научного фонда (№ 14-33-00009) и Правительства РФ (Федерального агентства научных организаций).
Проблема биопленочных инфекций в настоящее время приобретает все большую актуальность в связи с ростом и развитием числа инфекций и осложнений ,вызываемых внедрением в медицинскую практику инвазивных методов диагностики и лечения. Особенно серьезно этот вопрос рассматривается при возникновении инфекций ,имеющих хроническое течение ,проблемы устойчивости к антибиотикам ,бактерий находящихся в составе биопленки. В настоящей работе обобщены, систематизированы и проанализированы теоритические аспекты инфекций, возникающих при оказании медицинской помощи. Рассматриваются вопросы образования биопленки, ее строение, и роль в распространении инфекции, приводящих к формированию хронических очагов в органах и тканях организма .
Особое внимание уделяются вопросам направленным на предотвращении, возникновении и развитии биопленочных инфекций ,и борьбы с антибиотикоустойчивостью микроорганизмов ,находящихся в составе биопленки.
Ключевые слова
Статья
Более 99% бактериальных популяций существуют в природных экосистемах не в виде свободно плавающих планктонных клеток, а в виде специфически организованных, прикрепленных к субстратам биопленок, образование которых представляет сложный, строго регулируемый биологический процесс. Способность формировать биопленки является составной частью жизненного цикла большинства микроорганизмов и успешной стратегией защиты бактерий от неблагоприятных факторов среды. Биопленки - это физические структуры, образуемые микробными сообществами на поверхности раздела фаз: развивающиеся на границе жидкой и твердой сред.
Биопленки имеют сложную архитектуру - они заключены в экзополимерный матрикс, содержат каналы, наполненные жидкостью, через которые происходит приток питательных веществ и кислорода и выведение продуктов метаболизма бактерий. Основным компонентом матрикса являются экзополисахариды (ЭПС); матрикс содержит также белки, нуклеиновые кислоты и другие вещества; состав матрикса различен у бактерий разных таксономических групп.Каналы в матриксе создают своеобразную проводящую систему, по которой перемещаются вещества по градиентам концентрации, по ним также могут мигрировать бактерии. Важнейшей функцией матрикса, помимо каркасной, обеспечивающей стабильность биопленки, является защитная. Показано, что матрикс защищает бактерии в биопленке от антибактериальных препаратов, а также от неблагоприятных возднействий внешней среды
Стадии формирования биопленок Выделяют несколько последовательных этапов образования биопленок . Первая стадия - начало развития биопленок – это переход бактерий от планктонного способа существования к другому, связанному с прикреплением клеток к биотической или абиотической поверхности. Прикрепление возможно только у подвижных бактериальных клеток.Первичный контакт планктонно плавающей (неприкрепленной) бактерии и поверхности среды происходит либо случайно (например, при пассивной миграции клеток с током жидкости), либо вследствие направленного движения, обусловленного хемотаксисом. Стадия первичной адгезии занимает несколько секунд, является обратимой и зависит от неспецифических физико-химических механизмов взаимодействия между поверхностными структурами микроорганизма и самого субстрата.
Вторая стадия адгезии характеризуется необратимым связыванием бактериальных клеток с поверхностью при помощи специфических молекул – адгезинов. Важную роль на этом этапе играют такие клеточные структуры, как фимбрии (пили), жгутики, поверхностные белки, липополисахариды.На второй стадии образования биопленок формируются микроколонии. Происходит агрегация клеток, прикрепившихся ранее к твердой поверхности, бактерии теряют подвижность, некоторые из них слипаются друг с другом, начинают выделять полимеры, формируя внеклеточный полимерный матрикс, и образуют многоклеточный слой. При достижении определенной толщины слоя клеток наступает следущая стадия – стадия созревания биопленки. На стадии созревания биопленок в результате деления клеток возникают компактные микроколонии, объединенные внеклеточным полимерным матриксом. Микроколонии постепенно увеличиваются в размерах и объединяются с образованием макроколоний. Одновременно с увеличением толщины биопленки формируются ее специфические структуры - полости, выросты, поры и каналы Возможность роста любой биопленки ограничена доступностью питательных веществ и кислорода, проникновением их в различные слои биопленки, эффективностью удаления метаболических отходов, рН среды, осмолярностью и т.д.
Последней стадией является стадия дисперсии биопленки: в определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Этот процесс имеет большое значение, так как приводит к распространению, расширению инфекции, захвату патогенными бактериями новых мест обитания. В разрушении биопленки принимают участие собственные поверхностно-активные вещества бактерий, ферменты альгинатлиаза и другие полисахаридлиазы. Открепление бактерий от биопленки может быть обусловлено как внешними (движение жидкости), так и внутренними (энзиматическая деградация) причинами. По данным ряда исследований, планктонные клетки, потерявшие связь с биопленкой, представляют большую опасность в связи с приобретением новых свойств, включая устойчивость к антибиотикам.
Катетер-ассоциированные инфекции
Повседневная практика интенсивной терапии предполагает многочисленные инвазивные вмешательства, связанные с нарушением целостности кожных и слизистых покровов, что создает условия для проникновения условно-патогенных микроорганизмов во внутреннюю среду организма человека. К наиболее распространенным вмешательствам относится установка различного рода внутрисосудистых устройств, прежде всего, центральных венозных катетеров. Так, по данным статистики, в США в год устанавливается более 5 млн центральных венозных катетеров. В силу ряда объективных причин центральные венозные катетеры могут становиться вполне реальным источником инфекции.
Патогенез и этиология
Ключевым моментом в патогенезе катетер-ассоциированных инфекций является формирование на внутренней и/или наружной поверхности катетера микробной биопленки.
Известны следующие пути проникновения микроорганизмов внутрь сосудистого русла.
- Микроорганизмы из состава нормальной микрофлоры кожи пациента могут проникать в сосудистое русло через разрез в месте введения катетера и прикрепляться к его наружной поверхности-ЭКСТРАЛЮМИНАЛЬНЫЙ ПУТЬ. Вероятность такого пути колонизации поверхности катетера наибольшая в течение первых 10 сут после его постановки.
- В более поздний период возрастает вероятность колонизации внутренней поверхности катетера-ИНТРАЛЮМИНАЛЬНО- через канюлю при нарушении техники асептики и при уходе за катетером. Необходимо, однако, отметить, что описанные закономерности носят чисто статистический характер, у индивидуальных пациентов колонизация и внутренней, и наружной поверхностей может происходить в любые сроки. Более того, не являются редкостью и случаи, когда одновременно колонизуется и внутренняя, и наружная поверхности, причем участие в этих процессах могут принимать различные микроорганизмы.
- Колонизация катетеров возможна также при использовании контаминированных инфузионных растворов. К крайне редким случаям относится гематогенный путь колонизации катетеров.
Большинство микроорганизмов в той или иной степени способны прикрепляться к поверхности катетеров за счет неспецифических механизмов адгезии. Однако адгезия происходит гораздо эффективнее при отложении на поверхности катетера белков плазмы крови (фибрина, фибронектина, ламинина).
В настоящем обзоре представлены современные взгляды на формирование хронической ортопедической инфекции, связанной с биопленкообразованием бактерий. Кратко рассмотрены этапы формирования биопленок, фенотипы бактериальных клеток, существующих в них, а также их роль в патогенезе имплантат-ассоциированной инфекции. Состояние биопленки позволяет патогенам быть устойчивыми к лечению антибиотиками и к воздействию факторов иммунной системы из-за структурной и метаболической гетерогенности, которая обусловлена одновременным сосуществованием микробных клеток в различных состояниях, сочетающимся с активным синтезом межклеточного матрикса. В настоящее время существует несколько направлений в профилактике микробной адгезии и созревания пленок на ортопедических имплантатах. В травматологии и ортопедии в профилактических и терапевтических целях помимо системных и локальных антибактериальных препаратов можно использовать материалы для создания имплантатов с определенными физическими и химическими свойствами поверхностей. Приведены основные мишени воздействия противобиопленочных агентов. Показаны результаты клинического применения серебра и йода для профилактики и лечения инфекционных осложнений при ортопедических операциях. Сделан вывод, что, несмотря на все оптимистичные результаты, большинство применяемых методик находятся на этапе изучения и их трудно масштабировать до отраслевых стандартов, что требует дальнейших исследований.
Ключевые слова: биопленки, биопленкообразование, перипротезная инфекция, имплантат-ассоциированная инфекция, имплантаты.
Для цитирования: Гордина Е.М., Божкова С.А. Бактериальные биопленки в ортопедии: проблема и возможные перспективы профилактики. РМЖ. 2021;8:29-32.
Bacterial biofilms in orthopedics: the problem and possible prospects for prevention
E.M. Gordina, S.A. Bozhkova
Vreden National Medical Research Center of Traumatology and Orthopedics, St. Petersburg
This review presents modern views on the formation of a chronic orthopedic infection associated with the biofilm formation of bacteria. The stages of biofilm formation, the phenotypes of bacterial cells existing in them, as well as their role in the pathogenesis of implant-associated infection are briefly considered. The biofilm state allows pathogens to be resistant to antibiotic treatment and to the effects of immune system factors due to structural and metabolic heterogeneity because of simultaneous coexistence of microbial cells in various states, combined with active synthesis of the intercellular matrix. Currently, there are several directions in the prevention of microbial adhesion and maturation of films on orthopedic implants. For preventive and therapeutic purposes in traumatology and orthopedics, in addition to systemic and local antibacterial drugs, materials can be used to create implants with certain physical and chemical properties of surfaces. The main action targets of anti-biofilm agents are given This review shows the results of the clinical use of silver and iodine for the prevention and treatment of infectious complications during orthopedic operations. It is concluded that, despite all the optimistic results, most of the applied methods are still to be studied and difficult to scale up to industry standards, which requires further research.
Keywords: biofilms, biofilm formation, periprosthetic joint infection, implant-associated infection, implants.
For citation: Gordina E.M., Bozhkova S.A. Bacterial biofilms in orthopedics: the problem and possible prospects for prevention.
RMJ. 2021;8:29–32.

Введение
В настоящее время потребность в костных и суставных протезах растет из-за старения населения и, вероятно, будет продолжать расти в будущем [1, 2]. Даже с учетом современных широко используемых методов профилактики и асептической хирургической техники частота перипротезной инфекции (ППИ) после вмешательства не снижается ниже 1–2% [3, 4].
Особенностями развития инфекционных осложнений ортопедических вмешательств являются слабовыраженная воспалительная реакция организма пациента, а также способность патогенов к адгезии и биопленкообразованию на поверхности костей и имплантатов, что обусловливает низкую эффективность лечения ввиду устойчивости возбудителей к антибиотикам и факторам иммунной защиты организма [5]. Длительно текущая хроническая инфекция костей может приводить к таким осложнениям, как амилоидоз почек, дистрофические изменения паренхиматозных органов и формирование септикопиемических очагов [6], при этом основной причиной формирования инфекционного очага и развития рецидивов заболевания считают биопленкообразование патогенов [7, 8].
Биопленки: особенности строения и функционирования
Биопленки образованы микробными сообществами, которые встроены в самостоятельно продуцируемую матрицу внеклеточных полимерных веществ (extracellular polymeric substances) [9]. Матрикс, в свою очередь, объединяет бактериальные клетки в единую систему и выполняет структурно-образующую функцию. Например, полимерный матрикс Staphylococcus aureus может быть образован полисахаридами на основе β-1,6-N-ацетилглюкозамина (PNAG), белками (семейства Bap, Rbf), внеклеточной ДНК, а у Pseudomonas aeruginosa — полисахаридами (альгинат, Psl, Pel), протеинами (CdrA) и внеклеточной ДНК [10]. Толщина и структура пленок могут варьировать от монослоя до многослойного плотного сообщества клеток и зависят от таксономической принадлежности микроорганизма, длительности контакта микробов с поверхностью, свойств субстрата, на который происходит адгезия, а также ряда других факторов [11].
Закрепленные в матриксе бактерии претерпевают ряд метаболических изменений, приобретая отличия друг от друга. Даже в моновидовых биопленках сосуществуют бактерии в различных состояниях [12]. В настоящее время выделяют четыре основных метаболических состояния внутри биопленки: аэробное, ферментативное, спящее, мертвое [13].
Различия формируют несколько бактериальных фенотипов: клетки-персистеры, малые колонии (SCV — small colony variants) и жизнеспособные, но некультивируемые (VBNC — viable but non-culturable) бактерии [14, 15].
Клетки-персистеры — это бактерии, которые уже присутствуют в планктонной популяции. Они могут выдерживать высокие концентрации противомикробных препаратов и чаще обнаруживаются в биопленках [16].
Формирование SCV-фенотипа происходит в результате замедления метаболизма, роста и секреции цитотоксического фактора. Такие бактерии характеризуются меньшим размером колоний, формируемых на питательных средах [17, 18]. Перестройка на SCV-фенотип и бактериальная интернализация увеличивают выживаемость и время существования инфекта в организме хозяина [17].
Состояние VBNC соответствует метаболически наименее активным бактериям, не способным расти на питательных средах. Именно это состояние микробов в биопленках может возникать под воздействием антибиотиков [19]. Поскольку значительная часть антибиотиков нацелена на активные бактериальные клетки, эти метаболические адаптации являются ключевым фактором биопленочной устойчивости бактерий [5].
Рассеивание кластеров микроорганизмов позволяет персистировать источнику резистентной бактериальной популяции, а также обеспечивать непрерывную микробную диссеминацию в различные локусы организма, приводя к хронизации инфекционного процесса.
S. aureus, включая метициллинчувствительные (MSSA) и метициллинрезистентные (MRSA) штаммы, является наиболее распространенным видом, вызывающим ортопедическую инфекцию [6]. Streptococcus spp., Enterococcus spp., Cutibacterium acnes — это прочие виды, часто выступающие этиологическими факторами ППИ, но только S. aureus ответственен за около 50% всех ППИ [5]. Причем если ранее рассматривали только S. aureus как наиболее актуальный этиопатоген в случаях инфекционных осложнений эндопротезирования крупных суставов, то в настоящее время повсеместно растет частота ППИ, обусловленных коагулазонегативными представителями рода, преимущественно S. epidermidis [20, 21].
Существование в биопленке обеспечивает долгосрочное выживание патогенов в макроорганизме, а также наносит значительный ущерб окружающей ткани. В инфицированных тканях патоген-ассоциированные молекулярные паттерны взаимодействуют с врожденными Toll-подобными рецепторами, экспрессируемыми на различных типах клеток, а также стимулируют высвобождение воспалительных цитокинов, включая ИЛ-1 и ИЛ-6. Это приводит к активации и дифференцировке остеокластов и повышенной продукции остеобластами рецептора-активатора ядерного транскрипционного фактора каппа-В лиганд (RANKL — Receptor activator of nuclear factor kappa-B ligand). RANKL является ключевым звеном гомеостаза костной ткани, непосредственно регулирующим дифференцировку и активацию остеокластов и остеолиз. Активация Т-лимфоцитов приводит к индукции экспрессии цитокинов, повышению остеокластогенеза, потере костной ткани и, как следствие, к нестабильности компонентов эндопротеза [22].
Подходы к профилактике пленкообразования
Логичным представляется вопрос о возможности модификации поверхности имплантата с целью придания ей антиадгезивных и противомикробных свойств для предотвращения формирования микробных биопленок. В 1987 г. A. Gristina [23] впервые предложил концепцию конкуренции за поверхность, в которой судьба имплантата из биоматериала зависит от баланса между тканевой интеграцией и микробной адгезией с образованием биопленки. В рамках этой концепции была выдвинута гипотеза о том, что модификации материалов, которые усиливают остеоинтеграцию при одновременном подавлении бактериальной адгезии, могут обеспечить теоретическое преимущество и устранить риск образования биопленок и развития инфекции [24], что послужило толчком для дальнейших исследований.
C.L. Romanò et al. [25] классифицировали методики получения антибактериальных покрытий имплантатов на три основные группы:
Пассивная обработка поверхности с антиадгезивными свойствами без высвобождения антибактериальных компонентов. Данная методика не обеспечивает достаточный бактерицидный эффект, необходимый для устранения инфекционного агента, поскольку их действие ограничено периимплантационной областью.
Активная обработка поверхности с последующей элюцией антибактериальных средств.
Периоперационные антибактериальные носители или покрытия, наносимые во время операции (в том числе биоразлагаемые).
Вторая и третья группы обеспечивают только временное решение проблемы, так как их бактерицидный эффект нивелируется со временем.
Существует мнение, что оптимальная поверхность имплантата должна обладать сильным антиинфекционным потенциалом, продолжительным действием, стабильностью, не быть токсичной и вызывать минимальную реакцию со стороны макроорганизма [26].
Для достижения пролонгированного выраженного антимикробного и антибиопленочного действия поверхности могут быть физически и механически обработаны, а также покрыты или химически модифицированы. Ряд антиадгезивных покрытий на титан созданы путем изменения поверхности полимерами, сополимерами или белками. Так, D. Curto et al. [27] показали, что кристаллическая фаза оксида титана на поверхности биоматериалов снижает адгезию бактерий, не влияя на биосовместимость. S. Ferraris et al. [28] продемонстрировали, что механически получаемые нанобороздки (0,1–0,2 мкм) и кератиновые нановолокна могут увеличивать биосовместимость без увеличения степени микробной адгезии. M. Lorenzetti et al. [29] применили гидротермические методы лечения для достижения аналогичного снижения бактериальной адгезии. Полученные результаты указывают на существование возможности модификации поверхности биоматериала с целью предотвращения адгезии патогенов и формирования на его поверхности микробных биопленок.
Существуют данные о возможности физической модификации поверхности для адсорбции антибиотиков или просто применения простого погружения имплантата в антибактериальные препараты для создания временного покрытия с антимикробными и противобиопленочными свойствами [32]. Известно, что антибиотики, ковалентно связанные с металлическими поверхностями, ингибируют бактериальную колонизацию как in vitro, так и in vivo [24]. Однако антибактериальные препараты, дополнительно вносимые в костный цемент, должны соответствовать определенным требованиям — отличаться безопасностью, термостабильностью, гипоаллергенностью, водорастворимостью, иметь адекватный спектр бактерицидной активности; должна быть возможность получения препарата в форме стерильного порошка или лиофилизата [33].
По точкам приложения механизма действия Brackman и Coynye [34] разделили противобиопленочные агенты на группы, воздействующие на:
системы межбактериальной коммуникации, в частности на аутоиндуктор AI-2 (грамотрицательных бактерий), диффузный фактор сигнала (diffusible signal factor);
транскрипционную активность грамнегативных бактерий (деценовая кислота и др.);
механизмы обеспечения железом (лактоферрин, препараты галлия, пиовердин и др.);
молекулы стенки бактерии (например, D-аминокислоты препятствуют закреплению белковых амилоидных волокон; сарагозиновая кислота (zaragozic acid) нарушает архитектуру микродоменов в клеточных мембранах);
межбактериальные взаимодействия (антиматриксные молекулы, например норспермидин (norspermidine), AA-861, партенолид (parthenolide), рамнолипид (rhamnolipid) и другие бактериальные поверхностно-активные вещества);
молекулы, способствующие гибели клеток (индукторы синтеза оксида азота, вызывающего гибель бактерий).
Одним из перспективных направлений борьбы с биопленкообразованием на поверхностях ортопедических имплантатов является применение химических агентов, в том числе металлов (серебро, золото, медь, кобальт) и галогенов [35].
Антимикробное действие серебра связано с взаимодействием его ионов с тиольными группами ферментов и белков, а также с влиянием на высвобождение ионов К + из бактериальной клетки [36]. Кроме того, предполагается, что механизм действия серебра заключается в образовании активных форм кислорода и биологически активных ионов, которые повреждают клеточные стенки бактерий, связываются с нуклеиновыми кислотами, препятствуя размножению бактерий [37]. N. Harrasser et al. [38] изучали антимикробные эффекты серебра и наблюдали значительную антимикробную активность, которая положительно коррелировала с концентрациями серебра. Кроме того, V. Aurore et al. [39] определили, что наночастицы серебра усиливают бактерицидную активность в остеокластах. К числу преимуществ ионов серебра относятся антиадгезивное действие и предупреждение образования биопленок на поверхности спейсера из ПММА [40, 41].
K. Kalishwaralal et al. [42] продемонстрировали, что наночастицы серебра в концентрации 100 нМ почти полностью предотвращали биопленкообразование штаммов S. epidermidis и P. aeruginosa. В другом исследовании [43] костный цемент, импрегнированный серебром, значительно снижал биопленкообразование патогенов в сравнении со стандартным цементом. В ряде экспериментов отмечен синергичный эффект серебра в комбинации с антибиотиками [44–46]. Значимым преимуществом поверхностей, покрытых наночастицами серебра, является их способность непрерывно высвобождать действующее вещество в перипротезную область в течение значительного периода времени, таким образом, действуя как на поверхностном слое, так и непосредственно в окружающей среде [45].
Сравнительно недавно было установлено, что йод является успешным адъювантом для ирригации и санации в случаях ППИ [47]. На сегодняшний день описаны различные методики обработки поверхности имплантата растворами йода. N.M. Brown et al. [49] показали эффективность 10% повидон-йода при обработке им хирургической раны и поверхности имплантата. После имплантации протезных компонентов рану пропитывали раствором повидон-йода, а перед окончательным ее закрытием препаратом обрабатывали кожу вокруг разреза [47]. Адаптировав эту идею к поверхностям имплантатов, H. Tsuchiya et al. [48] провели клиническое исследование, в которое включили 222 пациента с послеоперационной инфекцией, в комплексном лечении которых использовали титановые имплантаты с йодной подложкой. Такие имплантаты показали свою эффективность в профилактике и лечении инфекции, связанной с ортопедическими вмешательствами. T. Shirai et al. [49] показали значимое снижение частоты инфекции, связанной с остеосинтезом, при использовании обработанных йодом внутренних и внешних фиксаторов. Толщина пленки анодного оксида составляла от 10 мкм, с более чем 50 000 пор/мм 2 и способностью удерживать 10–12 мкг/см 2 йода. T. Kabata et al. [50] также оценили клиническую эффективность и безопасность титановых имплантатов, покрытых йодом. Из 14 случаев лечения ППИ и 13 случаев первичного тотального эндопротезирования у иммуносупрессивных пациентов ни в одном случае не было диагностировано инфекционных осложнений и не получено данных о проблемах, связанных с локальной токсичностью применения препаратов йода или с нарушением остеоинтеграции покрытых йодом имплантатов. Таким образом, можно отметить, что йод, как и наночастицы серебра, обладает определенным антибиопленочным потенциалом.
Заключение
Подводя итог, можно сказать, что биопленкообразование — это естественный процесс существования микроорганизмов в окружающей среде и в организме хозяина, обеспечивающий их выживание. Состояние биопленки позволяет бактериям быть толерантными к лечению антибиотиками и к воздействию факторов иммунной системы из-за структурной и метаболической гетерогенности, которая обусловлена одновременным сосуществованием микробных клеток в различных состояниях, сочетающимся с активным синтезом межклеточного матрикса. Кроме того, близость бактерий в состоянии биопленки индуцирует возможность обмена генами устойчивости к антибактериальным препаратам.
Одним из неблагоприятных последствий биопленочных инфекций является чрезмерное потребление антибактериальных препаратов (в основном без какого-либо терапевтического эффекта) в случае сохранения инфицированного имплантата, что также способствует прогрессированию устойчивости возбудителей к антибиотикам.
Профилактика образования пленок на поверхностях имплантатов представляется одним из перспективных методов борьбы с хроническими рецидивирующими имплантат-ассоциированными инфекциями. В травматологии и ортопедии в профилактических и терапевтических целях помимо системного и локального (в составе костного цемента) применения антибиотиков возможно использование различных материалов для создания имплантатов с определенными физическими и химическими свойствами поверхностей. Однако, несмотря на все оптимистичные результаты, большинство систем находятся на этапе изучения и их трудно масштабировать до отраслевых стандартов, что требует дальнейших исследований.
По-видимому, в идеале необходима технология, которая позволяет интегрировать биологическую защиту в конструкцию имплантата, обеспечивая пролонгированную антимикробную и антибиопленочную защиту в течение срока службы заменяющего протеза и не вызывая селекцию антибиотикоустойчивых штаммов бактерий.
Читайте также:

