Инфекции мочевыводящих путей при химиотерапии
Обновлено: 18.04.2024
Химиотерапия заключается в использовании специальных препаратов для лечения рака мочевого пузыря.
Выделяют два способа проведения химиотерапии рака:
- При системной химиотерапии рака препараты попадают в кровеносную систему человека, и распространиться по всему организму. При этом лекарство достигает все раковые клетки, даже те которые расположены далеко от первичной опухоли.
- Интравезикальная терапия, или локальная химиотерапия заключается во введении препарата непосредственно в мочевой пузырь и его местном воздействии на опухоль, без системного эффекта.
Системная химиотерапия рака мочевого пузыря
Может использоваться в следующих ситуациях:
- Перед операцией. Такая химиотерапия носит название неоадъювантной. Это позволяет добиться уменьшения размера опухоли и сокращения объема хирургического вмешательства. Благодаря этому эффективность операции выше, риск метастазов и рецидивов ниже.
- После операции или облучения. Такая химиотерапия называется адъювантной. Она направлена на раковые клетки, которые невозможно было удалить во время операции или разрушить путем облучении. Это позволяет снизить риск рецидива рака.
- Иногда химиотерапия может использоваться в комбинации с облучением для достижения наилучшего результата лечения.
- Химиотерапия может использоваться как отдельная опция для лечения метастатического рака мочевого пузыря.
Как проводится химиотерапия рака мочевого пузыря?
Химиотерапия представляет собой курс лечения, занимающий несколько месяцев, как правило, от трех до шести. В большинстве случаев препараты вводятся внутривенно или внутримышечно, также вы можете принимать их через рот. Курс лечения состоит из нескольких циклов, или блоков. Между каждыми блоками пациенту дается пауза для того чтобы организм мог восстановиться. Например, цикл может длиться 4 недели, препарат вводиться в первый, второй и третий день, а с четвертого до двадцать восьмого дня делается пауза.
До начала химиотерапии и в течение всего курса врач контролирует анализы крови и общее состояние, для раннего выявления и предотвращения серьезных осложнений лечения.
После окончания курса химиотерапии проводится контроль лечения. Как правило, выполняется цистоскопия и компьютерная томография.
Препараты для химиотерапии рака
Чаще всего пациенту требуется комбинированная химиотерапия. Существуют следующие комбинации препаратов:
- GC – гемцитабин и цисплатин
- MVAC – метотрексат, винбластин, адриамицин и циспластин
- GemCarbo – гемцитабин и карбоплатин
- Carbo MV – карбоплатин, метотрексат и винбластин
- CMV – цисплатин, метотрексат и винбластин
Наиболее широко используется комбинация гемцитабин и цисплатин (GC). Она находит свое применение перед операцией или радиотерапией. Также по всему миру используется MVAC комбинация.
Побочные эффекты химиотерапии рака
Спектр и тяжесть возникающих побочных эффектов зависит как от используемых препаратов и их дозировок, так и от индивидуальной переносимости пациента.
Каждый препарат обладает своими побочными эффектами, о которых вы более подробно можете узнать у своего врача. Здесь мы рассмотрим наиболее часто возникающие нежелательные эффекты химиотерапии рака мочевого пузыря:
- Выраженная слабость и быстрая утомляемость;
- Потеря аппетита и снижение массы тела;
- Тошнота и рвота;
- Уменьшение числа кровяных клеток (анемия, лейкопения, тромбоцитопения);
- Кровоточивость вследствие тромбоцитопении;
- Высокий риск инфекции вследствие лейкопении;
- Выпадение волос, ломкость ногтей;
- Сухость во рту;
- Изъязвление слизистых оболочек рта, мочевого пузыря, прямой кишки;
- Бесплодие и др.
Локальная химиотерапия рака мочевого пузыря
Локальная, или интравезикальная терапия проводится путем введения химиопрепарата через катетер в мочевой пузырь.
Локальная химиотерапия используется для лечения поверхностного рака мочевого пузыря после трансуретральной резекции опухоли.
После удаления рака в мочевом пузыре на время остается катетер. Через катетер медицинский работник вводит химиопрепарат. Как правило, используется митомицин С, эпирубицин, доксорубицин. Далее катетер перекрывается на время. Основное условие, чтобы препарат как минимум два часа оставался в полости мочевого пузыря и контактировал с его слизистой оболочкой.

Рисунок. Интравезикальная химиотерапия рака мочевого пузыря.
Через два часа мочевой пузырь опорожняется, катетер извлекается на следующий день после операции.
Для ранней стадии рака мочевого пузыря с низким риском рецидива одной процедуры достаточно.
Если же у вас существует умеренный или высокий риск рецидива, вам могут порекомендовать курс интравезикальной химиотерапии или иммунотерапии с использованием БЦЖ вакцины. Об использовании вакцины БЦЖ для лечения рака мочевого пузыря вы сможете подробно прочитать в статье "Иммунотерапия при раке мочевого пузыря".
Курс интравезикальной химиотерапии проводится в течение шести недель, химиопрепарат вводится один раз в неделю. Перед введением лекарства рекомендуется ограничить потребление жидкости за 12 чесов до процедуры. Это позволит поддержать высокую концентрацию препарата в пузыре. Лекарство вводится с помощью катетера, требуется экспозиция препарата не менее 1-2 часов. В течение этого времени необходимо периодически, примерно один раз в пятнадцать минут, менять положение тела, чтобы быть уверенным, что лекарство достигло всех участков мочевого пузыря. По истечении времени экспозиции мочевой пузырь опорожняется, катетер извлекается.
В течение первых шести часов после процедуры необходимо соблюдать осторожность в процессе мочеиспускания, важно, чтобы моча не попадала на кожные покровы, так как она еще может содержать достаточно высокие концентрации лекарства. Если это произошло, необходимо промыть кожу водой с мылом, избегая растирания.
Побочные эффекты интравезикальной химиотерапии рака
Для интравезикальной химиотерапии характерно не так много побочных эффектов, как для системного лечения. Химиопрепараты воздействуют на слизистую оболочку мочевого пузыря и лишь в минимальных количествах попадают в кровь.
Наиболее частый побочный эффект – раздражение мочевого пузыря и кожных покровов промежности. У пациента возникают симптомы, как при цистите (воспаление мочевого пузыря). Вас может беспокоить учащенное мочеиспускание, дискомфорт в процессе опорожнения мочевого пузыря и др. У одного из десяти человек может появиться сыпь на руках и ногах.
Инфекции у больных раком при подавлении иммунитета
Инфекции — главные причины смерти при раке. Они не только часто встречаются, но нередко имеют более тяжелое течение, чем у других пациентов, менее подверженных действию терапии, и иногда вызываются организмами, которые не патогенны для здоровых людей. Такая восприимчивость является следствием подавления защитных механизмов больного, вызванного опухолью и ее лечением.
Кожа и слизистые оболочки служат барьером для инфекции. Опухолевая инфильтрация и местная лучевая радиотерапия могут привести к повреждению лимфатических или венозных сосудов, что приводит к увеличению восприимчивости к локальной инфекции. Воспроизводство эпителиальных клеток в желудочно-кишечном тракте подавляется химиотерапией, из-за чего повреждается и изъязвляется слизистая, что позволяет организмам из кишечника попасть в систему воротной вены.
Кожа повреждается внутривенными иглами и канюлями, особенно туннельными подкожными каналами. Это частые источники инфекции, которые вызываются такими кожными организмами, как Staphylococcus epidermidis. В носоглоточной полости возникают инфекции, вызванные Candida albicans.
Рак при запущенной стадии иногда связан с ухудшением функций и нейтрофилов, и моноцитов. Было описано подавление хемотаксической, фагоцитарной и бактерицидной активностей.
Ослабленная замедленная гиперчувствительность довольно распространена при запущенной болезни Ходжкина, но менее часта в других случаях злокачественных опухолей. Лимфопения неизменно вызывается действием алкилирующих агентов и массивной радиотерапией. Клеточный иммунитет особенно важен при защите организма хозяина от грибов, вирусов, туберкулеза и простейших.
Интенсивная цитотоксическая химиотерапия ведет к ухудшению образования антител к бактериальным и вирусным антигенам.
Циркулирующие бактерии удаляются фагоцитарными клетками, находящимися в синусах ретикулоэндотелиальной системы, особенно в печени и селезенке. Для этой чистки важны антитела и белки системы комплемента. Спленэкто-мия увеличивает риск серьезной бактериальной инфекции, особенно пневмококковый сепсис в детском возрасте и в меньшей степени во взрослом.
Возбудители сепсиса
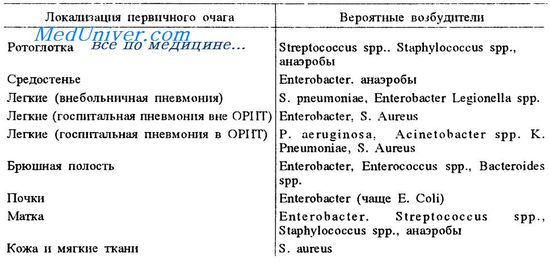
Бактериемия и септицемия у больных раком
Инфекции кровяного русла довольно часты у пациентов с гранулоцитопенией. Патогенами часто являются грамотрицательные бактерии (Escherichia coli, Pseudomonas aeruginosa), стафилококки и стрептококки. Увеличивается частота инфекций, вызванных грамположительными бактериями, особенно Staphylococcus epidermidis. Пациенты с тунельными подкожными каналами особенно подвержены поражениям этим организмом.
Жар у пациента с нейтропенией при раке — показатель присутствия бактерий в крови и под кожей. Если существует очевидный источник инфекции, например инфицированный порт для инфузий, следует взять культуру бактерий и удалить канюлю. Лечение не следует откладываеть для пациента с нейтропенией. Пациенты с лихорадочной нейтропенией с относительно низким риском развития серьезных осложнений относятся к тем, кого лечат короткими циклами химиотерапии для солидных опухолей.
Эти пациенты должны быть госпитализированы. Недавние исследования показали, что пероральный прием амоксициллина-клавуланата комбинированный с пероральным приемом ципрофлоксацина так же эффективен, как и внутривенная химиотерапия в этой группе (70% пациентов). Пациенты с высоким риском (с неконтролируемым раком или на стационарном лечении интенсивной терапией) лечатся внутривенными антибиотиками, в том числе b-лактамом и аминогликозидом или цефтазидимом.
Респираторные инфекции у больных раком
У пациента с серьезным подавлением иммунитета довольно часто возникает жар с легочным инфильтратом. Главные причины этого даны в таблице.
Осложнения в постановке диагноза могут быть значительны, поскольку тесты слюнных и кровеносных культур иногда отрицательны, а более инвазивные процедуры, такие как трансбронхиальная биопсия, невозможны из-за тромбоцитопении или общего состояния пациента.
Существуют некоторые клинические особенности, которые помогают при постановке диагноза. Кавитация наиболее часто сопровождает поражения анаэробными бактериями, стафилококками и микобактериями. Инфекции Pneumocystis вызывают заметную одышку, а на рентгенограмме грудной клетки видны билатеральные инфильтраты, обычно состоящие из хилуса. Болезнь, однако, может протекать вяло и вызвать долевое уплотнение. Цитомегаловирусные инфекции встречаются главным образом у пациентов с серьезным подавлением иммунитета, в частности в течение аллогенной ВМТ. Болезнь может также вызывать миокардит, невропатию или офтальмию.
Легочные инфильтраты обычно билатеральны. Инфекции Candida вызывают широкое разнообразие изменений в рентгенограмме. Инфекции Aspergillus обычно быстро прогрессируют. Тесты культур крови обычно отрицательны, а инфильтраты возможны в одном или двух легких.
При затруднениях в постановке диагноза можно следовать следующей схеме.
У пациентов без нейтропении или тромбоцитопении исследовать посевы крови, слюны, бронхоскопические промывания и трансбронхиальную биопсию там, где это возможно. Если кровяные и слюнные культуры отрицательны, лечить антибиотиками широкого антибактериального спектра действия (обычно в комбинации с аминогликозидом, пенициллином и метронидазолом или аналогичными соединениями). Если возможной причиной инфекции является Pneumocystis, следует давать высокие дозы котримоксазола. Если ответа нет, рассмотрите ацикловир для вируса простого герпеса и противогрибковую терапию с амфотерицином или кетоконазолом. Ацикловир не эффективен против цитомегаловирусов.
Если кровяные или слюнные тесты положительны, лечите соответствующе, но если ответа нет, рассмотрите смешанные инфекции.
Пациентам с нейтропенией или тромбоцитопенией проводят бронхоскопию, но биопсия не всегда возможна, и лечение продолжают без дальнейшего диагностического исследования. До и после бронхоскопии иногда необходимы антибиотики и переливание тромбоцитов.

Инфекции мочевыводящих путей у больных раком
Инфекции часты у пациентов с затрудненным мочеиспусканием. Затруднения могут быть вызваны опухолью или ослаблением мочевого пузыря у пациентов с компрессией спинного мозга и его корешков. Диагноз ставится после исследования уринокультуры, и лечение осуществляется антибиотиками и снятием осложнений, если это возможно.
Желудочно-кишечные инфекции у больных раком
Молочница ротовой полости (инфекция, вызываемая Candida albicans) — частое осложнение химиотерапии. Она особенно распространена у пациентов с подавленным иммунитетом, у пациентов, принимающих стероиды и тех, кого лечат антибиотиками с широким спектром действия. Рот и глотка становятся очень болезненными, а белые пятна грибков видны на эри-темной основе. У плохо питающихся пациентов инфекция может проникать глубже и распространяться по пищеводу, желудку и кишечнику. Обычно эффективен пероральный прием нистатина, амфотерицина или миконазола.
Проявление вируса простого герпеса на губах часто проблематично для пациентов с лейкопенией, и повреждения могут быть довольно обширными. В данном случае необходимо местное применение ацикловира для пациентов с подавленным иммунитетом или систематический прием ацикловира при более серьезных инфекциях.
Инфекции, вызванные Candida в пищеводе, необходимо лечить пероральным приемом суспензии нистатина, но если такое лечение неэффективно, то необходимо применение кетоко-назола или короткий курс амфотерицина. Кишечные инфекции, возникающие при поражении Candida, должны лечиться амфотерицином.
Перианальные инфекции распространены среди пациентов с нейтропенией. Всегда необходимо применять профилактические меры совместно с тщательной гигиеной промежности и смягчителями стула для предотвращения запора и анальных трещин. Распространяющиеся перинеальные (паховые) инфекции могут угрожать жизни пациента, и требуется срочное лечение внутривенными антибиотиками, действующими против грамотрицательных и анаэробных бацилл.
Менингит у больных раком
Инфекции центральной нервной системы (ЦНС) довольно редки, но у пациентов с лимфомой или лейкемией иногда развивается менингит из-за Cryptococcus neoformans. Начало заболевания индивидуально у каждого и сопровождается головной болью. Микроорганизм обнаруживают при окрашивании India ink спинномозговой жидкости (CSF).
Выявление антигенов Cryptococcus в крови и CSF возможно у большинства пациентов. Состояние многих пациентов улучшается при приеме амфотерицина, некоторые вылечиваются.
Кожные инфекции у больных раком
В отличие от инфекции, представленной на портах для вливания, наиболее частое кожное заболевание — опоясывающий лишай (varicella zoster). Возникает из-за реактивации вируса varicella zoster в ганглии дорсального корешка, вызывает кожную пузырчатую сыпь, которая особенно серьезна у людей с подорванным иммунитетом, может распространяться как ветряная оспа и вызывать фатальную пневмонию. Пациентов следует лечить ацикловиром как можно быстрее.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Среди органов мочевыводящих путей мочевой пузырь наиболее часто поражается злокачественными новообразованиями: рак мочевого пузыря составляет около 2–2,5% среди всех онкологических заболеваний. В структуре онкологической заболеваемости населения России на долю рака мочевого пузыря приходится 4,4% от всех опухолей мужского населения и 1,1% – женского [1]. Опухоли лоханки и мочеточника встречаются значительно реже и составляют соответственно около 7% и 1% от всех злокачественных новообразований почек и верхних мочевыводящих путей. Первичный рак уретры встречается очень редко.
Более 90% опухолей мочевыводящих путей представлено переходноклеточным раком, около 7% приходится на долю плоскоклеточных новообразований, редко встречается аденокарцинома.
В большинстве работ, посвященных химиотерапии уротелиального рака, рассматриваются вопросы лечения рака мочевого пузыря (РМП). Предполагается, что переходноклеточные опухоли верхних мочевыводящих путей реагируют на химиотерапию так же, как и новообразования мочевого пузыря.
Лекарственная терапия применяется как при поверхностном, так и при инвазивном и диссеминированном раке мочевого пузыря. При поверхностных новообразованиях внутрипузырная химиотерапия применяется главным образом после радикального хирургического удаления опухоли. Основная цель адъювантной химиотерапии – профилактика рецидивов заболевания и предупреждение прогрессии опухоли.
Наиболее активными химиопрепаратами при внутрипузырном применении считаются тиофосфамид, митомицин С, доксорубицин, эпирубицин. Применяются различные разовые дозы и схемы лечения. По суммированным данным многих авторов, проводивших рандомизированные исследования по изучению влияния профилактической химиотерапии на частоту рецидивов РМП, рецидивы поверхностного РМП после трансуретральной резекции (ТУР) мочевого пузыря составили в среднем около 60%. Профилактическое применение тиофосфамида снижало их частоту в среднем на 17%, доксорубицина – на 18%, митомицина С – на 15% [2].
Более поздние рандомизированные исследования, охватывающие значительное число больных, также подтвердили положительное влияние адъювантной внутрипузырной химиотерапии на снижение частоты рецидивов поверхностного РМП, не выявили достоверных различий в частоте прогрессии опухоли и не отметили различий в отдаленных результатах лечения между больными, получавшими профилактическое лечение, и подвергнутыми только ТУР [3,4].
Интересные данные были опубликованы Tolley и соавт. [4] по адъювантному применению митомицина С у больных поверхностным раком мочевого пузыря после трансуретральной резекции. Авторы провели анализ частоты рецидивов рака мочевого пузыря в трех группах больных: в 1 группе 40 мг митомицина вводили в мочевой пузырь на 1 ч не позже чем через 24 ч после ТУР, во 2 группе митомицин вводили однократно после ТУР в той же дозе, а затем подобные инстилляции выполняли 1 раз в 3 месяца на протяжении года, в 3 группе адъювантную терапию не проводили. Анализ показал, что риск рецидива снизился в 1 группе на 34%, во 2 группе на 50% (р=0,01 и 0,0001) по сравнению с 3 группой больных.
Европейская урологическая ассоциация рекомендует всем больным после ТУР однократную внутрипузырную инстилляцию химиопрепарата. Больные с низким риском возникновения рецидива в дальнейшем проведении химиотерапии не нуждаются. Больным со средней и высокой степенью риска развития рецидива следует провести 4–8–недельный курс внутрипузырной химотерапии или БЦЖ–терапии. Целесообразность поддерживающей внутрипузырной химиотерапии более 6 месяцев, если нет рецидива, не доказана [6].
Кроме адъювантного применения, внутрипузырная химиотерапия может быть использована и как самостоятельный метод лечения. Обычно в таких случаях речь идет о больных раком мочевого пузыря in situ или о больных поверхностными опухолями, которым по тем или иным причинам невозможно провести оперативное лечение. Наиболее часто для внутрипузырной химиотерапии применяется митомицин. Однако эффективность химиотерапии рака in situ уступает эффективности БЦЖ–терапии [8].
Для повышения эффективности в схему лечения включают несколько химиопрепаратов или применяют комбинацию химиотерапии с иммунотерапией [9,10,11]. Сочетанное применение нескольких препаратов позволяет добиться удовлетворительных результатов и одновременно снизить токсичность БЦЖ–терапии.
В РОНЦ им. Н.Н. Блохина РАМН проводилось также изучение эффективности внутрипузырной химиотерапии при поверхностном раке мочевого пузыря. Применялись адриабластин, фармарубицин, тиофосфамид и митомицин. Было показано, что наиболее эффективными препаратами для лечения папиллярного рака мочевого пузыря являются фарморубицин (частота объективной ремиссиии составила 64,3%) и митомицин (частота полной регрессии 30,8%, частичной регрессии – 15,4%). В плане адъювантной химиотерапии применялись адриамицин и тиотэф. Наибольшую эффективность показал тиофосфамид, применение которого позволило уменьшить частоту рецидивов на 21,6% по сравнению с контрольной группой больных, не получавших после ТУР адъювантного лечения [12,13].
Что касается поверхностных опухолей почечной лоханки и мочеточника, то методом выбора считается оперативное лечение (внутриполостная химиотерапия практически не применяется). Обсуждаются вопросы внутриполостной БЦЖ–терапии, имеются немногочисленные публикации о результатах иммунотерапии, но широкого применения метод пока не нашел.
Переходноклеточный рак уретры развивается чаще всего вторично у больных раком мочевого пузыря. При поражении уретры предпочтение отдается оперативному методу лечения. Попытки внутриуретрального введения химиопрепаратов немногочисленны, и судить об эффективности такого метода лечения крайне сложно.
Успехи химиотерапии диссеминированных уротелиальных опухолей привели к тому, что она стала применяться при местнораспространенном раке мочевого пузыря в качестве неоадъювантного и адъювантного лечения.
Задачами неоадъювантной химиотерапии (ХТ) являются: 1) уменьшение размеров или стадии опухоли; 2) повышение абластичности операции и увеличение резектабельности опухоли; 3) воздействие на микрометастазы.
Наряду с вышеперечисленными достоинствами неоадъювантная химиотерапия имеет и определенные недостатки: во–первых, не все больные нуждаются в химиотерапии по поводу микрометастазов; во–вторых, используемая комбинированная ХТ достаточно токсична, наблюдаются летальные исходы из–за осложнений лечения; в–третьих, если неоадъювантная химиотерапия будет неэффективна, упускается время для выполнения радикальной операции.
Оценка эффекта неоадъювантной химиотерапии является наиболее сложным моментом. Несмотря на применение самых современных методов исследования (КТ, МРТ) ошибка достигает 30–40%. По данным РОНЦ РАМН, у 75% больных с клинически полной регрессией опухоли, которым была произведена цистэктомия, гистологически находили опухолевые клетки в толще стенки мочевого пузыря. То есть достижение клинически полной регрессии не говорит об излечении больного. Поэтому большинство специалистов выполняет цистэктомию даже больным с клинически полной регрессией опухоли.
Результаты применения неоадъювантной химиотерапии противоречивы. Некоторые авторы сообщают об улучшении отдаленных результатов лечения [19], другие показывают, что улучшение касается только больных с поздними стадиями заболевания – Т3 – Т4 [20], третьи не отмечают преимущества в выживаемости больных, получавших предоперационную терапию, по сравнению с теми, кому было проведено только хирургическое лечение [21, 22, 23]. Существует мнение, что неоадъювантная химиотерапия лишь разделяет больных на пациентов с хорошим прогнозом (тех, кто достиг полной регрессии опухоли) и плохим прогнозом (пролеченные с частичным эффектом или без эффекта).
Адъювантная химиотерапия проводится больным с высоким риском развития рецидива после радикальной операции. К факторам, повышающим вероятность рецидива, относят гистологически подтвержденные метастазы в удаленных регионарных лимфатических узлах, опухолевую инфильтрацию паравезикальной клетчатки, инвазию опухоли в лимфатические или кровеносные сосуды.
Положительным качеством адъювантной химиотерапии является то, что она воздействует на предполагаемые микрометастазы – минимальный объем опухоли создает наиболее благоприятные условия для достижения положительного результата. Кроме того, химиотерапия проводится после операции, и в случае ее неэффективности не теряется время до радикального хирургического лечения, как это может быть при проведении неоадъювантной химиотерапии. Основным недостатком послеоперационной химиотерапии является отсутствие контроля за ее эффективностью. Предполагается что часть пациентов получает заведомо неэффективную терапию, которая может привести к нежелательным последствиям.
Было проведено несколько проспективных контролируемых исследований по изучению эффективности адъювантной химиотерапии. В исследование Skinner и соавт. включали больных, которым была произведена цистэктомия по поводу местнораспространенного рака мочевого пузыря (рТ3–4, pN+). Применялась комбинация химиопрепаратов CISCA. Проводили 3–4 курса послеоперационной химиотерапии. Только 61% больных смогли перенести запланированную терапию. Контрольную группу составили пациенты, не получавшие лечения после операции. Средняя выживаемость в группе химиотерапии была 4,3 года, а в контрольной группе – 2,4 года. Послеоперационная химиотерапия позволила увеличить безрецидивный период на 14 мес. Однако различие результатов было недостоверным [24].
В исследовании Stockle и соавт. у больных раком мочевого пузыря рТ3–4а pN1–2 для адъювантнщй химиотерапии применяли схему M–VAC; 69% больных получили 2–3 курса химиотерапии. В контрольной группе после цистэктомии лечение не проводилось. При среднем сроке наблюдения 24 мес. рецидив заболевания выявлен у 17% больных, получавших послеоперационное лечение, и у 78% – в контрольной группе. Достоверных различий в общей выживаемости не получено, хотя безрецидивная выживаемость была выше в группе химиотерапии [25].
Единого мнения об эффективности адъювантной химиотерапии не существует. Некоторые авторы считают, что она позволяет улучшить отдаленные результаты лечения в группе больных с высоким риском развития рецидива в среднем на 20–30%. Однако вопрос о целесообразности адъювантного лечения остается предметом исследований.
Применение при уротелиальном раке схем химиотерапии, в основе которых лежит использование цисплатина, связано с существенной токсичностью. Токсические проявления заключаются в развитии нейтропении и инфекционных осложнений на ее фоне; выраженных мукозитов, вызывающих трудности в приеме пищи, диаррею, которые ухудшают общее состояние больного, приводят к потере веса, слабости. Кроме того, наблюдаются тошнота и рвота, почечная, кардиальная и неврологическая токсичность. Несмотря на успехи химиотерапии при диссеминированных опухолях, средняя выживаемость составляет около 1 года, длительная наблюдается лишь у 15–20% больных. Менее 5% пациентов переживают 5 лет. Поэтому требовалось создание новых подходов к лечению уротелиального рака, которые могли бы снизить токсичность терапии и улучшить отдаленные результаты.
Одним из таких подходов явилось увеличение доз химиопрепаратов с одновременным применением колониестимулирующих факторов. EORTC было проведено рандомизированное исследование, в котором сравнивались стандартный режим M–VAC и высокодозный M–VAC на фоне применения гранулоцитарного колониестимулирующего фактора. Исследование показало, что в группе больных, получавших высокодозный режим, уменьшилась частота мукозитов и проявлений миелотоксичности, однако доля объективных ремиссий и продолжительность жизни была одинаковой в обеих группах [26]. В настоящее время высокодозный режим M–VAC не рекомендован в качестве стандартного лечения.
Новые режимы и схемы лечения при уротелиальном раке стали изучаться в связи с появлением новых химиопрепаратов. Одним из наиболее перспективных является гемцитабин – противоопухолевый агент из группы антиметаболитов, который показал высокую активность у больных переходноклеточным раком уротелия.
Клиническое изучение гемцитабина началось в 1994 году. Во время I фазы испытаний препарата разовая доза гемцитабина составляла 875–1370 мг/м 2 . Препарат вводили путем 30–минутной инфузии еженедельно в течение 3 последовательных недель каждого 4–недельного цикла. Объективный эффект наблюдался у 27% пациентов. В результате этого исследования была определена основная токсичность гемцитабина: нейтропения (53%), анемия (53%), тромбоцитопения (20%), негематологическая токсичность (повышение уровня АСТ, АЛТ) была отмечена у 27%, лихорадка у 60%, рвота у 40%. Также была установлена дозолимитирующая гематологическая токсичность для гемцитабина – 1370 мг/м 2 1 раз в неделю [27].
Учитывая обнадеживающие результаты I фазы, в нескольких центрах Северной Америки и Европы была проведена II фаза исследования гемцитабина в монотерапии у больных переходноклеточным РМП. Совокупно лечение получили 107 больных диссеминированным РМП, при этом частота ремиссий составила около 25% [28,29,30].
На сегодняшний день закончено несколько крупных исследований в рамках II фазы с использованием схемы гемцитабин–цисплатин. Терапия проводилось по следующей схеме: гемцитабин 1000 мг/м 2 внутривенной инфузией в 1, 8 и 15 дни; цисплатин 70–100 мг/м 2 внутривенной инфузией в 1 или 2 день каждого цикла. Интервал между циклами лечения составлял 28 дней. Общий ответ на лечение составил 48–66% при частоте полных ремиссий 15–28% [31, 32, 33].
Высокая эффективность и хорошая переносимость комбинации гемцитабина с цисплатином позволили начать ее сравнение со стандартной схемой MVAC. К настоящему времени закончено крупное рандомизированное мультинациональное мультицентровое исследование в рамках III фазы [34]. В исследовании приняли участие 405 пациентов с IV стадией РМП, которые до этого не получали ХТ. В первую группу вошло 203 больных (гемцитабин + цисплатин), во вторую 202 больных (MVAC). Общая выживаемость, время до прогрессирования, прогрессирование на фоне лечения, количество ремиссий (49% при применении гемцитабина с цисплатином и 46% при использовании режима MVAC) были одинаковы в обеих группах. Однако проявления токсичности были меньше и переносимость была лучше при лечении по схеме гемцитабин + цисплатин. Кроме того, при лечении по схеме GC в меньшей степени использовались вспомогательные средства и поддерживающие препараты (переливание крови, антиэметики, анальгетики) [34].
Таким образом, лечение по схеме гемцитабин + цисплатин оказалось более безопасным и является альтернативой схеме MVAC при местнораспространенном и диссеминированном уротелиальном раке. Схему гемцитабин + цисплатин можно использовать в качестве стандартного лечения у этих больных.
Другой класс противоопухолевых препаратов представляют таксаны. Механизм действия заключается в стимуляции полимеризации клеточного белка тубулина и препятствии его деполимеризации, что приводит к нарушению процесса формирования клеточного веретена и задержке клеток в G2 и М фазах митоза. Применение доцетаксела у больных метастатическим уротелиальным раком в качестве химиотерапии первой линии привело к объективной ремиссии у 31% больных [35]. Однако использование доцетаксела у больных, ранее получавших химиотерапию другими препаратами, позволило добиться ответа лишь у 13% пациентов [36].
Применение паклитаксела в комбинации с метотрексатом и цисплатином привело к объективной регрессии опухоли у 40% больных, ранее получавших химиотерапию M–VAC [37]. В дальнейшем были изучены сочетания паклитаксела с цисплатином, карбоплатином, однако наиболее перспективным оказалось введение паклитаксела в комбинацию гемцитабина с цисплатином [38].
В исследовании приняли участие ранее нелеченные пациенты с местнораспространенным или метастатическим РМП, имеющие измеряемые проявления заболевания. Цисплатин вводили в 1 день в фиксированной дозе 70 мг/м 2 . Паклитаксел и гемцитабин вводились в 1 и 8 дни с эскалацией доз. Всего проводилось до 6 курсов химиотерапии с интервалом в 3 недели. В исследование включен 61 больной, в том числе 15 – в I фазе. Дозолимитирующей токсичностью оказалась астения. Для II фазы исследования рекомендован паклитаксел 80 мг/м 2 и гемцитабин 1000 мг/м 2 . Данный режим в окончательном виде получили 49 пациентов. Основной негематологической токсичностью была астения 2 степени у 18 больных, с ранним появлением у 5 из них, и астения 3 степени у 4 пациентов. Нейтропения и тромбоцитопения 3–4 степени наблюдались у 27 (55%) и 11 (22%) больных, соответственно. Фебрильная нейтропения зафиксирована у 11 больных, 1 пациент умер от нейтропенического сепсиса. Комбинация показала себя активной при всех дозовых уровнях. Эффект оценен у 58 из 61 пациента. Достигнуто 16 (27,6%) полных и 29 (50%) частичных эффектов, общая эффективность терапии составила 77,6% (95% доверительный интервал, 60–98%). Медиана выживаемости известна только у больных из I фазы исследования, которая составила 24 мес. Авторы делают вывод, что комбинация паклитаксела, цисплатина и гемцитабина показала себя безопасной и высокоактивной у больных распространенным РМП [38].
Таким образом, достигнутые в последнее десятилетие результаты лекарственной терапии уротелиального рака позволяют отнести его к химиочувствительным опухолям. При поверхностных новообразованиях мочевого пузыря высокую эффективность в предупреждении рецидивов показало однократное внутрипузырное введение митомицина непосредственно после трансуретральной резекции. При местнораспространенных и диссеминированных опухолях появился новый стандарт химиотерапии – режим гемцитабин + цисплатин. Он столь же эффективен, как схема M–VAC, но менее токсичен и легче переносится больными. Дальнейшие перспективы лекарственной терапии уротелиального рака связаны с изучением трехкомпонентных комбинаций с включением таксанов, разработкой режимов химиотерапии второй линии, преодолением механизмов резистентности опухоли.
Онкологический процесс в слизистой оболочке мочевого пузыря – патологическое новообразование, которое быстро распространяется на соседние органы и на лимфатическую систему, а также – может негативно повлиять на работу печени, легких, костей и головного мозга. При отсутствии медицинского контроля и лечения заболевание быстро прогрессирует, что угрожает жизни и здоровью пациента из-за угнетения основных функций организма.
В зависимости от вида пораженных клеток различают уротериальную карциному (переходно-клеточный рак) и аденокарциному. Реже встречаются плоскоклеточный рак, мелкоклеточная карцинома и саркома, развивающаяся в структуре соединительной ткани. На долю первого заболевания приходится до 95% случаев.
В числе причин, которые вызывают развитие онкологического процесса, часто отмечают:
- Курение. Вдыхание дыма с огромным содержанием токсических веществ сопровождается их скоплением в области мочевого пузыря, что вызывает процесс озлокачествления клеток.
- Длительный контакт с вредными и канцерогенными веществами. Значительное число случаев отмечается у сотрудников предприятий лакокрасочной промышленности, машинистов, водителей грузовиков и т.д.
- Недостаток жидкости в организме. У пациентов, которые пьют много воды ежедневно, мочевой пузырь стабильно очищается от вредных веществ, поэтому случаи рака носят единичный характер.
- Возраст пациента старше 55 лет.
У мужчин вероятность патологии в разы выше, чем у женщин — в пропорции 3:1. Это связано с пристрастием к курению и работе в условиях постоянного контакта с канцерогенными веществами.
Особенности химиотерапии при раке мочевого пузыря
Несмотря на длительное изучение заболевания, до настоящего времени не существует механизма эффективного лечения рака мочевого пузыря. Тем более что заболевание требует тщательной дифференциальной диагностики, быстро прогрессирует и часто дает рецидивы после успешно пройденного курса. Если крупные образования удается удалить, то микроскопические очаги в том же месте продолжают развиваться, что приводит к рецидиву патологии. Единственный способ снизить этот риск – адъювантная химиотерапия в течение 6 часов после завершения операции, благодаря которой удается подавить интенсивное размножение клеток мелких опухолей, которые сложно обнаружить даже при современном инструментальном обследовании.
Если заболевание обнаружено на 3 или 4 стадии, показано проведение химиотерапии при раке мочевого пузыря до или после оперативного вмешательства. Терапия назначается в срок до трех месяцев с даты удаления опухоли. Если у пациента обнаружены метастазы, только благодаря введению цитостатиков удается продлить срок жизни пациента и улучшить ее качество.
Основная задача проведения химиотерапии при раке мочевого пузыря после операции у мужчин и у женщин или вместо оперативного вмешательства — это:
- Уничтожение всех раковых клеток в органах и системах организма пациента.
- Подавление роста новых клеток.
- Замедление роста и распространения опухоли.
Важно: лечение пациента только цитостатиками не дает нужного эффекта. Однако в некоторых случаях при распространении метастаз химиотерапия — лучший способ продлить жизнь пациента.
Особенности и симптомы заболевания у женщин
Опасность развития РМП у женщин — невозможность увидеть первый верный признак болезни в виде появления крови в моче и обратиться за медицинской помощью. Поэтому чаще заболевание обнаруживается на поздних стадиях, что снижает вероятность успешного лечения патологии. Также в числе особенностей протекания заболевания у пациенток:
- Вероятность развития ракового процесса на стенках мочевого пузыря — 1:88.
- Развитие патологии в более позднем возрасте, чем у мужчин.
- Чаще у женщин обнаруживаются менее агрессивные опухоли.
- При диагностике запущенных случаев рака шансы на выживаемость у женщин ниже, чем у мужчин.
Проведение химии при раке мочевого пузыря у женщин назначается с учетом возможных противопоказаний и сохранения качества жизни больных.
Особенности онкологического процесса у мужчин
Первый признак патологии – появление крови в моче, которая окрашивает жидкость в оранжевый или темный цвет. Кровь может появиться однократно, после чего моча вновь приобретает нормальный оттенок. Также многие пациенты жалуются на частое мочеиспускание, боли и рези в мочевом пузыре, слабую струю мочи или ее затрудненный вывод. В запущенных случаях отмечаются боли в спине, состояние слабости и усталости, отечность на ногах, потеря веса и снижение аппетита. Аналогичные симптомы могут наблюдаться при мочекаменной болезни, аденоме простаты, цистите и отеке мочевого пузыря.
В перечне особенностей протекания и диагностики патологии у мужчин:
- Сравнительно высокий риск развития заболевания.
- Шансы возникновения патологии – 1:26.
- Частые случаи диагностики заболевания среди пациентов раннего возраста.
- Сравнительно высокая агрессивность и инвазивность патологического процесса.
- Необходимо провести дифференциальную диагностику, чтобы исключить вероятность аденомы простаты, имеющей схожую симптоматику с онкологией.
Схожесть онкологического процесса в мочевом пузыре с инфекционными и воспалительными заболеваниями заставляет проводить целый набор диагностических обследований, по результатам которых можно точно установить наличие в организме пациента злокачественного опухолевого процесса.
Виды химиотерапии при раке мочевого пузыря
При выборе противоопухолевых препаратов для проведения химиотерапии при раке мочевого пузыря у мужчин и у женщин врачи ориентируются на уровень их токсичности и эффективности. Чаще выбирается митомицин, снижающий вероятность рецидивов. Цисплатин позволяет предотвратить образование метастаз после проведения операции радикального удаления пораженных тканей. Комбинированный прием препаратов позволяет подавить развитие мелких раковых опухолей и снизить риск их распространения по организму.
Различают следующие виды химиотерапии:
- Внутрипузырная. Рекомендована после операции при поверхностном типе опухолей для исключения образования множественных метастаз. Особую эффективность данный метод имеет при лечении карциномы. Назначение химиотерапии при раке мочевого пузыря у мужчин в пожилом возрасте ставит своей целью снизить риск рецидивов и улучшить качество жизни пациента.
- Адъювантная терапия. Назначается после удаления тканей опухоли. Пациенту вводят комбинацию из нескольких препаратов различного направления действия, в число которых обычно входят доксорубицин, митомицин, цисплатин, эпирубицин и метотрексат.
- Неоадъювантная терапия. Рекомендована до момента проведения операции с целью уменьшить размер опухоли и сделать возможным ее частичное или полное удаление без угрозы для жизни пациента. Результат применения данного метода лечения – резектабельность опухоли, подавление развития метастаз и продление жизни пациента. Комбинация препаратов может состоять из двух, трех или четырех действующих составов, выбор которых осуществляется с учетом характера опухоли.
Если злокачественное образование на мочевом пузыре неоперабельно, пациенту рекомендована паллиативная терапия, позволяющая рассчитывать на частичное устранение неприятных болевых симптомов. Наибольшей эффективностью при поддерживающем лечении обладают метотрексат, цисплатин, винбластин и доксорубицин, которые назначают в оптимальном сочетании с учетом состояния пациента и влияния опухоли на внутренние процессы в организме.
Сколько курсов проводят
Продолжительность курсов химиотерапии и количество сеансов зависят от выбранной тактики лечения и состояния пациента:
- Внутрипузырная терапия с использованием вакцины БЦЖ проводится в три сеанса с обязательным перерывом в 7 дней для восстановления организма.
- Адъювантная терапия препараты вводятся после проведения операции и до 6-8 раз еженедельно, после чего пациенту рекомендовано прохождение поддерживающего лечения в течение трех лет.
При выборе комбинации препаратов врачи принимают в расчет возможную реакцию опухоли и вероятность ее привыкания к внешнему химическому воздействию. По мере прохождения курса проводится обязательный мониторинг состояния пациента, что позволяет своевременно скорректировать лечение и заменить набор цитостатиков.
Побочные эффекты химиопрепаратов
Необходимость перерывов в ходе химиотерапевтического лечения обусловлена необходимостью восстановления пораженных тканей и органов пациента. Но даже в этом случае отмечается негативное влияние цитостатиков на здоровую ткань желудка, кишечника, корни волос и кровеносную систему организма. У пациентов, прошедших или завершающих назначенный курс, часто отмечаются:
- Рвота и тошнота.
- Диарея, расстройство пищеварения.
- Частичное или полное облысение.
- Повышенная чувствительность к патогенным микроорганизмам из-за угнетения иммунной системы.
- Риск развития кровотечений.

Согласно исследованиям, лечение Радием-223 повышает срок жизни пациентов и качество жизни. Пациенты живут в среднем на 3-4 месяца дольше, отмечается уменьшение боли, восстановление способности свободно двигаться. Кроме того, снижается шанс переломов костей и риск возникновения костных осложнений в принципе.
Благодаря маленькому радиусу излучения, Ксофиго значительно снижает выраженность побочных эффектов от химиотерапии. Препарат почти не оказывает токсичного влияния на печень, почки и другие внутренние органы. Среди частых побочных явлений отмечены только нарушения в работе моторики ЖКТ и нарушения показателей крови. Все это, как правило, проходит ко времени следующей инъекции, то есть в течение 4-6 недель.
Читайте также:

