Инфекции после стоматологического лечения
Обновлено: 24.04.2024
Взаимосвязь фокальных одонтогенных очагов инфекции и воспалительных заболеваний глаза
C. Jones описал клинический случай пациента 16 лет, у которого развилось паренхиматозное воспаление роговиц обоих глаз. Несмотря на активное антисифилитическое и другое противовоспалительное лечение в течение 6 мес, кератит прогрессировал до состояния, когда обе роговицы стали полностью непрозрачными. При этом васкуляризации роговиц не было отмечено. Лишь спустя 9 мес от начала болезни у пациента были выявлены и удалены 9 зубов с апикальными абсцессами, а также была произведена тонзиллэктомия инфицированных миндалин. Посевы гнойного содержимого из миндалин и апикальных абсцессов выявили рост одного и того же микроорганизма — гемолитического стрептококка. Впервые за все время болезни уже спустя 48 ч после санации очагов фокальной инфекции было зафиксировано улучшение состояния обоих глаз — значительное уменьшение мучительной фотофобии, гиперемии и резорбция инфильтрации обеих роговиц. Острота зрения стала уверенно расти и в итоге повысилась с правильной светопроекции до 1,0 в течение последующих 8 мес. При этом прозрачность роговиц OU полностью восстановилась, за исключением помутнения верхненаружного квадранта роговицы правого глаза [3].
Согласно теории F. Billings [6], фокус инфекции может оставаться неактивным в течение продолжительного времени, так как защитные функции организма препятствуют развитию инфекции. Однако при негативных воздействиях на организм, таких как травма, переохлаждение, стресс, острая вирусная инфекция, высокая температура и др., фокус латентной инфекции способен активироваться и привести к развитию септических осложнений.
R. Haden [7] в своих исследованиях выделил бактериальные культуры из околоверхушечных тканей 1500 удаленных зубов. Из 400 недепульпированных удаленных зубов лишь в 15% были выявлены стрептококки. Но из 500 раннее депульпированных удаленных зубов с выявленными рентгенологически гранулемами и кистами стрептококки выявлялись в 72,4% случаев, а из 600 раннее депульпированных удаленных зубов, где рентгенологически очаги инфекции выявлены не были, — в 55,7%. Самой распространенной культурой были негемолитические стрептококки.
Депульпирование зубов потенциально создает риск развития хронического инфекционно-воспалительного процесса в полости рта из-за неправильной или неполной очистки зубных каналов, неполного удаления пораженных нервов или недостаточного пломбирования открытых каналов. Эти факторы способствуют распространению микробов и образованию фокальных очагов одонтогенной инфекции [8].
P. Chojnocki [10] внутривенно вводил подопытным кроликам инфекционный материал, выделенный из депульпированных зубов 10 пациентов с иридоциклитом и 4 пациентов с ретробульбарным невритом. В большинстве случаев у кроликов проявлялась та же глазная патология, что и у пациентов. Ученый отметил также, что экстракция больного зуба пациента благоприятно влияла на состояние его глаза.
C. Henry [11] описал 50 случаев циклитов, иридоциклитов и конъюнктивитов, развившихся как следствие инфицирования непрорезавшегося 3-го моляра (зуба мудрости) и быстро купированных после его удаления. Автор считал, что поиск зубного сепсиса никогда не должен рассматриваться как полноценный, если он не включает прицельную рентгенограмму зубов мудрости. Зуб мудрости, как и любой другой зуб, может быть местом развития инфекции, однако автор приводит ряд примеров, где совершенно здоровый, но непрорезавшийся, дистопированный или ретинированный зуб мудрости вызывал воспаление глаза вследствие давления на верхние или нижние зубные нервные сплетения и рефлекторного раздражения тройничного нерва.
Дентальные источники инфекции расценивались J. Doggart [12] как пусковые факторы таких заболеваний глаза, как конъюнктивиты, склериты, эписклериты, различные формы кератитов с изъязвлениями или без, катаракты, хориоретиниты, тромбозы вен сетчатки, ретробульбарные невриты, орбитальные целлюлиты, блефариты, дакриоциститы.
P. Klieve и J. Reh описали более 50 случаев иридоциклитов и кератитов, успешно вылеченных лишь после удаления пораженных зубов. F. Krusin доложил о нескольких случаях язв роговицы, полностью излеченных после устранения дентальных очагов инфекции (цит. по [14]).
S. Mujevic [15] после тщательного обследования 127 пациентов с иридоциклитами выявил, что одонтогенная инфекция послужила непосредственной причиной развития заболевания у 49 (38,5%) из них. Причем автор заметил, что санация очагов инфекции приводила к короткому обострению симптомов с последующим немедленным выздоровлением, естественно, на фоне адекватной консервативной терапии. W. Lang [16] в ходе работы отмечал, что очаги одонтогенной инфекции были обнаружены примерно у 1/3 его пациентов, страдающих иридоциклитом. У ряда пациентов им же была выявлена ЛОР-патология, в частности тонзиллит. При этом одонтогенная инфекция была причиной иридоциклитов в 40 раз чаще, чем очаги инфекции в миндалинах.
K. Langmann [19] указывает на возможность рецидива герпетического кератита вследствие одонтогенной инфекции. У наблюдаемого им больного с тяжелым рецидивирующим герпетическим кератитом и вторичной глаукомой при рентгенологическом исследовании была обнаружена зубная гранулема в верхней челюсти на стороне пораженного глаза. После удаления зуба с гранулемой быстро достигнуто выздоровление, внутриглазное давление нормализовалось и рецидивы кератита не повторялись.
L. King и соавт. [22] описан случай септического тромбоза центральной вены сетчатки, развившегося вследствие транзиторной бактериемии на фоне глубокого кариеса верхних моляров. После проведения системной антибиотикотерапии зрение пациента полностью восстановилось.
S. Blum и cоавт. (цит. по [14]) полагали, что кератиты возникали под влиянием раздражения тригеминального ганглия, которое производил воспаленный зуб на тройничный нерв. S. Blum описал 7 случаев кератита, при которых устранение очага одонтогенной инфекции способствовало уменьшению выраженности симптомов кератита или излечению.
S. Theobald (цит. по [23]) также предположил наличие рефлекторного ответа ветвей тройничного нерва на раздражители со стороны зубных очагов инфекции и, как следствие, развитие воспаления роговицы. Автор отметил, что значительно чаще подвергается воспалению тот глаз, на стороне которого находится пораженный зуб. Преимущественно такая связь наблюдалась при очагах, расположенных в верхней челюсти. В своих работах автор призывал незамедлительно удалять пораженные зубы во избежание глазных осложнений.
И.Г. Лукомский (цит. по [25]) выдвинул нейротоксическую концепцию механизма действия инфекционных очагов полости рта на организм, суть которой заключается в следующем: при воспалительном процессе в тканях периодонта образуются промежуточные продукты распада белка типа биогенных или протеиногенных аминов, а также клеточные и тканевые яды. Эти вещества, всасываясь в кровь, раздражают нервно-трофический аппарат и воздействуют на процессы обмена и функцию вегетативной нервной системы в отдельных органах. В то же время указанные вещества, являясь антигенами, изменяют чувствительность организма, что приводит к сенсибилизации и развитию явлений общей интоксикации. И.Г. Лукомский считал, что наиболее частой причиной ротового сепсиса является хронический гранулирующий апикальный периодонтит, который из всех других форм периодонтитов является наиболее активной формой нейротоксической связи между хроническими очагами в периодонте и другими системами организма.
Поскольку стоматологические манипуляции всегда сопровождаются кровотечением, риск развития транзиторной бактериемии очень высок. В 88% случаев микрофлора одонтогенных очагов инфекции попадает в кровяное русло и временно циркулирует там до 15 мин [26].
A. Heimdahl и соавт. [27] выявили бактериемию после экстракции зуба у 100% пациентов, у 70% — после глубокой чистки зубов, у 55% — после хирургического вмешательства на 3-м моляре, у 20% — после эндодонтического лечения (механической и лекарственной обработки зубных каналов с последующей герметизацией) и у 55% — после тонзиллэктомии. D. Kaye (1985) (цит. по [28]) также установил, что в 90% случаев после удаления зубов возникала бактериемия. При этом в 74% удаленных зубов из корневых каналов были выделены Streptococcus viridans, а в 61% — Bacteroides melanogenicus. Кроме того, в корневых каналах были выявлены стафилококки, энтерококки и другие микроорганизмы.
Чаще всего бактериемия протекает бессимптомно, однако пациенты со сниженным иммунитетом имеют высокий риск развития тяжелых последствий подобной бактериемии — от случаев кератитов и эндофтальмитов, абсцессов глазницы, синдрома верхушки глазницы до абсцесса мозга, что требует срочного привлечения врачей других специальностей — офтальмологов, отоларингологов, нейрохирургов [3, 29—32]. D. May и соавт. [33] описали случай гематогенного распространения инфекции через 1 нед после стоматологического лечения, когда у пациента появились симптомы прогрессирующего увеита, перешедшего в эндофтальмит (гнойное воспаление внутренних оболочек глазного яблока), что потребовало эвисцерации — хирургического удаления содержимого глазного яблока с сохранением фиброзной оболочки. В литературе имеется множество работ, описывающих развитие эндофтальмита после удаления больного зуба [34, 35].
В исследовании G. Debelian и соавт. [36] использовали фенотипические и генетические методы, чтобы проследить распространение микроорганизмов из полости рта на фоне эндодонтического лечения. Микробиологические образцы были взяты из корневых каналов 26 пациентов с бессимптомным апикальным периодонтитом однокорневых зубов. В материале были выявлены штаммы анаэробных бактерий: Propionibacterium acnes, Peptostreptococcus prevotii, Fusobacterium nucleatum, Prevotella intermedia, Saccharomyces cerevisiae, Actinomyces israelii, Streptococcus intermedius, Streptococcus sanguis. Те же штаммы были обнаружены в кровотоке у пациентов через 10 мин по окончании пломбировки канала зуба.
В подтверждение изложенного M. Kilian и соавт. [37] приводят данные о том, что распространение микроорганизмов из полости рта в кровоток происходит в большинстве случаев менее чем за 1 мин после стоматологических процедур, и микроорганизмы из очагов инфекции способны проникать в мозг, сердце и легкие.
Анализ статистических данных за последние 40 лет показывает, что число больных с острой одонтогенной инфекцией неуклонно растет. По данным стоматологических клиник, в 1978 г. этот показатель составил 51,1—56%, в 1992 г. — 56—59%, в 2000 г. уже 63—70%, а в 2017 г. 85,5—95,6%. Болезни периодонта занимают одно из важнейших мест среди проблем в современной стоматологии [38, 39].
Результаты опроса среди стоматологов, проведенного Department of Oral Pathology (Индия) в 2017 г., показали, что 45,7% опрошенных не знали о существующей связи между фокальными очагами инфекции полости рта и заболеваниями глаз. Только 26,8% были согласны с данной теорией, в то время как 16,2% отрицали наличие взаимосвязи [40].
Хронический гранулирующий и гранулематозный периодонтиты сопровождаются воспалительными и деструктивными изменениями кости альвеолярного отростка, а продукты распада тканевых белков (биогенные амины) представляют большую опасность для организма, вызывая хроническую интоксикацию и сенсибилизацию. В 85—98% случаев периодонтит зубов служит этиологическим фактором острых воспалительных процессов в челюстно-лицевой области (периостит, абсцесс, флегмона, лимфаденит, остеомиелит челюсти) [41].
Как правило, хронический апикальный периодонтит протекает в бессимптомной форме. Гранулемы и корневые кисты часто обнаруживают в области разрушенного зуба, а также зубов после травмы и на фоне недостаточного или неправильного эндодонтического лечения кариеса и пульпита. Местом образования кисты может быть любой поврежденный зуб, однако в 2,5—3 раза чаще гнойные кисты локализуются на верхней челюсти. Киста образуется из околоверхушечной гранулемы, в которую пролиферируют активированные воспалением эпителиальные остатки периодонтальной связки, приводящие к образованию кистогранулемы, затем трансформирующейся в кисту. В неактивном состоянии гранулемы и кисты содержат незначительное количество гноя и не вызывают жалоб у пациентов, что затрудняет клиническую диагностику. В период обострения количество гноя увеличивается за счет гибели макрофагов. Гнойное воспаление повреждает костные структуры, нервные окончания и сосуды альвеолы и кости. Корневая киста всегда инфицирована — содержимое может варьировать от прозрачного серозного до гнойного; в нем обнаруживаются микроорганизмы, которые находятся в полости рта и кариозных зубах. Прорыв гноя из полости кисты в околочелюстные мягкие ткани приводит к таким осложнениям, как развитие абсцесса или флегмоны, а также образованию свищевого хода, который располагается в преддверии полости рта, небе или коже лица [42, 43].
Пути распространения инфекции. Сложные пути, по которым инфекция распространяется в организме, изучены недостаточно. Однако экспериментальные данные позволяют считать возможным существование трех путей распространения инфекции в организме — неврального, гематогенного и лимфогенного.
Невральный путь. Экспериментальные исследования, проведенные И.Ф. Баринским и соавт. [44], И.Ф. Баринским и Ф.Р. Махмудовым [45] с помощью светового микроскопа в 1964 и 1986 гг., подтвердили предположения S. Blum, S. Theobald, A. Nesburn и P. Absell о том, что герпесвирусная инфекция распространяется в различные органы двумя путями — невральным (по чувствительным, двигательным и симпатическим нервным волокнам) и гематогенным (в результате выраженного эритротропизма вируса простого герпеса — ВПГ), вследствие чего происходит заражение новых клеток.
В ходе экспериментов на кроликах A. Nesburn и соавт. [46] и P. Absell и соавт. [47] доказали, что ганглий тройничного нерва является основным резервуаром для латентного существования вируса простого герпеса (ВПГ) в течение многих лет.
При изучении механизма распространения герпетической инфекции K. Hayashi и Y. Uchida [48] пришли к выводу, что раздражение ганглия тройничного нерва приводит к реактивации ВПГ и обратному поступлению вируса из ганглия по первой ветви тройничного нерва к органу-мишени — глазу. Развиваются острый герпетический кератит или его рецидивы. Миграция вируса по нервным путям осуществляется с помощью аксоплазматического транспорта в анте- и ретроградном направлениях, распространяется интрааксонально, периневрально, эндоневрально, по леммоцитам. J. Szanto и J. Rajcani [49] доказали, что вирионы вируса герпеса после прикрепления к нервным окончаниям поглощаются аксонами и транспортируются внутри них со скоростью 1,5 мм/ч. Авторы считают невральный путь распространения ВПГ преобладающим.
Гематогенный путь. По мнению J. Bullock и J. Fleishman [50], предположительным путем гематогенного распространения инфекции является ретроградный занос через глазные вены. Верхняя и нижняя глазные вены анастомозируют с угловой и лицевой венами у медиального угла глаза. Нижняя глазная вена проходит через нижнюю глазную щель и соединяется с крыловидным венозным сплетением. Эти вены не имеют клапанов, и в них нет сопротивления распространению инфекции. Отсутствие клапанов при наличии анастомозов между венами глазницы и лица, пазух носа и крылонебной ямки формирует условия для оттока крови в трех направлениях: в пещеристую пазуху, крылонебную ямку и к венам лица. Это создает возможность распространения инфекции с кожи лица, из пазух носа в глазницу и пещеристую пазуху. C кровотоком по указанным венам инфекция распространяется из полости рта и придаточных пазух носа в орбиту, далее — по глазным, вортикозным и эписклеральным венам, осуществляющим венозный отток от переднего отрезка глаза [29, 50, 51]. R. Brooks [52] и D. Parke и соавт. [53] описано 38 и 32 соответственно случаев гематогенного распространения Candida albicans, приводивших к возникновению эндофтальмитов.
Лимфогенный путь. Лимфатическая система находится в тесной связи с кровеносной, принимая активное участие в обменных процессах, а также обеспечивая защитную функцию организма от инфекционного и интоксикационного воздействий. От фокальных очагов инфекции бактерии, вирусы и грибы способны по афферентным лимфатическим сосудам достигать лимфатических узлов (ЛУ). Далее инфекция распространяется от пораженного ЛУ к следующему ЛУ по эфферентным лимфатическим сосудам, достигая глубоких ЛУ и попадая в кровеносное русло [54].
По данным Y. Shinomura и S. Higaki [55], ВПГ обладает не только тропизмом к нервной ткани и эритроцитам, но и способностью к сохранению и размножению в лейкоцитах и лимфоцитах, что приводит к дальнейшей реактивации вируса при определенных условиях. Инфицированные ВПГ лейкоциты и лимфоциты обеспечивают последующее его распространение по ходу лимфатических сосудов, поражая близлежащие структуры.
От перикорнеального лимфатического кольца лимфа оттекает в сторону экватора, в густую сеть широко анастомозирующих между собой извитых лимфатических сосудов. Первыми Л.У. для конъюнктивальных лимфатических сосудов являются околоушные; кроме того, установлены дренажные связи конъюнктивального лимфооттока с подчелюстными и шейными ЛУ. В подчелюстные ЛУ осуществляется отток от всех зубов, кроме нижних резцов и верхних третьих моляров (для них отток лимфы идет в глубокие ЛУ шеи). Таким образом, подчелюстные и шейные ЛУ могут быть связующим звеном лимфооттока от зубов и глаз [56].
Заключение
Многочисленные наблюдения врачей разных специальностей (офтальмологов, стоматологов), изложенные в настоящем обзоре, подтверждают существование несомненной взаимосвязи очагов одонтогенной инфекции и воспалительных заболеваний глаз.
По данным литературы, фокальные очаги инфекции оказывают раздражающее или токсическое воздействие на вторую и третью ветви тройничного нерва, вызывая рефлекторное раздражение ганглия тройничного нерва, являющегося резервуаром для вируса герпеса. Вирус простого герпеса, имеющий тропность к нервной ткани и эритроцитам, распространяется из ганглия тройничного нерва по глазничной ветви тройничного нерва нейрогенным, а также гематогенным путем. Таким образом, инфекция через сосуды и нервы в супрахориоидальном пространстве достигает переднего отрезка глаза. Гематогенный путь распространения микробной инфекции возможен благодаря анастомозу верхней и нижней глазных вен с угловой и лицевой венами. Лимфатический путь распространения предположительно осуществляется через подчелюстные и шейные лимфатические узлы, которые служат общим звеном в системе оттока лимфы от зубов и глаз.
Знание того, что одонтогенные очаги инфекции являются потенциальными триггерами возникновения и развития тяжелых воспалительных заболеваний глаз, обеспечит стоматологам и офтальмологам повышение качества своевременной дифференциальной диагностики с установлением этиологии заболевания, эффективность лечения и предупреждение рецидивов данных тяжелых заболеваний.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
КАК ЦИТИРОВАТЬ:
Важно, чтобы серьезно разрушенные или поврежденные зубы были обработаны как можно скорее. Несвоевременное лечение зуба может привести к инфекции корневого канала. В нашей стоматологии вы можете получить как профилактическую помощь, так и лечение корневых каналов (эндодонтическое лечение) инфицированных зубов.
Наша команда хотела бы рассказать вам основы инфекций корневых каналов и наиболее распространенные признаки и симптомы.
Что такое инфекция корневых каналов?
Инфекция корневого канала включает инфекцию пульпы, расположенной внутри зуба. Когда эта мякоть заражена, это может вызвать зубную боль и абсцессы зубов. Распространение инфекции корневого канала может нанести серьезный вред челюстной кости, ткани десны и смежным зубам, поэтому важно, как можно скорее взять под контроль проблему.
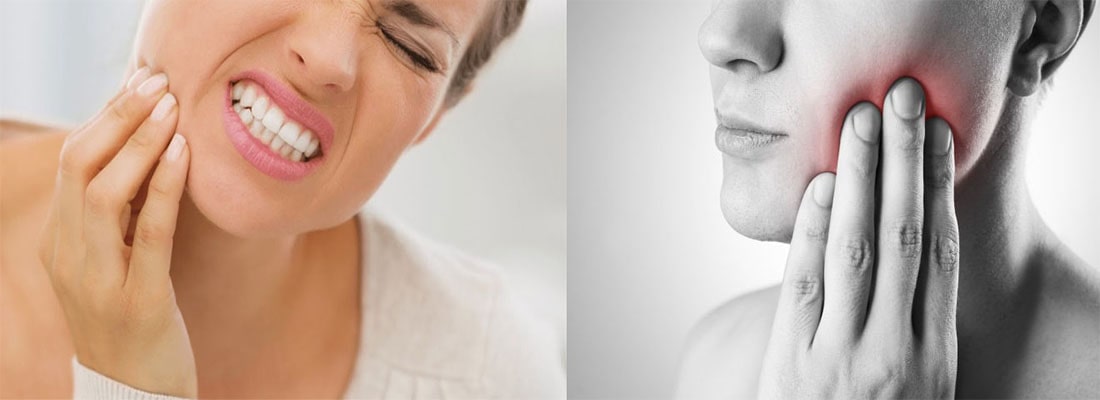
Что вызывает инфекции корневых каналов?
Бактерии обычно находятся во рту. Инфекции возникают, когда кариес или разрушение эмали и дентина зуба позволяют бактериям получить доступ к мякоти внутри зуба. Распространенные причины обычно включают плохую гигиену полости рта и травмы рта.
Чувствительность зубов
Многие люди, у которых начинается инфекция, заметят, что их зубы чувствительны к горячим и холодным температурам. Имейте это в виду, наслаждаясь едой или напитками.
Боль и дискомфорт
Чувствительность зубов может перерасти в серьезную боль и дискомфорт. Многие пациенты, которые приходят в нашу клинику с жалобами на зубную боль, узнают, что они страдают от инфекции корневого канала.
Нежность и отек десен
По мере того, как инфекция пульпы зуба ухудшается, это приводит к набуханию ткани десны вокруг зуба. Чувствительность десен не редкость для людей с инфекциями корневых каналов.
Изменение цвета пораженного зуба
По мере прогрессирования заболевания зуб может стать обесцвеченным. Обычно зараженный зуб становится темнее. Инфекция внутренних структур зубов обычно приводит к потемнению или пожелтению внешнего цвета зуба.
Хроническое неприятное дыхание
Серьезный неприятный запах изо рта не редкость для людей, страдающих от данного заболевания. Это также может быть признаком развития зубного абсцесса. Если вы заметили комбинацию вышеперечисленных симптомов, вам необходимо как можно скорее обратиться к стоматологу.
Лечение зараженного зуба
При лечении инфекции корневого канала важно удалить инфицированную пульпу зуба. Затем стоматолог стерилизует и заполняет камеру пульпы, чтобы уничтожить все бактерии и контролировать инфекцию. Обработанный зуб будет закрыт коронкой, чтобы пациенты могли снова кусать и жевать.
Если вам нужна дополнительная информация о лечении инфицированных зубов и восстановлении здоровья и хорошего самочувствия зубов, обязательно свяжитесь с нашей квалифицированной командой стоматологов.
Кафедра инфекционных болезней и эпидемиологии, ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
Лаборатория патогенеза и методов лечения инфекционных заболеваний отдела клинической медицины НИМСИ, Москва
Инфекции в стоматологии
Журнал: Стоматология. 2014;93(1): 64‑71
Шестакова И.В., Ющук Н.Д., Балмасова И.П. Инфекции в стоматологии. Стоматология. 2014;93(1):64‑71.
Shestakova IV, Yushchuk ND, Balmasova IP. Oral infections. Stomatologiya. 2014;93(1):64‑71. (In Russ.).
Кафедра инфекционных болезней и эпидемиологии, ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
В обзоре проанализированы основные аспекты инфекционной патологии, встречающиеся в работе стоматолога. Подробно описана внутрибольничная инфекция, вызванная условно-патогенной флорой. Дана клиническая характеристика проявлений в полости рта основных «традиционных" инфекционных заболеваний.
Кафедра инфекционных болезней и эпидемиологии, ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
Лаборатория патогенеза и методов лечения инфекционных заболеваний отдела клинической медицины НИМСИ, Москва
По нашему твердому убеждению, найти решение этой проблемы можно лишь сообща с привлечением специалистов из разных областей знаний. Ведь сущность инфекционной патологии как медицинской проблемы заключается не только в риске эпидемий и утяжелении течения острых инфекционных болезней. Сегодня ни для кого не секрет, что на первый план выходят длительно персистирующие инфекции со скудными клиническими проявлениями, возбудители которых выполняют этиологическую или триггерную роль в развитии гематологических, онкологических, неврологических, стоматологических заболеваний, поражения почек, печени, суставов и др. [7, 8, 12, 15-18, 21, 23]. Необходимость глубокого понимания вопросов инфекционной патологии и инфекционной безопасности врачами различных специализаций - насущная, жизненно важная проблема.
В настоящее время доля лиц с отягощенным преморбидным фоном среди пациентов стоматологов достигает 93,3%. Наиболее часто среди них встречаются лица с инфекционной патологией (острыми и хроническими гнойно-септическими заболеваниями, вирусными гепатитами, герпесвирусной инфекцией, ВИЧ-инфекцией, микозами и др.), пищевой и лекарственной аллергией, часто болеющие острыми респираторными вирусными инфекциями (ОРВИ) и пр. Причем в большинстве случаев пациенты даже не подозревают о наличии у них той или иной болезни, а в условиях временноݩго цейтнота стоматологического приема врачу получить исчерпывающую информацию о состоянии здоровья пациента крайне трудно. Следовательно, любой пациент, обратившийся за стоматологической помощью, должен рассматриваться врачом-стоматологом как представляющий эпидемиологическую опасность независимо от степени риска заражения!

Из основных групп ВБИ в стоматологии наиболее актуальны инфекции операционных ран и кровотока [6], развивающиеся в результате реализации гемоконтактного механизма передачи (через медицинские манипуляции) или контактного механизма, при котором возбудители, локализующиеся на коже и ее придатках, слизистой оболочке глаз, полости рта, поверхности ран одного пациента, инфицируют другого пациента при их прямом контакте или через обсемененные предметы госпитальной среды. Необходимо помнить о возможности перекрестного инфицирования пациентов и профессионального заражения медицинского персонала в результате реализации воздушно-капельного и контактного механизма передачи инфекции. Вероятные пути передачи инфекции от пациента к пациенту при стоматологических вмешательствах представлены в виде эпидемиологической цепочки (рис. 1, см. на цв. вклейке). Рис. 1. Возможные пути передачи инфекции от пациента к пациенту при стоматологических вмешательствах.
К современным факторам, способствующим росту ВБИ в стоматологической практике, следует отнести:
- сложившуюся эпидемиологическую ситуацию по ВИЧ-инфекции, вирусным гепатитам, герпесвирусным инфекциям и др.;
- распространение потребления парентеральных психотропных препаратов;
- быстрый рост устойчивости микроорганизмов к противомикробным препаратам вплоть до мультирезистентности (например, M. tuberculosis, грамотрицательные бактерии);
- распространение резистентных штаммов среди пациентов лечебно-профилактического учреждения в отсутствие эффективных программ инфекционного контроля;
- широкое использование инвазивных методов диагностики и лечения;
- создание крупных высокотехнологичных медицинских комплексов со специфической микроэкологией;
- трудности дезинфекции и стерилизации сложной медицинской аппаратуры;
- неблагополучная экологическая обстановка;
- увеличение среди пациентов числа лиц с проявлениями вторичного иммунодефицита.
Описаны экзогенные (первичные) и эндогенные (вторичные) источники инфицирования при стоматологических вмешательствах. При экзогенном инфицировании источником инфекции являются пациенты и медицинский персонал, инфицированные патогенными и условно-патогенными микроорганизмами. Под эндогенным инфицированием следует понимать активацию латентной инфекции под воздействием стрессовых воздействий (страх, обострение хронических заболеваний, ОРВИ и др.) и аутоинфицирование, этиологическими факторами которых в 85% случаев являются представители условно-патогенной флоры [1, 4].
Особого внимания заслуживает эндогенное инфицирование, легкость реализации которого объясняется чрезвычайно богатой аухтонной и аллохтонной микрофлорой слизистой, значительно варьирующейся у разных людей, а также у одного и того же человека в разное время. Представителями аухтонной микрофлоры являются резидентные микроорганизмы (от 160 до 300 видов; до 100 видов может быть выделено из 1 участка, из которых не менее 30 видов - постоянно живущие) и транзиторные микроорганизмы, состав которых зависит от факторов внешней среды (потребляемые продукты и вода, гигиенические процедуры и др.). Представители аллохтонной флоры попадают в полость рта из других микробиоценозов (из кишечника, носоглотки, дыхательных путей и др.). В результате исследований, проведенных в 2003 г. Л.П. Зуевой и соавт., было показано, что более 1/3 больных являются носителями Staphylococcus aureus, 10% штаммов которого устойчивы к 5 и более антибактериальным препаратам (рис. 2, см. на цв. вклейке). Рис. 2. Представители микрофлоры полости рта, носа и зева, выявленные у пациентов, обратившихся за стоматологической помощью в отделение челюстно-лицевой хирургии. По результатам многолетних исследований J. Prieto-Prieto, A. Calvo и T. Kuriyama и соавт., в спектре одонтогенных бактерий среди анаэробов преобладают Peptostreptococcus, Prevotella и Fusobacterium, среди аэробов - Str. viridians (рис. 3, см. на цв. вклейке) Рис. 3. Спектр одонтогенных бактерий (Kuriyama и соавт., 2002; Prieto-Prieto J., Calvo A., 2004). [13, 19]. По данным А.А. Зорькина и соавт. (2009), наиболее часто при воспалительных процессах в полости рта выявляют Actinobacillus actinomycetemcomitans и Porphyromonas gingivalis, реже - Bacteroides forsythus, Prevotella intermedia, Prevotella nigrenscens, Fusobacterium spp., Peptococcus micros, Carnocytophaga spp., Treponema denticola, Treponema sokranskii. Типичные возбудители одонтогенных инфекций - Peptostreptococcus spp., Peptococcus spp., Fusobacterium spp., инфекций пародонта - A. actinomycetemcomitans, P. gingivalis, Pr. intermedia, Eikenella corrodens, Fusobacterium nucleatum (особенно при тяжелых инфекциях).
Практикующим врачам важно помнить, что разнообразие микроорганизмов создает уникальные возможности для передачи детерминант вирулентности и резистентности, резервуаром которых является нормальная микрофлора [9, 20]. Описана возможность обмена генетической информацией между бактериями мочеполовых путей и полости рта, а в лабораторных условиях - между таксономически отдаленными видами микроорганизмов [9].
Инфекционные агенты тканей полости рта, от коммесалов до патогенов, играют этиологическую роль не только в запуске стоматологических заболеваний (кариеса, пародонтита, гингивита и др.). Нарушенная при стоматологических процедурах, травмах, инфекциях целостность барьера мягких тканей полости рта приводит к транзиторной бактериемии (фунгемия, виремия) и попаданию микроорганизмов в не свойственные им ткани (например, соединительную ткань, кровь), в результате чего индуцируются системные изменения экспрессии генов, приводящие к повышению вирулентности инфекционных агентов. Становясь эндогенными патогенами, микроорганизмы могут выполнять триггерную роль в формировании патологии пищеварительной, дыхательной, сердечно-сосудистой (ДВС-синдром, инфекционный эндокардит, атеросклероз) систем, ревматизма, нефропатии, многих инфекционно-аллергических состояний, аутоиммунных болезней (ревматоидный артрит - РА, болезнь Бехчета и др.) [10, 11, 20]. Так, доказано, что у S. sanguinis, S. oralis, S. mutans, S. salivarius достаточно конститутивной экспрессии генов вирулентности, чтобы при попадании в кровоток индуцировать связывание тромбоцитами фибриногена, агрегацию и образование тромба, а при оседании на измененных или аномально развитых клапанах приводить к развитию инфекционного эндокардита. Изменение вирулентности может происходить под действием генов, регулируемых кислотностью среды, в которую попадают микроорганизмы. Так, при повышении pH до 7,3-7,5 у S. gordonii возрастает тромбиноподобная активность. При контакте с ламинином и коллагеном поврежденных клапанов сердца S. gordonii запускают экспрессию ламининсвязывающего белка, повышающего адгезию бактерий к поверхности клапана [11].
Интересен феномен бактериальной мимикрии у представителей микрофлоры полости рта. Так, сходство эпитопа белка клеточной стенки S. sanguinis - PAAP, связанного с агрегацией тромбоцитов, с артритогенным эпитопом коллагена типа II, может быть одной из причин развития РА. Образуемый в норме у человека белок теплового шока (HSP60) высокогомологичен бактериальным HSP Mycobacterium (HSP65), S. sanguinis (HSP65), Helicobacter pylori (HSP60). Образующиеся антитела к ним перекрестно реагируют с развитием системной воспалительной реакции и через активацию системы комплемента приводят к иммунному воспалению в стенке сосудов, артриту, болезни Бехчета [14].
Следует признать, что проявления даже хорошо известных инфекционных болезней могут меняться на фоне хронических заболеваний пациента или при ко-инфицировании, приобретая несвойственные им черты, что затрудняет их клиническую диагностику и требует своевременного лабораторного обследования.
Кроме представленных в таблице инфекционных заболеваний, существует обширная группа вирусных инфекционных болезней, не имеющих характерных патологических проявлений в полости рта, но передающихся гемоконтактно при стоматологических вмешательствах, что ведет к развитию угрожающих жизни заболеваний пациентов и медицинского персонала (вирусный гепатит В, С, Д; цитомегаловирусная инфекция; Эпштейна-Барр вирусная инфекция - кроме описанных выше инфекционного мононуклеоза и опоясывающего герпеса; герпесвирусная инфекция, вызванная HHV-6, HHV-7, HHV-8 типом, и др.).
Все вышесказанное свидетельствует о большой роли инфекционных агентов в патологии человека в целом и в стоматологической практике, в частности. Врач-стоматолог в любой момент может встретиться с инфекционным больным. От его эрудиции и знаний нередко зависят жизнь пациента и своевременное пресечение эпидемического процесса, позволяющее предупредить перекрестное заражение и инфицирование медицинского персонала при оказании стоматологической помощи.
Одонтогенная инфекция – это любой вторичный инфекционный процесс, источником которого служит воспаление околозубных тканей. Включает такие нозологии как одонтогенный периостит, остеомиелит, синусит, флегмоны головы и шеи, лимфаденит и др. Проявляется общей (интоксикация, лихорадка) и местной симптоматикой (боль, припухлость пораженной области, гнойные выделения, затруднение жевания и глотания). Патология диагностируется на основании стоматологического осмотра, рентгенологических данных, УЗИ, КТ, микробиологических посевов. Лечение – санация полости рта, антибиотикотерапия, дезинтоксикация, вскрытие и дренирование гнойных очагов.
МКБ-10


Общие сведения
Одонтогенные инфекции (ОИ) – это острые или хронические гнойно-воспалительные заболевания, причиной которых становятся патологические процессы в тканях зуба (периодонте). Из стоматогенного очага микроорганизмы могут распространяться не только на близлежащие структуры (надкостницу, челюстную кость, придаточные пазухи), но и на органы и ткани, удаленные от источника инфекции (шею, средостение, оболочки головного мозга). Частота острых одонтогенных процессов среди инфекционных поражений ЧЛО достигает 69,5%. Одонтогенные инфекции являются предметом изучения клинической стоматологии, ЧЛХ, отоларингологии.

Причины
Микробная флора, вызывающая одонтогенную инфекцию, чаще представлена кокками (β-гемолитическим стрептококком, пептострептококком, золотистым стафилококком, превотеллами, фузобактериями). Также из очагов инфекции могут высеваться бактероиды, актиномицеты, спирохеты, протей, клостридии, кандиды. Микробный пейзаж при одонтогенных инфекциях обычно носит смешанный характер.
Источниками ОИ выступают различные локальные патологические процессы в полости рта. Чаще всего ими становятся дефекты твердых зубных тканей и периодонта:
- глубокий кариес;
- абсцессы полости рта: пульпарный (гнойный пульпит), пародонтальный, периапикальный;
- хронический гангренозный пульпит;
- острый апикальный или хронический периодонтит;
- нагноившаяся киста зуба, одонтома;
- перикоронарит;
- альвеолит.
Иногда спровоцировать манифестацию одонтогенной инфекции могут стоматологические манипуляции: эндодонтическое лечение, травматичное удаление зуба, синус-лифтинг, дентальная имплантация. При неправильном проведении эти процедуры способствуют перфорации верхнечелюстной пазухи, попаданию в синусы инородных предметов (осколков зубов, пломбировочных материалов), образованию незаживающих ороантральных свищей, поддерживающих инфекционный процесс.
Факторы риска
Пусковыми факторами, приводящими к развитию одонтогенных патологических процессов, могут являться переохлаждение, переутомление, стрессы, кровопотеря, инсоляция. ОИ чаще развиваются у пациентов с отягощенным соматическим фоном. Наибольшее значение имеют следующие сопутствующие патологии:
- сахарный диабет;
- ХНЗЛ;
- инфекции (грипп, туберкулез, гепатит, ВИЧ);
- онкологические заболевания;
- химические зависимости (алкогольная, наркотическая, токсическая).

Патогенез
На развитие одонтогенной инфекции влияют вирулентность и количество микроорганизмов в первичном очаге, а также состояние макроорганизма. Распространение инфекционных патогенов из первичного стоматогенного очага в большинстве случаев происходит контактным путем. При определенных условиях (высокая степень патогенности, снижение местной и общей резистентности) возбудители проникают в лимфатическое и кровеносное русло, мигрируют по организму.
В области инфекционного очага в полости рта создаются условия для беспрепятственного размножения микроорганизмов (венозный застой, отек, ишемия тканей). Через верхушку корня зуба патогены могут выходить за пределы очага через межмышечное, поднадкостничное, клетчаточное пространство. Так возникают одонтогенные периоститы, оститы, гаймориты, остеомиелиты.
Кроме этого, микробные токсины вызывают усиление сосудистой проницаемости, что в условиях хорошей васкуляризации околочелюстных тканей облегчает проникновение бактериальных агентов в сосудистое русло. Таким путем формируются околочелюстные абсцессы и флегмоны. Оседание микроорганизмов в лимфатических узлах при нарушении барьерной функции последних сопровождается развитием регионарного лимфаденита.
Симптомы одонтогенной инфекции
Одонтогенный периостит
В зависимости от клинического течения периостит может быть острым (серозным, гнойным) либо хроническим (простым, гиперпластическим). В области пораженного зуба – вероятного источника инфекции – ощущается боль, иррадиирущая в ухо, висок. Нередко визуально заметна припухлость щеки, асимметрия лица за счет одностороннего отека мягких тканей. Затруднено открывание рта.
При одонтогенном периостите страдает общее самочувствие: беспокоит слабость, фебрильная температура, головная боль, нарушение сна и приема пищи. Регионарные лимфоузлы увеличены и болезненны.
Одонтогенный остеомиелит
Чаще диагностируется у мужчин в возрастной группе 20-40 лет, в 68% случаев поражает нижнюю челюсть. На фоне резко выраженного интоксикационного синдрома беспокоит интенсивная локальная боль в зубе или разлитая боль во всей челюсти, которая распространяется на соответствующую половину головы. Конфигурация лица изменена за счет припухлости на стороне воспаления.
Отмечаются трудности при открывании рта, боль при пережевывании и глотании пищи, нарушение речевой функции, парестезии верхней или нижней губы. Может ощущаться гнилостный запах изо рта. Температурная кривая при одонтогенном остеомиелите колеблется от 37,5 до 39-40°С.
Одонтогенный синусит
На долю одонтогенного гайморита приходится от 10 до 30% случаев всех инфекций верхнечелюстных пазух. Острый синусит манифестирует с головной боли, температурной реакции, ощущения давления в проекции соответствующей пазухи. Нарастает отечность полости носа, затрудняется дыхание, снижается обоняние. Через некоторое время из пазухи начинает отделяться слизисто-гнойный или гнойный секрет. Мягкие ткани подглазничной области и щеки выглядят припухшими.
Одонтогенные абсцессы и флегмоны
Около 57% гнойных инфекций мягких тканей головы и шеи имеют стоматогенную этиологию. Одонтогенные абсцессы обычно локализуются в подглазничной, щечной, подчелюстной, околоушной области. Сопровождаются появлением припухлости в области лица или шеи, гиперемией кожи над гнойником. При поверхностном абсцессе ощущается симптом флюктуации. Отмечается локальная боль и пульсация в проекции гнойника. Признаки интоксикации выражены умеренно.
По локализации выделяют одонтогенные флегмоны дна полости рта, подчелюстного, подподбородочного, окологлоточного пространства, области шеи. Возникает припухлость мягких тканей без четких границ с наличием плотного болезненного инфильтрата. Боль самопроизвольная, разлитая, присутствует постоянно. В зависимости от локализации флегмоны нарушается жевание, глотание, дыхание, речь. Характерно выраженное ухудшение общего самочувствия, фебрильная лихорадка, ознобы.
Одонтогенный лимфаденит
Обычно развивается в области подчелюстных или шейных лимфоузлов. Характеризуется их локальной припухлостью, болезненностью, плотной консистенцией. Возникает асимметрия лица. При абсцедировании лимфоузлов повышается температура тела, появляется озноб, недомогание. При пальпации гнойного очага ощущается флюктуация.
Осложнения
Одонтогенные инфекции могут становиться источником тяжелых септических заболеваний. При нагноении лимфоузлов развивается аденофлегмона, а при хронизации воспаления – подкожная одонтогенная гранулема. Инфекции верхней челюсти чреваты формированием флегмоны глазницы, которая может привести к панофтальмиту и слепоте. Инфекционные процессы в области нижней челюсти выступают причиной гнойного медиастинита.
Крайне опасными по своим последствиям являются одонтогенные внутричерепные осложнения: абсцесс мозга, менингит, тромбоз пещеристого синуса. Из кардиальных осложнений наиболее часто развивается бактериальный эндокардит. Любой очаг ОИ может послужить источником одонтогенного сепсиса.
Диагностика
Одонтогенные инфекции диагностируются на основании выявления их связи с заболеваниями зубов (запущенный кариес, пульпит, периодонтит) или стоматологическими манипуляциями/операциями. Пациенты нуждаются в консультации стоматолога-терапевта, стоматолога-хирурга, челюстно-лицевого хирурга, врача-отоларинголога. В зависимости от клинической картины одонтогенной инфекции выполняется:
- Стоматологический осмотр. В полости рта удается обнаружить первичный очаг, повлекший за собой прогрессирование гнойного воспаления. Это может быть сильно разрушенный зуб, воспаленная лунка, воспалительный инфильтрат с флюктуацией или без, свищ на десне с гнойным отделяемым и т.д. При этом пальпация и перкуссия области поражения болезненна, десна отечна, гиперемирована (иногда цианотична), зубы подвижны.
- Рентген. Для оценки местных изменений зубных и костных тканей выполняется ОПТГ, рентгенография челюсти, придаточных синусов, мягких тканей шейной области. При планировании оперативного вмешательства рентгеновская диагностика дополняется КТ и МРТ соответствующих областей.
- ЛОР-осмотр. Наряду с рентгеновской визуализацией выполняется эндоскопическое обследование: риноскопия, эндоскопия носа, синусоскопия. При необходимости прибегают к диагностической пункции верхнечелюстной пазухи.
- Сонография. При развитии гнойного лимфаденита, флегмон, медиастинита осуществляют УЗИ лимфоузлов, околоносовых пазух, мягких тканей, средостения. Для исключения поражения сердца выполняют ЭхоКГ.
- Лабораторные анализы. При любых одонтогенных инфекциях исследуется общий анализ крови, маркеры воспаления (прокальцитонин, СРБ, фибриноген и др.). Производится забор и бакпосев материала из инфекционного очага, посев крови на гемокультуру.
Дифференциальная диагностика
При подозрении на одонтогенное инфицирование мягких тканей необходимо исключить неодонтогенные патологические процессы: рожистое воспаление, фурункулы и карбункулы, сиаладенит, аденофлегмоны и лимфадениты иной этиологии. Остеомиелиты челюстей дифференцируют посттравматическими, гематогенными формами заболевания. Также исключают синуситы риногенного, травматического, аллергического генеза.

Лечение одонтогенных инфекций
Хирургическое лечение
Лечение любых форм ОИ необходимо начинать с устранения первичного патологического очага. При этом может выполняться лечение пульпита или периодонтита, удаление зуба или импланта, вскрытие абсцесса, резекция верхушки корня. В дальнейшем проводится активное лечение вторичной патологии. При необходимости осуществляется госпитализация пациента в отделение челюстно-лицевой хирургии.
Консервативная терапия
Параллельно с хирургическими мероприятиями назначают массивную антибиотикотерапию с учетом выделенной микрофлоры, по показаниям вводят антимикотические препараты. Не утратили своей актуальности при одонтогенных инфекциях сульфаниламиды, нитрофураны. Проводят дезинтоксикационную, десенсибилизирующую терапию, витаминотерапию. В рамках иммунокоррекции вводят нативную и гипериммунную плазму, гамма-глобулин, осуществляют аутогемотерапию.
Прогноз и профилактика
Своевременное комплексное лечение предопределяет благоприятный исход одонтогенной инфекции. Генерализация гнойно-воспалительного процесса чревата формированием тяжелейших по своим последствиям осложнений. Существенное влияние на прогноз оказывает противоинфекционная резистентность организма, общее состояние здоровья. Профилактика одонтогенных инфекций заключается в регулярном санировании полости рта, ликвидации очагов стоматогенной инфекции, выполнении стоматологических манипуляций в строгом соответствии с протоколом.
1. Одонтогенная инфекция: существующие проблемы/ Матчин А.А.// Оренбургский медицинский вестник. – 2015.
2. Одонтогенные инфекции головы и шеи/ М. Тримарки, А. Галли, П. Каппаре и др.// Journal of Osseointegration. - 2019;11(1).
3. Совершенствование диагностики тяжелых осложнений острой одонтогенной инфекции/ Харитонов Ю.М., Громов А.Л.// Актуальные проблемы медицины. – 2011.
4. Клинико-функциональная характеристика пациентов с острыми одонтогенными воспалительными заболеваниями/ Романенко И.С., Конев С.С., Гандылян К.С., Караков К.Г., Карпова Е.Н., Апагуни А.Э.// Современные проблемы науки и образования. – 2015. – №4.
Читайте также:
- Микробы холеры паразитируют
- О внедрении методических рекомендаций мероприятия инфекционной безопасности в лечебно-профилактических
- Невосприимчивостью к инфекционным заболеваниям обладают люди у которых
- Профилактика туберкулеза информационный лист для населения
- Грибы лисички от рака туберкулеза рецепт

