Инфекции респираторного тракта у детей
Обновлено: 28.04.2024
Респираторные инфекции у детей: причины, классификация
Респираторные заболевания, сопровождающиеся нарушением дыхательных функций:
• составляют 50% консультаций у врачей общей практики по поводу острых заболеваний у детей младшего возраста и треть — у детей старшего возраста;
• приводят к 20-35% госпитализаций в детские стационары по поводу острых заболеваний, некоторые из них угрожают жизни;
• астма — наиболее распространённое хроническое заболевание у детей в Великобритании;
• MB — наиболее распространённое врождённое, ухудшающее качество жизни расстройство у представителей европеоидной расы.
Респираторные инфекции - это наиболее часто встречающиеся инфекции в детском возрасте. Ребёнок дошкольного возраста болеет респираторными инфекциями в среднем от 6 до 8 раз в год. Большинство из них составляют лёгкие самоограничивающиеся заболевания верхних дыхательных путей (уха, горла, носа), но некоторые, такие как бронхиолит или пневмония, потенциально угрожают жизни.
Причины респираторных инфекций у детей
Вирусы вызывают 80-90% детских респираторных инфекций. Наиболее важными из них считают РСВ, риновирусы, вирус парагриппа, метапневмовирус и аденовирусы. Отдельный вирус может вызвать несколько различных типов заболеваний, например РСВ может вызывать бронхиолит, круп, пневмонию или обычную простуду.
Важные бактериальные патогены респираторного тракта — Streptococcus pneumoniae (пневмококк) и другие стрептококки, Haemophilus influenzae, Bordetella pertussis, вызывающая коклюш, и Mycoplasma pneumoniae. Могут возникать двойные инфекции — с двумя вирусными возбудителями или вирусным и бактериальным возбудителем. Важным патогеном остаётся Mycobacterium tuberculosis.
Некоторые возбудители вызывают предсказуемые эпидемии, такие как РСВ-бронхиолиты каждую зиму, тогда как другие, например пневмококк, демонстрируют небольшие сезонные колебания.

Факторы организма и среды приводящие к респираторным инфекциям у детей
Повышенный риск симптоматической респираторной инфекции связан со следующими факторами:
• низким социально-экономическим статусом (например, перенаселённое влажное жильё и плохое питание);
• многодетные семьи;
• курением родителей, особенно матери;
• полом: мальчики болеют чаще, чем девочки;
• недоношенностью, особенно если требуется ИВЛ или длительная оксигенотерапия;
• MB;
• врождёнными аномалиями сердца или лёгких;
• иммунодефицитом (редко) — как врождённым (например, гипогаммаглобулинемия), так и приобретённым (например, как результат лечения злокачественного новообразования или ВИЧ-инфекции).
Возраст ребёнка влияет на распространённость и тяжесть инфекций. В грудном возрасте распространены тяжёлые заболевания, требующие госпитализации, и существует наибольший риск смерти. Отмечают повышение частоты инфекций, когда ребёнок или его старшие братья или сестры начинают посещать детский сад или школу. Повторные инфекции верхних дыхательных путей бывают обычным явлением и редко указывают на первичное заболевание.
Классификация респираторных инфекций
Респираторные инфекции классифицируют в соответствии с наиболее поражённым уровнем дыхательных путей:
• инфекция верхних дыхательных путей;
• инфекция гортани и/или трахеи;
• бронхит;
• бронхиолит;
• пневмония.
Видео этиология, патогенез инфекции верхних дыхательных путей
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Зайцева С.В., Зайцева О.В. Острые респираторные инфекции у детей: этиопатогенетические возможности современной терапии. РМЖ. 2014;21:1520.
В мире все больше внимания уделяется проблеме возникновения новых штаммов вирусов, обладающих большой токсигенностью. В работах последних лет появились данные о новых респираторных вирусах, способствующих развитию тяжелых ОРВИ. Получены доказательства участия метапневмовируса и бокавируса в развитии тяжелого бронхообструктивного синдрома у детей первых лет жизни. Длительное проспективное исследование, выполненное в Vanderbilt University (Нашвилл, США) с 1976 по 2001 г., выявило особую роль метапневмовируса в структуре ОРЗ у детей первых лет жизни. В ходе исследования было показано, что метапневмовирус часто способствует развитию бронхиолита (59%), крупа (18%) и пневмонии (8%), а в 15% случаев вызывает обострение бронхиальной астмы. В последующем исследовании, проходившем в 2003–2009 гг. в 3 штатах США, было установлено, что метапневмовирус вызывает 12% инфекций нижних отделов дыхательных путей у детей. Заболевания, вызванные этим вирусом, особенно тяжело протекают у детей первых лет жизни. Именно им часто требовались кислородная поддержка, а также длительное лечение в отделениях интенсивной терапии [30].
Первоначально проникновению вирусов в организм противостоят кожа (эпидермис, жирные и молочная кислоты, рН) и слизистые (эпителий, ингибиторные компоненты слизи, рН). Именно полноценность данного барьера нередко препятствует внедрению вирусов. Однако в детском возрасте существующие анатомо-функциональные особенности создают предпосылки к проникновению инфекции. Среди них можно отметить повышенную ранимость слизистых, высокую васкуляризацию, гипертрофию лимфоидной ткани, узость проводящих отделов респираторного тракта и особенности его аэрации. Частые рецидивы ОРЗ являются еще одним фактором, который способствует внедрению возбудителей.
Если прикрепление и проникновение вируса в клетку все же состоялись, то в ответ на его внедрение в организме происходят многоэтапные изменения с участием молекул, клеток и органов, регуляторных и эффекторных систем. Основной их целью является эффективное отражение возникшей угрозы. На ранних этапах инфекции они носят неспецифический характер. К факторам иммунологической неспецифической противовирусной защиты относятся гуморальные (интерфероны (ИФН), интерлейкины, хемокины, система комплемента, естественные антитела) и клеточные (toll-like рецепторы, рецепторы цитокинов, натуральные киллеры – NK-клетки, моноциты и макрофаги, дендритные клетки (ДК)) факторы.
Противовирусный ответ иммунной системы начинается с распознавания вирусных агентов toll-like рецепторами. Общим свойством всех toll-like рецепторов является их способность взаимодействовать со структурами инфекционного агента. Результаты этого взаимодействия – формирование и проведение активационного сигнала, ведущего к усилению защитных неспецифических механизмов организма. Так, установлено, что toll-like рецепторы участвуют в индукции биосинтеза 3-х основных классов ИФН, являющихся важнейшим звеном защиты врожденного иммунитета [29, 40].
ИФН не обладают прямым противовирусным эффектом, а проявляют активность, воздействуя на клетки. Этим и объясняются множественные биологические эффекты, которые вызывают ИФН. Антивирусные свойства более всего присущи ИФН-α и ИФН-β. ИФН-γ является модулятором активности клеток иммунной системы. Отличительная особенность ИФН – возможность ингибировать внутриклеточные этапы репродукции вирусов в зараженных клетках и обеспечивать невосприимчивость к вирусам окружающих здоровых клеток. Попадая из ворот инфекции в кровь, ИФН распределяются по организму, предотвращая последующую диссеминацию вирусов [12, 13].
Еще одной важной составляющей защиты врожденного противовирусного иммунитета являются лимфоциты – NK–клетки. Противовирусный эффект этих клеток неспецифичен. В их цитоплазме содержатся гранулы с белком перфорином, вызывающим образование в мембранах клеток-мишеней пор, и гранзимами (белками, инициирующими апоптоз). Эти гранулы высвобождаются из цитоплазмы клеток в процессе взаимодействия с клетками, инфицированными вирусом. В результате происходит гибель клеток-мишеней. Установлено, что именно на ранних стадиях вирусной инфекции наблюдается процесс интенсивного увеличения содержания NK-клеток в периферической крови больных [35].
Первые этапы гуморального иммунного ответа на инфекцию соответствуют инкубационному периоду. Именно в конце инкубационного периода и в продромальном периоде у инфицированных лиц синтезируются вирус-специфические иммуноглобулины IgM класса, составляя основу первичного иммунного ответа. Продукция антител начинается довольно быстро, и за 1–2 нед. их уровень достигает высоких значений и в 2–8 раз превосходит таковой антител IgG изотипа. К концу 2–3 нед. содержание IgM и IgG антител в сыворотке крови практически одинаково. Содержание антител IgM изотипа некоторое время еще остается на том же уровне, а затем в течение 20–30 дней резко снижается, и через 1–3 мес. после завершения инфекции они могут полностью исчезнуть.
Для благоприятного исхода вирусной инфекции иммунной системе ребенка необходимо интенсивно продуцировать молекулы антител в количествах, многократно превышающих содержание вирионов и вирусных антигенов. В таких случаях содержание вирусных частиц быстро снижается, угасают клинические симптомы инфекции. В последующем вирус-специфические видо- и серотип-специфические IgG антитела остаются основным изотипом антител, осуществляющим контроль инфекции во внутренней среде организма. Однако надо учитывать, что протективная активность противовирусных антител обусловлена преимущественно их нейтрализующей активностью в отношении вирионов, находящихся внеклеточно. Они агглютинируют вирусные частицы, вызывают конформационные изменения поверхностных белков вириона, препятствуют их взаимодействию с рецепторами клеток. Это в свою очередь сопровождается значительным уменьшением количества вновь инфицированных клеток в организме и вирусных частиц как в органах, так и в крови. Некоторые фрагменты антител способны проникать внутрь клеток и воздействовать на вирус и его компоненты, блокируя важные этапы репликации, препятствуя сборке и выходу из клетки [2, 4, 12, 23].
Роль клеточного иммунного ответа заключается в защите от внутриклеточных вирусов. Он обусловлен образованием вирус-специфических цитотоксических CD8+ Т–лимфоцитов, которые появляются на 7–10-й день после инфицирования организма, и их количество достигает пика на 3–6-й нед. После завершения инфекции в течение 3–6 нед. их содержание довольно быстро снижается. Установлено, что раннее и интенсивное накопление вирус-специфических цитотоксических лимфоцитов – благоприятный признак, ассоциирующийся с низкой вирусной нагрузкой и способностью иммунной системы контролировать инфекционный процесс, замедленное – неблагоприятный признак, ассоциирующийся с высоким уровнем вирусной нагрузки, хронизацией, прогрессированием болезни [23, 36].
Таким образом, эффективность противовирусной защиты организма ребенка зависит от сбалансированного функционирования врожденного и адаптивного иммунитета. Именно интенсивность и скорость нарастания активности отдельных звеньев иммунного ответа во многом определяют эффективность и скорость элиминации вируса. Задержка или блокада на любом уровне защиты приводит к развитию тяжелых форм заболевания, персистенции вируса в организме больного и нередко к летальному исходу.
Эффективность противовирусной защиты детского организма во многом определяется зрелостью иммунной системы ребенка. Установлено, что его иммунная система имеет несколько критических периодов, когда ребенок особенно восприимчив к инфекционным агентам. Так, известно, что в первые годы жизни у ребенка имеют место Th2-направленность иммунного ответа, несостоятельность макрофагально-фагоцитарного звена, интерфероногенеза, снижение концентрации компонентов комплемента при альтернативном пути воспаления и снижение продукции Ig классов A и G, а также незрелость Т- и В-лимфоцитов [2, 15, 16, 19, 22 ].
Согласно литературным данным, способность к полноценному синтезу антител класса IgG, соответствующего уровню взрослых, появляется только к 4–6 годам жизни ребенка. Особенно длительно происходит формирование продукции антител субклассов IgG 2 и IgG 4. Местный иммунитет слизистых дыхательных путей и пищеварительного тракта, который обеспечивается сочетанным действием секреторных антител класса IgA и неспецифических гуморальных факторов (лактоферрина, лизоцима, ионов тиоцианата, лактопероксидазы), окончательно формируется только к 7–8 годам жизни. Сложные изменения происходят в пубертатный период и обусловлены эндокринным влиянием. У девочек этот этап начинается с 12–13 лет, у мальчиков – с 14–15 лет. В иммунной системе уменьшается масса лимфоидных органов, что связано с пубертатным скачком роста и веса детей, подавляется функция Т-системы (клеточный иммунитет), стимулируется функция В-системы (гуморальный иммунитет). Все это способствует частым ОРВИ, микст-инфицированию и персистенции вирусов. Так, вирусы гриппа, парагриппа, РС-вирусы, риновирусы, аденовирусы удается идентифицировать в течение продолжительного времени после острого периода болезни — от 2 нед. до нескольких месяцев [2, 15, 16, 19, 22].
Таким образом, в детской практике, особенно в критические периоды развития иммунной системы ребенка, имеет место возрастная несостоятельность противовирусной защиты, что способствует развитию микст-вирусных инфекций и длительной персистенции возбудителя в организме ребенка. Это обстоятельство нередко требует применения этиотропных лекарственных препаратов, обладающих иммуномодулирующей активностью. Именно назначение данной группы препаратов способствует быстрой элиминации вируса, уменьшению тяжести заболевания и снижает риск развития осложнений.
Для полноценной эффективной элиминации вируса необходимы препараты, обладающие направленным противовирусным действием и иммуностимулирующей активностью. Однако современная медицина располагает небольшим спектром избирательно действующих противовирусных средств с подтвержденной клинической эффективностью и безопасностью у детей. Основным недостатком этиотропных противовирусных препаратов является узкий спектр их противовирусного действия, которое направлено на конкретный, небольшой этап (стадию) репликационного цикла вируса. Так, например, рекомендованные ВОЗ для лечения и профилактики гриппа препараты этиотропного действия работают как блокаторы ионных каналов (римантадин, амантадин) или ингибиторы нейраминидазы (осельтамивир и занамивир). Препараты адамантанового ряда активны только относительно вируса гриппа А, т. к. блокируют ионные каналы, образуемые М2-белком гриппа А. Их применение ограничено в связи с отсутствием эффективности действия на вирус гриппа В.
В педиатрической практике разрешены препараты, ингибирующие репродукцию респираторно-синцитиального вируса (паливизумаб), герпетической группы вирусов, ретровирусов. Однако спектр их противовирусной активности ограничен преимущественно одним семейством вирусов. Вместе с этим у постели больного врач не всегда может клинически идентифицировать этиологию ОРВИ, особенно при наличии микст-инфекции. Лабораторная диагностика до настоящего времени затруднительна в практической медицине. Соответственно, препараты назначаются эмпирически, без учета этиологии вирусов, что не улучшает прогноз заболевания.
Еще один недостаток современных этиотропных препаратов заключается в том, что при их многократном применении формируются резистентные вирусные штаммы. Эта резистентность обусловлена мутациями в том вирусном белке, который является мишенью действия для препарата. Лекарственная устойчивость является результатом изменений наследственных свойств вирусов. Так, в работе Е.И. Бурцевой и соавт. изучалась чувствительность штаммов вирусов гриппа А и В к римантадину, арбидолу, осельтамивиру. Было установлено, что в сезон 2007–2008 гг. подавляющее число (77%) штаммов вируса гриппа А (Н3N2) были резистентны к этим препаратам. В 2011 г. Центром экологии и эпидемиологии гриппа представлены итоги эпидемиологического сезона гриппа 2009–2010 гг. Проведенный анализ выявил резистентность пандемичного штамма вируса гриппа А (H1N1) к римантадину. Выявлены также штаммы гриппа А (H1N1), несущие ответственность за резистентность к ингибитору нейраминидазы – осельтамивиру [6, 9, 14, 18, 21].
Таким образом, на современном этапе возникают определенные сложности при выборе противовирусных препаратов у детей. Они обусловлены ограниченным спектром противовирусных препаратов с узкой направленностью их механизма действия, возрастающей резистентностью вирусов к наиболее часто и необоснованно используемым медикаментам. Именно поэтому подбор этиотропной и иммуномодулирующей терапии при ОРВИ у детей является непростой задачей для педиатра, решение которой предупреждает тяжелое осложненное течение заболевания и персистенцию вирусов.
При выборе терапии необходимо учитывать как незрелость иммунной системы детей, так и иммуносупрессию, возникающую под действием вирусов. Установлено, что тяжелые и осложненные формы гриппа и ОРВИ протекают с развитием транзиторной Т-клеточной иммуносупрессии, снижением функциональной активности NK-клеток, фагоцитарной и метаболической активности нейтрофилов периферической крови, повышением содержания сывороточных иммунных комплексов, наличием ИФН-дефицита [2, 3, 24].
Именно поэтому актуальны поиск и применение таких препаратов, которые не только имеют мощный противовирусный эффект, но и обладают стимулирующим действием на клеточный и гуморальный иммунитет.
Одним из современных средств с комбинированным иммуномодулирующим и противовирусным действием является препарат Изопринозин (инозин пранобекс). Данный препарат представляет собой комплекс, содержащий инозин и М-диметиламино-2-пропанол в молярном соотношении 1:3. Эффективность комплекса определяется присутствием инозина, второй его компонент повышает его доступность для лимфоцитов. Инозин пранобекс является синтетическим аналогом инозина. В свою очередь инозин – это природное пуриновое соединение, которое присутствует в пище и входит в состав таких веществ, как пуриновые коэнзимы, высокоэнергетические фосфатные соединения (АТФ, ГТФ). Инозин, обладая противовоспалительным, антигипоксическим, анаболическим и антиаритмическим действием, участвует в регуляции многих физиологических процессов. Соответственно, дефицит инозина в клетке приводит к ухудшению ее жизнедеятельности.
Исследования показали, что высокая клиническая эффективность препарата, широкий спектр противовирусной и иммуномодулирующей активности, безопасность применения позволяют рекомендовать Изопринозин для включения в комплекс лечения ОРВИ у детей старше 3-х лет жизни независимо от формы заболевания и характера нарушений иммунного статуса.
Таким образом, проблема вирусных инфекций у детей сохраняет свою актуальность в связи с появлением случаев давно забытых инфекций и новых вирусов. Механизмы защиты от вирусных инфекций у детей во многом зависят от анатомо-физиологических особенностей, что часто определяет неэффективность иммунной защиты. Вместе с этим появление вирусов с выраженными иммуносупрессивными свойствами, резистентных к лекарственным препаратам, требует применения современных медикаментов, обладающих широким противовирусным и иммуномодулирующим действием. Один из таких препаратов – препарат инозин пранобекс – Изопринозин. Его особенностями являются как наличие прямого неспецифического противовирусного действия наряду с терапевтической эффективностью при ОРВИ, так и безопасность в педиатрической практике. s
Авторы: Каннер Е.В. 1 , Максимов М.Л. 2, 3, 4 , Ермолаева А.С. 5 , Горелов А.В. 1, 6
1 ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва, Россия
2 ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
3 КГМА — филиал ФГБОУ ДПО РМАНПО Минздрава России, Казань, Россия
4 РНИМУ им. Н.И. Пирогова Минздрава России, Москва
5 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва
6 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва
В настоящее время острые респираторные инфекции (ОРВИ), включая грипп, представляют собой одну из самых актуальных медицинских и социально-экономических проблем. Терапия острых респираторных инфекций (ОРИ) у детей остается важной задачей практического здравоохранения. В статье приведены данные по эпидемиологии, этиологии ОРИ, представлена клиническая картина ОРИ. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути. В статье рассмотрены результаты исследований по изучению эффективности влияния пробиотических микроорганизмов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12. Описаны пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами, целесообразность их включения в рацион питания детей.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
E. V. Kanner 1 , M.L. Maximov 2 , A.S. Ermolaeva 3 , A.V. Gorelov 1,3
1 Central Research Institute of Epidemiology, Moscow
2 Kazan State Medical Academy — Russian Medical Academy of Continuing Professional Education
3 Sechenov University, Moscow
Nowadays, acute respiratory infections (ARI), including influenza, are one of the most pressing medical and socio-economic problems. Therapy of acute respiratory infections (ARI) in children remains an important task of practical health care. The article presents data on the epidemiology, etiology and clinical picture of ARI. Interaction factors and mechanisms of a mucous membrane immune system of digestive and respiratory tracts are described in detail. It has been shown that an intestinal microbiota has a directly modulating effect on the immune response in relation to pathogens affecting the respiratory tract. The article discusses the results of studies on the effectiveness of probiotic microorganisms on the state of mucosal immunity and demonstrates clinical effects. The results of a number of studies demonstrating the clinical efficacy of the probiotic strain of bifidobacteria Bifidobacterium animalis subsp. lactis BB-12 are given. Probiotic products containing live microbial cultures with proven probiotic properties, the expediency of their inclusion in children diet are described.
В статье приведены данные по эпидемиологии, этиологии острых респираторных инфекций, представлена их клиническая картина. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12.
Актуальность
Патогенез и клиническая картина ОРИ
Большинство ОРИ объединены схожим симптомокомплексом, включающим насморк, лихорадку, боль в горле и др. Воспалительный процесс СО респираторного тракта является следствием воздействия повреждающего инфекционного фактора с развитием неспецифической воспалительной реакции. Компоненты воспаления в виде отека, гиперсекреции слизи, повышенной вязкости и бронхоспазма нарушают дренажную функцию дыхательных путей (ДП), а также важнейший механизм самоочищения — мукоцилиарный клиренс (МЦК). При этом создаются условия для присоединения новых патогенов, прогрессирования воспаления, развития осложнений. Вовлечение в воспаление новых отделов респираторного тракта приводит к нарастанию клинической симптоматики, появлению таких симптомов болезни, как кашель, проявления назальной и бронхиальной обструкции, инфекционно-токсический синдром, аускультативные изменения в легких [9]. Известно, что воспаление играет важную роль в ограничении вирулентных свойств возбудителя, элиминации продуктов клеточной деградации, а также формировании как местного, так и общего иммунного ответа. Воспалительная реакция организма может сопровождаться высокой функциональной активностью различных типов иммунокомпетентных клеток и/или выраженным синергизмом в действиях провоспалительных медиаторов (цитокинов); это сопровождается прогрессивной дисфункцией эндотелия, повышением сосудистой проницаемости, нарушением микроциркуляции, перераспределением кровотока и др.
Иммунная система слизистых оболочек: факторы и механизмы взаимодействия

Иммунная система СО организма играет огромную роль в развитии, поддержании и регуляции иммунного гомеостаза, являясь важной составляющей многокомпонентной системы иммунитета, осуществляя защиту организма от генетически чуждых ему экзогенных и эндогенных элементов [10].
Структурной основой местного иммунитета является лимфоидная ткань, ассоциированная с СО (mucosal-associated lymphoid tissue (MALT)). В MALT принято выделять несколько отделов (рис. 1): TALT (носоглотка, евстахиева труба, ухо; NALT (носовая полость, рот и ротоглотка, конъюнктивы), BALT (трахея, бронхи, легкие, грудные железы у женщин), GALT (пищевод, желудок, кишечник и урогенитальный тракт), SALT (дерма) [11].
К факторам мукозальной иммунной системы относят сапрофитную микрофлору, защитный эпителий, слизеобразование, кератинизацию и слюнообразование, антимикробные пептиды (лизоцим, дефензины, лактоферрин, интерфероны, пропердин), фагоциты, комплемент, секреторный иммуноглобулин А (sIgA), IgG, врожденные лимфоидные клетки (ILC), включая NK-клетки, CD4+ и CD8+ Т-лимфоциты [10].
Пробиотики и иммунитет
В ряде работ отечественных и зарубежных авторов показано влияние отдельных пробиотических штаммов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты такого воздействия, приняты международные согласительные документы, закрепляющие целесообразность применения пробиотиков как у здоровых, так и у больных детей [41–44]. В частности, показано усиление фагоцитарной активности и выработки sIgA у детей, принимавших Lactobacillus ramnosus (LGG) и Bifidobacterium lactis (BB-12) [45]. Влияние штамма L. casei DN-114001 на мукозальный иммунитет детей доказано на примере статистически достоверного нарастания уровня sIgA в слюне [46].
К настоящему времени известны 32 вида бифидобактерий и 56 видов лактобактерий, их эффекты различаются, более того, они штаммоспецифичны. Bifidobacterium lactis BB-12 является одним из наиболее клинически изученных. Основными механизмами действия Bifidobacterium BB-12 являются усиление иммунного ответа [47], влияние на врожденный иммунитет [48], модификация микробиоты [49]. Изучено влияние Bifidobacterium animalis подвида lactis BB-12 на риск острых инфекционных заболеваний у здоровых младенцев. Обнаружено снижение частоты респираторных инфекций при добавлении в терапию одного пробиотика BB-12 [50]. Исследования показали либо снижение частоты инфекций [51, 52], либо уменьшение продолжительности и/или тяжести инфекции [53] после потребления пробиотика.
Bifidobacterium lactis BB-12 используется в пищевой промышленности и в качестве пищевых добавок с 1985 г., описан в более чем 370 научных публикациях 180 клинических исследований, Bifidobacterium (BB-12) является лучшим в мире документально изученным штаммом.
Пути коррекции кишечной микробиоты у детей
Заключение
Учитывая влияние факторов питания на метаболизм и иммунитет, профилактику и течение инфекционных заболеваний у детей, следует выстраивать рацион ребенка с включением пробиотических продуктов с доказанным положительным действием на показатели здоровья. Очевидно, что разные штаммы пробиотиков способны по-разному восприниматься иммунной системой, более того — восприятие каждого из них может быть индивидуально, поскольку зависит от состояния иммунной системы и собственной микробиоты хозяина.
Таким образом, перспективы профилактики и лечения многих инфекционных заболеваний кроются в обоснованном и дифференцированном назначении пробиотических штаммов, что стимулирует иммунный ответ во всех отделах мукозальной иммунной системы, а использование пробиотических продуктов питания повышает клиническую эффективность лечения, снижает продолжительность основных симптомов заболевания.
Что такое острые респираторные заболевания (ОРЗ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
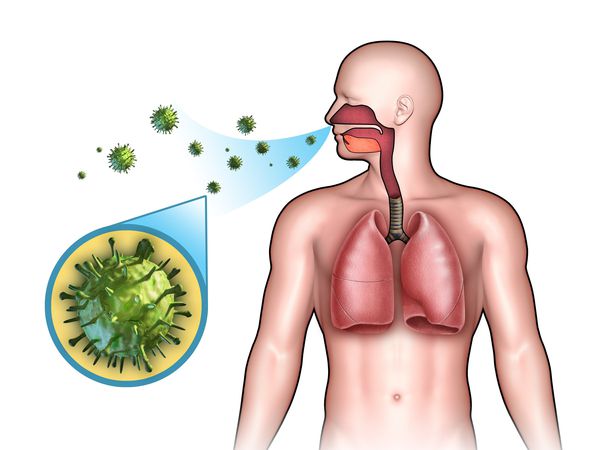
Острые респираторные заболевания (ОРЗ) — группа острых инфекционных заболеваний, при которых возбудители проникают в организм человека через дыхательные пути и вызывают синдром поражения респираторного тракта и общей инфекционной интоксикации. Употребление термина ОРВИ (острое респираторное вирусное заболевание) при отсутствии лабораторно подтверждённой этиологической расшифровки является некорректным.
Этиология
ОРЗ — полиэтиологический комплекс заболеваний, т. е. они могут быть вызваны различными видами возбудителей:
- бактерии (стафилококки, стрептококки, пневмококки, гемофильная палочка, моракселла катаралис и др.);
- вирусы (риновирусы, аденовирусы, респираторно-синцитиальный вирус, реовирусы, коронавирусы, энтеровирусы, герпесвирусы, вирусы парагриппа и гриппа);
- хламидии (х ламидия пневмония , хламидия пситаки, хламидия трахоматис );
- микоплазмы (м икоплазма пневмония ).
Чаще всего возбудителем ОРЗ являются вирусы, поэтому термин ОРВИ используют небезосновательно. В последнее время иногда встречается употребление термина ОРИ (острая респираторная инфекция) [2] [4] .
Эпидемиология
ОРЗ — это преимущественно антропонозы, т. е. болезни, способные поражать только человека . Являются самой многочисленной и частой группой заболеваний у человека (до 80 % всех болезней у детей). Поэтому они представляют серьёзную проблему для здравоохранения различных стран вследствие наносимого ими экономического ущерба.
Источник инфекции — больной человек с выраженными или стёртыми формами заболевания. Восприимчивость всеобщая, иммунитет к некоторым возбудителям (аденовирусы, риновирусы) стойкий, но строго типоспецифичный. Это значит, что заболеть ОРЗ, вызванным одним видом возбудителя, но разными серотипами (их могут быть сотни), можно многократно. Заболеваемость повышается в осенне-зимний период, может принимать вид эпидемических вспышек, довлеет к странам с прохладным климатом. Чаще болеют дети и лица из организованных коллективов (особенно в период адаптации).
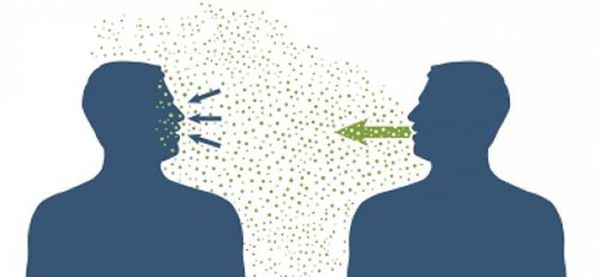
Основной механизм передачи — воздушно-капельный (аэрозольный, в меньшей степени воздушно-пылевой путь), но может также играть роль контактно-бытовой механизм (контактный — при поцелуях, бытовой — через загрязнённые руки, предметы или воду) [2] [7] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острых респираторных заболеваний (ОРЗ)
Инкубационный период различен и зависит от вида возбудителя, может варьироваться от нескольких часов до 14 дней (аденовирус).
Для каждого возбудителя ОРЗ имеются свои специфические особенности протекания заболевания, однако все их объединяет наличие синдромов общей инфекционной интоксикации (СОИИ) и поражения дыхательных путей в той или иной степени. СОИИ проявляется общей слабостью, адинамией, быстрой утомляемостью, повышенной температурой тела, потливостью и др.
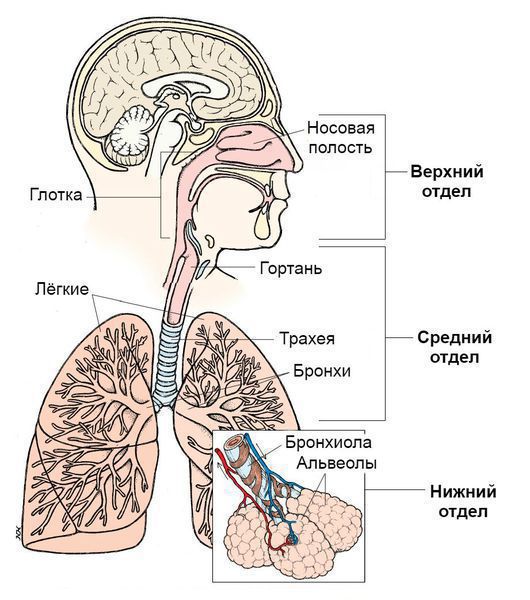
Синдром поражения респираторного тракта (СПРТ) — основной синдром для данных заболеваний, он включает:
- Ринит — воспаление слизистой оболочки носа. Характеризуется заложенностью носа, снижением обоняния, чиханием, выделениями из носа — сначала прозрачными слизистыми, затем слизисто-гнойными (более плотные выделения жёлто-зелёного цвета появляются в результате присоединения вторичной бактериальной флоры). — воспаление слизистой оболочки глотки. Основные симптомы: першение и боли в горле различной интенсивности, сухой кашель — "горловой".
- Ларингит — воспаление слизистых оболочек гортани. Проявляется осиплостью голоса, иногда афонией (отсутствием голоса), кашлем и болью в горле.
- Трахеит — воспаление трахеи. Сопровождается мучительным, преимущественно сухим кашлем, саднением и болями за грудиной.
- Бронхит — воспаление слизистой оболочки бронхов. При этом возникает кашель с наличием мокроты и без, сухие хрипы, редко крупнопузырчатые хрипы при аускультации (выслушивании).
- Бронхиолит — воспаление бронхиол (мелких бронхов). Характеризуется наличием кашля различной интенсивности и хрипов разных калибров.
Дополнительными синдромами могут быть:
- синдром экзантемы (высыпания на кожных покровах);
- тонзиллита (воспаления миндалин);
- лимфаденопатии (ЛАП) — увеличения лимфатических узлов ; ( воспаления слизистой оболочки глаза) ;
- гепатолиенальный синдром (увеличение печени и селезёнки);
- геморрагический синдром ( повышенная кровоточивость) ;
- синдром энтерита (воспаления слизистой оболочки тонкого кишечника) .
Алгоритм по распознаванию ОРЗ различной этиологии:
Наиболее распространенным заболеванием, имеющим тяжёлое течение и высокий риск развития осложнений является грипп. Инкубационный период гриппа длится от нескольких часов до 2-3 дней. В отличие от других острых респираторных заболеваний, при гриппе сначала появляется синдром общей инфекционной интоксикации (высокая температура, озноб, сильная головная боль, слезотечение, боль при движении глазных яблок, ломота в мышцах и суставах). На 2-3-день присоединяются симптомы поражения респираторного тракта: першение в горле, насморк, сухой надсадный кашель.
Типичное ОРЗ начинается с чувства дискомфорта, першения в носу и горле, чихания. В течение непродолжительного периода симптоматика нарастает, першение усиливается, появляется чувство интоксикации, повышается температура тела (обычно не выше 38,5 ℃), появляется насморк, неярко-выраженный сухой кашель. В зависимости от вида возбудителя и свойств микроорганизма могут последовательно появляться все перечисленные синдромы ОРЗ в различных сочетаниях и степени выраженности. Возможно появление осложнений и неотложных состояний [6] [7] .
Патогенез острых респираторных заболеваний (ОРЗ)
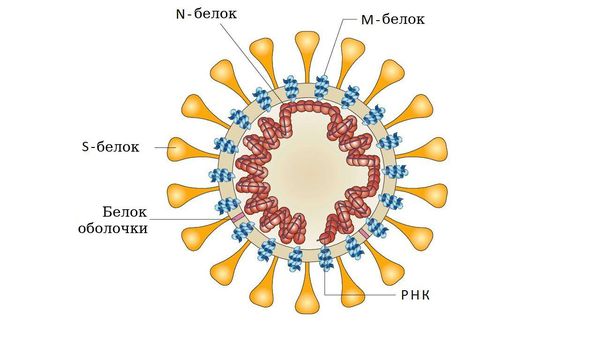
- у аденовирусов — гликопротеином (фибриллы);
- у парамиксо- или ортомиксовирусов шипами гемагглютинина;
- у коронавирусов — S-белком соединения и гликолипидами.
Взаимодействие болезнетворного агента с клеточными рецепторами необходимо не только для прикрепления его к клетке, но и для запуска клеточных процессов, подготавливающих клетку к дальнейшей инвазии. Т. е. наличие соответствующих рецепторов на поверхности клеток — это один из важнейших факторов, определяющих возможность или невозможность возникновения инфекционного процесса. Внедрение возбудителя в клетку хозяина вызывает поток сигналов, активирующих целый ряд процессов, с помощью которых организм пытается от него освободиться, например, ранний защитный воспалительный ответ, а также клеточный и гуморальный иммунный ответ. Повышение метаболизма клеток представляет собой защитный процесс, но с другой стороны в результате накопления свободных радикалов и факторов воспаления запускается патологический процесс:
- нарушается липидный слой клеточных мембран эпителия верхних отделов респираторного тракта и лёгких;
- нарушаются матричные и барьерные свойства внутриклеточных мембран, увеличивается их проницаемость;
- развивается дезорганизация жизнедеятельности клетки вплоть до её гибели.
Второй этап инфицирования характеризуется вирусемией — попаданием вируса в кровь и распространением по всему организму. В совокупности с повышением деятельности защитных механизмов и появлением в крови продуктов распада клеток этот процесс вызывает интоксикационный синдром.
Третий этап характеризуется усилением выраженности реакций иммунной защиты, элиминацию (выведение) микроорганизма и восстановление строения и функции поражённой ткани хозяина [5] [7] .
Классификация и стадии развития острых респираторных заболеваний (ОРЗ)
По вовлечению отдельных частей дыхательной системы:
- Инфекции верхних дыхательных путей. Верхние дыхательные пути начинаются с носа и включают голосовые связки в гортани, придаточные пазухи носа и среднее ухо.
- Инфекции нижних дыхательных путей. Нижние дыхательные пути начинаются с трахеи и бронхов и заканчиваются бронхиолами и альвеолами.
По клинической форме:
- Типичная.
- Атипичная:
- акатаральная (отсутствие признаков поражения дыхательных путей при наличии симптомов общей инфекционной интоксикации);
- стёртая (маловыраженная клиника);
- бессимптомная (полное отсутствие клинической симптоматики).
По течению:
По степени тяжести:
По длительности течения:
- острое (5-10 дней);
- подострое (11-30 дней);
- затяжное (более 30 дней) [8] .
Осложнения острых респираторных заболеваний (ОРЗ)
Если острое респираторное заболевание не пролечить вовремя, могут появиться различные более серьёзные заболевания:
- Связанные с ЛОР-органами: отит, синуситы, бактериальный ринит, ложный круп.
- Связанные с лёгочной тканью: вирусные пневмонии, вирусно-бактериальные и бактериальные пневмонии, абсцесс лёгкого ( ограниченный очаг гнойного воспаления в лёгочной ткани) , эмпиема плевры ( скопление гноя в плевральной полости) . Пневмония проявляется значимым ухудшением общего состояния, выраженным кашлем, усиливающимся на вдохе, при аускультации звуком крепитации ( потрескиванием или похрустыванием) , влажными мелкопузырчатыми хрипами, иногда одышкой и болями в грудной клетке.

- Связанные с поражением нервной системы: судорожный синдром, неврит ( воспаление нерва) , менингит ( воспаление оболочек головного и спинного мозга) , менингоэнцефалит (воспаление оболочек и вещества головного мозга), синдром Гийена—Барре и др. [10]
- Связанные с поражением сердца: миокардит (воспаление сердечной мышцы).
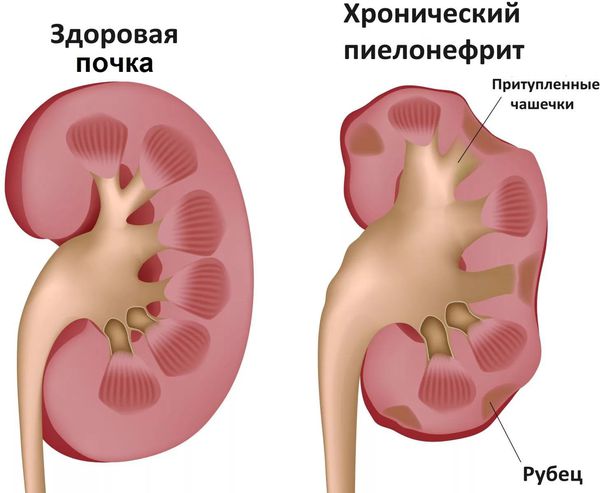
- Связанные с обострением хронических заболеваний: обострение ревматизма, тонзиллита, туберкулёза, пиелонефрита (воспаление почки) и др. [7]
Диагностика острых респираторных заболеваний (ОРЗ)
В широкой рутинной практике лабораторная диагностика ОРЗ (особенно при типичном неосложнённом течении) обычно не проводится. В отдельных случаях могут использоваться:
- Развёрнутый клинический анализ крови. При этом может обнаружиться лейкопения ( снижение количества лейкоцитов) и нормоцитоз ( нормальный размер эритроцитов) , лимфо- и моноцитоз ( увеличение числа лимфоцитов и моноцитов) , при наслоении бактериальных осложнений — нейрофильный лейкоцитоз со сдвигом влево (увеличение количество нейтрофилов и появление их незрелых форм );
- Общеклинический анализ мочи (изменения малоинформативны, указывают на степень интоксикации).
- Биохимические анализы крови. Может выявляться С-реактивный белок (указывает на наличие инфекции). При некоторых системных возбудителях, например аденовирусной инфекции, характерно повышение АЛТ.
- Серологические реакции. Возможна ретроспективная диагностика методами РСК, РА, ИФА, однако она редко используется в практической деятельности. В настоящее время широко применяется ПЦР-диагностика мазков-отпечатков, но её применение ограничено в основном стационарами и научно-исследовательскими группами.
При подозрении на развитие осложнений проводят соответствующие лабораторные и инструментальные исследования (рентген придаточных пазух носа, органов грудной клетки, КТ и др.) [3] [5] .
Лечение острых респираторных заболеваний (ОРЗ)
ОРЗ встречается очень часто и в большинстве случаев протекает в лёгкой и средней степени тяжести, поэтому обычно больные проходят лечение дома. При тяжёлых формах (с риском развития или развившимися осложнениями) пациенты должны проходить терапию в условиях инфекционного стационара до нормализации процесса и появления тенденций к выздоровлению. В домашних условиях лечением ОРЗ занимается терапевт или педиатр (в некоторых случаях инфекционист).
Пища должна быть разнообразной, механически и химически щадящей, богатой витаминами, рекомендуются мясные нежирные бульоны (идеально подходит негустой куриный бульон и т. п.), обильное питьё до — 3 л/сут. (тёплая кипячёная вода, чай, морсы). Хороший эффект оказывает тёплое молоко с мёдом, чай с малиной, отвар брусничных листьев.
Медикаментозная терапия ОРЗ включает в себя этиотропную (т. е. воздействующую на возбудителя заболевания), патогенетическую (дезинтоксикация) и симптоматическую (уменьшение беспокоящих симптомов) терапию.
Этиотропная терапия имеет смысл лишь при назначении в раннем периоде и лишь при ограниченном спектре возбудителей (в основном при гриппе). Использование средств отечественной фарминдустрии ("Арбидол", "Кагоцел", "Изопринозин", "Амиксин", "Полиоксидоний" и т. п.) не обладают никакой доказанной эффективностью и могут иметь эффекта, лишь в качестве плацебо.
В качестве симптоматической терапии могут быть использованы препараты следующих групп:
- жаропонижающие при температуре у взрослых свыше 39,5, у детей — свыше 38,5 ℃ (парацетамол, ибупрофен);
- противовирусные и антибактериальные глазные капли при конъюнктивите;
- сосудосуживающие капли в нос при заложенности носа и насморке (не более 5 дней);
- солесодержащие капли в нос при рините для разжижения слизи;
- противоаллергические препараты при аллергическом компоненте ОРЗ;
- средства противовоспалительного и противомикробного действия местного действия (таблетки, пастилки и др.);
- средства для улучшения образования, разжижения и выделения мокроты (муколитики);
- антибиотики широкого спектра действия (при отсутствии улучшения в течении 4-5 дней, присоединении вторичной бактериальной флоры и развитии осложнений) [2][6] .
Прогноз. Профилактика
Прогноз при ОРЗ — положительный. Больные обычно выздоравливают в течение 5-10 дней без неблагоприятных последствий. Осложнения респираторных заболеваний могут возникнуть при гриппе, другие возбудители менее агрессивны. Также неблагоприятные последствия возможны у пациентов с ослабленным иммунитетом. После выздоровления организмом вырабатывается иммунитет к той инфекции, которой человек переболел .
Ведущую роль в профилактике распространения ОРЗ (исключая грипп) является:
Читайте также:

