Инфекции вызванные acinetobacter baumannii
Обновлено: 18.04.2024
Нозокомиальные менингиты, вызванные Acinetobacter baumannii, у пациентов отделения нейрореанимации
Журнал: Анестезиология и реаниматология. 2019;(4): 43‑49
Бактерии Acinetobacter baumannii (A. baumannii) включены Всемирной организацией здравоохранения в перечень из 12 устойчивых к антибиотикам бактерий, представляющих наибольшую угрозу для здоровья человека [1]. Они входят в число 6 основных антибиотико-резистентных бактерий, занимающих лидирующее место в развитии нозокомиальных инфекций [2]. С A. baumannii связаны длительное пребывание пациентов в отделении реанимации и интенсивной терапии (ОРИТ) и высокая летальность [3—7]. Клиническое значение возбудителя обусловлено наличием различных механизмов резистентности и способностью к выживанию в течение длительного времени в окружающей больничной среде [7—9]. Инфекции центральной нервной системы (ЦНС), вызванные данным возбудителем, являются актуальной проблемой современных отделений нейрореанимации [4, 5, 7, 10—12].
Цель исследования — установить клинические особенности, факторы неблагоприятного исхода нозокомиального менингита (НМ), вызванного A. baumannii (АБМ), и провести анализ тактики лечения пациентов с этой патологией.
Материал и методы
Результаты

Оценка функции выживаемости (кривая Каплана—Майера) у пациентов с нозокомиальными менингитами, вызванными A. baumannii. Пунктирной линией показаны границы доверительного интервала для функции выживаемости.
У 21 (63,6%) пациента с АБМ из-за ликвороциркуляторных нарушений в послеоперационном периоде проведено наружное вентрикулярное дренирование (НВД). У 21 (63,6%) пациента развилась раневая ликворея. Датчик внутричерепного давления (ВЧД) интрапаренхиматозно установлен в 2 (6%) случаях. У 32 пациентов с АБМ проводили длительную искусственную вентиляцию легких (ИВЛ), Me 40 (диапазон 3—87) сут, 32 из 33 больных выполнили трахеостомию. Одновременно с развитием НМ регистрировали: инфекции дыхательной системы (ИДС) и инфекции системы кровотока (ИСК). ИДС выявлена у 20 (60,6%) из 33 пациентов, ИСК — у 2 (6%) больных.

Анализ воспалительных изменений ликвора. У всех 33 пациентов, заболевших менингитом, коэффициент GluCSF/Glublood (учитывали минимальные значения для каждого больного) был существенно ниже референсных значений (0,4). В целом по группе он не превышал 0,36; Me 0,01 (табл. 1). Таблица 1. Основные демографические и клинические показатели у пациентов с менингитами, вызванными A. baumannii, в зависимости от исхода заболевания Примечание. 1 — расчет проведен по U-критерию Манна—Уитни; 2 — по критерию Фишера. ОРИТ — отделение реанимации и интенсивной терапии; ЧМТ — черепно-мозговая травма; НВД — наружный вентрикулярный дренаж; ВЧД — внутричерепное давление; ИВЛ — искусственная вентиляция легких; АБМ — нозокомиальный менингит, вызванный Acinetobacter baumannii; CRP — С-реактивный белок. У 15 (45%) больных зафиксированы эпизоды снижения концентрации глюкозы ликвора до 0 ммоль/л. У всех больных отмечено превалирование нейтрофильного цитоза ликвора (80—95%). Развитие АБМ сопровождалось резким увеличением количества лейкоцитов в ликворе: Me 26 112 (54—102 400) клеток (см. табл. 1).
Системные воспалительные маркеры. Общий лейкоцитоз в периферической крови с превышением числа лейкоцитов выше референсных значений (10⋅10 3 /мкл) наблюдался у 28 (85%) из 33 пациентов. В среднем по группе он составлял 15,9 (диапазон 5,0—41,0)⋅10 3 /мкл. CRP повышен (более 5 мг/л) у 32 (97%) из 33 больных, составив в среднем 167 мг/л (см. табл. 1). Во всех случаях манифестация менингита сопровождалась повышением температуры тела выше 38,0 °С.
В качестве дополнительного диагностического критерия мы оценили частоту развития гипонатриемии: она встречалась в 51,5% наблюдений.
Клиническая манифестация менингита. Во всех случаях манифестация менингита сопровождалась повышением температуры тела выше 38,0 °С. У 12 (36,4%) из 33 больных не было выраженной отрицательной динамики неврологического статуса, но эти пациенты характеризовались нарушением сознания до развития АБМ. У 19 (57,6%) больных развитие менингита сопровождалось появлением неврологической симптоматики: у 12 пациентов — угнетением сознания вплоть до оглушения и комы, у 4 — эпизодами психомоторного возбуждения, у 3 — развитием вегетативной реакции с генерализованным тремором. У одного пациента на фоне манифестации АБМ развились судороги. Появление изолированной менингеальной симптоматики выявлено у 2 (6%) больных.
Сравнение показателей у пациентов с положительным и отрицательным исходом. Для пациентов, у которых впоследствии наступил летальный исход, характерны следующие показатели: более выраженное снижение глюкозы ликвора, выраженное нарастание в крови уровня системных воспалительных маркеров (CRP, общего лейкоцитоза), больший неврологический дефицит до развития АБМ, однако данные различия статистически незначимы. В группе умерших от АБМ больных НВД применяли статистически значимо чаще (p<0,01) (см. табл. 1).
Характеристика штаммов A. baumannii, выделенных из ликвора. Тестирование чувствительности выделенных из ликвора микроорганизмов к антимикробным препаратам проводилось согласно принятым EUCAST критериям определения чувствительности Acinetobacter spp. [15]. У всех 33 больных с АБМ определялась чувствительность ликворных штаммов A. baumannii к карбапенемам, у 18 пациентов определена чувствительность возбудителя к колистину, и у 23 — к тигециклину. У 25 (75,76%) из 33 пациентов A. baumannii обнаружена резистентность к карбапенемам (CPR) с минимальной ингибирующей концентрацией (МИК) более 16 мг/л.
К колистину A. baumannii были чувствительны 17 больных (МИК 0,5—2 мг/л), исключение составила 1 пациентка, имевшая в ликворе резистентные к колистину возбудители (МИК 16 мг/л). В отношении тигециклина EUCAST не установлен диапазон МИК ввиду недостатка имеющихся данных о лечении заболеваний, вызванных A. baumannii, с помощью данного антибиотика [15]. В 20 из 23 случаев ликворные штаммы A. baumannii чувствительны к тигециклину согласно показателям анализатора Vitek 2 (МИК 0,5—2 мг/л), в 3 случаях выявлена промежуточная чувствительность (МИК 4 мг/л). При сравнении летальности у пациентов с АБМ в зависимости от выделения CPR штаммов A. baumannii статистически значимых различий не получено (р>0,05 по критерию χ 2 ).
Длительность персистенции микроорганизма в ликворе оценивали в днях: за первый день принимали 1-й день роста патогена в пробе ликвора, за последний — 1-й день, когда в пробе ликвора отсутствовал рост A. baumannii. Длительность высева возбудителя из ликвора в группе АБМ составляла в среднем 7,9±9 сут; Me 5 (3; 8), диапазон 1—42. При сравнительном анализе длительности роста между группами больных с CPR АБМ и менингитом, вызванным чувствительными к карбапенемам A. baumannii, статистически значимых различий не выявлено. Таким образом, основными характеристиками штаммов A. baumannii, выделенных из ликвора, были резистентность к карбапенемам и чувствительность к колистину.
Тактика лечения. Всем пациентам с АБМ проводили системную антибактериальную терапию. Стартовая эмпирическая терапия во всех случаях представлена комбинацией карбапенемов (меропенема) и ванкомицина (2000 мг/сут) или линезолида (1200 мг/сут). Меропенем применяли в максимальной принятой суточной дозе (6,0 г) в виде пролонгированной 3-часовой инфузии. Через 3—4 дня, после получения данных о верификации возбудителя и его чувствительности к антибиотикам, проводили коррекцию терапии с учетом чувствительности A. baumannii к антимикробным препаратам. Целенаправленная терапия АБМ у всех 33 пациентов также включала меропенем. Комбинацию карбапенемов с антибиотиками другого класса системно применяли у 30 (91%) больных с учетом профиля чувствительности и клинической ситуации: с цефоперазоном-сульбактамом, амикацином, тигециклином. Антибиотики назначали только внутривенно 15 (45,5%) из 33 больных с АБМ. У 18 (54,5%) пациентов системную антибактериальную терапию сочетали с введением антибиотиков в ликвор: интравентрикулярно, при наличии дренажа в желудочковой системе, интратекально при наличии люмбального дренажа или путем проведения регулярных люмбальных пункций. В ликворе у 14 из 18 больных обнаружены CPR A. baumannii (14 случаев), у 4 из 18 — чувствительные к карбапенемам штаммы. Решение о сочетании системной антибактериальной терапии и введении антибиотиков в ликвор принималось на основании консилиума специалистов с участием лечащих нейрохирургов, анестезиологов-реаниматологов и госпитального эпидемиолога. Значительную роль в принятии решения играли: профиль резистентности A. baumannii к карбапенемам, выраженность воспалительных изменений ликвора, уровень системных воспалительных маркеров крови, наличие сопутствующей органной дисфункции. Среди используемых для местной терапии антибиотиков превалировал колистиметат натрия, его применяли у 13 из 18 больных; 3 пациентам в ликвор вводили амикацин, 2 — полимиксин В. Ориентировочные дозы препаратов для интравентрикулярного применения определяли на основании рекомендаций Американского общества инфекционных болезней (IDSA) [16, 17]. При сравнении длительности высева микроорганизма из ликвора в зависимости от способа введения антибиотиков не было статистически значимых различий между показателями у больных, получавших комбинированную терапию (сочетание системной антибактериальной терапии с введением антибиотиков в ликвор), и у пациентов, получавших антибиотики только внутривенно (р>0,05 по U-критерию Манна—Уитни). В группе больных (n=18), получавших комбинированную терапию, умерли 6 (33,3%) человек, в группе (n=15), получавших только внутривенную терапию, — 10 (66,7%) пациентов. Но статистически значимой разницы между этими величинами не было. При сравнении способа введения антибиотиков и исхода заболевания выяснено, что в группе больных с отрицательным исходом чаще использовали внутривенную терапию, реже — ее комбинацию с введением антибактериальных препаратов в ликвор, однако статистически значимых различий в показателях также не получено. При сравнительном анализе длительности высева A. baumannii из ликвора в зависимости от исхода статистически значимых различий между показателями у выживших и умерших больных с АБМ также не было. Распределение пациентов с учетом способа введения антибиотиков, их комбинации, длительности высева A. baumannii из ликвора в зависимости от исхода НМ представлено в табл. 2.

Таблица 2. Распределение пациентов с менингитами, вызванными A. baumannii, по тактике лечения и длительности высева A. baumannii в зависимости от исхода заболевания Примечание. 1 — расчет проведен по U-критерию Манна—Уитни; 2 — по критерию Фишера.
Длительность терапии у пациентов с менингитом зависела от сроков стерилизации ликвора, динамики воспалительных маркеров ликвора, периферической крови, а также регресса клинических проявлений, и составляла в среднем 22,8±15,2 сут, Me 24. При сравнении длительности лечения АБМ в зависимости от резистентности статистически значимых различий в показателях не выявлено: в случае CPR штаммов A. baumannii терапия продолжалась в среднем 23,2±16,9 сут, Me 22, в случае чувствительных штаммов — 21,5±8,7 сут, Me 25 сут.
Инфекции, вызванные A. baumannii, отличаются крайне высокой атрибутивной летальностью у пациентов ОРИТ. При менингитах данной этиологии после нейрохирургических вмешательств смертность может достигать 71% [3, 5, 18]. Мы получили показатель летальности 48%, что соответствует данным литературы и существенно превышает показатель летальности в целом по группе пациентов с НМ, полученный в нашем предыдущем исследовании, который составлял 29,2% [14]. Доля A. baumannii среди всех возбудителей нозокомиальных менингитов по годам за 6-летний период составила в среднем 22,1±6,6%. Пациенты с верифицированным АБМ характеризовались длительным пребыванием в ОРИТ (средняя продолжительность примерно 48 сут), Me выживаемости в нашей выборке равна 59 сут. Манифестация АБМ сопровождалась, в первую очередь, выраженными воспалительными изменениями ликвора: высоким нейтрофильным цитозом, эпизодами значительного снижения глюкозы в ликворе вплоть до ее отсутствия у 45%, угнетением сознания до уровня оглушения и комы. Отмечены нарастание уровня системных воспалительных маркеров крови (общего лейкоцитоза, CRP) и развитие гипонатриемии у 51,5% больных. Указанные критерии, по данным литературы, характерны для АМБ [4, 19]. При этом больные, находящиеся в ОРИТ, отличаются сложностью в верификации НМ, так как на фоне седации и проведения ИВЛ трудно оценивать динамику неврологического статуса, интерпретировать лихорадку и ряд воспалительных маркеров [19—21].
При сравнительном анализе данных обследования выживших и умерших пациентов у больных из группы впоследствии умерших исходно отмечены более выраженное нарушение сознания, снижение уровня глюкозы ликвора и нарастание уровня маркеров системной воспалительной реакции, однако указанные различия статистически не значимы, возможно, по причине небольшого количества наблюдений. В группе впоследствии умерших больных с АБМ НВД применяли статистически значимо чаще. По данным различных авторов, для развития АБМ характерны все установленные факторы риска развития НМ: ликворея, сопутствующая инфекция хирургической раны, большая продолжительность операций и необходимость повторного вмешательства, длительное НВД [4, 6, 14, 22].
Вместе с тем для оценки вклада каждого фактора риска в развитие АБМ необходимо сравнение с группой пациентов с НМ другой этиологии. У 75,76% больных с АБМ из ликвора выделены CPR штаммы A. baumannii, однако статистически значимого повышения летальности на этом фоне не было, что может быть связано с небольшим числом наблюдений или с наличием других факторов, влияющих на исход менингита. Стартовая терапия во всех случаях представлена комбинацией карбапенема (меропенема) и ванкомицина или линезолида в максимальной суточной дозе, что согласуется с рекомендациями по эмпирической терапии НМ [4, 6, 17, 23, 24]. Этиотропная терапия у всех пациентов сохраняла в своем составе антибиотик карбапенемового ряда, который в 3 случаях использовали в качестве монотерапии, а у 30 (91%) больных сочетали с введением цефоперазона сульбактама, амикацина, тигециклина. Статистически значимых различий в частоте неблагоприятного исхода АБМ при использовании системной монотерапии карбапенемом или его комбинации с другими антибиотиками не получено. Использование комбинированной внутривенной антибактериальной терапии считается наиболее адекватным и эффективным подходом для лечения тяжелых инфекций, вызванных грамотрицательными возбудителями, хотя наличие CPR штаммов существенно ограничивает арсенал антибактериальных средств [7, 12, 19, 25, 26]. У 54,5% системную антибактериальную терапию сочетали с введением антибиотиков в ликвор, чаще всего применяли колистимитат натрия (колистин). Дополнение системной антибактериальной терапии местным введением антибиотиков в ликвор, по данным литературы, позволяет достичь эффективной концентрации препарата в ЦНС [4, 12, 19, 27—31].
Интратекальное или интравентрикулярное применение антибиотиков принято как компонент антимикробной терапии на основании последних рекомендаций по лечению НМ [17, 23]. В нашем исследовании длительность высева микроорганизмов из ликвора не зависела от способа введения антибиотиков и составляла 5 сут (Me). Летальность в группе больных, получавших комбинированную терапию АБМ, была в 2 раза ниже, чем у пациентов, получавших антибиотики только внутривенно. Но статистически значимых различий между этими величинами не было. В группе впоследствии умерших больных чаще использовали внутривенную антибактериальную терапию, реже — ее комбинацию с введением в ликвор, однако статистически значимых различий с показателями группы выживших пациентов не отмечено. Для подтверждения или опровержения этих результатов требуются дополнительные исследования и увеличение числа наблюдений. Длительность лечения составляла в среднем 22,8±15,2 сут, что соответствует последним рекомендациям по проведению терапии менингитов, вызванных грамотрицательными бактериями [17], и не зависела от CPR A. baumannii.
Заключение
Нозокомиальные менингиты, вызванные Acinetobacter baumannii, являются причиной высокой атрибутивной летальности и длительного пребывания пациентов в отделении реанимации и интенсивной терапии. На первый план в диагностике нозокомиальных менингитов, вызванных Acinetobacter baumannii, у нейрореанимационных больных выходят выраженные воспалительные изменения в ликворе (высокий нейтрофильный цитоз, снижение уровня глюкозы в ликворе), лихорадка, а также угнетение сознания. Умершие впоследствии больные исходно имели более выраженные нарушения сознания, более значимое снижение уровня глюкозы в ликворе, большее нарастание уровня системных воспалительных маркеров крови, однако указанные различия с показателями выживших пациентов статистически незначимы, возможно, по причине небольшого числа наблюдений. В группе умерших впоследствии больных менингитом, вызванным Acinetobacter baumannii, наружный вентрикулярный дренаж применяли статистически значимо чаще. Особенностью нозокомиальных менингитов, вызванных Acinetobacter baumannii, является высокая частота выявления резистентных к карбапенемам штаммов Acinetobacter baumannii, что обусловливает трудности в антибактериальной терапии. В лечебной тактике представляется целесообразной стартовая терапия с максимальной дозой карбапенемов, которую необходимо сохранять в составе последующей этиотропной антибактериальной терапии. Учитывая согласованное мнение экспертов, дополнение системной антибактериальной терапии введением антибиотиков интравентрикулярно или эндолюмбально может быть использовано как компонент антимикробной терапии нозокомиальных менингитов, вызванных Acinetobacter baumannii. Для полноценной эрадикации Acinetobacter baumannii из ликвора необходимо продолжительное лечение.

Ацинетобактер (англ. Acinetobacter) — род грамотрицательных споронеобразующих неферментирующих строго аэробных бактерий.
Acinetobacter — повсеместно встречающаяся бактерия. У здоровых людей, в частности, он обитает на коже, также выделяется из кишечника.
Ацинетобактер — причина внутрибольничных инфекций
Acinetobacter может вызывать у госпитализированных пациентов инфекции дыхательных путей (синусит, трахеобронхит, пневмония), кровотока (сепсис, эндокардит естественных и искусственных клапанов), мочевыводящих путей, раневой и хирургической инфекций, инфекций кожи и мягких тканей (включая некротизирующий фасциит), нервной системы (менингит, вентрикулит, абсцесс мозга), интраабдоминальные (абсцессы различной локализации, перитонит), опорно-двигательного аппарата (остеомиелит, артрит). Наиболее клинически значимым видом рода Acinetobacter является Acinetobacter baumannii, который вызывает 2–10% грамотрицательных инфекций в Европе и США и до 1% всех нозокомиальных инфекций (Горбич Ю.Л. и др.).
Ацинетобактер в анализах кала
Ацинетобактер в систематике бактерий
Род Acinetobacter относится к семейству Moraxellaceae, которое входит в порядок Pseudomonadales, класс гамма-протеобактерии (γ proteobacteria), тип протеобактерии (Proteobacteria), царство бактерии.
В род ацинетобактер включены следующие виды: Acinetobacter albensis, Acinetobacter antiviralis, Acinetobacter apis, Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter beijerinckii, Acinetobacter bereziniae, Acinetobacter bohemicus, Acinetobacter boissieri, Acinetobacter bouvetii, Acinetobacter brisouii, Acinetobacter calcoaceticus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter celticus, Acinetobacter courvalinii, Acinetobacter defluvii, Acinetobacter dispersus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter endosymbiont of Culex pipiens, Acinetobacter endosymbiont of Nilaparvata lugens, Acinetobacter equi, Acinetobacter gandensis, Acinetobacter genospecies, Acinetobacter gerneri, Acinetobacter glutaminasificans, Acinetobacter guangdongensis, Acinetobacter guillouiae, Acinetobacter gyllenbergii, Acinetobacter haemolyticus, Acinetobacter halotolerans, Acinetobacter harbinensis, Acinetobacter idrijaensis, Acinetobacter indicus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter kookii, Acinetobacter kyonggiensis, Acinetobacter lactucae, Acinetobacter larvae, Acinetobacter lwoffii, Acinetobacter marinus, Acinetobacter modestus, Acinetobacter movanagherensis, Acinetobacter nectaris, Acinetobacter oleivorans, Acinetobacter oryzae, Acinetobacter parvus, Acinetobacter plantarum, Acinetobacter populi, Acinetobacter proteolyticus, Acinetobacter psychrotolerans, Acinetobacter puyangensis, Acinetobacter qingfengensis, Acinetobacter radioresistens, Acinetobacter refrigeratoris, Acinetobacter rhizosphaerae, Acinetobacter rudis, Acinetobacter schindleri, Acinetobacter seohaensis, Acinetobacter septicus, Acinetobacter soli, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii, Acinetobacter variabilis, Acinetobacter venetianus, Acinetobacter vivianii, Acinetobacter xiamenensis.
Ряд видов, а именно: Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter nosocomialis, Acinetobacter pittii объединены в отдельную группу Acinetobacter calcoaceticus/baumannii complex.
Антибиотики, активные и неактивные в отношении ацинетобактера
Необходимо отметить, что ацинетобактер отличаются высокой и поливалентной резистентностью к антибиотикам, что крайне затрудняет эффективное лечение больных (Гельфанд Е.Б. и др.).
A. Противомикробные средства из имеющих описание в данном справочнике
- Acinetobacter spp. — нифурател, офлаксацин
- Acinetobacter anitratus, Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter lwoffii — левофлоксацин
- Acinetobacter calcoaceticus — норфлоксацин
Ацинетобактер устойчив к: рокситромицину.
Б. Иные противомикробные препараты
Ацинетобактер умеренно чувствителен к цефалоспоринам IV поколения: цефепиму, цефпирому и другим (Яковлев С.В.).
Из карбапенемов в отношении ацинетобактера активны меропенем, имипенем, биапенем и панипенем. Эртапенем, наоборот, не активен (Белобородов В.Б.).
Ацинетобактер имеет высокий уровень устойчивости к фторхинолонам. В частности, к ципрофлоксацину на территории России в отделениях реанимации частота устойчивости варьирует от 13 до 53% (Сидоренко С.В.).
По мнению С.В. Яковлева, при выявленном возбудителе, препаратам первого ряда для лечения инфекции (мочевыводящих путей у больных пожилого возраста) ацинетобактера, являются фторхинолоны, в качестве альтернативных средств рекомендуются карбапенемы, амикацин и цефалоспорины IV поколения.
Ацинетобактер чувствителен к сульбактаму и к комбинации амоксициллин + сульбактам (Царапкин Г.Ю. и др.).
Виды ацинетобактера в общем резистентны к азтреонаму (R. de Groot).
Acinetobacter calcoaceticus и рассеянный склероз
E. Cekanaviciute и др. из США в своём исследовании* установили связь микробиоты толстой кишки человека и рассеянного склероза. Они определили, что у больных рассеянным склерозом количество Acinetobacter calcoaceticus и Akkermansia muciniphila повышено, а Parabacteroides distasonis снижено. Было высказано предположение, что состав микробиоты кишечника может стимуловать развитие рассеянного склероза. Определенные виды бактерий способны модулировать иммунный ответ в организме, подстегивая или подавляя заболевание.
*Cekanaviciute E et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models / Proc. Natl. Acad. Sci. USA, vol. 114, no. 40, 10713–10718, doi: 10.1073/pnas.1711235114.

Acinetobacter baumannii — вид грамотрицательных споронеобразующих неферментирующих строго аэробных бактерий.
Acinetobacter baumannii широко распространены в природе, а также во внутрибольничной среде и обладают множественными механизмами резистентности к антибиотикам. Acinetobacter baumannii могут колонизировать желудочно-кишечный тракт, кожу пациента, рото- и носоглотку, конъюнктиву, влагалище и уретру.
В то же время Acinetobacter baumannii могут являться причиной пневмонии, трахеобронхита, сепсиса, инфекций мочевыводящих путей, эндокардита, раневой и хирургической инфекции, инфекций кожи и мягких тканей (включая некротизирующий фасциит), менингита, вентрикулита, абсцессов мозга, интраабдоминальных абсцессов, хориоамнионита, остеомиелита, артрита, синусита и перитонита.
Acinetobacter baumannii — возбудитель внутрибольничных инфекций
Проблема нозокомиальных (внутрибольничных) инфекций, вызываемых Acinetobacter baumannii, становится всё более актуальной из-за растущей резистентности данных микроорганизмов к антибактериальным препаратам. Резистентность Acinetobacter baumannii к цефтазидиму и ампициллину/сульбактаму за 5 лет увеличилась в 2–2,5 раза, к амикацину и ципрофлоксацину — в 8–9 раз. Встречаются штаммы, резистентные ко всем применяемым антибактериальным препаратам. Появление таких устойчивых внутрибольничных микроорганизмов связано с необоснованным и неограниченным использованием антибиотиков.
Acinetobacter baumannii относится к основными возбудителями раневых инфекций (Д.О. Вагнер).
Acinetobacter baumannii в систематике бактерий
По современным представлениям вид Acinetobacter baumannii входит в Acinetobacter calcoaceticus/baumannii complex, который относится к роду ацинетобактеры (лат. Acinetobacter), семейству Moraxellaceae, порядку Pseudomonadales, классу гамма-протеобактерии (Gamma proteobacteria), типу протеобактерии (Proteobacteria), царству бактерии.
Антибиотики, активные в отношении Acinetobacter baumannii
В течение многих лет основой терапии инфекций, вызванных Acinetobacter baumannii, были бета-лактамные антибиотики, часто в сочетании с аминогликозидами в случаях тяжелых инфекций. Однако большинство внутрибольничных Acinetobacter baumannii в настоящее время устойчивы к этим препаратам. Фторхинолоны, тетрациклины и глицилциклин, триметоприм-сульфаметоксазол, карбапенемы (за исключением эртапенема), полимиксины могут сохранять активность в отношении некоторых внутрибольничных штаммов. Однако в большинстве стран наблюдается быстрое нарастание резистентности к этим группам антибиотиков. В настоящее время наиболее клинически и финансово эффективным является использование монотерапии ампициллином/сульбактамом в дозах 24 г/сут или комбинированных режимов, включающих карбапенемы и ампициллин/сульбактам или карбапенемы и цефоперазон/сульбактам и нетилмицин. Последняя комбинация является экономически менее выгодной (Н.Д. Дмитриева и др., 2012).
Из представленных в данном справочнике антимикробных средств в отношении Acinetobacter baumannii (в общем) активны: левофлоксацин, нифурател, доксициклин. Acinetobacter baumannii устойчив к рокситромицину.

Про ацинетобактер знают все, кто в том или ином виде работает в стационарах. Ацинетка очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.

Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Поэтому будем изучать врага в лицо
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
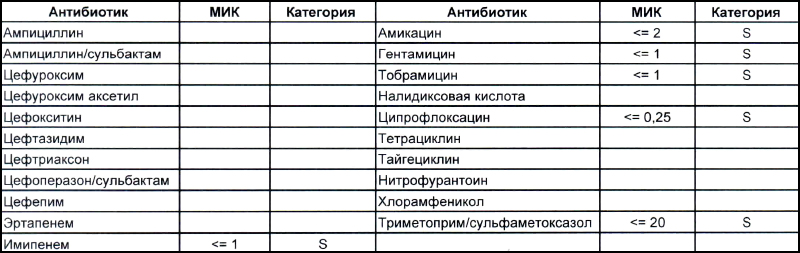
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
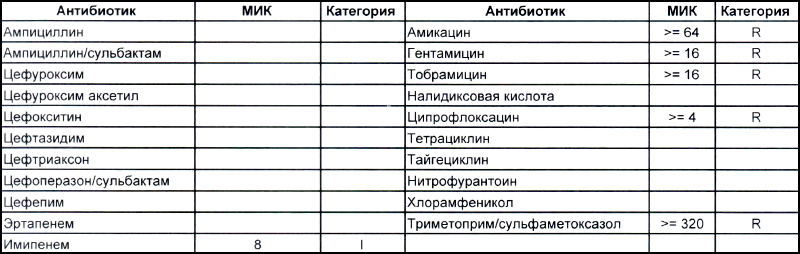
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
- Раневую инфекцию
- Инфекции кровотока
- Инфекции дыхательных путей – в первую очередь, внутрибольничную пневмонию, часто вентилятор-ассоциированную, особенно так называемую позднюю (более семи суток на ИВЛ). Здесь он делит пальму первенства с синегнойкой и MRSA
- Внутрибольничные менингиты
- Инфекции мочевыводящих путей, чаще всего ассоциированные с использованием эндоскопического оборудования
- Перитониты у пациентов на перитонеальном диализе
- Почти полный набор инфекций, связанных с установкой имплантов или протезов
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Появление и распространение успешных клонов Acinetobacter baumannii создало серьезную проблему для медицинского сообщества.
ЦЕЛЬ РАБОТЫ
Изучение клонального состава A. baumannii, выделенных из крови больных опухолями системы крови.
МАТЕРИАЛ И МЕТОДЫ
Материалом исследования были A. baumannii, выделенные из крови больных, находившихся на стационарном лечении в 7 лечебных учреждениях России (2003—2017 гг.). Изоляты были отнесены к одной из международных клональных линий (G1-G14) на основании обнаружения комбинаций амплифицированных генов ompA, csuE и blaOXA-51-подобные, полученных с использованием двух мультиплексных ПЦР.
РЕЗУЛЬТАТЫ
В последние годы (2011—2017 гг.) отмечено значительное увеличение изолятов G1 (IC II), несущих гены blaOXA-23-подобные.
Дата принятия в печать:
Введение
Инфекции, вызванные Acinetobacter baumannii, представляют одну из серьезных проблем медицины, обусловленную способностью этих бактерий быстро приобретать устойчивость к антимикробным препаратам. Увеличение частоты выделения A. baumannii с фенотипом множественной резистентности (multidrug resistance, MDR) и фенотипом экстремальной резистентности (extreme drug resistance, XDR) отмечено во всем мире. Карбапенемы долгое время были препаратами выбора для лечения инфекций, вызванных MDR A. baumannii. Однако за последнее десятилетие во многих странах мира в этиологии инфекций увеличилась доля карбапенем-резистентных A. baumannii. Согласно данным (2012—2016 гг.) Европейской сети по контролю над устойчивостью к антимикробным препаратам (EARS-Net), уровень резистентности к карбапенемам у Acinetobacter spp. в Греции, Хорватии и Румынии достигал 80% и более, а в Португалии, Венгрии, Испании, Польше и Болгарии — от 50 до 80% [1]. По данным российского исследования МАРАФОН, доля карбапенем-нечувствительных A. baumannii за 7 лет увеличилась на 36—66% [2].
Цель исследования — изучение клонального состава A. baumannii, выделенных из крови больных опухолями системы крови.
Материал и методы
Источники бактериальных изолятов
Видовая идентификация и хранение
Определение чувствительности к антибактериальным препаратам
Выявление генов карбапенемаз
Генотипирование с помощью ПЦР
Принадлежность изолятов A. baumannii к международным клональным линиям определяли с помощью двух мультиплексных ПЦР, разработанных для селективной амплификации аллелей генов ompA, csuE и blaOXA-51-подобные, с использованием специфических праймеров, представленных J. Turton и соавт. [14]. В зависимости от полученной комбинации амплифицированных генов изоляты были отнесены к одной из 14 групп (клональных линий), согласно обобщенной классификации, представленной N. Karah и соавт. [13]. В соответствии с этой классификацией к группе 1 (G1) принадлежал IC II, к группе 2 (G2) — IC I, а к группе 3 (G3) — IC III, к группам G4-G12 — другие клональные линии.
Результаты и обсуждение
Исследовано 96 изолятов A. baumannii, выделенных из крови больных опухолями системы крови, из них 77 (80,2%) были нечувствительными к меропенему или имипенему (резистентными были 76 изолятов, умеренно-резистентными — 1). Нечувствительными к меропенему были 75 (78,1%) из 96 изолятов, к имипенему — 72 (75%) из 96.
В табл. 1 представлены результаты генотипирования A. baumannii с помощью двух мультиплексных ПЦР. Исследуемые 96 изолятов были отнесены к 8 клональным группам. У 3 (3,1%) изолятов A. baumannii не была определена принадлежность к исследуемым группам.
Таблица 1. Генотипирование A. baumannii, выделенных из крови, с помощью двух мультиплексных ПЦР
Изоляты A. baumannii, n (%)
чувствительные к карбапенемам, n=19, абс. (%)
нечувствительные* к карбапенемам, n=77, абс. (%)
Примечание. * — умеренно-резистентные и резистентные.
Большинство (60,4%; n=58) изолятов вошли в группу G1 (IC II) и были представлены как карбапенем-нечувствительными (70,1%), так и карбапенем-чувствительными (21,1%) изолятами. В группы G4 и G8 вошли только карбапенем-нечувствительные A. baumannii, в то время как в группу G5 — только чувствительные изоляты. Все остальные изоляты A. baumannii, у которых не была установлена принадлежность к исследуемым группам, были карбапенем-чувствительными.
Карбапенем-нечувствительные изоляты A. baumannii с продукцией приобретенных OXA-карбапенемаз относились к 7 группам, среди которых доминировали (62,3%) представители G1 (IC II) (табл. 2). К группе G1 (IC II) принадлежали более 1 /2 (64,3%) изолятов с продукцией OXA-24/40-подобных ферментов и 67,9% изолятов с продукцией OXA-23-подобных ферментов. Изоляты A. baumannii, продуцирующие ферменты группы OXA-58, не принадлежали к международному клону G1 (IC II) (см. табл. 2).
Таблица 2. Генотипирование карбапенем-нечувствительных A. baumannii, содержащих гены приобретенных OXA-карбапенемаз (n=61), с помощью двух мультиплексных ПЦР
A. baumannii, содержащие гены приобретенных OXA-карбапенемаз, n (%)

Рис. 1. Распределение генов приобретенных OXA-карбапенемаз у A. baumannii, выделенных в разные временные периоды исследования.
Интерес вызывал тот факт, что клональный состав A. baumannii, несущих гены OXA-карбапенемаз, менялся в течение периода исследования. Так, в первый временной период (2003—2010 гг.) не было выявлено ни одного изолята A. baumannii с продукцией OXA-23-подобных карбапенемаз, относящихся к G1 (IC II), в то время как во второй период (2011—2017 гг.) подавляющее большинство изолятов (86,4%), содержащих гены blaOXA-23-подобные, принадлежало именно к G1 (IC II), а представители G12, доминирующего клона в 2003—2010 гг. (83,3%), выявлены не были (рис. 2, а). Клональный состав A. baumannii, несущих гены blaOXA-24/40-подобные, практически не изменился, и большинство изолятов как в первый временной период (2003—2010 гг.), так и во второй (2011—2017 гг.) принадлежали к G1 (IC II) (соответственно 61,1 и 70%) (см. рис. 2, б).

Рис. 2. Распределение исследуемых клональных групп среди A.baumannii, содержащих гены blaOXA-23-подобные (а) и blaOXA-24/40-подобные (б), в разные временные периоды.
В представленном нами исследовании большинство (80,2%) изолятов A. baumannii было нечувствительным к карбапенемам. По результатам других исследований, посвященных изучению A. baumannii, выделенных из крови больных гемобластозами, доля карбапенем-нечувствительных изолятов также была высока и варьировала от 36,1% [7] до 100% [6]. Отличия в показателях устойчивости к карбапенемам были выявлены и среди изолятов A. baumannii, выделенных в многопрофильных стационарах. Так, в Испании доля нечувствительных к карбапенемам изолятов A. baumannii, выделенных из крови, составила 84,75% [17], а в Италии — 54% [18].
Устойчивость к карбапенемам A. baumannii в большинстве случаев обусловлена наличием генов приобретенных карбапенемаз. Среди карбапенем-нечувствительных A. baumannii, выделенных в данном исследовании, доля изолятов, содержащих гены OXA-карбапенемаз, составила 79,2%. Основными генами OXA-карбапенемаз были blaOXA-24/40-подобные (45,9%) и blaOXA-23-подобные (45,9%). В других российских исследованиях среди карбапенем-нечувствительных изолятов преобладали гены группы blaOXA-24/40. Так, в исследовании МАРАФОН доля A. baumannii с продукцией OXA-24/40-подобных карбапенемаз составила 81,1% в 2011—2012 гг. и 62,5% в 2013—2014 гг. [2, 19]. Среди карбапенем-нечувствительных изолятов A. baumannii, выделенных от пациентов в отделениях хирургии, реанимации и интенсивной терапии (ОРИТ) в трех стационарах Москвы, также преобладали (80%) изоляты, содержащие гены группы blaOXA-24/40 [20].
В настоящем исследовании были выделены A. baumannii, относящиеся к 8 клональным линиям, распространенным в мире. Большинство (60,4%) изолятов относилось к международному клону G1 (ICII), что сопоставимо с результатами, полученными E. Dahdouh и соавт. [17] при изучении A. baumannii, выделенных из крови, где доля изолятов, принадлежащих к клону G1 (ICII), составила 71,2%. Хотелось бы отметить, что в Греции до 2004 г. A. baumannii, выделенные из клинически значимых образцов, относились в основном к G2 (ICI), в то время как уже в 2005—2009 гг. подавляющее большинство (77,8%) изолятов принадлежало к G1 (ICII), и из них 79,4% A. baumannii, содержали гены blaOXA-23-подобные [21]. Такой факт демонстрирует, что A. baumannii, принадлежащие к G1 (IC II) и содержащие гены blaOXA-23-подобные, обладают лучшими механизмами адаптации и способностью к распространению в стационарах в сравнении с A. baumannii, принадлежащих к другим клональным линиям.
Рядом исследователей было отмечено, что в большинстве стран мира A. baumannii, содержащие гены blaOXA-23-подобные, принадлежали к клональным линиям G1 (ICII) и G2 (ICI) [15, 22]. Также было отмечено, что изоляты A. baumannii группы G1 (ICII) обладают лучшей способностью к адгезии и формированию биопленок в сравнении с A. baumannii, относящихся к другим клональным линиям [22], имеют более высокие показатели устойчивости к антимикробным препаратам [21]. Способность к формированию биопленок и приобретению детерминант устойчивости у A. baumannii клональной линии G1 (ICII) вполне определенно способствует распространению и персистенции A. baumannii в условиях стационара [23].
Заключение
Большинство (80,2%) изолятов A. baumannii, выделенных из крови больных опухолями системы крови, были нечувствительными к карбапенемам. Гены приобретенных OXA-карбапенемаз обнаружены у 79,2% таких изолятов. A. baumannii, выделенные из крови, принадлежали к 8 клональным линиям, распространенным в мире. Было отмечено преобладание изолятов A. baumannii, принадлежащих к международному клону G1 (ICII) (60,4%). В ходе исследования выявлено увеличение доли A. baumannii, содержащих гены blaOXA-23-подобные, что могло быть следствием распространения изолятов, принадлежащих к международному клону G1 (ICII). За 8 лет исследования (с 2011 по 2017 г.) доля OXA-23-продуцирующих A. baumannii, принадлежащих к клону G1 (ICII), возросла до 86,4% при полном отсутствии в 2003—2010 гг. Полученные результаты подтверждают глобальные тенденции распространения успешной клональной линии G1 (IC II) в стационарах с вытеснением других клональных линий.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Результаты исследования были представлены на Международной конференции European Congress of Clinical Microbiology and Infectious Diseases (ECCMID) в 2019 г. в виде стендового доклада P0935.
Читайте также:

