Инфекционная эритема укус насекомого
Обновлено: 24.04.2024
В статье представлены основные сведения, касающиеся клинико-эпидемиологических особенностей клещевых боррелиозов у детей, проживающих на территории Новосибирской области. Наблюдения за показателями заболеваемости фиксируют отчетливый тренд в повышении кол
Иксодовые клещевые боррелиозы (ИКБ) (синонимы: болезнь Лайма, Лайм-боррелиоз) в настоящее время рассматриваются как группа природно-очаговых инфекций, с трансмиссивным механизмом передачи, характеризующаяся полисистемным поражением и большим полиморфизмом клинических проявлений.
До открытия возбудителя ИКБ проявления болезни описывались как отдельные синдромы или самостоятельные заболевания с неясной этиологией: лимфоцитарный менингорадикулит (синдром Баннварта), серозный менингит, хронический артрит, клещевая эритема, лимфоцитома и т. д. (A. Bannwarth, V. Sedlacek и др.). В России нозологическую самостоятельность иксодовые клещевые боррелиозы получили с 1991 года, а с 1992 года — были введены в форму статистической отчетности по инфекционным заболеваниям [1, 2].
Проводимые исследования в самих природных очагах как на территории Российской Федерации, так и в странах Европы показывают увеличение численности клещей и усиление активности циркуляции самого возбудителя [1, 5], что определяет тенденцию к повышению заболеваемости клещевыми боррелиозами в настоящее время.
Этиология клещевых боррелиозов
Сегодня известно (Johnson и соавт., 1984), что спирохеты, вызывающие клещевые боррелиозы, относятся к роду Borrelia. Данный род представляет собой гетерогенную популяцию микроорганизмов и подразделяется на две большие подгруппы:
1) возбудители возвратной клещевой лихорадки: B. recurrentis, B. duttoni, B. parkeri, B. turicatae, B. hermsii, B. miyamotoi и др.;
2) возбудители Лайм-боррелиозов: B. burgdorferi sensu stricto, B. garinii, B. afzelii, B. usitaniаe, B. valaisiana, B. andersonii, B. bissettii, B. japonica, B. tanukii, B. turdi, B. inica.
Указанные виды боррелий вследствие высокого фенотипического и генетического сходства были объединены в единый комплекс B. burgdorferi sensu lato [7]. Хотя этот комплекс сегодня включает до 18 видов Borrelia, только три из них являются явно патогенными: B. afzelii, B. burgdorferi и B. garinii (в том числе B. garinii OspA, тип 4, или B. bavariensis) [8, 9]. Зараженность клещей боррелиями в природных очагах варьирует от 10% до 80% [7, 10, 11]. В Новосибирской области как в природном очаге, так и у больных иксодовыми клещевыми боррелиозами чаще выявляется ДНК Borrelia garinii и Borrelia afzelii.
Основной механизм заражения при ИКБ — трансмиссивный, боррелии попадают в организм человека со слюной инфицированных клещей при кровососании. Пути передачи: трансмиссивный, алиментарный, контактный (через микротравмы кожных покровов при снятии и раздавливании клеща) и трансплацентарный. Сезонность заболевания — весенне-летняя, обусловленная периодом активности клещей. Иммунитет нестерильный, возбудитель способен к длительной персистенции в организме, возможны супер- и реинфекции [11]. После укуса клеща вероятность сероконверсии у человека находится в диапазоне от 3% до 6%. Клинически манифестные формы заболевания возникают в 0,3–1,4% случаев от всех укусов клещей.
Учитывая, что входными воротами инфекции при клещевых боррелиозах является кожа, где происходит размножение возбудителя с последующим лимфогенным распространением его в ближайшие лимфатические узлы и развитием регионарного лимфаденита, в месте присасывания клеща возникает первичный аффект с образованием эритемы [11–13]. Согласно статистическим данным, по мнению и отечественных и зарубежных авторов [3, 14], эритемные формы заболевания наблюдаются в клинической картине ИКБ в 40–70% случаев. При анализе заболеваемости трансмиссивными клещевыми инфекциями 125 детей в возрасте от 1 до 18 лет, проживающих в Новосибирской области, за 13 лет (период с 1999 по 2011 годы), было установлено, что иксодовыми клещевыми боррелиозами заболели 78,5% из них (95 человек). Заболевание протекало в эритемной форме у 94 больных ИКБ (98,9%). Диагноз выставлялся в соответствии с МКБ 10-го пересмотра на основании клинико-эпидемиологических, общеклинических, специфических (серологического — иммуноферментный анализ (ИФА), молекулярно-генетического — полимеразная цепная реакция (ПЦР)) и биохимических методов обследования.
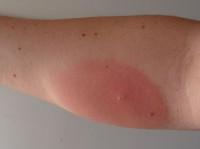
Поражением кожи — мигрирующей эритемой — характеризуется период ранних локализованных проявлений (стадия локальной инфекции) при ИКБ. Эритема обычно возникает через 7–14 дней от момента укуса клеща (от 3 до 30 дней), локализуется вокруг места укуса, имеет округлую или овальную форму и тенденцию к распространению. В месте эритемы возможно возникновение кожного зуда, парестезий, повышение местной температуры. В отсутствие антибактериальной терапии эритема спонтанно угасает в сроки от нескольких дней до нескольких недель (в среднем — около 4 недель). У 10–30% больных мигрирующая эритема сопровождается неспецифическими симптомами, такими как недомогание, субфебрильная температура, кратковременные мигрирующие боли в мышцах и небольших суставах, утомляемость [15].
По нашим данным, в 44 случаях (46,3%) первыми признаками заболевания при ИКБ у детей явилось именно покраснение в месте укуса клеща. При наблюдении за детьми с эритемной формой иксодовых клещевых боррелизов, эритема появлялась в месте укуса клеща в срок до 45 дней (максимально) от момента присасывания клеща к коже, в среднем — на 11 ± 7 день. Размеры эритемы составляли от 1,5 до 20 см (в среднем — 6,6 ± 4 см). В редких случаях отмечался рост эритемы в размерах за период наблюдения. Эритема сохранялась на коже максимально до 36 дней, в среднем 8 ± 5 дней, с момента начала антибактериальной терапии угасала в среднем через 7 ± 4 дней. В 11 случаях (11,6%) эритема угасала с последующим шелушением. В двух случаях отмечалась эритема в виде двойного кольца, у троих детей отмечалось повышение местной температуры в области мигрирующей эритемы. В 5 случаях (5,3%) кожные проявления были представлены экзантемой (петехиальные, крупно- и среднепятнистые элементы сыпи), в сочетании с эритемой в месте присасывания клеща. Во всех пяти случаях сочетания эритемы и сыпи на туловище, у больных отмечалась лихорадка до фебрильных цифр и довольно интенсивные проявления интоксикации.
Наличие мигрирующей эритемы является патогномоничным симптомом клещевого боррелиоза. В последующем происходит диссеминация возбудителя: гематогенно, лимфогенно и периневрально боррелии распространяются на другие участки кожи, во внутренние органы (печень, селезенку, почки, сердце), суставы, оболочки мозга, центральную и периферическую нервную системы.
Генерализация инфекции (стадия диссеминации боррелий) у взрослых наиболее часто характеризуется поражением нервной системы в виде менингорадикулоневрита (синдрома Баннварта): сочетание серозного менингита, радикулита и поражения черепномозговых нервов (чаще всего в виде одно- или двустороннего периферического паралича лицевого нерва). Генерализованная стадия заболевания может протекать также с формированием кардита, лимфоцитомы (доброкачественная опухоль красно-фиолетового цвета), которая обычно локализуется на мочке уха у детей, а у взрослых в области ареол, мошонки, носа и предплечий.
К поздним и персистирующим клиническим проявлениям ИКБ (стадия органных поражений) относятся хронический атрофический акродерматит (acrodermatitis chronica atrophicans of Herxheimer, ACA) и хронический артрит, а также полинейропатии, хронический прогрессирующий менингоэнцефалит и мультифокальный церебральный васкулит, которые характеризуются необратимым неврологическим дефицитом и прогредиентным течением болезни. Обычно такие проявления развиваются не более чем у 5% пациентов, перенесших нейроборрелиоз. Также редко описываются случаи экстрапирамидных нарушений на фоне хронической боррелиозной инфекции. Суставные поражения могут возникать отсроченно, при отсутствии терапии, через несколько месяцев и даже лет после укуса клеща и обычно протекают в виде хронического олигоартрита, с ассиметричным поражением одного из суставов (чаще коленных и локтевых). Хронические формы иксодовых клещевых боррелиозов являются наиболее сложными с точки зрения диагностики и лечения. Это связано с тем, что заболевание имеет неспецифические симптомы, которые могут быть характерны также для заболеваний другой этиологии (например, артрит, энцефаломиелит или периферическая невропатия), которые не позволяют уточнить диагноз при отрицательных или сомнительных лабораторных и клинических критериях.
У детей в течении ИКБ можно выделить следующие клинические особенности.
- Наиболее часто ИКБ заболевают дети в возрасте от 3 до 10 лет.
- Мигрирующая эритема развивается у детей в 70–80% случаев и у большинства больных имеет кольцевидную форму.
- Характерной локализацией эритемы у детей является волосистая часть головы, околоушная область, лицо, верхняя часть туловища.
- Общеинфекционный синдром наблюдается у 60–70% больных ИКБ детей и обычно более выражен, чем у взрослых.
- У большинства больных детей наблюдается увеличение регионарных к месту укуса клеща лимфатических узлов.
- У 10% больных детей с острым течением ИКБ наблюдается вовлечение в патологический процесс мозговых оболочек с развитием серозного менингита.
- Развитие хронического течения после перенесенных острых ИКБ у детей наблюдается в 15–20% случаев.
Диагностика ИКБ
Для постановки диагноза ИКБ необходимо учитывать сведения эпидемиологического анамнеза (присасывание клеща, посещение мест с высокой вероятностью нападения клеща — выезд на природу, выход в лес) с учетом времени года (весенне-осенний период), клинические проявления: появление мигрирующей кольцевидной эритемы, увеличение регионарных лимфоузлов, наличие неврологической, суставной и кардиальной симптоматики.
Более доступны в практическом применении серологические методы диагностики. К наиболее распространенным методам определения антиборрелиозных антител относят иммуноферментный анализ (ИФА и ELISA), метод непрямой иммунофлюоресценции, реакция связывания комплемента, реакция пассивной гемагглютинации, а также иммуноблоттинг.
При ИКБ антитела класса IgM в максимальном количестве вырабатываются к 3–4 неделе болезни, ко второму месяцу появляются антитела класса IgG. У некоторых больных синтез IgM может задерживаться или отсутствовать вообще [3, 7, 11, 16]. Сероконверсия наблюдается у 20–50%, а по некоторым данным, у 80% больных ранним боррелиозом [8]. Наличие IgM-антител к боррелиям в сыворотке крови, как правило, указывает на раннюю инфекцию. Наличие IgG-антител указывает на диссеминацию боррелий или на переход в стадию хронического персистирования. Оба класса антител могут определяться в течение длительного времени (до 10 лет), в том числе и после успешно проведенной антибактериальной терапии [17–19].
С целью повышения диагностической точности американским Центром контроля болезней было предложено проверять положительные или пограничные результаты скрининговых тестов с помощью иммунноблоттинга, используя стандартизированные критерии серопозитивности метода [20]. Основным скрининг-тестом в этой схеме является ИФА. Исследуемые образцы с положительными или сомнительными результатами в ИФА обязательно дополнительно тестируют методом иммунного блоттинга [3, 7, 20, 21]. Согласно этим рекомендациям, серологическое тестирование на болезнь Лайма считается положительным, если в одной сыворотке как скрининговый метод, так и иммунноблоттинг дали положительные результаты. В РФ не имеется таких стандартизированных критериев диагностики, однако, учитывая сложный иммунопатогенез при боррелиозах, не следует основываться для постановки диагноза лишь на одном диагностическом тесте. Расширенное обследование с использованием всех доступных методов дает преимущество, особенно в диагностике безэритемных форм и поздних стадий заболевания, а также позволяет избежать диагностических ошибок, связанных с ложноположительными реакциями.
Своевременная диагностика и раннее назначение этиотропных препаратов являются эффективным средством предупреждения развития органных поражений и хронизации заболевания. Раннее назначение антибактериальной терапии при иксодовых клещевых боррелиозах позволяет достоверно снизить риск развития неврологических, суставных и кардиальных осложнений.
Лечение и профилактика ИКБ
В настоящее время стандартом терапии иксодовых клещевых боррелиозов считается использование у детей старше 8 лет и взрослых пациентов доксициклина (100 мг 2 раза в сутки) или амоксициллина (500 мг 3 раза в сутки) в течение 14 дней при острых ИКБ. При генерализованных формах (нейроборрелиоз) терапия проводится парентеральным введением пенициллина или препаратов группы цефалоспоринов (цефотаксим, цефтриаксон) не менее 14 дней. Эффективность антибактериальной терапии оценивается по характеру клинических проявлений.
Попытки создания вакцин против клещевого боррелиоза были предприняты в США, но оказались неэффективными в связи с большим разнообразием геновидов возбудителя. В настоящее время работы по созданию вакцин продолжаются [22].
Наиболее эффективными профилактическими мерами являются мероприятия по защите от укусов инфицированных клещей при посещении мест их вероятного обитания: специальная одежда, использование защитных репеллентов, акарицидные обработки лесопарковых зон, само- и взаимоосмотры [23]. Укусов клещей также можно избежать путем тщательного осмотра и удаления клещей с домашних животных [24].
При обнаружении клеща необходимо как можно скорее удалить его с помощью пинцета, избегая раздавливания насекомого. Удалять клеща необходимо полностью, поскольку оставшиеся в коже части насекомого могут привести к аллергическим реакциям и вторичной бактериальной инфекции. Использование вазелина при удалении клеща для нарушения функции дыхания у насекомого не является эффективным, поскольку клещи имеют низкую частоту дыхания (3–15 вдохов в час) и время, требуемое для гибели насекомого, может быть достаточным для передачи возбудителя человеку [25].
Возможность и необходимость превентивной антибиотикопрофилактики после укуса инфицированного клеща в настоящее время широко обсуждается отечественными и зарубежными авторами. В США антибиотикопрофилактика после укуса инфицированного клеща проводится, если:
- клещ находился на коже более 72 часов;
- продолжительность питания клеща неизвестна;
- клещ отпал сам после насыщения.
Превентивная антибиотикотерапия не показана, если:
- укус клеща случился вне эндемичных территорий;
- клещ находился на коже менее 24 часов;
- с момента укуса прошло более 72 часов.
Если клещ находился на коже от 24 до 72 часов, вопрос решается в индивидуальном порядке, например, если сделан анализ клеща и он заражен боррелиями. Для антибиотикопрофилактики используется доксициклин 200 мг — однократный прием. Для детей старше 8 лет доза составляет 4 мг/кг массы тела до максимальной 200 мг. Беременным и кормящим женщинам, детям до 8 лет назначают амоксициллин. Время до начала приема антибиотика должно составлять не более 72 часов после удаления клеща.
В России предлагаются следующие варианты антибактериальной профилактики:
- доксициклин в дозе 0,1 г 2 раза в день курсом от 3 до 5 дней, альтернативными препаратами с целью терапии и профилактики ИКБ могут быть ампициллин, азитромицин (Н. Н. Воробьева, Э. И. Коренберг) [12];
- тетрациклин по 0,5 г 4 раза в сутки 5 дней, бензатина бензилпенициллин + бензилпенициллин прокаина + бензилпенициллин 1,2–2,4 млн ЕД внутримышечно однократно, бензатина бензилпенициллин в дозе 2,4 млн ЕД внутримышечно однократно, доксициклин по 0,1 г 2 раза в сутки в течение 10 дней, амоксициллин + клавулановая кислота по 0,375 г 4 раза в сутки в течение 5 дней. Лечение проводят не позже 5-го дня от момента укуса. Риск возникновения заболевания уменьшается до 80% (Ю. В. Лобзин, С. С. Козлов, А. Н. Усков) [26].
Если говорить о выборе оптимального препарата для профилактики ИКБ, то антибиотик, используемый в этих целях, должен обладать, с одной стороны, высокой активностью в отношении боррелий даже при однократном приеме, с другой — благоприятным спектром безопасности. Доксициклин является наиболее часто применяемым для профилактики ИКБ препаратом, так как отвечает обоим требованиям. В целях минимизации риска побочных явлений предпочтительно использовать доксициклин в форме его нейтральной соли — моногидрата, который практически не ассоциирован с развитием кислотозависимых заболеваний ЖКТ (таких, как эзофагит, язва пищевода). Кроме того, доксициклина моногидрат, представленный в форме солютаб, характеризуется максимальным удобством применения, что немаловажно для пациентов, получающих антибиотик без отрыва от повседневной активности.
Резюмируя вышесказанное, можно заключить, что тактика ведения пациентов с риском развития клещевого боррелиоза должна предусматривать рациональное назначение эффективного антибактериального препарата, позволяющего предотвратить заболевание и его потенциальные осложнения.
Литература
И. В. Куимова 1 , доктор медицинских наук, профессор
О. А. Радионова
Е. И. Краснова, доктор медицинских наук, профессор
ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
Abstract. The article reveals the basic information on the clinical and epidemiological characteristics of tick-borne borreliosis in children living in the Novosibirsk region. Observation has indicated a certain tendency of increasing the amount of Ixodes tick-bore borrelioses.
Укусы ядовитых насекомых – это комплекс реакций, возникающих при контакте с шершнями, пчелами, осами, шмелями, некоторыми видами пауков, скорпионов. Патологическое влияние обусловлено проникновением в организм пострадавшего четырех видов токсических веществ: аминов, белтидов, протеинов, животных ферментов. К местным симптомам относятся жгучая боль, гиперемия, отек. Спектр системных явлений включает головокружение, слабость, головную боль, диарею, признаки аллергических реакций, судороги, паралич дыхательного центра. Диагноз устанавливается на основании анамнеза и клинической картины. Лечение предполагает удаление жала, введение гормонов, специфических сывороток.
МКБ-10

Общие сведения
Патология распространена повсеместно за исключением зон вечной мерзлоты. Встречается в теплое время года, в основном заканчивается благополучно – у пациента обнаруживаются местные признаки отравления животными ядами, исчезающие через несколько дней. В 5% ситуаций укусы ядовитых насекомых приводят к возникновению аллергических реакций, преимущественно крапивницы и ангионевротического отека. Около 1-2% случаев сопровождается выраженными нейротоксическими эффектами, развитием судорог и смерти пострадавшего. Группа риска: дети, грибники, охотники, люди, чья трудовая деятельность проходит на открытом воздухе.

Причины
Абсолютное большинство случаев связано с провокацией насекомого человеком: прикосновение руки, попытка проникнуть в гнездо, поймать животное. Укус является способом защиты, который позволяет отпугнуть значительно более крупного и физически сильного противника или убить его. Нападения происходят и с целью размножения. Так, человеческий кожный овод, обитающий в Центральной Америке, способен откладывать на коже личинки, которые впоследствии внедряются в ткани.
К числу факторов риска относится пребывание в загородной зоне летом, весной и осенью. Особой опасности подвергаются люди, которые часто совершают походы в лес, на озера, пруды, болота, не используя средства защиты (одежду из плотной ткани, москитные сетки). Травмы, возникающие как результат неосторожного контакта с насекомыми, свойственны пчеловодам. За год они получают до 15-20 ужаливаний. Аллергические реакции встречаются у людей, использующих пчел как народный способ лечения ревматических болей.
Патогенез
Патогенетическое воздействие напрямую зависит от разновидности яда. Фосфолипаза А, содержащаяся в секрете пчел, шершней и ос, обладает гемолизирующим влиянием. Происходит распад эритроцитов. Мелиттин способствует увеличению проницаемости сосудов, формированию отеков, развитию судорог, коронарных нарушений. Нейротоксин апамин воздействует на бульбарные центры и спинной мозг, способен угнетать дыхание. При единичном укусе концентрация токсиканта недостаточна для развития значимых изменений. Они возникают при массивном поражении (150-200 пчел).
Отдельные укусы ядовитых насекомых опасны из-за высокого риска аллергии. При травме происходит массивный выброс реагинов, гистамина и других биологически активных веществ. Реакция может протекать по типу анафилактического шока (нарушение центрального и периферического кровотока под действием медиаторов воспаления), ангионевротического отека (связывание жидкости в тканях на отдельном участке тела) или крапивницы (повышенная проницаемость микроциркуляторного русла, которая сопровождается блокировкой сенсорных нервных окончаний).
Классификация
Укусы ядовитых насекомых подразделяются по виду животного (пчела, оса, шершень, скорпион), по типу реакции (истинно токсическая, аллергическая), по превалирующему синдрому для истинно токсических явлений (гемолитический, нейротоксический, местная симптоматика). Наиболее распространенной считается классификация по степени тяжести поражения:
- Легкое. Проявляется преимущественно местными признаками, не приводит к возникновению значимых общих симптомов. Развивается после укуса одного или нескольких насекомых, обладающих ядом с умеренной отравляющей способностью. Обычно не требует медицинской помощи. Исключение — дети младше 1 года.
- Средней тяжести. Отмечаются локальные и умеренные системные явления, связанные преимущественно с нейротоксическим влиянием токсиканта. К среднетяжелым аллергическим реакциям относят крапивницу и отек Квинке, не затрагивающий дыхательные пути. Нарушения функции нервной системы возникают при укусах нескольких десятков пчел. Реакция гиперчувствительности может развиваться независимо от числа животных.
- Тяжелое. Наблюдается анафилактический шок, ангионевротические процессы, нарушающие проходимость ВДП, а также тяжелые токсические реакции. Последние характеризуются выраженным гемолизом эритроцитов, поражением центральной и периферической нервной системы. Обнаруживаются после ужаливания 100-150 пчелами или 5-10 скорпионами.
Симптомы
Единичные укусы ядовитых насекомых проявляются жгучей болью, возникающей сразу после происшествия. Через 15-20 минут развивается отек пораженного участка, гиперемия. Далее боль сменяется зудом. Неприятные ощущения полностью проходят спустя 24-48 часов, образовавшаяся папула может сохраняться на протяжении недели и более. При поражении глаз отмечается конъюнктивит, блефарит, слезотечение. Проникновение яда под слизистые оболочки приводит к их выраженному отеку.
Признаки системной реакции — головокружение, головная боль, светобоязнь, падение или резкий подъем артериального давления. При тяжелых отравлениях наблюдаются фибрилляторные подергивания скелетной мускулатуры, судороги, рвота, диарея, боли в области сердца. Возможен сосудистый коллапс, угнетение сознания. Наиболее неблагоприятный вариант — нарушение работы дыхательного центра, ослабление респираторной активности, массивный гемолиз и связанная с этим нефропатия.
Аллергические реакции проявляются иначе. Крапивница приводит к образованию на теле плоско-приподнятых розовых волдырей, напоминающих последствия контакта с крапивой. Симптом отека Квинке — увеличение отдельных участков, богатых подкожной клетчаткой. Наиболее опасна разновидность данного состояния с поражением верхних отделов дыхательных путей. Возникает осиплость голоса, одышка, диффузный цианоз, потливость, беспокойство. Признаки анафилактического шока — генерализованный кожный зуд, падение АД до критических величин, боль в животе и за грудиной, коллапс, утрата сознания.
Осложнения
Самое распространенное осложнение — нарушение дыхания по механическому типу, вызванное ангионевротическим отеком. Отмечается у 2-5% людей, перенесших укус насекомого. Обычно легко купируется внутривенным введением терапевтических доз глюкокортикостероидов. Приводит к гибели только при отсутствии медицинской помощи. Анафилактический шок возникает у 0,3-0,5% пострадавших. Имеет летальность около 50% без лечения и 10-25% при проведении терапевтических мероприятий.
Тяжелым осложнением множественных укусов является полиорганная недостаточность, чаще провоцируемая гемолизом эритроцитов. Остатки разрушенных красных кровяных телец забивают почечные канальцы, вызывая внутриканальцевый некроз. Нарушение работы других органов обусловлено электролитным сдвигами, изменением pH, ухудшением деятельности ферментативного аппарата. При поражении одной или двух систем летальность составляет около 20%, трех – примерно 60%.
Диагностика
Постановкой первичного диагноза на фоне тяжелых реакций занимается бригада скорой помощи. Люди с легкими поражениями обычно обращаются за медицинским пособием самостоятельно, поэтому специалистом, производящим первичный осмотр, является терапевт или врач общей практики. Требуется дифференциальная диагностика с аллергическими явлениями другого происхождения, укусами змей, эндотоксикозом, обусловленным внутренними болезнями. Необходимые обследования:
- Физикальное. АД в норме или повышено, тяжелые формы состояния сопровождаются гипотензией. Частота пульса выше нормы на 10-30 ударов/минуту. На коже обнаруживается характерная для большинства укусов папула или явления крапивницы. В анамнезе присутствует контакт с ядовитым насекомым. При аускультации легких и бронхов могут выслушиваться хрипы, свистящее дыхание.
- Лабораторное. Определяются неспецифические признаки воспаления: увеличение СОЭ, сдвиг формулы влево, лейкоцитоз, эозинофилия аллергической природы. Поражение внутренних органов приводит к росту активности печеночных ферментов, накоплению креатинина, мочевины. Выявляются электролитные сдвиги, смещение pH в кислую сторону.
- Аппаратное. Требуется только при выраженных системных явлениях. УЗИ обнаруживает участки некроза почек, увеличение размеров печени. На рентгенограмме могут присутствовать признаки стеноза дыхательных путей или отека легких (инфильтративные тени, симптом бабочки). На ЭКГ — блокады проводимости, фибрилляция предсердий, тахикардия.
Лечение укусов ядовитых насекомых
Поражения, сопровождающиеся возникновением только местных симптомов, не требуют обязательного обращения за медицинской помощью. Достаточно обработать пораженный участок преднизолоновой мазью или диметиндена малеатом, который обладает противозудным и противоотечным действием. После контакта с пчелами следует пинцетом удалить жало, делать это щипком пальцев не рекомендуется. Если у пострадавшего возникли системные проявления, необходимо обеспечить ему покой и обильное питье, вызвать бригаду СМП.
Первая помощь
На догоспитальном этапе показано введение антигистаминных средств, гормонов. Доза гормональных препаратов зависит от тяжести состояния пациента, варьируется в достаточно широких пределах. Если приступ не удается купировать, необходима симптоматическая терапия (бронхолитики, анальгетики, седативные средства) и госпитализация в токсикологический стационар. Серьезный некупирующийся отек ВДП — показание для экстренной коникотомии.
Стационарное лечение
Основа лечения — введение антитоксической сыворотки. Поскольку специфического состава, предназначенного для устранения последствий укуса насекомого, не существует, применяется противокаракуртовый или поливалентный противозмеиный препарат. Показаны повторные инъекции антигистаминных и гормональных средств, бронхолитиков. Для ускоренного выведения токсиканта используется метод форсированного диуреза и обильное питье. Срок пребывания в больнице обычно не превышает 2-5 суток.
Реанимационное пособие
Осуществляется при анафилаксии, полиорганной недостаточности, ангионевротическом отеке, слабо поддающемся лекарственному воздействию. При нарушении дыхания производится искусственная респираторная поддержка. При шоке она выполняется через интубационную трубку, при отеках ВДП накладывается трахеостома. Нарушения гемодинамики корректируют с помощью прессорных аминов, коронарные сбои могут потребовать кардиоверсии, установки внешнего стимулятора. Для устранения судорог используют бензодиазепины, мышечные релаксанты. В отдельных случаях проводят гемодиализ.
Прогноз и профилактика
При легком и среднетяжелом течении прогноз благоприятный. Высокий риск летального исхода возникает только при анафилактическом шоке и развитии полиорганной недостаточности. Количество подобных осложнений не превышает 1% от числа укушенных. Своевременно оказанная помощь не только позволяет нормализовать состояние пациента в течение 10-30 минут, но и в абсолютном большинстве случаев устраняет необходимость госпитализации. Следует учитывать возможность рецидива реакции после окончания действия препаратов.
Укусы ядовитых насекомых можно предотвратить путем использования защитной одежды при походах к местам их обитания (леса, поля, водоемы). Для минимизации последствий травмы во время путешествий следует иметь с собой несколько таблеток антигистаминного препарата и ампулу дексаметазона. Для быстрой нейтрализации аллергических явлений препарат необходимо рассосать во рту. Терапевтический эффект достигается через 5-10 минут, что незначительно превышает начало действия этого средства при внутривенном вливании.
Аллергия на укусы жалящих и кровососущих насекомых - это развитие реакции гиперчувствительности к компонентам яда, слюны и другим веществам, попадающим в организм человека при контакте с членистоногими. При этом аллергическая реакция может быть немедленной или замедленной, клинические проявления местными – в виде отека, покраснения или общими – вплоть до анафилактического шока. Диагностика аллергии включает сбор анамнеза, анализ симптомов заболевания и данных лабораторных исследований. Лечение – удаление аллергена и уменьшение его всасывания, противошоковые мероприятия, АСИТ.
МКБ-10
Общие сведения
Аллергия на укусы и ужаления насекомых, а также гиперреакция при контакте с продуктами их жизнедеятельности (инсектная аллергия) обнаруживается у каждого десятого жителя нашей планеты. Наиболее опасна аллергическая реакция на яд перепончатокрылых жалящих насекомых, которая нередко заканчивается анафилактическим шоком и смертельным исходом. Сенсибилизация к яду пчел, ос, шершней чаще развивается у молодых пациентов в возрасте до 20 лет, в том числе у детей и подростков.

Причины
Чаще всего острые аллергические реакции возникают при укусах перепончатокрылых жалящих насекомых: пчел, шмелей, ос, шершней, а также муравьев. В яде, проникающем в организм во время укуса, содержится большое количество высокомолекулярных белков-ферментов, основных пептидов, биогенных аминов, которые приводят к развитию целого каскада нежелательных реакций. Это местные изменения в зоне укуса (расширение сосудов и повышение их проницаемости, раздражение болевых рецепторов), токсический эффект всасываемого яда и непосредственно сама аллергическая реакция.
При укусах кровососущих насекомых: комаров, мошек, слепней, клопов, блох в кожные покровы со слюной проникают различные биологически активные элементы, обладающие токсическим, противосвертывающим действием и нередко вызывающие развитие гиперчувствительности. Аллергия может возникать на укусы жуков, тараканов, некоторых разновидностей бабочек, а также при контакте с продуктами жизнедеятельности насекомых.
Патогенез
Сенсибилизация при инсектной аллергии развивается несколькими путями: парентеральным (при ужалении, укусе), аэрогенным (попадание в дыхательные пути с домашней пылью частиц насекомых и их экскрементов), контактным, алиментарным (при приеме пищи). Основные механизмы патологического процесса обусловлены возникновением аллергических реакций немедленного типа, иммунокомплексных и псевдоаллергических реакций.
При немедленном реагировании иммунной системы вырабатываются специфические иммуноглобулины IgE к конкретному виду инсектного аллергена. В этом случае симптомы болезни обычно появляются в первые 10-20 минут после укуса. Иммунокомплексный тип реакций сопровождается синтезом IgG и формированием циркулирующих иммунных комплексов, при псевдоаллергии патологический процесс запускают биологически активные компоненты, содержащиеся в яде и слюне насекомых.
Симптомы аллергии на насекомых
Клинические признаки аллергии могут быть местными (ограниченными местом ужаления или укуса), органными (характеризующимися нарушением функции органов-мишеней) и генерализованными, когда патологический процесс является системным, нарушает работу всего организма и представляет серьезную угрозу для жизни. Местные изменения характеризуются появлением на коже локального очага покраснения и отека размером от 7-10 сантиметров в диаметре, сопровождающегося выраженным кожным зудом. Иногда в районе укуса может возникать папулезная сыпь, локализованные участки некроза, пузыри. При расчесах и отторжении эпидермиса возможно инфицирование.
Системные проявления аллергии на укусы членистоногих могут быть легкими (распространенная сыпь, зуд, беспокойство), выраженными (присоединение головокружения, болей за грудиной и по ходу кишечника, диспепсии), тяжелыми (осиплость голоса, одышка, удушье, страх смерти, сопор). В крайне тяжелых случаях после укуса развивается анафилактическая реакция с выраженным снижением артериального давления, потерей контроля над функцией тазовых органов, появлением сопора и комы, остановкой дыхания и сердечной деятельности, что при отсутствии экстренной помощи заканчивается летальным исходом.
Органные проявления аллергии встречаются достаточно редко и характеризуются развитием сосудистого воспаления по типу васкулита, поражения сердечной мышцы, ткани почек, мозга, суставов, периферической нервной системы и появлением симптоматики, встречающейся при данных заболеваниях. Непосредственный контакт с телами насекомых и их экскрементами иногда приводит к появлению симптомов риноконъюнктивита, стоматита, бронхоспазма, диспепсии.
Диагностика
Основная задача специалиста в области современной аллергологии на этапе постановки диагноза – тщательный сбор анамнестических данных (наличие в прошлом аллергических реакций при контакте с насекомыми, установление факта укуса, вид членистоногого и т. д.), внимательный клинический осмотр (выявление симптомов поражения кожных покровов, наличие признаков генерализации и органных расстройств). При необходимости назначаются дополнительные исследования, помогающие диагностировать системные и органные нарушения (общий и биохимический анализ крови, анализ мочи, ЭКГ, спирография, УЗИ органов брюшной полости и т. д.).
Выполняются специальные тесты, используемые в диагностике аллергических болезней. Среди них – кожные аллергопробы с инсектными аллергенами (проведение тестов должно осуществляться только врачом-аллергологом в специализированном кабинете), лабораторные анализы для выявления специфических иммуноглобулинов к аллергенам и другие исследования. Дифференциальная диагностика аллергии на укусы насекомых осуществляется с другими аллергическими реакциями (крапивницей, отеком Квинке, ринитами и конъюнктивитами, бронхоспастическими состояниями), контактным дерматитом, различными токсическими реакциями, заболеваниями внутренних органов. Может потребоваться консультация дерматолога, кардиолога, нефролога, ревматолога и других специалистов.
Лечение аллергии на насекомых
При местных реакциях лечение амбулаторное. При развитии анафилактического шока, системных и органных реакций показано лечение и последующее наблюдение в стационаре. Лечебные мероприятия при аллергии на укусы насекомых предусматривают скорейшее выведение аллергена из организма и уменьшение его всасывания, проведение симптоматического лечения и АСИТ.
- Элиминация аллергена. При наличии жала производится его удаление. Накладывается жгут выше места укуса на 20 минут и холод местно. Необходимо обеспечить покой и возвышенное положение конечности.
- Лекарственные препараты. Применяются антигистаминные средства первого и второго поколения, глюкокортикостероидные гормоны, прессорные амины, бронхолитики и другие медикаменты, показанные для нормализации функции пострадавшего органа или системы.
- АСИТ. Проведение аллерген-специфической иммунотерапии осуществляется по показаниям в условиях специализированного аллергологического кабинета.
Прогноз и профилактика
При своевременном обращении к специалисту и оказании квалифицированной медицинской помощи аллергия на укусы насекомых в большинстве случаев заканчивается благоприятно при полном восстановлении трудоспособности. При развитии тяжелых системных и органных поражений прогноз ухудшается.
Профилактика предусматривает проведение санитарно-просветительной работы, ограничение пребывания возле пасек и других мест, где могут скапливаться насекомые (плодоовощные рынки, свалки мусора и т. д.), использование средств защиты (маски, сетки, одежда), поддержание чистоты в помещениях, обработка химическими средствами для отпугивания и уничтожения членистоногих. При наличии в анамнезе случаев аллергии на укусы насекомых следует составить и носить с собой паспорт больного аллергическим заболеванием и набор с медикаментами (противошоковый комплект).
1. Инсектная аллергия: новые подходы к диагностике/ Лазаренко Л. Л.//Группа компаний Алкор-Био. - 2016 - №4.
2. Инсектная аллергия и особенности ее терапии/ Мачарадзе Д.Ш.// Медицина неотложных состояний. - 2007 - №4 (11). - 2007.
3. Аллергия к насекомым. Современные принципы диагностики и лечения/ Федоскова Т.Г.// Русский медицинский журнал. - 2007 -№2.
Мигрирующая эритема (хроническая мигрирующая эритема Афцелиуса-Липшютца) – кожное проявление первой стадии боррелиозной инфекции. Возникает в месте укуса заражённого боррелиозом клеща при проникновении возбудителя болезни в кожу со слюной насекомого. Отличительной особенностью эритемы является её постоянное увеличение в размерах с одновременным разрешением гиперемии в центре. Патология диагностируется после консультации врача-инфекциониста с учетом данных иммуноферментного анализа венозной крови на антитела к возбудителю. Лечение – антибиотикотерапия, иногда глюкокортикоиды и антигистаминные средства.
Общие сведения

Причины мигрирующей эритемы
Возбудитель мигрирующей эритемы – боррелия, переносчиком которой является заражённый иксодовый клещ. Существуют природные очаги его обитания, клещ встречается в лесах, прибрежных зонах и парках, где насекомое обитает на стеблях цветов и трав. Заражение человека происходит в момент укуса, когда со слюной клещ впрыскивает в кровь боррелию. Продолжительность пребывания переносчика на коже не имеет значения, инфекционно-аллергический процесс начинает развиваться сразу после проникновения слюны с возбудителем в кровь пациента. Хозяевами боррелий являются домашние или дикие животные, клещ выступает только в роли пожизненного носителя, становясь переносчиком инфекции после укуса заражённого животного.
Укус клеща нарушает целостность кожных покровов. Часть боррелий остаётся в месте внедрения, остальные с током крови и лимфы разносятся ко всем органам и тканям, оседают в лимфатических узлах. Инфекционно-аллергическая эритема является патогномоничным проявлением дебюта болезни Лайма и образуется на коже в первые часы с момента заражения. Вслед за ней через месяц появляется полиорганная симптоматика. Следует отметить тот факт, что в 25% случаев мигрирующая эритема не развивается. Вероятно, это связано с особенностями функционирования иммунной системы организма, силой ответной реакции, количеством проникшего в кожу возбудителя и его вирулентностью.
Боррелия внедряется в кожу, по лимфатическим сосудам проникает в глубокие слои и вызывает воспаление, одновременно сенсибилизируя дерму. В процессе альтерации, экссудации и пролиферации участвуют клетки иммунной и гистиоцитарной системы кожи, лимфоциты и макрофаги. Они связывают боррелии, воспринимая их как чужеродные антигены. Одновременно происходит стимуляция клеточной пролиферации с замещением дефекта ткани в месте укуса клеща.
Симптомы мигрирующей эритемы
Мигрирующая эритема является ключевым признаком, позволяющим установить наличие боррелиоза, поэтому ранняя диагностика этого заболевания чрезвычайно важна. Патологический процесс при возникновении мигрирующей эритемы имеет инкубационный период продолжительностью 32 дня и включает 3 клинические стадии развития: раннюю, диссеминированную и позднюю.
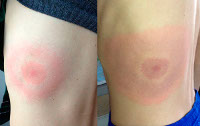
В диссеминированной стадии мигрирующей эритемы боррелии в большом количестве поступают в кровь из лимфоузлов. Эритема увеличивается в размерах. Происходит дополнительная сенсибилизация организма, отмечается снижение иммунитета. Появляются новые множественные уртикарные высыпания и вторичные кольцевидные элементы, возможна доброкачественная лимфоцитома кожи. Присоединяются температура и головная боль, нарастают слабость и бессонница, выявляются неврологические и кардиальные симптомы. Вторая стадия длится от 6 месяцев до 2 лет. При недостаточном иммунном ответе, некорректно рассчитанной дозе лекарственного препарата, высокой вирулентности и большом количестве боррелий заболевание переходит в третью стадию.
Хроническая (поздняя) стадия мигрирующей эритемы характеризуется развитием акродерматита и хронического Лайм-артрита. Наблюдается симметричное поражение суставов, сопровождающееся отеком, ограничением движений, локальной гиперемией и гипертермией. Мигрирующая эритема приобретает фиолетовый оттенок, истончается и атрофируется в центре, через кожу начинают просвечивать сосуды и подлежащие ткани. При этом пятно по-прежнему растёт, увеличиваясь в размерах, но локализуется уже не в месте укуса клеща, а рядом с суставами или на разгибательной поверхности конечностей. Стадия длится годами.
Диагностика мигрирующей эритемы
Быстрота и точность диагностики при мигрирующей эритеме важны для своевременного купирования процесса. Диагноз выставляется коллегиально врачом-дерматологом и врачом-инфекционистом на основании клинической картины и данных анамнеза. Для подтверждения проводят иммуноферментный анализ венозной крови, взятой через 21 день после укуса клеща (раньше антитела не различимы), на антитела к боррелиям. Применяют метод непрямой иммунофлуоресценции (РНИФ), иммуноблоттинг (сочетание электрофореза и ИФА или РИА). Реже используют иммунофлюорометрию и реакцию непрямой агглютинации.
Для исключения менингита и сочетанной инфекции проводят люмбальную пункцию с исследованием спинномозговой жидкости методом ПЦР и ИФА. Патоморфологическая картина неспецифична. Мигрирующую эритему дифференцируют с укусами пчёл и других насекомых, дерматитом, трихофитией, сифилитической розеолой, склеродермией, эритемой Дарье, мигрирующим миазом.
Лечение мигрирующей эритемы
Самолечение исключается. Лечение мигрирующей эритемы патогенетическое, проводится врачом-инфекционистом. Необходимость в местной терапии отсутствует. Во время инкубационного периода превентивно в амбулаторных условиях назначают цефалоспорины, антибиотики тетрациклинового и пенициллинового ряда. Аналогичную терапию продолжают на ранней стадии заболевания. Индивидуальную схему приёма антибактериальных препаратов рассчитывают для каждого пациента на килограмм веса. При возникновении осложнений или резистентности к проводимой терапии осуществляют инъекционное введение антибиотиков в сочетании с антигистаминными средствами. В тяжёлых случаях применяют глюкокортикоиды.
После купирования мигрирующей эритемы пациент обязан находиться на диспансерном наблюдении у врача инфекциониста в течение 1,5-3 лет (в зависимости от тяжести патологического процесса), периодически сдавая анализ крови на титр антител к боррелиям.
Профилактика и пргноз мигрирующей эритемы
Специфической профилактики боррелиоза не существует. Летом, в фазу активной жизнедеятельности клещей, нужно минимизировать риск попадания насекомых на кожу: помнить, что клещи живут в траве, использовать репелленты при выезде на природу, одеваться в светлые одежды, максимально закрывающие кожу от насекомых (длинные рукава, брюки с резинками, высокие сапоги, головные уборы), осматривать кожу по возвращении домой.
При укусе клеща не следует дожидаться развития мигрирующей эритемы. Необходимо снять насекомое с кожи, поместить в герметичный сосуд и сдать на анализ в СЭС. Нужно обратиться к инфекционисту, который может сделать инъекцию интерферона или (реже) назначить профилактический курс антибактериальной терапии. После получения результатов анализа решение о дальнейшем ведении пациента принимает специалист. Прогноз при своевременной диагностике и лечении благоприятный.
Аллергены насекомых могут вызвать развитие сенсибилизации при попадании в организм несколькими путями: с ядом — при ужалении перепончатокрылых (пчелы, осы и др.); со слюной — при укусе насекомых отряда двукрылых (комары, москиты
Аллергены насекомых могут вызвать развитие сенсибилизации при попадании в организм несколькими путями: с ядом — при ужалении перепончатокрылых (пчелы, осы и др.); со слюной — при укусе насекомых отряда двукрылых (комары, москиты и др.); ингаляционным и контактным способом — с чешуйками, личинками бабочек, сверчков, жуков и т. п. [1].
Аллергия на укусы насекомых протекает в виде немедленной или замедленной реакции в местах укуса. Обычно укус кровососущих насекомых (комаров, москитов, блох) вызывает локальные проявления в виде отека, покраснения и полиморфной сыпи (папулезной, уртикарной, геморрагической, буллезной, некротической формы) и крайне редко — серьезные аллергические реакции. Иногда на укусы мошек может наблюдаться рожистоподобная реакция в виде острой эритемы, протекающей без повышения температуры и увеличения регионарных лимфоузлов. Аллергены слюны москитов могут быть также причиной развития зудящей узелковой сыпи (флеботодермия). Описаны редкие случаи генерализованной уртикарной сыпи на укус даже одного кровососущего насекомого [1, 2].
Наибольшую опасность представляет ужаление перепончатокрылых насекомых, которые могут вызвать серьезные аллергические реакции вплоть до анафилактического шока. Самым частым аллергеном, вызывающим развитие аллергии, является яд ос и пчел, шмели жалят очень редко [2]. Причем шмели и пчелы жалят только в тех случаях, когда бывают спровоцированы.
Инсектная аллергия чаще встречается в летнее и осеннее время. Насекомые жалят при проведении садовых работ, в местах пикников, привлекают их также дворовые мусорные баки, компостные ямы; не стоит забывать о гнездах ос, которые располагаются, как правило, под карнизами, на чердаках. Однократное воздействие больших доз яда насекомых через ужаление сопоставимо с ежегодной дозой вдыхаемых аллергенов пыльцы. Развитие такой высокодозовой сенсибилизации объясняет, почему распространенность атопии среди пациентов с IgЕ-сенсибилизацией к ядам та же, что и в нормальной популяции [3].
Нормальная реакция на ужаление насекомых обычно проявляется в виде умеренного локального покраснения и отечности, тогда как выраженная локальная реакция — эритемой и сильным отеком, который может нарастать в течение 24–48 ч и сохраняться даже более 10 дней. Одновременно больного могут беспокоить слабость, недомогание, тошнота. В редких случаях имеют место инфекция и воспаление подкожно-жировой клетчатки [2].
Местные реакции лечат наложением на место укуса холодного компресса, используют также наружную терапию топическими противозудными препаратами (Фенистил гель, Псилобальзам), больному дают антигистаминный препарат нового поколения (лоратадин, цетиризин и др.). При сильно выраженной локальной реакции назначают топические кортикостероиды нефторированного ряда (метилпреднизолона аципонат, мометазона фуроат и др.). В наиболее тяжелых случаях местной реакции обосновано назначение 2–3-дневного курса преднизолона в дозе 30–40 мг/сут.
Примерно у 5% больных с выраженной местной реакцией в анамнезе при повторном ужалении насекомого может развиться генерализованная системная реакция с жизнеугрожающим состоянием — анафилактический шок. Чаще всего такие реакции вызываются ужалениями ос, пчел, реже шмелей и шершней; в 30% случаев больные не могут назвать вид ужалившего насекомого.
В США ежегодно погибает около 50 человек от аллергии на ужаление насекомых. Анафилактический шок на ужаление считается также одной из причин необъяснимой внезапной смерти. Большинство летальных случаев в 1998 г. в этой стране было отмечено у лиц в возрасте 40–60 лет, чаще у мужчин (28%), крайне редко — у детей (1 случай среди детей в возрасте 0–9 лет) [4]. В Казани, по данным проф. Р. С. Фассахова и соавторов, с 1993 по 1998 г. в аллергологическое отделение поступило 55 пациентов с аллергией на ужаление насекомого в возрасте от 16 до 70 лет [5]. В 44% случаев реакции были вызваны ужалением ос, в 31% случаев — пчел, шершня — в 1 случае. В популяционном исследовании мы не выявили ни одного случая системной аллергии на укус насекомых при опросе 2147 школьников г. Москвы (2003 г.) [6].
Реакции на ужаление перепончатокрылых насекомых делятся на аллергические, токсические и псевдоаллергические. Гиперчувствительность к яду или слюне насекомых запускается иммунологическими механизмами по немедленному типу с включением аллергенспецифических IgE-антител. Токсические реакции возникают при одновременном ужалении большим количеством насекомых и индуцируются действием ряда медиаторов, содержащихся в их яде. По клинической картине отличить токсические от аллергической реакции иногда бывает довольно трудно. У некоторых больных через 2–7 дней после ужаления могут возникать реакции, напоминающие сывороточную болезнь (артралгии, уртикарная сыпь, недомогание, повышение температуры). Такие больные при повторном ужалении имеют высокий риск развития анафилактического шока [2].
Выше уже говорилось о локальных реакциях при укусе насекомых. Системные реакции встречаются намного чаще местных (до 70% всех случаев ужаления насекомых) и, по мнению ряда авторов, могут различаться по степени тяжести [2, 4]. Однако клинические симптомы анафилактического шока, вызванного ужалением насекомого, хотя и могут варьировать по проявлениям и выраженности, но они ничем не отличаются от анафилактического шока любой этиологии [4].
У больных с анафилактическим шоком в 100% случаев встречаются гемодинамические нарушения: снижение артериального давления, слабость, головокружение. Другие типичные клинические симптомы анафилактического шока — диффузная эритема, сыпь, крапивница и/или ангиоотек; бронхоспазм; ларингоотек и/или нарушение сердечного ритма. У больного могут наблюдаться также такие признаки, как тошнота, рвота, головная боль, потеря сознания; в 5–8% случаев — головная боль, судороги, боль в груди.
Генерализованная крапивница или ангиоотек являются наиболее частой клинической манифестацией анафилаксии (92%) и наблюдаются как изолированно в виде одного симптома, так и на фоне тяжелой анафилаксии [7]. Однако кожные симптомы могут появиться позже или отсутствовать при быстром прогрессирующем течении анафилаксии. Следующие по частоте симптомы — респираторные (ангиоотек гортани, острый бронхоспазм), реже встречаются абдоминальные и гастроинтестинальные симптомы (боль в животе, тошнота, диарея).
Чаще всего симптомы анафилактического шока появляются в течение первых 15 мин после ужаления, причем раннее начало практически всегда ассоциируется с более тяжелым течением и соответственно выраженной симптоматикой заболевания. Дети имеют меньший риск развития повторной анафилаксии, особенно если у них аллергия на ужаление проявлялась в виде кожных симптомов (крапивница, сыпь, отек Квинке). Однако у больных любого возраста с первичным тяжелым анафилактическим шоком в анамнезе при повторном ужалении насекомого возможен рецидив анафилаксии в 70% случаев [2].
Поскольку жизнеугрожающие симптомы анафилаксии могут рецидивировать, больных следует наблюдать в течение первых 24 ч после первых проявлений заболевания (в 20% случаев анафилактический шок может рецидивировать через 8–12 ч после первого эпизода) [7]. Исследователи отмечают бифазное течение анафилаксии, которое клинически не отличается друг от друга, но требует использования достоверно больших доз адреналина.
К факторам, которые усиливают тяжесть анафилактического шока или влияют на его лечение, относят наличие у больного бронхиальной астмы, сопутствующих заболеваний сердечно-сосудистой системы, лекарственную терапию β-адреноблокаторами (Анаприлин, Атенолол, Метопролол и др.), ингибиторами ангиотензинпревращающего фермента и моноаминооксидазы. В таких случаях, с одной стороны, усиливается реакция дыхательных путей на высвобождаемые при анафилаксии медиаторы воспаления, а с другой — уменьшается влияние адреналина: наряду с тяжелой степенью анафилаксии появляется парадоксальная брадикардия, гипотензия, тяжелый бронхоспазм [7]. Экспериментально было доказано, что в таких случаях для купирования бронхоспазма и восстановления β-адренергической чувствительности у больного, принимающего β-адреноблокаторы, дозу неселективного β-агониста тербуталина необходимо увеличить в 80 раз [8]. Применение ингибиторов ангиотензинпревращающего фермента (Капотен, Энап) у ряда больных вызывает кашель, отек гортани или языка с последующим развитием асфиксии. Ингибиторы моноаминооксидазы (моклобемид, ниаламид и др.) замедляют скорость расщепления адреналина, усиливая его побочные эффекты [2, 8].
Наибольшее количество летальных случаев от инсектной аллергии, регистрируемые в группе лиц старшего возраста, связывают с наличием сопутствующих сердечно-сосудистых заболеваний, с приемом лекарств и наличием других возрастных патологических изменений в организме [8].
Лечение и профилактика
Анафилактический шок требует проведения неотложной терапии: незамедлительно у больного оценивают сердечную и дыхательную деятельность, проверяют адекватность поведения. Препаратом выбора при анафилактическом шоке является адреналина гидрохлорид.
Адреналин обладает следующими свойствами:
- оказывает прямое стимулирующее влияние на β- и α-адренорецепторы. Преобладание эффекта возбуждения тех или иных адренорецепторов зависит от дозы препарата и уровня регионарного кровотока;
- способен вызвать сильный спазм периферических сосудов, особенно при заболеваниях почек и других внутренних органов;
- при аллергии немедленного типа препятствует высвобождению из тучных клеток и базофилов гистамина, серотонина, брадикинина и других медиаторов воспаления;
- стимулирует метаболизм, повышая потребление кислорода, вызывает развитие ацидоза вследствие накопления молочной кислоты, усиливает липолиз и способствует возникновению гипергликемии в результате стимуляции гликогенолиза;
В зависимости от диапазона применяемых доз может оказывать эффекты:
Адреналина гидрохлорид выпускают в виде 0,1%-ного раствора в ампулах по 1 мл (в разведении 1 : 1000 или 1 мг/мл); для внутривенного введения 1 мл 0,1%-ного раствора адреналина разводят в 9 мл физиологического раствора. Адреналин нельзя разводить в растворе глюкозы или гидрокарбоната натрия. Важно помнить, что на активность адреналина также влияют условия хранения препарата.
Дозы при внутривенном введении рекомендуются следующие. При развитии анафилактических реакций: 0,1–0,3 мл адреналина (в разведении 1 : 1000) разводится в 9 мл раствора натрия хлорида (от 1 : 100 000 до 1 : 33 000) с последующей инфузией в течение нескольких минут; возможно повторное введение в случае отсутствия чувствительности, а также при стойкой артериальной гипотензии.
При тяжелом терминальном состоянии больного 0,1%-ный раствор адреналина в дозе 0,1 мл разводят в 0,9 мл венозной крови больного (аспирируют непосредственно из вены или катетера) или раствором натрия хлорида (для получения разведения 1 : 10 000), вводят внутривенно в течение нескольких минут; повторно — по показаниям до поддержания систолического артериального давления выше 100 мм рт. ст. у взрослых и 50 мм рт. ст. у детей.
В качестве побочного действия адреналин может вызвать острый инфаркт миокарда, выраженные аритмии и метаболический ацидоз; малые (менее 1 мкг/мин) дозы адреналина могут послужить причиной развития острой почечной недостаточности.
Вероятность развития подобных серьезных осложнений является главной причиной рекомендации воздержаться от широкого применения адреналина самими пациентами. Однако своевременное введение именно адреналина имеет решающее значение для благоприятного исхода анафилактического шока. За рубежом эта проблема решена: больных с любым анафилактическим шоком в анамнезе снабжают специальным шприцом-ручкой — эпинефрином в виде аутоинъектора (Epi-Pen, Аnа-Kit). В научной литературе ежегодно публикуются исследования, посвященные анализу использования аутоинъекторов эпинефрина у пациентов с инсектной аллергией, а также пищевой, латексной и идиопатической анафилаксией в анамнезе. Есть также работы, в которых освещается роль обучающих программ для школьных медсестер и инспекторов школ с целью незамедлительного введения эпинефрина детям с тяжелой формой аллергии и анафилаксией, что в значительной степени облегчается именно с помощью использования аутоинъектора.
Каждый больной, перенесший анафилактический шок, подлежит госпитализации в реанимационное отделение, где проводится инфузионная терапия преднизолоном 1–2 мг/кг каждые 6 ч, физиологическим раствором, глюкозой из расчета 5–10 мл/кг веса пациента; вводятся антигистаминные препараты внутривенно. При резистентной гипотонии назначают допамин (400 мг в 500 мл физиологического раствора, скорость введения — 2–20 мкг/кг/мин) под контролем артериального давления (> 90 мм рт. ст.) или глюкагон (струйно 1–5 мг каждые 5 мин, затем капельно 5–15 мкг/мин) до нормализации артериального давления. Через 1–2 дня из реанимационного отделения больного переводят в аллергологическое или терапевтическое отделение, где ему продолжают гормональную терапию преднизолоном перорально в дозе 10–15 мг в течение 10 дней; назначают антигистаминные препараты II поколения (лоратадин, цетиризин и др.), антибиотики (по показаниям), проводят контроль за функцией почек, печени, сердца, ЭКГ, консультацию невропатолога.
Диагноз IgE-гиперчувствительности к насекомым обязательно следует подтверждать кожными или серологическими пробами. Для постановки правильного диагноза и назначения аллергенспецифической терапии важно определить вид насекомого, вызвавшего реакцию. Локальная реакция без системных проявлений (анафилактический шок) не требует проведения аллергологического обследования. Напротив, кожные пробы на аллергены насекомых обязательно ставят, если в анамнезе у пациента любого возраста отмечались системные реакции жизнеугрожающего характера, а также неугрожающие жизни системные проявления у взрослых и детей (младше 16 лет). Возможна постановка проб также при локальных и токсических реакциях в анамнезе у больного [4]. Разработаны тесты in vitro — определение специфических IgЕ-антител, например: к яду пчелы медоносной, осы, шершня, слепня, комару обыкновенному, огневке мельничной, амбарному долгоносику, голубиному клещу, платяной моли (Allergopharma).
Больным с аллергией на ужаление насекомых аллергенспецифическую терапию назначают только в двух случаях: при системной жизнеугрожающей реакции и системной, не угрожающей жизни реакции у взрослых, имеющих положительные кожные пробы. Дети младше 16 лет с кожными проявлениями, не угрожающими жизни (например, в виде генерализованной крапивницы), не нуждаются в проведении аллергенспецифической иммунотерапии даже при наличии положительных специфических IgЕ-антител в крови. Продолжительность специфической иммунотерапии составляет не менее 5 лет [2, 5].
Соответствующим медицинским органам необходимо рассмотреть возможность преодоления всех этих неблагоприятных ситуаций. Добиться прорыва в данном направлении частично удастся, если мы обучим пациентов простым превентивным мерам, что нередко является решающим в спасении их жизни. Пациенты должны соблюдать определенные правила, в частности не привлекать насекомых и избегать их укусов, для чего:
— не пользоваться духами и не надевать яркую одежду;
— не есть на улице зрелые фрукты, не подходить близко к мусорным бакам и компостным ямам, которые привлекают насекомых;
— не открывать окна в автомобиле во время езды.
Следует довести до сведения родителей, учителей и школьников информацию о необходимости обеспечивать безопасность окружающей среды ребенку с высоким риском анафилактических реакций на укусы насекомых. Каждый пациент с аллергией на ужаление насекомого должен иметь бирку или браслет с данными о своем диагнозе и письменными рекомендациями по проведению неотложных мер в случае ужаления [1–5].
По вопросам литературы обращайтесь в редакцию.
Д. Ш. Мачарадзе, доктор медицинских наук, профессор
РУДН, Москва
Читайте также:

