Инфекционно токсические заболевания новорожденных это
Обновлено: 22.04.2024
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
СЕПСИС ( С) – Неонатальный С – генерализованное инфекционное заболевание с ациклическим течением, вызванное условнопатогенной бактериальной микрофлорой, в основе которого лежит дисфункция иммунной системы организма с развитием очага (очагов) гнойного воспаления или бактериемии, системной воспалительной реакции и полиорганной недостаточности у детей первого месяца жизни.
Эпидемиология. Данные о распространенности С противоречивые. Считают, что С развивается у 0,1-0,8% новорожденных. Особенно часто С встречается у недоношенных и у детей, находящихся на лечении в реанимационных отделениях – до 14%. Установлено, что один документированный случай сепсиса приходится на 11-23 случаев, когда новорожденным назначают лечение, исходя из подозрения на наличие сепсиса (Gerdes J.S., 1991).
Этиология. В антенатальном период наиболее частыми возбудите-
лями С являются: стрептококки группы В, E. Coli, S. Agalactucae . В
интранатальном периоде С вызывают: S. Agalactucae, E. Coli, S. Aureus. Для постнатального периода характерны: S. Aureus, E. Coli, Klebsiella spp., S. Pyogenis и др.
Табл. 2.28. Наиболее вероятные возбудителя сепсиса в зависимо-
сти от локализации первичного очага инфекции
Наиболее вероятные возбудители
S. Aureus, E. Coli
Легкие. В том числе
S. pneumonie, K. pneumonie, S. Aureus et
epidermidis, H. Influenzae тип В, Ps.
Aeruginosae (при ИВЛ), Actnetobacter spp (при
Enterobacteriocease spp., Enterobacter spp.,
Enterobacteriocease spp., Enterobacter spp., Ps.
S. Aureus et epidermidis
S. pyogenis et viridas
S. pyogenis et viridas
S. pyogenis et viridas, E. Coli, H. Influenzae
E. Coli, Enterobacteru Enterococcus spp., S.
Aureus et epidermidis
S. Aureus et epidermidis
Развития бактериемии является важным этапом патогенеза С. Существенным моментом при этом является недостаточная активность иммунной системы новорожденного. Выделяющиеся при развития воспалительного процесса цитокины, катехоламины, кинины и другие биологически активные вещества приводят к формированию системного воспалительного ответа (реакции). На первом этапе этих изменений происходит повышение периферического сопротивления, АД, снижение капиллярной перфузии тканей. В дальнейшем развиваются гиповолемия, нарушение утилизации глюкозы, избыточная активация гипоталамо-гипофизарно-надпочечниковой системы.
Падение уровня СТГ, неадекватный выброс АКТГ, с нижение функциональной активности щитовидной железы лежат в основе усугубления системного воспалительного ответа, что приводит к формированию полиорганной недостаточности.
Важным моментом в развитии С является формирование ДВСсиндрома, который присутствует при этом заболевания практически во всех случаях.
ДВС-синдром является одним из основных причин развития гемокоагуляционного и септического шоков.
Полиорганная недостаточность, вторичная иммунная недостаточность, способствуют формированию вторичных гнойных очагов.

Активация защитных систем ор-
Избыточная активация гипоталамо-
тываю- щая и проти тивосвос- верты тываю- щая
Формирование полиорганной недостаточ-
Рис. 2.3. Схема патогенез сепсиса Классификация. Единой классификации сепсиса новорожденных
в России в настоящее временя нет. Выделяют ранний (врожденный С), при котором проявления заболевания появляются в первые 3 дня жизни ребенка и поздний С, который развивается после 3-го дня жизни.
В зависимости от условий инфицирования выделяют внебольничный и внутрибольничный С. В диагнозе С так же указывают этиологию заболевания, входные ворота (пупочная ранка, кожа, легкие, ЖКТ и др.). По клинической форме выделяют: септицемию и септикопиемию.
Проявлениями полиорганной недостаточности являются: септический шок, острая легочная недостаточность, острая сердечная недостаточность, острая почечная недостаточность, острая кишечная непроходимость, острая надпочечниковая недостаточность, отек мозга, вторичная иммунная дисфункция.
Исследования. Общий анализ крови (с подсчетом тромбоцитов) и анализ мочи, посев крови, а также посевы из гнойных очагов (экссудата, мочи, ликвора и др.) ; протеинограмма ; коагулограмма; общий билирубин, трансаминазы крови ; копрограмма; рентгенография органов грудной клетки, УЗИ; уровни мочевины и креатинина в крови; парциальное давление газов крови (РаО 2 , РаСО 2 ), SaO 2 ; показатели КОС; ЭКГ, ЭхоКГ; уровень кортизола в крови, уровень тиреотропного гормона (ТТГ); С-реактивный белок, иммунограмма, прокальцитонин сыворотки, интерлейкин-8 в сыворотке крови.
Клиника С зависит от формы заболевания, возраста, этиологии, и т.д. Для оценки степени тяжести С целесообразно использование различных шкал.
Характерной клинической картины С у новорожденных нет. Клинику неонатального С можно описать следующим образом: младенец плохо выглядит, плохо дышит и плохо усваивает питание. При раннем неонатальном С отмечают патологические прибавки массы тела, отеки, в том числе плотные (склерема), геморрагический синдром и тромбозы, раннее появление и быстрое прогрессирование желтухи, дыхательные расстройства в отсутствии выраженных рентгенографических изменений, чаще гипотермия, гепатоспленомегалия, срыгивания и рвота, олигурия. В этом случае возможна манифестация септическим шоком. При позднем неонатальном С выявляют более постепенное начало с формированием типичного септического габитуса: серый оттенок ко-
жи, усиление мраморного рисунка, патологические потери массы или плоская весовая кривая, затяжное течение желтухи, диспептические расстройства, неврологические и дыхательные нарушения, геморрагический синдром, нарушения кровообращения.
Первичный септический очаг при раннем неонатальном С как правило отсутствует. Первичный септический очаг у детей позднего неонатального периода чаще всего проявляется поражением пупочных сосудов (<25%), заболеваний легких (20-25%) и кишечника (не менее 20%), другие локализации входных ворот не превышают 2-6%. В некоторых случаях установить входные ворота С не удается (криптогенный С).
Септицемия – форма С с наличием не более одного очага гнойной инфекции (входные ворота). Характерно фульминантное развитие клинических симптомов, системной воспалительной реакции и ПОН при отсутствии метастатических пиемических очагов.
Септический шок – С с гипотензией, сохраняющейся, несмотря на адекватное волемическое возмещение, и нарушением тканевой перфузии, полиорганной недостаточностью.
Клиника раннего С у новорожденных, вызванного β - гемолитическим стрептококком группы В: развитие С в первые дни жизни, апноэ, снижение АД, персистирующее фетальное кровообращение, заболевания легких, неотличимые от РДС, масса тела при рождении менее 2500 г, низкая оценка по шкале Апгар, лихорадка у матери, преждевременные роды, длительный безводный период.
Диагностика С включает три этапа.
Первый этап постановки диагноза – предположение о наличии заболевания. Диагностика раннего неонатального С затруднительна изза отсутствия специфических для этого периода проявлений. В первую очередь необходимо установить наличие инфекционного заболевания
вообще и постараться выявить местную воспалительную реакцию (входные ворота) с учетом инфекционного статуса матери.
Второй этап диагностики – выявление дисфункции жизненно важных органов и систем и оценка степень нарушения их функции.
Очень существенным моментом в диагностике С является выявление признаком полиорганной недостаточности (ПОН). Полиорганная недостаточность – характеризуется выраженным нарушением функции не менее чем 2-х органов с учетом возрастных критериев. Синдромы органной недостаточности изложены в табл. 2.29.
Табл. 2.29. Клинические и лабораторные критерии органной недостаточности при сепсисе новорождённых (Неонатология. Нацио-
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
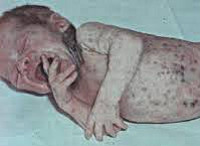
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Читайте также:

