Инфекционно токсический синдром у детей
Обновлено: 19.04.2024
ТОКСИЧЕСКИЙ СИНДРОМ у детей (греч. toxikos служащий для смазывания стрел, т. е. ядовитый; синдром) — патологическое состояние у детей раннего возраста, развивающееся в ответ на воздействие инфекционного агента, характеризующееся поражением центральной нервной системы, нарушением периферической микроциркуляции, обмена веществ, а также расстройством функции многих органов и систем организма.
В зависимости от выраженности тех или иных симптомов различают две клинические формы Т. с.: нейротоксикоз и токсикоз с экспкозом. Нейротоксикоз характеризуется первичным токсическим поражением центральной и вегетативной нервной системы, к-рое становится пусковым механизмом в развитии Т. с.
Токсикоз с экспкозом — состояние, проявляющееся интоксикацией (см.), дегидратацией (см. Обезвоживание организма), гемодинамическими расстройствами (см. Гемодинамика). Токсикозу с эксикозом нередко предшествует нейротоксикоз. В зависимости от типа обезвоживания токсикоз с эксикозом подразделяют на токсикоз с вододефицитным эксикозом (внутриклеточная гипертоническая дегидратация), токсикоз с соледефицитным эксикозом (внеклеточная гипотоническая дегидратация), токсикоз с изотоническим эксикозом (общая изотоническая дегидратация).
Содержание
Этиология
Причиной Т. с. обычно бывает любое инф. заболевание, чаще вирусной или бактериальной этиологии, а также смешанная инфекция. Развитию Т. с. в раннем детском возрасте способствуют анатомо-физиологические особенности организма, повышенная чувствительность к возбудителю инфекции, неблагоприятный преморбидный фон, предшествующая сенсибилизация.
Патогенез
Исходными механизмами развития Т. с. являются поражения ц. н. с. и сосудов, обусловленные тропизмом вирусов и бактериальных токсинов. Степень и характер этих поражений в дальнейшем определяют тяжесть метаболических нарушений. При непосредственном воздействии инф. фактора на ц. н. с. и особенно диэнцефальную область наблюдается усиление функциональной активности системы гипоталамус — гипофиз — надпочечники (см. Адренокортикотропный гормон, Гипоталамо-гипофизарная система) и симпатоадреналовой системы (см.). Развивается спазм прекапиллярных артериол и прекапиллярных сфинктеров. Формируется централизация кровообращения (см. Кровопотеря), к-рая на первом этапе имеет защитный характер, а с развитием патол. процесса сменяется децентрализацией и патол. депонированием крови в микроциркуляторном русле. Последнее наряду с возрастающей проницаемостью сосудов, миграцией жидкости в ткани, потерей воды через жел.-киш. тракт и через легкие способствует снижению объема циркулирующей крови. При этом изменяются ее реологические свойства, повышается вязкость, усиливается агрегация эритроцитов. Нарушается целостность эндотелиального слоя стенок кровеносных сосудов в системе микроциркуляции, что приводит к активизации гемокоагуляции, возникновению диссеминированного внутри-сосудистого свертывания крови (см. Геморрагические диатезы). Одним из ведущих звеньев в патогенезе Т. с. становится гипоксия смешанного типа (см. Гипоксия), способствующая развитию метаболического ацидоза (см.) и приводящая к нарушению процессов биол. окисления. Основным путем получения энергии становится анаэробный гликолиз, развивается энергетическая недостаточность (см. Обмен веществ и энергии у детей, т. 20, доп. материалы), в результате к-рой страдают клетки нейроглии, клеточные структуры системы мононуклеарных фагоцитов (см.), проводящая система сердца и эритроциты. Усиление перекисного окисления липидов и снижение анти-окислительной активности плазмы, изменения фосфолипидной структуры клеточных мембран, сопровождающиеся нарушением активности калий-натриевого насоса и перераспределения ионов между клеткой и внеклеточной средой, приводят к отеку клетки.
Патологическая анатомия
При патологоанатомическом исследовании обнаруживают многочисленные мелкоочаговые кровоизлияния в легких, плевре, перикарде и эпикарде, расширение и полнокровие сосудов мягкой мозговой оболочки, нек-рую сглаженность борозд и извилин, дряблость ткани мозга. При гистол. исследовании различных органов определяются сужение и расширение кровеносных сосудов, неравномерное их кровенаполнение и периваскулярный отек, нарушение эндотелия сосудов микроциркуляторного русла, отек и разрыхление мышечной и соединительнотканной оболочек, периваскулярные кровоизлияния, стаз и тромбы (чаще в мелких сосудах мозга и легких). Отмечаются дистрофические изменения нервных клеток, жировая и белковая дистрофия паренхиматозных органов, особенно печени и почек (см. Дистрофия клеток и тканей).
Клиническая картина
Клиническая картина зависит от формы Т. с. Для нейротоксикоза характерно внезапное начало, возбуждение с последующим нарушением сознания, вплоть до комы (см.). Наблюдаются генерализованные тонические и клонические судороги на фоне выраженной мышечной гипотонии, гипертермия в результате расстройства терморегуляции и теплопродукции, расстройства дыхания (частое глубокое дыхание, гипервентиляция), коронарная недостаточность, повышение АД, уменьшение пульсовой амплитуды, нарушение функции почек (олигурия, анурия).
Расстройство осморегуляции, преобладание гиперэлектролитемии, задержка жидкости в тканях приводят к отеку мозга (см. Отек и набухание головного мозга) и легких (см. Отек легких). Неуклонное прогрессирование процесса при нейротоксикозе может привести к смерти. При этом симптомы заболевания, ставшего причиной Т. с., настолько слабо выражены, что его диагностика бывает крайне затруднена.
Токсикоз с эксикозом развивается чаще постепенно, в результате значительных невосполненных потерь воды и электролитов, возникающих в основном при поносе и рвоте. Клин, проявления зависят от типа и степени обезвоживания (см. Обезвоживание организма), тяжесть состояния — от степени расстройств периферического кровообращения. В результате потери жидкости и уменьшения объема циркулирующей крови происходит (в отдельных случаях на 50%) падение минутного объема крови (см. Кровообращение). Снижение скорости кровотока, уменьшение насыщения крови кислородом приводит к застойной аноксии (см. Гипоксия), а сокращение объема циркулирующей крови на 40% — к быстрому развитию часто необратимой недостаточности кровообращения (см.). Нарушения гемодинамики сопровождаются развитием некомпенсированного метаболического ацидоза и функциональной недостаточности почек. Гипокалиемическое состояние проявляется депрессией, мышечной гипотонией и снижением рефлексов, изменением моторной функции кишечника, приводящей к развитию динамической кишечной непроходимости (см. Непроходимость кишечника).
Лечение
Регидратационную терапию проводят с учетом формы Т. с. и характера нарушений водносолевого обмена. Длительность ее зависит от состояния ребенка. При нейротоксикозе объем вводимой парентерально жидкости не должен превышать суточной потребности в этом возрасте. Соотношение солевых и бессолевых р-ров равно 1:2—3, коллоидных и кристаллоидных — 1:3. Инфузионную терапию (см.) следует начинать с низко- или среднемолекулярных кровезаменителей (см. Кровезамещающие жидкости). Вводят глюкозу, р-ры калия в первые сутки не назначают. При парентеральном введении жидкости одновременно применяют мочегонные средства (см.)- При токсикозе с эксикозом объем вводимой жидкости определяется суточной возрастной потребностью ребенка в жидкости и возникающим в результате заболевания дефицитом воды и солей. Соотношение солевых и бессолевых р-ров зависит от характера дегидратации. Белковые и коллоидные р-ры должны составлять 1/3—1/4 часть общего объема парентерально вводимой жидкости. Необходимо возмещение дефицита калия. Парентеральное введение жидкостей проводят при постоянном контроле основных параметров гомеостаза (показателя гематокрита, содержания натрия и калия в плазме, pH крови и др.). Регидратационная терапия включает также обязательное введение р-ров глюкозы и жировых эмульсий.
При Т. с. с целью ликвидации патол. влияния гиперсимпатикото-нии назначают нейролептические (аминазин, дроперидол) и антигиста-минные (пипольфен, димедрол) средства; с целью снижения тонуса периферических сосудов применяют средства, непосредственно воздействующие на гладкую мускулатуру сосудистой стенки (папаверин, дибазол, эуфиллин, никотиновую к-ту и др.), а также препараты адреносим-патолитического действия (пентамин, бензогексоний, фентоламин). Противопоказанием к применению сосудорасширяющих средств являются артериальная гипотензия и коллапс.
Для улучшения реологических свойств крови и предупреждения синдрома диссеминированного внутрисосудистого свертывания назначают реополиглюкин и дипиридамол (курантил). При развитии синдрома диссеминированного внутрисосудистого свертывания применяют гепарин, ингибиторы протеаз (контрикал), а также осуществляют коррекцию дефицита факторов свертывания крови путем переливания плазмы или тромбоцитной массы.
С целью устранения гипоксии восстанавливают функцию внешнего дыхания, проводят лечение кислородом, а также применяют фармакол. средства, снижающие потребность организма в кислороде. С этой целью используют препараты, способствующие активации пентозного цикла (глюкозу, препараты калия, инсулин), а также седуксен, оксибутират натрия, коферменты, участвующие в окислительном декарбоксилировании гшровиноградной кислоты,— пиридоксальфосфат и липоевую к-ту. Для защиты биол. мембран вводят контрикал, гепарин, дипразин (пипольфен), седуксен, а также биоантиоксидант (токоферола ацетат). Стероидные гормоны (преднизолон, гидрокортизон) применяют в качестве средств заместительной терапии в течение 5—7 дней. Одновременно проводят лечение заболевания, вызвавшего Т. с.
Прогноз, Профилактика
Прогноз при своевременном лечении благоприятный.
Профилактика заключается в повышении сопротивляемости организма, организации правильного режима и вскармлршания детей.
При появлении у ребенка диспептических расстройств и признаков кишечного инф. заболевания с первых суток следует проводить пероральную регидратацию (введение глюкозосолевых р-ров).
Библиогр.: Вельтищев Ю. Е. Водно-солевой обмен ребенка, М., 1967; Диагностика и лечение неотложных состояний у детей, под ред. С. Я. Долецкого, М., 1977; Дизентерия — колиты — салмонел-лезы у детей раннего возраста, под ред. М. Г. Данилевича, с. 47, JI., 1949; К е р-п е л ь - Ф р о н и у с Э. Патология и клиника водно-солевого обмена, пер. с венгер., Будапешт, 1964; Л а б о р и А. Регуляция обменных процессов, пер. с франц., М., 1970; П а п а я н А. В. и Цыбулькин Э. К. Острые токсикозы в раннем детском возрасте, Л., 1979; Сперанский Г. Н. Дизентерия у детей раннего возраста, в кн.: Вопр. профилактики и лечения дизентерии, под ред. И. М. Берковича и др., с. 183, М., 1952; Levesque J. Traitement des diarr-hees du noutrisson, P., 1955; Parrish J. Remarks on the prophylactic treatment of cholera infantum, N. Amer. med. surg. J., v. 2, p. 68, 1826.
Нейротоксикоз у детей – это патологическое состояние, которое возникает у ребенка раннего возраста при генерализации вирусных и/или бактериальных заболеваний и преимущественно проявляется нарушениями функций ЦНС. Клинически данное состояние характеризуется нарушением сознания ребенка, повышением температуры, гипертонусом мышц, увеличением ЧСС и ЧД. Диагностика нейротоксикоза у детей подразумевает сопоставление клинической картины, клинических анализов и результатов исследования ликвора. Лечение включает в себя этиотропные препараты, дезинтоксикацию и симптоматическую терапию, зависящую от клиники.
Общие сведения

Причины нейротоксикоза у детей
Нейротоксикоз у детей – это полиэтиологическое явление. Он может возникать на фоне большого количества заболеваний вирусного (ОРВИ, аденовирусная инфекция и т. д.) и бактериального (шигеллез, сальмонеллез, пищевая токсикоинфекция и др.) генеза или их сочетания. Также нейротоксикоз является первым симптом нейроинфекций (менингиты и энцефалиты).
Нейротоксикоз чаще всего развивается у детей раннего возраста благодаря их анатомо-физиологическим особенностям. Для ребенка характерен высокий уровень обмена веществ, который значительно выше такового у взрослых. Строение ЦНС и ее функционирование также отличается. У детей есть склонность к массивным воспалительным реакциям тканей головного мозга. Ткани гипоталамуса более чувствительные к гипоксии и поражаются быстрее, чем у взрослых. В возрасте до 3 лет ГЭБ функционально незрелый, из-за чего он пропускает токсины через себя. Это проявляется повышением внутричерепного давления и отеком головного мозга.
Патогенетически нейротоксикоз у детей обусловлен нарушением микроциркуляторного русла центральной и автономной нервной системы. Экзотоксины, которые выделяют бактерии в процессе жизнедеятельности, и эндотоксины, что попадают в кровь после их гибели, повреждают сосудистую стенку, повышают ее проницаемость для патогенных агентов и провоцируют гипоксию тканей. Вирусы вызывают аналогичный эффект, но другими путями. Они разрушают клетки организма, в результате чего в кровь попадают агрессивные протеолитические ферменты. Также вирусы способны самостоятельно вызывать деструкцию клеток эндотелия сосуда. Благодаря АФО ребенка такие изменения происходят диффузно по всей ЦНС. В развитии нейротоксикоза ведущую роль играет нарушение работы гипоталамуса, т. к. он является высшим вегетативным центром человека и отвечает за терморегуляцию, контролирует работу всех систем и эндокринных желез.
Классификация нейротоксикоза у детей
Различают 3 степени тяжести нейротоксикоза у детей:
Также нейротоксикоз у детей классифицируется согласно вариантам его протекания и ведущим симптомам:
Симптомы нейротоксикоза у детей
Нейротоксикоз у детей возникает остро, клинические проявления развиваются быстро. Токсическая энцефалопатия протекает в 3 периода: продромальный, развернутой клинической симптоматики и восстановления. Для каждого из них характерны свои симптомы.
Продромальный период кратковременный – от 2 до 6 часов. Проявляется ранними симптомами нарушения ЦНС: тошнота, рвота, которая не приносит облегчения и не зависит от приема пищи; нарастание головной боли; чрезмерное беспокойство и капризность; беспокойство, вздрагивания во время сна; сонливость днем; постепенное нарастание температуры тела до 38,5-39°С. Без медицинского вмешательства развивается нарушение сознания (от ступора до комы), дыхательной (повышение ЧД, одышка) и сердечно-сосудистой (повышение ЧСС) систем.
Развернутый нейротоксикоз у детей может иметь различные проявления, которые зависят от степени поражения ЦНС и микроциркуляторного русла. Длительность варьирует от 12 до 72 часов. При интенсивном нарушении кровообращения нейротоксикоз у детей развивается молниеносно. За несколько часов возникает декомпенсация работы сердечно-сосудистой системы, появляются геморрагии, развивается дыхательная недостаточность и отек легких. Нарушения ЦНС выражены в меньшей степени.
При непосредственном поражении ЦНС течение нейротоксикоза у детей более медленное. Нарастает интенсивность симптомов продромального периода, возникают судороги. Сознание ребенка нарушается постепенно – от сонливости до комы, продолжительность которой может составлять до 2 суток. Могут развиваться гипервентиляционный и гипертермический синдромы. Гипервентиляция проявляется увеличением ЧД до 80/мин. без структурных изменений легких или дыхательных путей. Гипертермия при нейротоксикозе достигает 40° С и не снимается обычными жаропонижающими средствами. Без экстренного медицинского вмешательства может возникнуть остановка сердца и дыхания, которые переходят в клиническую и биологическую смерть.
Период восстановления начинается после купирования острого состояния. Восстановление напрямую зависит от тяжести нейротоксикоза, адекватности и своевременности лечения. При легкой степени симптомы нарушения ЦНС исчезают за 12-24 часа. При тяжелых случаях неврологическая симптоматика может сохраняться на протяжении 2-4 суток.
Диагностика нейротоксикоза у детей
При подозрении на нейротоксикоз проводится дифференциальная диагностика с нейроинфекциями, которые сопровождаются синкопе и судорожным синдромом. Для этого выполняется спинномозговая пункция с исследованием ликвора.
Лечение нейротоксикоза у детей
Терапия нейротоксикоза у детей проводится исключительно в условиях реанимационного отделения. Если ребенок на момент развития патологии находится дома – его немедленно госпитализируют. На догоспитальном этапе проводится лечение жизнеугрожающих проявлений: судорожного синдрома и гипертермии.
Этиотропное лечение включает назначение антибиотиков широкого спектра действия, после получения результатов антибиотикограммы – противомикробных препаратов, к которым чувствительна высеянная микрофлора. Допускается использование иммуностимуляторов. При проведении дезинтоксикационной терапии используются 0,9% раствор NaCl, 5% глюкоза, раствор Рингера-лактат. Важно соблюдать небольшой объем и низкую скорость введения растворов, т. к. инфузионная терапия может спровоцировать отек головного мозга.
Прогноз
Прогноз при нейротокискозе зависит от степени тяжести и своевременности лечения. I и II степени при адекватном лечении имеют благоприятный прогноз. При тяжелой (III) степени прогноз для жизни при полноценной терапии благоприятный, для здоровья – сомнительный. При несвоевременном оказании квалифицированной помощи при I-II степени прогноз сомнительный, III степени – неблагоприятный. Без соответствующего лечения – неблагоприятный прогноз нейротоксикоза любой степени тяжести.
Профилактика
Профилактика нейротоксикоза у детей заключается в полноценном лечении основного заболевания по рекомендациям педиатра, соблюдении рациональной диеты и укреплении иммунитета. Лечение инфекционных заболеваний у детей с наличием неврологических нарушений в анамнезе должно проводиться под строгим наблюдением в условиях стационара.
Синдром токсического шока — тяжелое острое полиорганное поражение, вызванное экзотоксинами золотистого стафилококка или пиогенного стрептококка. Проявляется внезапным повышением температуры до 38,9°С и более, падением артериального давления, эритематозными кожными высыпаниями с последующим шелушением, профузным поносом, рвотой, признаками поражения разных органов и систем. Диагноз СТШ устанавливают на основе клинической картины, данных физикального обследования, лабораторных, в том числе бактериологических, анализов. Лечение предусматривает санацию бактериального очага, назначение антибиотиков, инфузионной и симптоматической терапии.
МКБ-10
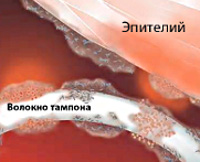
Общие сведения
Синдром токсического шока (СТШ) впервые диагностирован в 1978 г. у семи детей со стафилококковой инфекцией. Специалисты в области гинекологии столкнулись с ним двумя годами позже, отметив связь развития синдрома у молодых женщин с использованием суперадсорбирующих гигиенических тампонов во время месячных. Абсолютное большинство пациенток — женщины в возрасте 17-30 лет. Приблизительно у половины из них развитие синдрома связано с менструацией. В четверти случаев неменструального СТШ заболевание возникает в послеродовом периоде у носительниц Staphylococcus aureus, в 75% — в результате других причин (кожного и подкожного инфицирования, перенесенных операций с тампонированием и пр.).

Причины СТШ
Синдром токсического шока вызывают экзотоксин-продуцирующие микроорганизмы, оказывающие системное воздействие на разные органы и ткани, — золотистый стафилококк (Staphylococcus aureus) и пиогенный β-гемолитический стрептококк группы А (Streptococcus pyogenes). В большинстве случаев заболевание возникает не в момент первичного заражения бактериями, а на фоне носительства инфекционных возбудителей при воздействии следующих предрасполагающих факторов:
- Использование тампонов. Вероятность развития СТШ возрастает при пользовании гигиеническими средствами с повышенными адсорбирующими свойствами и нарушении рекомендуемой частоты их замены.
- Использование интравагинальных контрацептивов. Наличие во влагалище диафрагм, губок, колпачков создает благоприятные условия для размножения микроорганизмов.
- Нарушение целостности слизистых оболочек. При травмах половых органов, наличии в матке остатков плацентарной ткани, плодных оболочек, крови после родов и гинекологических операций возникают оптимальные условия для бактериального обсеменения и проникновения микроорганизмов или их токсинов в кровь.
Неменструальный синдром токсического шока может осложнять хирургические процедуры, при которых применяется перевязочный материал, накапливающий кровь (операции на полости носа с использованием турунд, тампонирование ран и др.), и травматические повреждения кожи. Сочетание указанных факторов с вирусными заболеваниями (ветрянкой, гриппом), приемом иммуносупрессивных препаратов повышает риск развития токсемии и бактериемии.
Патогенез
Ключевую роль в развитии синдрома токсического шока играют механические и химические воздействия, которые способствуют размножению бактерий и влияют на проницаемость тканей. Пусковым моментом служит проникновение в кровь значительных количеств специфических токсинов (TSST) и их взаимодействие с Т-лимфоцитами. В результате массивно высвобождаются цитокины, вызывающие полиорганную токсическую реакцию. Расширяются сосуды и повышается проницаемость их стенки, что приводит к перемещению плазмы крови и сывороточных протеинов во внесосудистое пространство. При этом наблюдается резкое падение давления, возникают отеки, нарушается коагуляция, повышается температура. Под влиянием опосредованных иммунных реакций и прямого действия токсинов поражаются кожа, паренхима печени, легких и других органов.
Симптомы СТШ
У менструирующих женщин, использующих тампоны, признаки СТШ появляются на 3—5-й день менструации. При синдроме токсического шока, осложнившем роды или гинекологические операции, патология проявляется в первые 2 дня послеродового или послеоперационного периода. Как правило, заболевание возникает остро. В редких случаях наблюдается продром в виде общего недомогания, тошноты, головной и мышечных болей. Первым признаком СТШ становится сильный озноб с повышением температуры до 39—40°С, после чего в течение 1—4 суток разворачивается полная клиническая картина.
Практически у всех пациенток возникают мышечная слабость и диффузные боли в мышцах, особенно в мускулатуре проксимальных отделов конечностей, брюшного пресса и спины. Часто беспокоят боли в суставах. Более чем 90% заболевших отмечают упорную рвоту и профузный водянистый понос, скудное количество мочи. Возникают першение в горле, парестезии, головная боль, светобоязнь, головокружение и обмороки на фоне падения АД. В ряде случаев беспокоит кашель, болезненные ощущения при глотании. В острой стадии, длящейся от 24 до 48 часов, пациентка выглядит заторможенной и дезориентированной.
Специфическое проявление синдрома — кожные высыпания в виде диффузного покраснения, которое напоминает солнечный ожог и начинает постепенно бледнеть на протяжении первых 3 дней. В последующем возникает грубое шелушение кожи, особенно заметное на подошвах и ладонях. У некоторых женщин покраснение носит характер пятен различных размеров, к которым присоединяются мелкие узелковые высыпания или точечные петехиальные кровоизлияния. Почти у четверти заболевших на 5—10-е сутки возникает сильный зуд на фоне пятнисто-узелковой сыпи. Практически у 100% пациенток к концу 1—2-ой недели наблюдается неглубокое генерализованное чешуйчатое отслаивание кожного эпителия с более выраженным пластинчатым шелушением ладоней, подошв, пальцев рук и ног. Половина пациенток, перенесших СТШ, к концу 2—3-го месяца отмечает выпадение волос и схождение ногтей.
Почти в 3/4 случаев выявляются гиперемия конъюнктивы, покраснение задней стенки глотки и слизистой рта, малиново-красный цвет языка. Каждую третью менструирующую женщину с СТШ беспокоят болезненность и отечность в области больших и малых половых губ. При тяжелом течении синдрома возникают признаки токсического поражения печени, почек, дыхательной системы с преходящей желтушностью кожи, болью в животе, пояснице, правом подреберье, помутнением мочи, одышкой и т. п.
Кроме клинически выраженного синдрома токсического шока, существует его стертая форма (при первичном проявлении или повторном эпизоде): у пациентки повышается температура, возникает озноб, умеренные мышечные боли, тошнота, рвота, понос, першение в горле. Однако артериальное давление не снижается, и патологическое состояние разрешается без лечения.
Осложнения
При тяжелом течении синдрома наблюдается токсический шок, приводящий к нарушению микроциркуляции и усугубляющий поражение паренхиматозных органов. Возникает дыхательная недостаточность с одышкой и ухудшением оксигенации крови, ДВС-синдром с тромбоэмболией и обильными кровотечениями, нарушается сердечный ритм, в результате острого тубулярного некроза отказывают почки. У пациенток со стрептококковым СТШ более чем в 50% случаев развиваются бактриемия и некротизирующий фасциит. В отдаленном периоде возможна временная потеря ногтей и волос, неврологические нарушения (парестезии, расстройства памяти, повышенная утомляемость).
Диагностика
С учетом полиорганного характера заболевания для постановки диагноза необходимо оценивать как локальные изменения со стороны женских органов, так и признаки нарушения других систем. В комплексное обследование включены:
- Осмотр гинеколога. Выявляются отечность и гиперемия половых органов, в некоторых случаях — скудные выделения гнойного характера из цервикального канала. Пальпаторно может определяться болезненность в области придатков.
- Физикальное обследование. В 100% случаев наблюдается повышение температуры более 38,9°С и падение систолического давления ниже 90 мм рт.ст. (обычно с ортостатическим снижением на 15 мм рт.ст.).
- Общеклинические анализы. Для ОАК характерны лейкоцитоз с высоким нейтрофилезом, сдвиг лейкоцитарной формулы влево, тромбоцитопения, анемия, повышение СОЭ. В общем анализе мочи определяется аномальный мочевой осадок с выщелоченными эритроцитами и стерильной пиурией.
- Биохимический анализ крови. При нарушенной функции печени повышаются уровень билирубина и активность трансфераз (выявляется почти у половины заболевших), при почечной недостаточности возникает азотемия, креатининемия, при поражении мышц — повышенное содержание КФК. В коагулограмме увеличивается протромбиновое время и частичное тромбопластиновое время, определяются продукты деградации фибрина. Анализ крови на электролиты выявляет метаболический ацидоз, снижение уровня кальция, фосфора, натрия, калия.
- Методы определения возбудителя. Для выявления инфекционного агента используют бакпосев мазка из половых органов с антибиотикограммой и посев крови (показан при подозрении на стрептококковый СТШ). Серологические исследования позволяют провести оценку показателей иммунной системы, исключить инфекционные заболевания со сходной клинической картиной.
- Инструментальная диагностика. ЭКГ позволяет своевременно выявить нарушения сердечного ритма. Флюорография или рентгенография ОГК рекомендованы для оценки состояния легких.
Синдром ТШ дифференцируют от сепсиса и инфекционных заболеваний (кори, скарлатины, лептоспироза, гепатита В, пятнистой лихорадки Скалистых гор, брюшного тифа, менингококцемии, вирусных экзантем). Пациентку консультируют анестезиолог-реаниматолог, инфекционист, кардиолог, хирург, уролог, дерматолог, пульмонолог, невропатолог.
Лечение синдрома токсического шока
При выборе схемы лечения синдрома токсического шока важно предусмотреть воздействие на факторы, вызвавшие заболевание, и мероприятия для стабилизации функций пораженных систем. Пациентке показаны:
- Санация бактериального очага. В первую очередь удаляют тампон, диафрагму, колпачок (при их наличии) и промывают влагалище стерильным раствором. При выявлении бактериально обсемененных ран возможно иссечение тканей с участками некроза.
- Антибиотикотерапия. Выбор препарата основан на результатах определения чувствительности к противомикробным средствам. До получения таких данных назначается эмпирическая терапия с учетом вероятного возбудителя и его возможной антибиотикорезистентности. Курс составляет до 10 дней.
- Инфузионная терапия. Ключевой элемент лечения — восстановление внутрисосудистого объема жидкости и стабилизация показателей гемодинамики. В зависимости от характера нарушений пациентке вливают кристаллоидные растворы, электролиты, свежезамороженную плазму крови, тромбоцитарную массу и т. п.
- Вазопрессорные средства. Если коррекция объема внутрисосудистой жидкости не позволяет нормализовать АД, вводят препараты с прессорным эффектом.
При выраженной органной недостаточности пациентке могут назначаться гемодиализ (при острой почечной недостаточности), искусственная вентиляция легких с положительным давлением на выдохе (при респираторном дистресс-синдроме). Ряд авторов отмечают более быстрое выздоровление при назначении кортикостероидов и иммуноглобулинов.
Прогноз и профилактика
В большинстве случаев благодаря достижениям современной гинекологии, своевременной диагностике и лечению пациентки со стафилококковым СТШ выздоравливают за 1—2 недели, при этом смертность на современном этапе составляет 2,6%. Температура и АД нормализуются в течение 2-х суток с момента госпитализации, а лабораторные показатели — на 7—14-ый день. Уровень эритроцитов восстанавливается через 4—6 недель. При стрептококковом токсическом шоке смертность до сих пор остается высокой и достигает 50%. Для профилактики СТШ важно соблюдать рекомендации по использованию тампонов и протоколы обследования перед родами и гинекологическими операциями для своевременного выявления возбудителей.
Причинами токсического синдрома у детей становятся инфекционные заболевания желудочно-кишечного тракта. В таком случае ребенок с соответствующей симптоматикой должен быть немедленно госпитализирован до начала серьезных осложнений, которые могут привести к печальным последствиям.

Токсический синдром: симптоматика и лечение
Токсический синдром – это следствие инфекционного заболевания, но оно имеет свою симптоматику, игнорирование которой крайне нежелательно, даже если на первый взгляд проблема не выглядит серьезной. При осмотре врача проблема выявляется сразу же, так как клиническая картина достаточно явная и указывает на отравление. В случае синдрома врачами не рекомендуются попытки самостоятельного лечения, которое может включать в себя растворы различного состава, массаж области живота и кормление смесями из конкретных продуктов. Чтобы выявить причину интоксикации, при этом назначив правильное лечение, ребенку требуется немедленная госпитализация.
Как определить токсический синдром у детей:
- Ярко выраженные симптомы интоксикации, включающие в себя тошноту и рвоту, головную боль, слабость, бледность, повышенную температуру.
- Вначале возбужденное, а затем угнетенное состояние. Возможна неполная и полная потеря сознания.
- Сначала проявляется повышенное артериальное давление, которое спустя некоторое время понижается, что видно по выраженному холодному поту, частым, но несильным пульсом.
- Наблюдаются боли в области живота, жидкий стул и тошнота, которой сопутствуют частые рвотные позывы.
- В связи с этим появляется сухость слизистых, стойкое ощущение жажды и нарушением водно-солевого баланса организма.
- Может появиться депрессия, слабость и снижение рефлексов, нарушение дыхательных процессов.
- Появление мышечных судорог.
Лечение
Ребенок с токсическим синдромом подлежит срочной госпитализации. После осмотра врача назначается специальный раствор, состоящий из 5% глюкозы и раствора Рингера. Он принимается по две чайные ложки каждые десять или пятнадцать минут. Часто на ранних стадиях при быстром выявлении синдрома может назначать морковный суп, который разливают по бутылочкам.
Только в случае видимого улучшения и после разрешения врача ребенка разрешается прикладывать к груди матери. До этого момента его кормление происходит посредством сцеженного молока.
В особо тяжелых случаях могут прописываться антибиотики широко спектра действия (уровень интоксикации критичен). На всех стадиях синдрома необходим полноценный осмотр врача и проведение соответствующих анализов.
Наиболее часто в педиатрии встречаются случаи, когда симптомы не воспринимаются всерьез. Это может привести к серьезным осложнениям.
Читайте также:

