Инфекционно воспалительные заболевания перевод
Обновлено: 17.04.2024
Человек постоянно контактирует с окружающей средой, а значит и с населяющими ее микроорганизмами, многие из которых являются патогенными, способными вызвать воспалительный процесс. Инфекционный артрит развивается при попадании инфекции в сустав. Предупредить тяжелые осложнения этого заболевания может только своевременное обращение за медицинской помощью.
Общие сведения о заболевании
Инфекционный артрит – это воспаление сустава, вызванное местной или общей инфекцией. Симптомы болезни и ее течение во многом зависят от вызвавшей инфекционный процесс инфекции.
Коды инфекционных артритов по МКБ-10:
- стафилококковый - M00.0;
- пневмококковый - M00.1;
- стрептококковые - M00.2;
- вызванные другими уточненными бактериальными возбудителями - M00.8;
- пиогенный неуточненный - M00.9;
- туберкулезный – М01.1;
- гонококковый - M01.3;
- вирусный – М01.5.
Заболевание очень распространено и может стать причиной стойкого нарушения суставной функции. Четверть пациентов, обращающихся по поводу заболеваний суставов, страдают инфекционными артритами.
Причины инфекционного артрита
Причиной заболевания является инфекция – гнойная инфекция из расположенных рядом очагов (флегмон, абсцессов) или занесенная с током крови при холециститах тонзиллитах, а также общие инфекционные заболевания. При попадании инфекционных возбудителей в сустав иммунная система начинает с ними бороться, вызывая воспалительный процесс, течение которого напрямую связано с особенностями инфекционного возбудителя.
Воспаление может быть:
- неспецифическим – то есть, иметь общие симптомы, характерные для воспалительных процессов; вызываются такие процессы гноеродной патогенной и условно-патогенной микрофлорой – стафилококками, стрептококками, синегнойной и кишечной палочками и др.; вызываемые ими воспалительные процессы носят обычно острый гнойный характер и протекают остро, особенно, у детей;
- специфическим – при таком воспалении развиваются, как общие симптомы, характерные для всех артритов, так и симптомы, свойственные данной инфекции; к таким инфекциям относят туберкулезный, бруцеллезный, гонорейный, вирусный, грибковый, паразитарный воспалительные процессы.
Инфекционные артриты имеют два механизма развития:
- бактериально-метастатический – воспаление начинается из-за присутствия в суставе инфекции;
- токсико-аллергический – воспаление развивается за счет общей интоксикации и неадекватного иммунного ответа на внедрение в организм инфекции;
- смешанный – действуют оба механизма.
Факторы, предрасполагающие к развитию инфекционного артрита: вредные привычки, поднятие тяжестей, наличие лишней массы тела, сахарного диабета. Гнойные поражения суставов особенно часто развиваются у женщин, страдающих ревматоидным артритом.
Симптомы инфекционного атрита
Инфекционный артрит обычно начинается и протекает остро, иногда подостро. Но при некоторых специфических инфекциях он имеет незаметное начало и длительное течение.
Начало болезни и первые симптомы
При остром начале основными симптомами инфекционного артрита являются: выраженная лихорадка, озноб, летучие мышечно-суставные боли в сочетании с резкой болезненностью в пораженном суставе, отеком и гиперемией кожи над ним. Практически всегда остро протекает инфекционный артрит у детей.
Подострое течение имеет не такое заметное начало, температура тела нормальная или субфебрильная. Отек, гиперемия и боль в суставах умеренные.
Самым опасным является скрытое, незаметное течение, характерное для туберкулезного артрита. Характерны неопределенные боли в суставах, похрустывание, снижение двигательной активности. Болезнь протекает на фоне туберкулеза, небольшое повышение температуры также может не привлечь внимания, поэтому туберкулезный артрит редко выявляется на ранних стадиях.
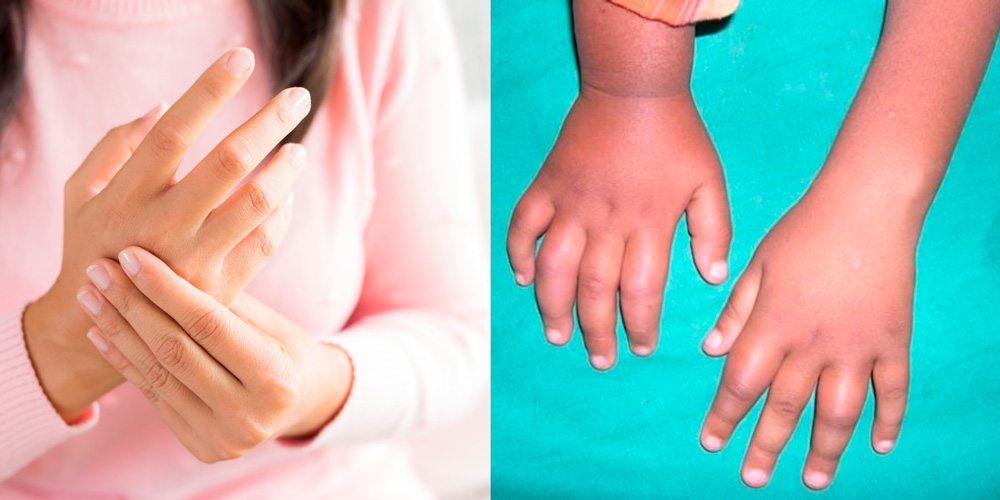
Боли и и отеки характерны для начальной стадии инфекционного токсико-аллергического артрита у детей и взрослых
Явные симптомы
Острый гнойный артрит развиваются очень быстро, состояние ухудшается с каждым днем, беспокоит лихорадка, отечность, гиперемия и боль нарастают. Не исключено, что больному потребуется хирургическая помощь.
При более медленном течении симптомы инфекционного артрита развиваются постепенно, появляется общее недомогание, слабость, суставные боли становятся постоянными, усиливаясь при движении. Постепенно нарушается функция конечностей: появляются трудности в их сгибании или разгибании.
Когда необходимо обращаться за медицинской помощью
К врачу нужно обращаться при появлении следующих симптомов:
- постоянных или регулярно повторяющихся болях в суставах;
- появлении лихорадки, недомогания в сочетании с болями в суставах;
- отека, гиперемии кожи над суставом в сочетании с лихорадкой у пациентов, уже страдающих хроническим артритом – возможно, к имеющемуся хроническому воспалению присоединилась инфекция;
- появление суставных болей при туберкулезе легких, гонорее, бруцеллезе и др. инфекционных заболеваниях.
Опасности
Заболевание часто протекает тяжело, с осложнениями.
Стадии заболевания
Течение болезни связано с ее клинической формой, поэтому стадии развития патологического процесса могут иметь значительные различия. Рассмотрим стадии развития острого гнойного артрита, разработанные НИИ им. Вишневского:
- Начальная – гнойный процесс без деструкции внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с развитием гнойных процессов в прилегающих тканях.
- Развернутая – гнойный артрит с деструкцией внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с гнойным поражением окружающих мягких тканей.
- Запущенная – с поражением костной и хрящевой ткани:
- А. - без поражения окружающих тканей;
- В. – с гнойным поражением данных тканей;
- С. – с выходом гноя на поверхность тела (свищами).
- Завершающая:
- при отсутствии адекватного лечения – деструкция, неподвижность сустава, инвалидизация;
- при правильном лечении – полное или частичное восстановление функции конечности.
Возможные осложнения
Инфекционный артрит может давать ранние и поздние осложнения. К ранним осложнениям относятся в основном осложнения гнойного артрита:
- нагноение околосуставных тканей;
- генерализация инфекции, сепсис.
Отдаленные последствия – это утрата функции конечности разной степени: от легкой до полной неподвижности.
Классификация
Происхождение и симптомы инфекционного артрита разных клинических форм имеют, как сходство, так и отличие. Рассмотрим наиболее распространенные формы.
Острый гнойный
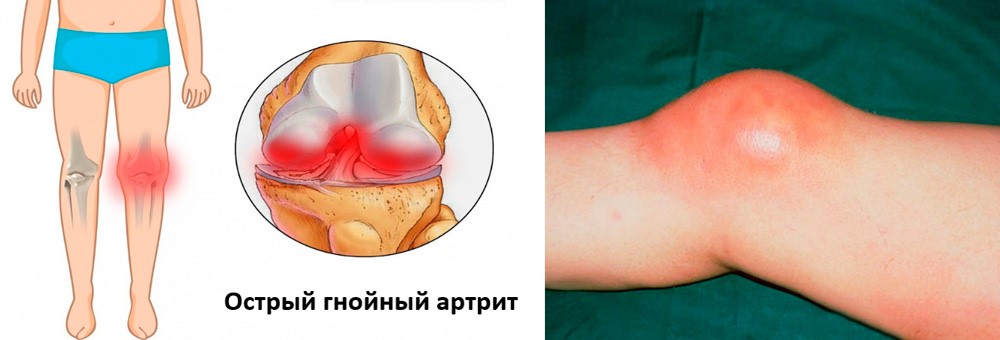
Острый гнойный артрит коленного сустава
Данная форма заболевания развивается при попадании в сустав гноеродной инфекции (синегнойной палочки, стафилококков, стрептококков и др.). Заражение может быть первичным при ранениях и вторичным – при переходе инфекции из окружающих тканей или отдаленных очагов инфекции. К группе риска относятся лица, страдающие ревматоидным артритом, особенно, женщины.
Начинается заболевание остро и протекает тяжело. Появляется лихорадка, головная боль, озноб. Пораженный сустав отекает, кожа над ним краснеет. Боль настолько сильная, что больной не может пошевелить конечностью и старается придать ей положение, вызывающее наименьшую болезненность.
Без оказания своевременной помощи суставные поверхности быстро разрушаются с ограничением подвижности конечности. При назначении адекватного лечения наступает полное выздоровление.
Септический
Развивается на фоне уже существующего сепсиса – генерализованного инфекционного процесса. Инфекция попадает в суставную полость гематогенным путем - с током крови. Заболевание может протекать в виде:
- бактериально-метастатической формы с симптомами острого гнойного артрита – состояние пациента может быть крайне тяжелым; прогноз заболевания зависит от своевременного лечения;
- токсико-аллергической формы – течение не всегда имеет острый характер, часто протекает подостро с множественным поражением суставов мигрирующего (чередующегося) характера; процесс носит негнойный характер и заканчивается выздоровлением на фоне излечения сепсиса.
Туберкулезный
Артрит в данном случае также протекает в виде бактериально-метастатической и токсико-аллергической форм. В первом случае поражаются в основном позвоночник и крупные суставы конечностей, а заболевание носит название костно-суставного туберкулеза. Протекает изначально хронически с нарастающими болями при движении, общим недомоганием. Основные изменения видны на рентгене в виде поражения суставной костной ткани от появления пятна с утратой костью кальция до разрушения кости. При отсутствии лечения приводит к инвалидности.
Токсико-аллергическая форма впервые описанная Понсе в начале 20-го века, протекает очень похоже на ревматоидный артрит с хроническим началом и поражением мелких суставов кисти и стоп. Возможна также их деструкция и инвалидизация. Поражение крупных суставов иногда протекает без последствий и проходит на фоне противотуберкулезной терапии.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Гонорейный
Поражение суставов гонококковой инфекцией может иметь бактериально-метастатическую и токсико-аллергическую формы. В обоих случаях поражаются крупные суставы, чаще всего один коленный (голеностопный, лучезапястный). Протекает болезнь остро, с высокой температурой, интоксикацией и сильнейшими суставными болями. Колено отекает, краснеет, до него невозможно дотронуться из-за болей.
При проведении своевременного лечения болезнь имеет благоприятный исход. Если же не лечить, быстро наступает полная неподвижность конечности.
Боррелиозный
Боррелиоз или болезнь Лайма – это инфекция, вызываемая спиралевидными бактериями – спирохетами боррелиями. Передается она клещами и протекает в виде последовательной смены стадий:
- Через 1-2 недели после укуса клеща появляются повышение температуры тела, интоксикация, скованность мышц и появление на теле в месте укуса клеща покраснения - эритемы, окруженной концентрическими кольцами, распространяющейся на большие участки тела. При своевременном назначении антибактериальной терапии заболевание может закончиться на этой стадии.
- Развивается через 1 – 3 месяца после начала заболевания и проявляется в виде поражений нервной системы (менингитов, невритов с острыми болями) и сердца (сердечных блокад, миокардитов и др.).
- Поражение суставов начинается через полгода (иногда через 2 года) после начала заболевания у генетически предрасположенных людей и протекает в виде сильных суставных болей, доброкачественного рецидивирующего воспалительного процесса, протекающего по типу инфекционно-аллергического артрита с асимметричным поражением 1 – 2 суставов (чаще всего коленного) и заканчивающегося через несколько лет выздоровлением у большинства больных. Но у некоторых пациентов заболевание может переходить в хроническую форму с постепенным нарушением функции конечностей.
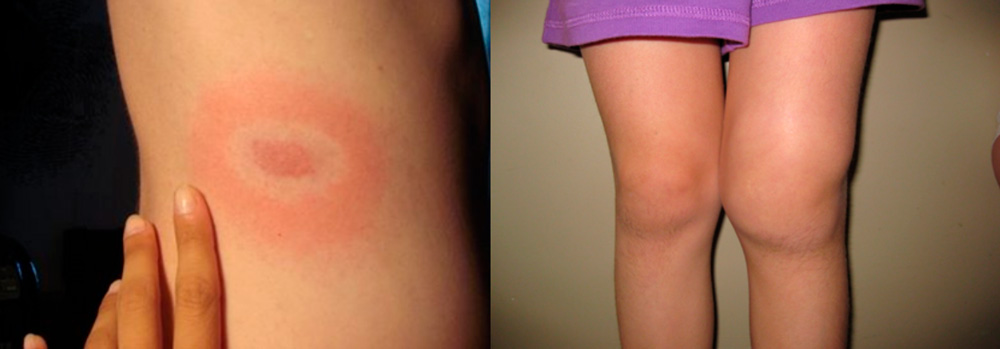
Начальная стадия боррелиоза – мигрирующая эритема и 3 стадия - хронический артрит колена
Вирусный
Развивается на фоне различных вирусных заболеваний:
- Парвовирусная инфекция, вызванная парвовирусом B19 – заболевание протекает с интоксикацией, лихорадкой, кожными проявлениями в виде красных пятен, возвышающихся над кожей папул и точечных подкожных кровоизлияний. Одновременно происходит симметричное поражение суставов. Могут вовлекаться мелкие суставчики кисти, лучезапястные, локтевые, коленные, голеностопные суставы. Симптомы похожи на ревматоидные поражения, но протекают от 3 месяцев до года и имеют благоприятный исход.
- Краснуха – артрит развивается чаще у взрослых женщин на фоне уже имеющихся симптомов краснухи или перед их появлением. У детей такие поражения встречаются редко. Околосуставные ткани отекают, краснеют, появляются сильные боли, нарушающие суставную функцию. Поражение асимметричное с вовлечением мелких суставов кисти, лучезапястных, коленных, локтевых суставов. Артрит продолжается две-три недели, после чего наступает полное выздоровление.
- Вирусные гепатиты В и С – артриты развиваются достаточно часто, но имеют доброкачественное течение и заканчиваются полным выздоровлением. Поражаются мелкие суставы кисти, локтевые, голеностопные и реже другие суставы. Воспаление в суставах обычно начинается до появления желтухи и заканчивается в период ее разгара.
Грибковый
Чаще всего грибковые поражения суставов развиваются при актиномикозе, но встречаются и при другой грибковой инфекции. Патогенные грибки попадают в суставную полость из расположенного рядом костного очага поражения или из отдаленных очагов (кариозные зубы) с током крови. Течение хроническое, с рецидивами и возможным присоединением бактериальной инфекции. Очень часто возникают свищи – ходы, по которым гной из сустава выделяется на поверхность кожи. При отсутствии адекватного лечения приводит к постепенной утрате суставной функции.
Паразитарный
Причиной артрита обычно является эхинококкоз, поражающий костную ткань позвонков, костей таза и длинных костей конечностей. В суставах обычно развивается токсико-аллергический воспалительный процесс. Часто вовлекаются суставы позвоночника, тазобедренные, коленные и локтевые суставы. Течение доброкачественное, но сопровождается сильными суставными болями. Выздоровление наступает при назначении полноценного лечения эхинококкоза.
Инфекционно-аллергический артрит
Инфекционно-аллергический артрит возникает, когда есть аллергия, на фоне которой развивается при неблагоприятных условиях воспалительный процесс в суставах. Заболевание протекает в бурной форме, сопровождается высокой температурой и сильными болевыми признаками. В области поражения наблюдается покраснение, отечность, припухлость. На разных участках кожи – кольцеобразная аллергическая сыпь. Лечением инфекционно-аллергического артрита занимаются ревматолог и аллерголог.
Локализация инфекционного артрита
При инфекционном поражении суставов локализация патологического процесса зависит от особенностей инфекции и ее клинической формы. При острых гнойных артритах – это в основном крупные суставы – коленный, голеностопный, локтевой. Мелкие суставы кисти и стопы поражаются при токсико-аллергической форме туберкулезного и некоторых вирусных артритах.
Асимметричное поражение одного-двух крупных суставов характерно для боррелиоза, чаще всего при этой инфекции в процесс вовлекаются коленные суставы.
Заявленное изобретение относится к фармакологии и медицине, касается создания нового лекарственного средства широкого спектра действия на основе интерферона для лечения инфекционно-воспалительных заболеваний различной этиологии.
The claimed invention relates to pharmacology and medicine, and to the production of a novel drug with a wide spectrum of activity on the basis of interferon for the treatment of infectious inflammatory diseases of various etiology.
Изобретение относится к фармакологии, медицине, ветеринарии и к фармацевтической промышленности, в частности, к способу получения оригинальных композитных антибактериальных препаратов для парентерального применения, которые обладают повьппенной терапевтической эффективностью при лечении тяжёлых форм инфекционно-воспалительных заболеваний.
The invention relates to pharmacology, medicine, veterinary medicine and to the pharmaceutical industry, in particular to a method for producing original composite antibacterial preparations for parenteral use, said preparations having increased therapeutic effectiveness in the treatment of severe forms of infectious inflammatory diseases.
Изобретение относится к медицине, а именно к стоматологии, и касается лекарственных средств для профилактики и лечения инфекционно-воспалительных заболеваний пародонта. в частности, лекарственных средств для профилактики и лечения пародонтоза.
The invention relates to medicine, specifically to dentistry, and concerns medicinal agents for the prophylaxis and treatment of infectious and inflammatory periodontal diseases, particularly medicinal agents for the prophylaxis and treatment of periodontosis.
СТАБИЛИЗИРОВАННОЕ ИММУНОКОРРИГИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ВИФЕРОН-ФОРТЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ
STABILIZED IMMUNE CORRECTION DRUG VIFERON-FORTE FOR THE TREATMENT OF INFECTIOUS INFLAMMATORY DISEASES
Другие результаты
Трайфед - комплексное симптоматичное средство для лечения инфекционно-воспалительных и аллергических заболеваний верхних дыхательных путей.
Trifed - is a complex symptomatic preparation indicated for the treatment of patients with infectious-inflammatory and allergic diseases of upper airways.
инфекционно-воспалительные заболевания новорожденных детей, в том числе недоношенных: менингит (бактериальный, вирусный), сепсис, внутриутробная инфекция (хламидиоз, герпес, цитомегаловирусная инфекция, энтеровирусная инфекция, кандидоз, в том числе висцеральный, микоплазмоз) в составе комплексной терапии;
infectious inflammatory diseases in newborns including premature ones, such as meningitis (bacterial, viral), sepsis and intrauterine infections (Chlamydia, Herpes simplex virus, Cytomegalovirus and Enterovirus infections, Candidiasis, particularly visceral Candidiasis, and mycoplasmosis), as part of complex therapy;
Противопоказан при инфекционных заболеваниях, воспалительных процессах, общем истощении, нефрите, циррозе печени, сердечной недостаточности с отеками, злокачественных опухолях.
¡¸1/23/41/2¸1/4Ñ: Ampazine, Amprazin, Centractil, Frenyl, Neuroleptil, Prazine, Promazine, Promazini hydrochloridum, Promazine hydrochloride, Promazinon, Promazinum, Protactyl, Sediston, Sinophenin, Sparine, Talofen, Verophen и 'Ñ.
Андрографолид ботанический продукт извлекается из травы, которая встречается в природе в Китае. Трава имеет обширную историю использования в традиционной китайской медицине для лечения инфекций верхних дыхательных путей и других воспалительных и инфекционных заболеваний.
Andrographolideis a botanical product extracted from a herb that occurs naturally in China. The herb has an extensive history of use in TCM for the treatment of upper respiratory tract infections and other inflammatory and infectious diseases.
Ожидаемые результаты Будет разработан метод аэрозольного применения поликомпонентной вакцины ВП-4 для лечения и профилактики гнойно-воспалительных и инфекционно-аллергических заболеваний органов дыхания, обеспечивающий высокую терапевтическую эффективность и низкую реактогенность.
Production of experimental, treatment - prophylactic preparation of Ps. aeruginosa and S. aureus specific bacteriophage - diphage with high therapeutic potential and wide spectra of lyses activity.
Лаборатория патогенеза и методов лечения инфекционных заболеваний отдела клинической медицины НИМСИ, Москва
Кафедра инфекционных болезней и эпидемиологии, ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
Современные методы лабораторной диагностики и биомаркеры инфекционно-воспалительных заболеваний полости рта на примере хронического пародонтита
Журнал: Российская стоматология. 2013;6(2): 35‑41
Балмасова И.П., Шестакова И.В., Ющук Н.Д. Современные методы лабораторной диагностики и биомаркеры инфекционно-воспалительных заболеваний полости рта на примере хронического пародонтита. Российская стоматология. 2013;6(2):35‑41.
Balmasova IP, Shestakova IV, Yushchuk ND. Modern methods for laboratory diagnostics and the biomarkers of the infectious-inflammatory oral diseases as exemplified by chronic periodontitis. Russian Stomatology. 2013;6(2):35‑41. (In Russ.).
Лаборатория патогенеза и методов лечения инфекционных заболеваний отдела клинической медицины НИМСИ, Москва
В обзоре дана характеристика информативных современных лабораторных методов (оптических методов, методов молекулярной биологии, иммунологических методов) диагностики пародонтопатий. Описаны основные и вспомогательные биомаркеры инфекционно-воспалительных заболеваний пародонта, используемые для диагностических и исследовательских целей при анализе биопленок, гингивально-цервикальной жидкости и слюны.
Лаборатория патогенеза и методов лечения инфекционных заболеваний отдела клинической медицины НИМСИ, Москва
Кафедра инфекционных болезней и эпидемиологии, ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
Можно полагать, что данная диаграмма может быть применена к диагностике не только кариеса, но и любой другой стоматологической патологии, при этом авторы так описывают основные этапы становления диагностического процесса:
1) разработка строгих критериев диагностики, основанных на легко выявляемых признаках заболевания;
2) совершенствование техники диагностических методов, направленных на снижение их диагностического порога при верификации диагноза на качественном уровне;
4) переход от логически построенной, номинальной или порядковой шкалы оценки патологического процесса к числовой шкале, позволяющей осуществлять мониторинг заболевания и прогноз его течения и исходов [14].
Представленная схема отчетливо демонстрирует, что начиная со второго этапа у врача-стоматолога возникает насущная необходимость не ограничиваться клиническими методами обследования больного, а прибегать к инструментальной и лабораторной диагностике. Так, если на первом этапе основу диагностики составляет принцип клинического наблюдения, то на втором этапе необходим иной уровень оценки данных, который требует научной разработки перечня биологических маркеров заболевания и наличия в арсенале лабораторной диагностики способов их регистрации. На третьем этапе речь идет о количественной оценке биомаркеров лабораторными методами и научной разработке сопутствующих признаков заболевания - индикаторов, факторов и детерминант риска развития самого заболевания и его неблагоприятных исходов. Наконец, четвертый этап предполагает создание системы диагностического мониторинга с определением предикторов заболевания, его биологических маркеров, критериев оценки его течения, прогноза возможных исходов и эффективности лечебных мероприятий.
С этой точки зрения развитие лабораторных методов и возможность их применения в диагностике стоматологических заболеваний требует не только их технического совершенства, но и учета особенностей патогенеза поражений полости рта, в том числе инфекционно-воспалительного генеза, а это, в свою очередь, является важнейшим шагом к разработке методов патогенетической терапии данных заболеваний [44].
1. Этиология и патогенез инфекционно-воспалительных заболеваний пародонта
Разработка критериев для лабораторно-диагностического процесса
Современный уровень организации лабораторно-диагностического процесса в стоматологии наглядно можно проследить на примере инфекционно-воспалительных заболеваний пародонта, частота развития которых у взрослых людей достигает 50-70% [3, 45].
Как известно, инфекционно-воспалительный процесс в пародонте чаще всего инициируется вирулентными микроорганизмами пародонтопатогенных видов, одного воздействия которых, по современным представлениям, недостаточно, поскольку для развития и прогрессирования патологического процесса определенное значение имеют особенности реагирования на патогены самого макроорганизма [21, 41]. После запуска инфекционного процесса поражение пародонта, как правило, прогрессирует с потерей волокон коллагена и их связи с цементом зуба, миграцией апикального эпителия, углублением пародонтальных карманов и резорбцией альвеолярной кости [36].

Современные представления о патогенезе развития инфекционно-воспалительных заболеваний пародонта довольно детально описаны в работах [24, 28, 45] и др., а общая схема их развития может выглядеть так, как это показано на рис. 2. Рисунок 2. Схема патогенеза развития инфекционно-воспалительных заболеваний пародонта.
В соответствии с представленной схемой важнейшим пусковым фактором в инициации патологического процесса является формирование зубной бляшки как многослойной микробной биопленки с участием пародонтопатогенных микроорганизмов [12, 29]. К их числу принадлежат такие возбудители хронического воспалительного процесса в пародонте, как Tanerella forsythensis, Porphyromonas gingivalis, Treponema denticola, а также индуктор острого агрессивного воспаления Actinobacillus actinomycetemcomitans [45, 50]. Все эти пародонтопатогены являются источником липополисахаридов (ЛПС), способных взаимодействовать с клетками поврежденного эпителия, нейтрофильными гранулоцитами, моноцитами/макрофагами, фибробластами через Toll-подобные рецепторы (TLR) [28].
Следует подчеркнуть, что процесс взаимодействия пародонтопатогенов с TLR клеток в значительной мере отличается от такового с участием нормальной микрофлоры биопленок. Так, на модели кариеса было установлено, что представители нормальной микрофлоры в отличие от патогенов индуцируют образование цитокина TФРβ 1 (трансформирующий фактор роста β 1 ), который в свою очередь угнетает экспрессию TLR [27]. В отличие от этого сценария при преобладании патогенной микрофлоры через TLR обеспечивается непрерывный поток сигналов, активирующих макрофаги и другие иммунокомпетентные клетки, несущие эти рецепторы [27], и побуждающих их к хемотаксису, секреции провоспалительных цитокинов (фактор некроза опухоли α (ФНОα), интерлейкины (ИЛ)-1, -6, -8), высвобождению матриксных металлопротеиназ и других ферментов, продукции специфичных к микробным антигенам иммуноглобулинов, продуцируемых с участием привлеченных хемокинами Т- и В-лимфоцитов [24, 28, 45, 50]. Высвобождающиеся ферментативные субстанции принимают участие в деградации коллагена и других белков внеклеточного матрикса, в результате чего теряется контакт между пародонтом и костью [3, 24, 45]. Довольно велика роль провоспалительных цитокинов, которые, помимо индукции воспалительных изменений в тканях, способны активировать остеокласты и способствовать таким образом резорбции кости альвеолярных отростков [45].
В результате всех описанных взаимодействий в гингивально-цервикальной жидкости возникает сложный комплекс молекул, включающий электролиты и другие малые молекулы, белки, цитокины, антитела, бактериальные антитела, ферменты, продукты распада соединительной и костной тканей [18, 31, 39, 43]. Все указанные компоненты потенциально могут рассматриваться как биомаркеры инфекционно-воспалительных заболеваний пародонта.

В таблице представлены основные и вспомогательные биомаркеры инфекционно-воспалительных заболеваний пародонта, используемые в настоящее время для диагностических и исследовательских целей и идентифицируемые при анализе биопленок, гингивально-цервикальной жидкости, слюны.
В наиболее полном виде эти биомаркеры описаны M. Taba и соавт. [45]. При этом M. Curtis, I. Gillett [15] в свое время предложили выделять три категории биомаркеров:
1) показатели текущей активности заболевания;
2) предикторы прогрессирования заболевания;
3) предикторы заболевания у здорового в настоящее время человека.
Среди этих категорий биомаркеров особого внимания заслуживает группа признаков, позволяющих прогнозировать прогрессирование заболевания и отражающих количественные характеристики показателей.
Таким образом, на примере инфекционно-воспалительных заболеваний пародонта отчетливо видно, что техническое совершенствование лабораторного определения биомаркеров, его перевод на уровень количественного тестирования является важнейшей задачей стоматологии, как и любой другой клинической дисциплины, поскольку позволяет не только точно и своевременно поставить диагноз заболевания, но и прогнозировать его прогрессирование, осложнения и исходы. С этой точки зрения современные методы лабораторной диагностики и их возможности заслуживают отдельного обсуждения.
2. Оптические методы в лабораторной диагностике инфекционно-воспалительных заболеваний полости рта
Существует несколько принципов, положенных в основу современных оптических методов, среди которых особое значение в медицине приобрели конфокальная микроскопия и сканирующая микроскопия ионной проводимости. Для исследовательских целей не потеряла своего значения в стоматологии и электронная микроскопия [12].
История создания конфокального микроскопа относится к середине прошлого века, когда в 50-х годах биологам понадобилось увеличить контраст наблюдения меченых флюорохромами объектов в толстых срезах тканей. Для разрешения этой проблемы М. Минский, профессор Массачусетского технологического института в США, предложил использовать для флюоресцентных микроскопов конфокальную схему. Конфокальный микроскоп основан на принципе получения точечного сигнала от флюоресцирующего объекта в толще ткани с помощью лазерного луча. В связи с этим конфокальный микроскоп, имеющий высокий контраст, дает две неоценимые возможности: он позволяет исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, а также оценивать результаты исследования (т.е. клеточной активности) в четырех измерениях - высота, ширина, глубина и время [37].
Эта техника оказалась пригодной не только для изучения препаратов из микроорганизмов или срезов тканей, а c 1980 г. стала применяться для исследований in vivo [48]. Так, указанным методом стало возможным определение структуры эпителиальных тканей на глубину 0,1-0,5 мм, давая при этом характеристику клеточного состава и микроваскуляризацию тканей пародонта [52]. Особенно эффективным было использование конфокальной микроскопии для изучения механизма формирования биопленок в составе зубной бляшки и идентификации, в частности, пародонтопатогенных микроорганизмов [29].
Принцип сканирующей микроскопии ионной проводимости (СМИП) был предложен в 1989 г. в Калифорнийском университете P. Hansma и соавт. [25] и в настоящее время предназначается для исследования мягких объектов биологической природы, в частности, клеток в нативном состоянии. Принцип работы СМИП основан на использовании в качестве зонда стеклянной микропипетки, регистрирующей ионный ток, протекающий через ее внутреннее отверстие с радиусом около 100-500 нм, что позволяет сканировать поверхность объекта. Используя СМИП, можно получить детальную информацию о функционировании биологических клеток с нанометровым уровнем пространственного разрешения [11].
Метод может быть использован in vivo для изучения особенностей функционирования клеточных мембран [33], для регистрации движения клеток и их контактов, взаимодействия клеток с вирусами и другими микроорганизмами. Несмотря на широкие возможности метода в изучении эпителиальных структур, опыт применения метода в стоматологии пока остается лишь перспективным.
3. Методы молекулярной биологии в лабораторной диагностике инфекционно-воспалительных заболеваний полости рта
Методы молекулярной биологии в стоматологии включают широкий круг способов оценки качественного и количественного состава микрофлоры полости рта и биомаркеров различных стоматологических заболеваний. К числу наиболее часто используемых методов относится полимеразная цепная реакция (ПЦР).
Метод ПЦР изобрел в 1983 г. американский ученый Кэри Мюллис. Впоследствии он получил за это изобретение Нобелевскую премию. Сущность метода заключается в том, что он имитирует естественную репликацию нуклеиновых кислот и позволяет получать фрагменты последовательности ДНК, характерные для того или иного микроорганизма, в количествах, достаточных для их распознавания.
В соответствии с этим принципом ПЦР клинического образца включает в себя три основных этапа: пробоподготовка (выделение ДНК из клинического материала), циклы амплификации (умножения фрагментов ДНК) и регистрация результатов. В каждом цикле число копий амплифицируемого участка удваивается, за 30-40 циклов происходит накопление коротких специфических фрагментов в количестве, достаточном для их дальнейшего распознавания. Детекция продуктов амплификации осуществляется по-разному: с помощью электрофореза в агарозном геле, или путем гибридизации со специфическим олигонуклеотидным зондом, или с использованием метода масс-спектрометрии и т. д. [9].
ПЦР очень широко используется для обнаружения и идентификации микробных возбудителей, в том числе и пародонтопатогенных микроорганизмов [4, 7, 8, 35], при этом метод позволяет обнаружить возбудитель в биологическом материале даже тогда, когда другие методы оказываются неэффективными. Диагностическая эффективность ПЦР в этом случае значительно возрастает при ее сочетании с культуральным методом диагностики [12].
Помимо микроорганизмов, методом ПЦР можно определять экспрессию генов, регулирующих образование рецепторов или секреторных продуктов в клетке. В последнем случае примером может служить обнаружение в остеокластах альвеолярных отростков генов, регулирующих нарушенный синтез коллагена I типа с образованием телопептидов, при этом детекция соответствующих генов после амплификации осуществляется путем ДНК-гибридизации [28].
Помимо ПЦР, к методам молекулярной биологии, перспективным для стоматологической клинической практики, следует отнести масс-спектрометрию - физический метод исследования вещества путем определения отношения массы заряженных частиц вещества к их заряду (качества) и количества заряженных частиц, образующихся в процессе воздействия на вещество. С помощью метода масс-спектрометрии различных биологических субстратов можно решать одну из важнейших задач медицины - определение маркеров болезней путем выявления белков, измененный уровень экспрессии которых может послужить средством ранней, доклинической диагностики заболеваний [6]. В стоматологии имеется пример проведения протеомных исследований методом масс-спектрометрии для исследования состава биопленок полости рта [30]. Этим методом было определено большинство биомаркеров инфекционно-воспалительных заболеваний пародонта, относящихся к продуктам распада соединительной и костной ткани.
В последние годы изучение протеома слюны как основы общеклинических лабораторных исследований стало занимать значительное место, наряду с исследованиями крови/плазмы, ликвора, мочи [47].
4. Иммунологические методы в диагностике инфекционно-воспалительных заболеваний полости рта
Для определения молекулярных продуктов деградации соединительной ткани, резорбции костной ткани, провоспалительных цитокинов широко используют методы иммуноанализа, основанные на применении меченых моноклональных антител. Моноклональные антитела - высокоспецифичные антитела, реагирующие, как правило, на одну антигенную детерминанту и получаемые с использованием гибридомных технологий, т.е. путем скрещивания иммуноцитов с клетками плазмоцитомы. Полученные таким образом клетки гибридомы обладают способностью к неограниченной пролиферации и синтезу антител только одной узкой специфичности, соответствующей клональной специфичности исходного иммуноцита [1]. Для использования в методах иммуноанализа моноклональные антитела подвергают мечению, сшивая их с молекулами флюорохрома, радиоактивной меткой, магнитными частицами или ферментом. В последнем случае использование меченых моноклональных антител служит основой иммуноферментного анализа.
Иммуноферментный метод нашел широкое применение практически во всех областях медицины, используется он и в стоматологии, в том числе для определения биомаркеров заболеваний полости рта инфекционно-воспалительной природы. В частности, при заболеваниях периодонта методом ИФА определяют содержание в гингивально-цервикальной жидкости таких биомаркеров, как цитокины [17, 26, 27], протеогликаны [40], пептидные продукты тканевой деструкции [49]. Этот принцип используется в стоматологии и в качестве экспресс-метода диагностирования ВИЧ-инфекции с использованием проб из десневого содержимого [2].
Помимо ферментного принципа мечения антител в медицине широко используется флюоресцентный принцип. Моноклональные антитела, меченные флюорохромами, широко используются для обнаружения микроорганизмов и биомаркеров различных заболеваний в тканях - иммуногистохимический метод, охарактеризованный в разделе оптических методов. Меченные флюорохромами моноклональные антитела к маркерам клеток иммунной системы позволяют определять количественный состав последних в различных биологических образцах, в том числе и из ротовой полости. Индуктором флюоресценции в данном случае чаще всего служат лазерные лучи с различной длиной волны, а метод такой детекции получил название проточной цитофлюориметрии [16]. Проточная цитофлюориметрия как способ количественной характеристики клеточного состава иммунограмм биологических жидкостей, а также факторов бактерицидной активности в ротовой полости нашла свое применение в различных разделах стоматологии, поскольку позволяет работать как с кровью больных, так и со слюной [10, 46] и гингивально-цервикальной жидкостью [27].
Заключение
Таким образом, развитие технологий, положенных в основу современных лабораторных методов, переводит диагностику стоматологических заболеваний на новый методический уровень. Создавая основу для разработки биомаркеров заболеваний полости рта, как было показано на примере заболеваний пародонта инфекционно-воспалительного генеза, современные лабораторные технологии не только открывают широкий простор для выявления признаков патологического процесса, но и позволяют прогнозировать его течение, осложнения, исходы на базе количественного мониторинга.
В данной статье раскрыты современные представления об инфекции почек и мочевыводящих путей, освещены основные принципы антибактериальной терапии, представлены клинические рекомендации по ведению данной группы пациентов. Представлены альтернативные методы
In this article modern ideas of infection of kidneys and urinary tract are revealed, the basic principles of antibacterial therapy are covered, clinical guidelines on conducting this group of patients are presented. Alternative methods of treatment and prevention are presented.
Инфекционно-воспалительные заболевания почек и мочевыводящих путей в амбулаторной практике занимают второе место по обращаемости после острых респираторных вирусных инфекций, а нозокомиальные инфекции мочевыводящих путей (ИМП) — первое место среди всех видов данных инфекций, что делает эту проблему особенно актуальной [1].
Все ИМП в зависимости от уровня поражения можно классифицировать на следующие формы:
- пиелонефрит — инфекционно-воспалительное заболевание почек с преимущественным поражением слизистой лоханки и чашечек и/или интерстициальной ткани;
- уретрит — воспаление мочеточника;
- цистит — воспаление слизистой оболочки мочевого пузыря;
- простатит — воспаление предстательной железы;
- уретрит — воспаление мочеиспускательного канала;
- фуникулит — воспаление семенного канатика;
- эпидимит — воспаление придатка яичка;
- орхит — воспаление яичка.
В рекомендациях Европейской ассоциации урологов (European Association of Urology, EAU) 2015 [3] представлена новая классификация ИМП:
- неосложненная инфекция нижних мочевыводящих путей: цистит — острый, спорадический или рецидивирующий;
- неосложненная инфекция верхних мочевыводящих путей: пиелонефрит — острый, спорадический, факторы риска не идентифицированы;
- осложненная ИМП с и без пиелонефрита;
- уросепсис;
- уретрит;
- инфекции мужских половых органов: простатит, эпидимит, орхит.
Под неосложненной ИМП (НИМП) понимают эпизод острой ИМП у пациентов в отсутствие у них каких-либо нарушений оттока мочи из почек и мочевого пузыря, структурных изменений в органах мочевыводящей системы и серьезных сопутствующих заболеваний, которые могут утяжелить ее течение или привести к неэффективности проводимой терапии.
Бессимптомная бактериурия (ББ) — это наличие двух последовательных (с промежутком 24 часа) положительных результатов бактериологического исследования мочи (> 100000 КОЕ/мл) у женщин, при которых был выявлен один и тот же штамм возбудителя ИМП при отсутствии клинических проявлений заболевания [2]. ББ может защищать от суперинфекции вирулентными уропатогенами, поэтому ее лечение следует проводить только в случае доказанной пользы для пациента, чтобы избежать риска селекции резистентных микроорганизмов и эрадикации потенциально протективных при ББ штаммов микроорганизмов [4]. Определение и лечение ББ наиболее важно у беременных женщин, так как уменьшает риск развития пиелонефрита, а также перед эндоурологическим вмешательством, когда планируется разрез слизистой оболочки мочевыводящих путей.
Наиболее частым возбудителем НИМП является уропатогенная E. coli, которую выявляют у 75–90% пациентов. Реже возбудителя НИМП могут быть Staphylococcus saprophyticus, Proteus mirabilis, Enterococcus spp., Klebsiella spp. и другие представители семейства Enterobacteriaceae. Первичный уретрит часто вызывают возбудители, передаваемые половым путем: N. gonorrhoeae, C. trahomatis, Mycoplasma genitalium, T. vaginalis, Herpes simplex virus [5].
Вторичный уретрит вызывают госпитальные уропатогенные штаммы микроорганизмов, в связи с чем выбор антимикробных лекарственных средств при вторичном уретрите такой же, как при лечении госпитальной осложненной ИМП.
К преобладающим возбудителям простатита относятся микроорганизмы семейства Enterobacteriaceae, преимущественно E. coli, Enterococcus faecalis, Proteus mirabilis, а также P. aeruginosa. У пациентов с иммунодефицитом простатит может быть вызван Candida albicans, M. tuberculosis.
Осложненная ИМП характеризуется наличием широкого спектра полирезистентных возбудителей (особенно после длительного лечения антибиотиками. Наиболее частыми возбудителя осложненный ИМП являются E. coli, Klebsiella pneumoniae, Klebsiella oxytoca, Proteus mirabilis, Citrobacter spp., Enterobacter spp. и Morganella morganii. При осложенной ИМП часто наблюдается смешанная инфекция, а также смена одного возбудителя другим в процессе проведения антибактериальной терапии, что может быть следствием биопленочной инфекции, которая развивается на катетерах, дренажах, камнях и в слизистых оболочках нижних мочевыводящих путей [1].
Возбудителями катетер-ассоциированной ИМП в 40% случаях являются грамотрицательные микроорганизмы, реже энтерококки, стафилококки и грибы. Из госпитальных штаммов микроорганизмов следует выделить E. coli, P. aeruginosa, Enterobacter agglomerans, Klebsiella spp., Staphylococcus spp., Enterococcus faecalis, Proteus mirabilis.
Важнейшим фактором вирулентности уропатогенных штаммов E. coli и других микроорганизмов семейства Enterobacteriaceae следует считать их способность к адгезии к уротелию с помощью ворсинок 1-го типа (pili), S-ворсинок (pap).
В табл. 1 приведены критерии для диагностики ИМП, в зависимости от лабораторных данных [3].
Антибактериальная терапия (АБТ) — основной метод лечения НИМП. Эффективность данного вида лечения будет зависеть от чувствительности к нему патогенных микроорганизмов и от концентрации лекарственного препарата в очаге воспаления. При проведении АБТ следует учитывать тяжесть заболевания, возможные побочные влияния антибиотиков, а также функциональное состояние почек [1–6].
Терапия ИМП является эмпирической, у больных с НИМП начинается сразу же после постановки диагноза. У больных с наличием обструкции мочевыводящих путей начинается только после ее устранения, так как существует опасность развития бактериотоксического шока вследствие гибели патогенных микроорганизмов и выделения токсинов.
Выбор АБТ должен быть основан на результатах местного или регионального микробиологического наблюдения, в котором отражается перечень возбудителей ИМП и их степень чувствительности или резистентности к АБТ. Кроме того, должны учитываться последние российские рекомендации [1]. Перед началом АБТ необходимо произвести забор материала (мочи, крови) с целью проведения бактериологического исследования.
При тяжелом течении ИМП препаратами первой линии могут являться антибиотики широкого спектра действия, в дальнейшем АБТ должна быть скорригирована с учетом результатов бактериологического исследования мочи.
Оценка эффективности АБТ проводится через 48–72 часа после ее начала. При отсутствии положительной динамики необходимо пересмотреть режим АБТ.
При выборе стартового антибиотика для лечения осложненной ИМП препаратами выбора являются карбапенемы первой группы (эртапенем), в отношении синегнойной палочки — второй группы (имипенем + циластатин, меропенем, дорипенем).
В качестве АБТ при лечении псевдомонадной инфекции эффективны карбапенемы, фторхинолоны и аминогликозиды и их комбинации.
Для лечения ИМП, вызванных Enterobacter spp., Citrobacter freundii, Serratia marcescens, P. vulgaris, P. rettegeri, используется цефепим и карбапенемы.
Срок лечения острого пиелонефрита составляет 10–14 дней, с острым неосложненным пиелонефритом 7–10 дней. Короткий курс лечения АБТ используется для лечения НИМП у пожилых женщин.
В табл. 2 и 3 представлена АБТ при различных формах ИМП. Средствами выбора считаются те препараты, к которым имеется наименьшая резистентность микроорганизмов, вызывающих развитие ИМП. Альтернативная терапия назначается при невозможности использовать препарат выбора.
Для профилактики рецидивов бактериального цистита могут быть использованы эндовезикальные инстилляции гиалуроновой кислоты и хондроитин сульфата.
У женщин в постменопаузе вагинальное применение эстрагенов (эстриол) позволяет уменьшить частоту рецидивов ИМП.
В лечении ИМП используется бактериофаготерапия. Применяются следующие бактериофаги: стафилококковый, стрептококковый, протейный, синегнойный, пиобактериофаг комплексный, бактериофаг Klebsiella oxytoca. Лечение бактериофагами пациентов начинают после определения чувствительности возбудителя к препарату бактериофага: по 30 мл 3 раза в день 10–14 дней.
При лечении острого пиелонефрита у беременных при имеющемся расширении верхних мочевыводящих путей рекомендуется установка мочеточникового стента либо чрезкожная пункционная нефростомия.
Пациенты с тяжелым неосложненным пиелонефритом (табл. 3) подлежат госпитализации в стационар. Лечение начинают с внутривенного введения препаратов, при улучшении состояния пациента, после 72 часов от начала АБТ, возможно перевести больного на прием тех же препаратов внутрь.
Лечение рецидивирующей ИМП проводится так же, как и неосложненного бактериального цистита. Кроме того, используется иммуноактивная профилактика препаратом Уро-Ваксом, который назначают для профилактики рецидивов по 1 капсуле утром, натощак в течение 3 месяцев.
После улучшения состояния возможен перевод больного на прием препаратов per os: левофлоксацин 0,75 внутрь 1 раз в сутки или ципрофлоксацин 1 г внутрь 1 раз в сутки.
Из фитопрепаратов наиболее широкое применение получил препарат Канефрон Н, который назначают по 2 драже 3 раза в сутки, биодобавка Монурель — по 1 таблетке в день на протяжении 2 недель с повторным приемом на протяжении 3 месяцев.
Для лечения острого цистита у беременных используется фосфомицина трометамол, бета-лактамные антибиотики и нитрофураны, средняя длительность лечения — 7 дней начиная со II триместра беременности.
Фосфомицина трометамол внутрь 3,0 г однократно, или
- цефиксим внутрь 0,4 г 1 раз в сутки — 7 дней, или
- цефтибутен внутрь 0,4 г 1 раз в сутки — 7 дней, или
- нитрофурантоин внутрь 0,1 г 2 раза в сутки — 7 дней, или
- цефуроксим внутрь 0,25–0,5 г 2 раза в сутки — 7 дней, или
- амоксициллин/клавуланат внутрь 0,625 г 3 раза в сутки — 7 дней.
ББ у беременных подлежит лечению АБТ (табл. 4). При остром пиелонефрите беременных рекомендуемая длительность АБТ составляет 14 дней (табл. 5).
У женщин в постменопаузе лечение ИМП должно быть дополнено применением эстрогенсодержащих препаратов. Это необходимо с целью улучшения регенерации слизистой влагалища и мочевого пузыря и предотвращения рецидива ИМП.
При остром бактериальном простатите продолжительность лечения составляет 14–28 дней, в течение 7 дней препарат вводится внутривенно, а далее переходят на пероральный прием (табл. 6).
ИМП у молодых мужчин встречается крайне редко. Чаще всего она считается осложненной, так как она связана с аномалиями МВС, обструкцией, инструментальными вмешательствами, инфекциями, передающимися половым путем. При лечении ИМП у мужчин используют препараты группы фторхинолонов: левофлоксацин по 0,5 г внутрь 1 раз в сутки 7 дней, или офлоксацин 0,4 внутрь 2 раза в сутки, или ципрофлоксацин 0,5 внутрь 2 раза в сутки. При рецидиве ИМП требуется проведение урологического обследования.
Оценка эффективности лечения проводится по клиническим и лабораторным изменениям. Проведение бактериологических исследований мочи рекомендуется до и после лечения, через 5–9 дней после окончания АБТ и далее через 4–6 недель.
Прогноз лечения НИМП благоприятен, осложненной — индивидуален. Для вылечивания ИМП необходим комплексный подход к пациенту: коррекция всех анатомических и функциональных нарушений мочевыводящих путей, лечение сопутствующей патологии, удаление катетеров и дренажей. Ранняя диагностика ИМП, своевременно назначенное лечение позволят значительно улучшить отдаленные исходы заболевания.
Литература
- Перепанова Т. С., Козлов Р. С., Руднов В. А. Синяква Л. А. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М., 2015. 72 с.
- Stark R. P., Maki D. G. Bacteriuria in the catheterized patient // NEJM. 1984; 311: 560–564.
- Guidelines on urological, EUA, 2015, 88 s.
- Cai T., Mazzoli S., Mondaini N. et al. The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not no treat? // Clin. Infect. Dis. 2012; 55 (6): 771–777.
- Нефрология: учебное пособие для послевузовского образования / Под ред. Е. М. Шилова. М.: ГЭОТАР-Медиа, 2007. 688 с.
- Лопаткин Н. А., Перепанова Т. С. Рациональная фармакотерапия в урологии: Compendium. М.: Литтера, 2015. 448 с.
О. Б. Поселюгина, доктор медицинских наук, профессор
Читайте также:

