Инфекционно зависимая астма у ребенка сидим на пульмикорте
Обновлено: 23.04.2024
На сегодняшний день взаимосвязь между заболеваниями верхних и нижних дыхательных путей можно считать доказанной. Особенное беспокойство вызывает тот факт, что такие болезни, как полипозный и полипозно-гнойный риносинусит при переходе их в хроническую форму не только являются фактором риска развития бронхиальной астмы (БА) сами по себе, но даже лечение этих заболеваний может негативно повлиять на течение уже имеющейся у пациента астмы. Ситуация осложняется непереносимостью антибиотиков, нередко встречающейся у пациентов с БА. Все это ставит перед лечащим врачом непростую задачу подбора эффективной и безопасной терапии.
Болезни верхних и нижних дыхательных путей
Полость носа и околоносовые пазухи представляют собой высокоорганизованную структуру с тонкими и сложными механизмами регуляции, обладающую множеством специфических функций. Подобная морфофункцио-нальная сложность обеспечивает создание первого барьера на пути проникновения инфекции. Очевидна тонкая функциональная связь полости носа и околоносовых пазух с другими органами и системами, в первую очередь с бронхолегочной [1, 2, 3].
Медицинская статистика последних лет убедительно свидетельствует о росте числа заболеваний носа и околоносовых пазух, причем увеличиваются как общая заболеваемость риносинуситами, так и удельный вес этой патологии в структуре ЛОР-болезней. Наличие тесной анатомической и физиологической взаимосвязи между верхними и нижними дыхательными путями приводит к тому, что рост числа риноси-нуситов происходит синхронно с увеличением заболеваемости бронхитами и бронхиальной астмой, и эту тенденцию пока не удается изменить, несмотря на совместные усилия ведущих специалистов всего мира [4].
Доказано, что хронические воспалительные процессы в верхних и нижних дыхательных путей имеют сходную этиологию [5, 6]. Это обусловлено тем, что слизистая оболочка воздухоносных путей от носовой полости до средних бронхов имеет сходное анатомическое и гистологическое строение.
Полипозный риносинусит (ПРС) является одним из наиболее распространенных хронических заболеваний полости носа и околоносовых пазух. Безусловно, ПРС не является угрожающим жизни заболеванием, но он существенно ухудшает качество жизни пациентов и играет определенную роль в патогенезе БА. [7, 8]. Именно поэтому ПРС рассматривается многими исследователями как фактор риска развития такого серьезного, тяжелого и иногда даже смертельного заболевания, как астма, распространенность которой, согласно статистике, растет повсеместно.
Адекватное и эффективное лечение ПРС часто приводит к улучшению течения БА при их сочетанном течении.
Успех лечения больных ПРС во многом обусловлен выраженностью патологического процесса в полости носа.
Лечение таких больных всегда должно оставаться комплексным, включающим применение различных групп лекарственных препаратов (топические глюкокортикостероиды, анти-лейкотриеновые препараты, блока-торы Н1-гистаминовых рецепторов последних поколений и др.) и проведение хирургического лечения. Диапазон хирургических методов лечения ПРС очень широк — от традиционной полипотомии носа до полисинусотомии.
Однако хирургическое лечение ПРС у больных БА является мощным провоцирующим фактором, в результате которого могут развиться нежелательные явления со стороны бронхолегочной системы: от обострения БА до присоединения пневмоний. Подобные осложнения возникают благодаря существованию ринобронхиального рефлекса [9, 10]. Это обстоятельство заставляет искать оптимальные методы предоперационного и послеоперационного лечения, разрабатывать методы щадящей хирургии для предотвращения ухудшения со стороны бронхолегоч-ной системы и, по возможности, сокращать число оперативных вмешательств за счет увеличения эффективности консервативного лечения.
Инфекционный процесс и развитие гнойного риносинусита
Известно, что одним из факторов, способствующих развитию БА либо ее обострению, служит бактериальная инфекция. Получены убедительные доказательства связи между характером хронической бактериальной инфекции дыхательных путей и тяжестью БА и числом ее обострений 11. Это, безусловно, необходимо учитывать при лечении больных с сочетанной патологией верхних и нижних отделов дыхательного тракта. Сочетание ПРС с БА в перспективе очень часто приводит к более тяжелым поражениям дыхательных путей, особенно при присоединении инфекционного процесса [15]. Инфекционно-воспалительный процесс, возникший на неблагоприятном аллергическом фоне, приводит к формированию полипозно-гнойного рино-синусита (ПГРС) — патологического состояния верхних дыхательных путей, способного в еще большей степени вызывать и поддерживать легочные заболевания и оказывать негативное влияние на бронхолегочную систему [16]. Последнее может быть объяснено следующим образом: во-первых, гнойный воспалительный процесс, идущий в пазухах, оказывает токсическое воздействие на другие структуры организма; во-вторых, отсутствие нормального носового дыхания отрицательно сказывается на состоянии бронхолегочной системы; в-третьих, под влиянием гнойного воспаления происходит снижение иммунитета и развивается дополнительная сенсибилизация организма. Подтверждена высокая распространенность полипозно-гнойных риносинуситов у больных инфекционно-зависимой бронхиальной астмой, что указывает на агрессивное влияние инфекционного агента на состояние как верхнего, так и нижнего отдела дыхательного тракта. Существуют непрямые доказательства того, что инфекционный риносинусит утяжеляет течение БА, т. к. его лечение антибактериальными препаратами облегчает течение БА.
По-видимому, одной из причин низкой эффективности лечения и частого рецидивирования полипозно-гнойного процесса или его латентного течения, является отсутствие сведений об особенностях микробного пейзажа конкретного больного. Подобная ситуация, в свою очередь, может привести к обострению БА или стать причиной развития осложнений.
Поэтому непосредственными результатами разрабатываемых схем ведения больных с полипозно-гнойным риносинуситом в сочетании с бронхиальной астмой должно стать создание комплексных методов обследования и лечения, учитывающих и распространенность полипозного процесса, и его длительность, и характер возбудителя и степень тяжести бронхиальной астмы.
Таким образом, перед современной оториноларингологией стоит задача создания комплексных эффективных методов обследования, консервативного и хирургического лечения с адекватной дооперационной подготовкой и послеоперационным ведением больных с сочетанной патологией верхнего и нижнего отделов дыхательного тракта для предупреждения обострения БА и увеличения сроков ремиссии полипоз-ного и полипозно-гнойного процессов.
При ПГРС воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызвано застоем секрета, нарушением аэрации пазух и, как следствие, колонизацией слизистой и пазух инфекционными агентами.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентными свойствами возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, и характеризуется как чувствительность и резистентность к инфекции. Не менее важное значение в развитии синусита имеют аномалии строения внутриносовых структур и решетчатого лабиринта. Особенно большое влияние они оказывают на хронизацию патологического процесса. Нарушение нормальных анатомических взаимоотношений в полости носа изменяет аэродинамику, способствуя попаданию неочищенного воздуха в околоносовые пазухи и повышая риск развития воспаления. Полипы, отечная слизистая оболочка, искривленная перегородка носа, шипы и гребни перегородки носа, расположенные на уровне среднего носового хода, и тому подобные анатомические аномалии нарушают проходимость естественных отверстий околоносовых пазух и приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах.
Тактика лечения ПГРС до настоящего времени была жестко предопределена и предусматривала обязательное хирургическое лечение. Однако любое оперативное вмешательство в полости носа и ОНП у больных БА является мощным провоцирующим фактором благодаря существованию ринобронхиального рефлекса, результат которого — ухудшение состояния бронхолегочной системы: от обострений БА до присоединения пневмоний. Кроме того, логичнее и безопаснее проводить оперативное вмешательство в период ремиссии воспалительного процесса при ПГРС.
При хронических синуситах микробная флора отличается большим разнообразием, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания, по мере развития болезни спектр возбудителей несколько смещается в сторону анаэробной флоры. Одним из наиболее значимых факторов возникновения инфекционного процесса является неблагоприятный аллергический фон, частые полипотомии носа, нерациональное назначение антибактериальных препаратов в виде как местной, так и общей терапии. Самой рациональной позицией антибактериальной терапии остается учет всех наиболее вероятных возбудителей или определение возбудителя в каждом конкретном случае синусита.
Непереносимость антибиотиков и антибактериальная терапия
Однако на практике все чаще возникают ситуации, когда назначение, точнее, выбор метода лечения синусита осложняется непереносимостью антибиотиков. И таких пациентов становится все больше. Это, с одной стороны, связано с увеличением аллергической нагрузки на организм, с другой стороны — с неаллергическими факторами, которые потенцируют действие аллергенов, например большая загазованность крупных промышленных городов, курение, все более широкое применение различных химических иммунотропных веществ. Все эти факторы усиливают аллергический ответ на этапе сенсибилизации, изменяя структуру заболеваемости инфекционными/неинфекционными болезнями. Также в последнее время изменилась иммунологическая реактивность населения, появились так называемые транзиторные иммунодефицитные состояния, на фоне которых легко развиваются острые и хронические инфекционно-воспалительные заболевания. Данные обстоятельства и стали стимулом к поиску нового решения описанной выше проблемы.
Карбоцистеин — единственный из мукоактивных препаратов, который обладает одновременно мукорегулирующим и муколитическим эффектом. Препарат нормализует количественное соотношение кислых и нейтральных муцинов бронхиального секрета, восстанавливая вязкость и эластичность слизи. Данный эффект достигается за счет активации фермента сиаловой трансферазы, вырабатываемого бокаловидными железами слизистой оболочки.
На фоне применения препарата восстанавливается секреция IgA, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбо-цистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отделов дыхательного тракта. Кроме того, карбоцистеин взаимно повышает эффективность глюкокортикостероиднойтерапии, усиливает бронхолитический эффект теофиллина. Активность карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Исследование эффективности карбоцистеина
Итоговая оценка результата лечения проводилась по следующим параметрам:
По окончании лечения положительный результат был отмечен у 13 (40,62%) человек из 32, удовлетворительный — у 9 (28,12%) человек, у 10 (31,25%) больных эффект отсутствовал, ухудшения состояния не отмечено ни у одного пациента (рис.).
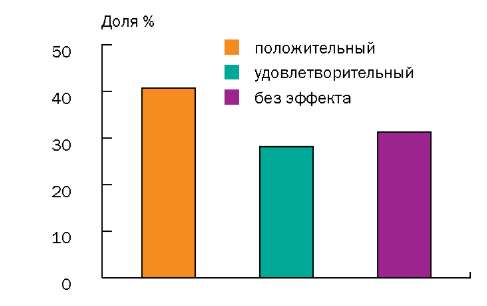
Результаты риноманометрии показали, что в данной группе среднее значение суммарного объемного потока (СОП) до лечения (420 ± 144,1 см3/с) было достоверно меньше (р < 0,05), чем среднее значения СОП после лечения (523 ± 228,3 см3/с).
У 10 (31,2%) пациентов отмечено улучшение течения БА, выражавшееся в исчезновении приступов удушья, кашля, одышки и других признаков бронхиальной обструкции, а также в достоверном повышении показателей ФВД (табл.).
Таблица. Изменение средних значений показателей ФВД до и после комплексного лечения (Флюдитек, ГКС)
Астма определяется врачами как заболевание, характеризующееся эпизодами бронхиальной обструкции (нарушения проходимости бронхов), полностью или частично обратимых. В основе ее лежит воспаление слизистой бронхов и бронхиальная гиперреактивность.
Во время приступа бронхиальной обструкции происходит сужение просвета как мелких, так и более крупных бронхов.
У всех больных астмой, когда нет приступа, тем не менее обнаруживаются признаки воспалительного процесса в слизистой оболочки бронха. Этот факт ставит вопрос о лечении воспалительного процесса - и не только во время приступа астмы. Такие препараты есть, так что настойчивое проведение длительного лечения должно стать основой борьбы с астмой.
Не менее важно и второе положение - о наличии у больных астмой бронхиальной гиперреактивности, то есть повышенной раздражимости бронхов, отвечающих спазмом даже на ничтожные количества раздражающих веществ во вдыхаемом воздухе. Это заставляет создавать для этих больных здоровую воздушную среду.
"Не все астма, что свистит"
Бронхиальная обструкция наблюдается не только при астме, но и при ряде других заболеваний. При большинстве из них, особенно у взрослых, заболевание не имеет ремиссии (светлых промежутков), что и отличает их от астмы.
Но в детском возрасте существует группа очень похожих на астму заболеваний, связанных с вирусной инфекцией. К астме они не имеют никакого отношения. И больной астмой грудной ребенок, и его сверстник без признаков аллергии могут дать эпизод обструкции на фоне ОРВИ. Разница состоит лишь в том, что у астматика приступы заболевания будут повторяться, причем не только при ОРВИ, но и в ответ на тот или иной неинфекционный аллерген, тогда как ребенок без аллергии заболеет обструктивным бронхитом и, скорее всего, "перерастет", так что бронхиальная обструкция после 1-2 подобных эпизодов прекратится. Именно этот факт порождает сложности в указанных выше "взаимоотношениях" с диагнозом "астма" у многих родителей, а также не полное принятие педиатрами определения астмы.
В чем отличие обструктивного бронхита на фоне ОРВИ и астмы? При некоторых вирусных инфекциях у грудных детей наблюдается воспаление слизистой оболочки бронха, которая утолщается, и увеличивается продукция слизи. Это ведет к сужению очень узких детских бронхов, что сопровождается, так же как при астме, затруднением выхода. Такая картина может повториться 1-2 раза, но с ростом ребенка и увеличением диаметра его бронхов новая инфекция, хотя и вызывает бронхит, существенного нарушения бронхиальной проходимости не вызывает.
То же происходит и у ребенка-аллергика, однако со временем, благодаря сохранению гиперреактивности бронхов, практически каждая новая инфекция будет сопровождаться бронхоспазмом. Более того, такой ребенок может дать приступы обструкции в ответ на вдыхание аэроаллергенов - а это и есть бронхиальная астма.
Среди детей первых трех лет, имеющих обструктивные заболевания, группой риска по бронхиальной астме являются:
- дети с аллергической предрасположенностью (аллергией у родителей, имеющих кожные аллергические проявления, положительные кожные аллергические пробы или высокий уровень иммуноглобулина Е);
- дети, обструктивное заболевание которых развивается без температуры (что говорит о роли неинфекционного аллергена);
- дети, имеющие более 3 обструктивных эпизодов.
В возрасте после 3 лет практически всем детям с обструктивными проявлениями уместно ставить диагноз бронхиальной астмы, правда, у многих из них через 1-3 года заболевание прекращается.
Формы бронхиальной астмы
Выше мы упоминали о двух формах астмы - аллергической и неаллергической. Этим деление астмы на формы не ограничивается.
У многих детей астма протекает без выраженных приступов, во время обострения у них возникает бронхит с явными признаками обструкции, который у нас принято называть астматическим бронхитом, что не должно успокаивать родителей: астматический бронхит есть форма бронхиальной астмы.
У некоторых детей приступ астмы протекает как упорный ночной кашель без выраженной одышки - это тоже форма астмы, которая со временем может переходить в типичную форму.
У ряда детей возникают одышка и затруднение дыхания в ответ на физическую нагрузку - это астма физического напряжения, а развивается приступ как результат бронхиальной гиперреактивности, стимулированной мышечными усилиями.
Как протекает астма
"Обычный" приступ развивается внезапно, учащается дыхание, затрудняется выдох, ребенок принимает сидячую позу и дышит поверхностно. Часто свистящее дыхание слышно на расстоянии, иногда оно ощущается только при поднесении уха ко рту ребенка. Затруднение выдоха ведет к задержке воздуха в грудной клетке, она обычно вздувается, если положить на нее руки, то ощущается дрожание на выходе.
Приступ может держаться от нескольких минут до многих часов, нередко он кончается самопроизвольно. Однако ждать, когда он пройдет, или применять сомнительные средства (их напридумано очень много) недопустимо: удушье - очень мучительное явление, так что каждая минута промедления с эффективным лечением усиливает страдания ребенка, пугает его, что само по себе может усиливать бронхоспазм. В более тяжелых случаях требуется интенсивная терапия.
Различаются больные и по характеру межприступного периода. У некоторых больных никаких изменений выявить не удается, тогда как у других и в межприступном периоде имеются существенные ограничения со стороны дыхательной функции.
Лечение астмы
Когда я смотрю больного астмой ребенка, первое, о чем я ставлю его родителей в известность, что астма не излечивается ни одним из известных средств. Возможно, это жестоко, но почему я говорю об этом? Потому что многие родители в поисках чудо-средства пробуют самые разные методы, большинство которых не только не приносят пользы, но и вредят больному.
Если не рассчитывать на излечение, то в чем смысл лечения? Смысл его состоит в том, чтобы уменьшить тяжесть астмы, научиться предотвращать приступы, по крайней мере сделать их более редкими, быстро снимать приступ в случае его возникновения. Короче, сделать жизнь ребенка полноценной - как у здорового ребенка.
А в отношении возможности излечения я всегда "облегчаю душу" родителей - в очень большом проценте случаев астма у ребенка проходит самостоятельно.
Ну, а как правильно лечить астму? Надо четко различать лечебные меры, помогающие избавиться от уже возникшего приступа, и средства, позволяющие смягчить течение болезни.
Как предупредить приступ? Предупреждение приступов является основной задачей базисного лечения. Но к этому следует добавить и меры по возможному предупреждению контакта с аллергенами, в первую очередь - с домашней пылью. Лучше убрать ковры и мягкую мебель, по крайней мере в комнате, где спит ребенок. Я нередко шучу - идеальная спальня для ребенка - тюремная камера, где, кроме койки, стола и табуретки, ничего нет. Важно закрыть книги в стеклянных полках, чаще использовать пылесос для уборки, причем лучше увлажняющий. Чтобы уменьшить контакт больного с клещом-дерматофагоидесом, следует обтянуть матрас ребенка полиэтиленовой пленкой и надеть 2 наволочки на подушки. С учетом аллергизирующих свойств пера птицы - следует заменить перьевые подушки на ватные или поролоновые.
Очень трудно расстаться с домашними животными, но это необходимо, если выявлена чувствительность ребенка к их шерсти. В комнате не следует иметь живых цветов - для больного могут быть опасны не только их запахи и пыльца, но и грибок-аспергилюс, который часто заводится в цветочных горшках. У маленьких больных астмой нередко приступ может быть связан с пищевыми аллергенами.
Вряд ли надо говорить о вреде курения в квартире, где есть больной астмой. Для него в первую очередь следует создать условия, обеспечивающие максимальное пребывание на свежем воздухе. Да и все другие меры предупреждения аллергии должны полностью соблюдаться.
Очень важно закалять ребенка - это уменьшит чистоту респираторных инфекций, которые часто являются причиной приступа и способствуют усилению бронхиальной гиперреактивности.
Очень многие дети с астмой плохо переносят физическую нагрузку - через 5-7 минут от начала бега или подвижных игр у них возникает бронхоспазм, вызывающий одышку, или даже приступ астмы. Для предупреждения этого следует сделать 1-2 ингаляции бета-мииетика или принять порошок эуфиллина, после этого бронхоспазм не разовьется, а через 20-30 минут под влиянием физической нагрузки бронхи, наоборот, расширятся, что очень полезно для больного.
Именно поэтому физическая культура, повышение физической выносливости входит в арсенал лечебных средств при астме. Более того, физическая тренировка повышает самооценку больного, способствует выработке у него уверенности в собственных силах и снижает зависимость от взрослых. Очень полезна дыхательная гимнастика, больные астмой в процессе занятий обучаются правильному дыханию.
Многие родители спрашивают, можно ли ребенку с астмой ехать на юг, к морю. Опыт показывает, что такая смена климата обычно провоцирует приступ астмы, так что к этому надо быть готовым. Но затем дети обычно чувствуют себя хорошо и получают много пользы от пребывания на море - ведь морской воздух очень чист, дыхание им снижает гиперреактивность бронхов. По возвращению домой многие больные вновь дают приступы астмы, и к этому тоже надо быть готовым. В целом, польза от такой поездки будет ощутимой, если пробыть на юге месяца полтора-два, не меньше.
Другой частый вопрос - о смене климата. В большинстве случаев "подобрать" климат не удается, так что я обычно не советую родителям пускаться в это очень непростое предприятие. Если астма четко связана с цветением определенного растения, на этот период иногда можно увезти ребенка в другой регион, но чаще всего полностью избавиться от астмы таким способом не удается. Это же относится и к поездкам в горы, где на высоте 1500-2000 метров очень мало аллергенов: это полезно (в том числе и с точки зрения физической тренировки), но полностью избавиться от астмы все же не удается.
Ну а как отнестись к лечению астмы в соляных шахтах? Там в воздухе нет аллергенов, и это способствует снижению гиперреактивности бронхов. Но ведь всю жизнь в шахте не просидишь, так что рассчитывать на излечение не приходится. А вот пребывание в галокамере (комнате, стены которой покрыты солью) представляется мне по меньшей мере сомнительным.
Альтернативные методы лечения
Многим приходилось слышать или читать о чудодейственных средствах - иглоукалывании, особых дыхательных приемах, о чудо-лекарствах, экстрасенсах, якобы излечивающих астму. Да, действительно, легкий приступ можно снять с помощью задержки дыхания или иглоукалывания, но я никогда не мог понять, чем иглоукалывание лучше ингаляции. Более того, задержки дыхания даже при среднетяжелой астме могут быть весьма опасны.
Я не знаю ни одного солидного исследования, в котором было бы доказано излечение астмы с помощью этих методов, а сведения типа "мы лечились у экстрасенса - и астма прошла" совершенно неубедительны: ведь у большенства детей астма рано или поздно проходит!
А вред от всех этих методов один - прибегая к ним, родители отвлекаются от тех мер, которые действительно помогают при астме, в частности - не проводят базисного лечения. Да и применение при приступе других лекарств (приходится слышать от родителей, что им рекомендовали бронхолитин, но-шпу, папаверин, солутан и даже антибиотики) недопустимо, так как они, как правило, не облегчают страдания ребенка.
Что ждет в будущем больного астмой? При правильном лечении, как правило, удается стабилизировать состояние ребенка, и если приступы не прекращаются совсем, то снижается их частота и тяжесть.
И не надо забывать, что очень часто астма проходит.
опубликовано 15/09/2011 21:15
обновлено 30/07/2018
— Болезни органов дыхания
Распространенность бронхиальной астмы (БА) у детей варьирует в различных странах и популяциях, однако среди хронической патологии органов дыхания она занимает ведущее место.
Бронхиальная астма - это хроническое аллергическое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, приводящей к повторным эпизодам свистящих хрипов, одышке, чувству заложенности в груди и кашлю, особенно по ночам или ранним утром. Во время этих эпизодов обычно отмечается диффузная, вариабельная бронхиальная обструкция, обратимая спонтанно или под действием лечения.
ЭПИДЕМИОЛОГИЯ
Результаты крупных эпидемиологических исследований свидетельствуют, что своевременная диагностика БА запаздывает. Так, продолжительность периода между первыми симптомами болезни и установлением диагноза в среднем превышает 4 года. Такая ситуация может быть обусловлена в первую очередь незнанием практическими врачами четких критериев диагностики БА, нежеланием регистрации болезни из-за боязни ухудшить отчетные показатели, негативным отношением родителей ребенка к данному диагнозу и т.д.
По данным исследователей [Coultas D.B. и Samet J.M., 1993], распространенность астмы варьирует в популяции в зависимости от половозрастных характеристик. Установлено, что в раннем возрасте чаще болеют мальчики, чем девочки (6% по сравнению с 3,7%), однако в пубертатном периоде частота заболеваний становится одинаковой у лиц обоего пола.
Более высокая распространенность БА у детей характерна для экологически неблагополучных промышленных районов городов. У жителей города чаще регистрируют БА, чем у жителей села (7,1 и 5,7% соответственно). В исследованиях, выполненных в разных странах, показана большая распространенность БА в регионах с влажным и теплым климатом и меньшая частота болезни в высокогорных районах, что связано с различным уровнем насыщенности воздуха аэроаллергенами. Несмотря на множество существующих гипотез, ни одна из них не объясняет в полной мере рост БА и аллергических заболеваний во всем мире.
ПРОФИЛАКТИКА
Выделяют первичную, вторичную и третичную профилактику БА.
Первичная профилактика направлена на лиц группы риска и предусматривает предотвращение у них аллергической сенсибилизации (образование IgE-антител). Известно, что сенсибилизация может развиваться уже внутриутробно, во II триместре беременности. Нарушение барьерных функций плаценты ведет к поступлению в амниотическую жидкость аллергенов, даже небольших концентраций которых достаточно для развития у плода реагинового иммунного ответа. Поэтому профилактикой аллергии у плода в этом периоде является предупреждение патологического течения беременности.
Фактически единственным мероприятием, направленным на развитие толерантности в постнатальном периоде, является сохранение естественного вскармливания ребенка до 4-6 месяцев жизни. Следует обратить внимание, что эффект грудного вскармливания носит транзиторный и кратковременный характер. Среди мероприятий первичной профилактики является обоснованным исключение влияния табачного дыма, воздействие которого как в пренатальном, так и в постнатальном периодах способствует развитию заболеваний, сопровождающихся бронхиальной обструкцией.
Мероприятия вторичной профилактики ориентированы на детей, у которых при наличии сенсибилизации симптомы БА отсутствуют. Для этих детей характерны:
- отягощенный семейный анамнез в отношении БА и других аллергических заболеваний;
- наличие у ребенка других аллергических заболеваний (атопический дерматит, аллергический ринит);
- повышение уровня общего IgE в крови в сочетании с выявлением значимых количеств специфических IgE к коровьему молоку, куриному яйцу, аэроаллергенам.
В целях вторичной профилактики БА в этой группе риска предлагается превентивная терапии цетиризином. Так, в исследовании ЕТАС [Early Treatment of the Atopic Child, The UCB Institute of Allergy, 2001] показано, что назначение данного препарата в дозе 0,25 мг/кг в сутки в течение 18 месяцев детям из групп высокого риска с бытовой или пыльцевой сенсибилизацией приводит к снижению частоты бронхо-обструкции с 40 до 20%.
Целью третичной профилактики является улучшение контроля БА и уменьшение потребности в медикаментозной терапии путем устранения факторов риска неблагоприятного течения заболевания.
Требует большой осторожности вакцинация детей с БА, при которой должны учитываться следующие моменты:
- иммунизация проводится детям с БА только в периоде стойкой ремиссии длительностью 7-8 недель при достижении контроля заболевания и всегда на фоне базисной терапии;
- вакцинация исключается в периоде обострения БА, независимо от ее степени тяжести;
- при рецидивировании респираторной патологии верхних и/или нижних дыхательных путей, способствующей неконтролируемому течению БА, индивидуально решается вопрос о вакцинации против пневмококка и гемофильной палочки (Пневмо 23, Хиберикс, Акт-ХИБ) при достижении контроля заболевания;
- дети, получающие СИТ, вакцинируются только через 2-4 недели после введения очередной дозы аллергена.
Большое значение имеет здоровый образ жизни, профилактика респираторных инфекций, санация лор-органов, рациональная организация быта с исключением активного и пассивного табакокурения, контактов с пылью, животными, птицами, устранению плесени, сырости, тараканов в жилом помещении. Необходима известная осторожность в применении лекарственных препаратов, особенно антибиотиков пенициллиновой группы, аспирина, и других НПВС у детей с атопией. Важным разделом третичной профилактики является регулярная базисная противовоспалительная терапия.
Элиминационный режим. Элиминация бытовых, эпидермальных и других причинных аллергенов является необходимым компонентом в достижении контроля БА и уменьшении частоты обострений. Согласно современным представлениям элиминационные мероприятия должны быть индивидуальными для каждого больного и содержать рекомендации по уменьшению воздействия клещей домашней пыли, аллергенов животных, тараканов, грибков и других неспецифических факторов. В ряде исследований показано, что несоблюдение элиминационного режима, даже на фоне адекватной базисной терапии, способствовало усилению симптомов БА и не позволяло достичь полного контроля над заболеванием.
КЛАССИФИКАЦИЯ
Классификация БА по этиологии выделяет аллергическую и неаллергическую форму болезни. У детей в 95% случаев имеет место аллергическая/атопическая БА.
Классификация тяжести БА, представленная в GINA 2006 (Global Initiative for Asthma), прежде всего ориентирована на клинико-функцио-нальные параметры заболевания (следует учитывать количество дневных и ночных симптомов в день/неделю, кратность применения β2-адреномиметиков короткого действия, значения пиковой скорости выдоха (ПСВ) или объема форсированного выдоха за первую секунду (ОФВ1) и суточные колебания ПСВ (вариабельность). Однако стоит отметить, что помимо клинико-функциональных изменений, характерных для данной патологии, при классификации БА учитывается объем текущей терапии, степень контроля заболевания, а также период болезни.
Классификация по периоду болезни предусматривает 2 периода - обострение и ремиссию.
I. Клинико-функциональные критерии диагноза БА. Для каждой степени тяжести заболевания характерны определенные изменения клинико-функциональных параметров. Важным является то, что наличие хотя бы одного признака, соответствующего более высокой степени тяжести (чем остальные признаки) позволяет определить ребенка в данную категорию. Стоит отметить, что использовать критерии, приведенные в таблице 1, для верификации степени тяжести астмы следует лишь в тех случаях, если пациент никогда не получал противовоспалительной терапии или использовал противоастматические препараты более месяца назад. Такой подход к оценке тяжести болезни используется только для решения вопроса о стартовой терапии.
Таблица 1. Классификация БА по степени тяжести [GINA, 2006]
| Характеристики | Степень тяжести | |||
| Интермиттирующая | Персистирующая | |||
| Легкая | Легкая | Средней степени | Тяжелая | |
| Дневные симптомы | < 1 раза в неделю | > 1 раза в неделю, но | Ежедневно | Ежедневно |
| Ночные симптомы | < 2 раз в месяц | > 2 раз в месяц | > 1 раза в неделю | Частые симптомы |
| Обострения | Кратковременные | Нарушают активность и сон | Нарушают активность и сон | Частые обострения |
| ОФВ1 или ПСВ (от должного) | ≥ 80% | ≥ 80% | 60-80% | ≤ 60% |
| Вариабельность ПСВ или ОФВ1 | < 20% | ≤ 30% | > 30% | > 30% |
Всем детям старше 5 лет с рецидивирующими свистящими хрипами в качестве скрининга необходимо проводить:
- спирометрию;
- пробы с бронхолитиком;
- пикфлоуметрию с ведением дневника самоконтроля.
II. Определение уровня контроля над БА в зависимости от ответа на терапию. Несмотря на первостепенное значение (для определения степени тяжести БА) клинико-функциональных параметров, а также объема терапии, приведенная классификация заболевания не отражает реакцию организма на проводимое лечение. Так, пациент может обратиться к врачу с симптомами астмы, соответствующими средней степени тяжести, в результате ему будет поставлен диагноз среднетяжелой персистирующей БА. Однако в случае недостаточного объема фармакотерапии в течение некоторого времени клинические проявления заболевания будут соответствовать тяжелой персистирующей БА. С учетом данного положения для принятия решения об изменении объема текущей терапии экспертами GINA предложено выделять не только степень тяжести, но и уровень контроля заболевания (табл. 2).
Таблица 2. Уровни контроля над БА [GINA, 2006]
| Характеристики | Контролируемая БА (все перечисленное) | Частично контролируемая БА (наличие любого проявления в течение недели) | Неконтролируемая БА |
| Дневные симптомы | Нет (≤ 2 эпизодов в неделю) | > 2 раз в неделю | Наличие 3 или более признаков частично контролируемой БА в течение любой недели |
| Ограничение активности | Нет | Есть - любой выраженности | |
| Ночные симптомы/ пробуждения | Нет | Есть - любой выраженности | |
| Потребность в препаратах неотложной помощи | Нет(≤ 2 эпизодов в неделю) | > 2 раз в неделю | |
| Показатели функции легких (ПСВ или ОФВ1) 1 | Норма | < 80% от должного (или от наилучшего показателя для данного пациента) | |
| Обострения | Нет | 1 или более раз в год 2 | Любая неделя с обострением 3 |
1 Исследование функции легких не является надежным методом исследования у детей 5 лет и младше. Периодическая оценка уровня контроля над БА, в соответствии с критериями, указанными в таблице 2, позволит индивидуально подбирать пациенту режим фармакотерапии.
2 Каждое обострение требует немедленного пересмотра поддерживающей терапии и оценки ее адекватности.
3 По определению, развитие любого обострения говорит о том, что БА не контролируется.
III. Диагноз аллергической и неаллергической БА у детей. Аллергический вариант БА определяется при наличии сенсибилизации к внешнесредовым аллергенам и сопровождается повышенным уровнем сывороточного IgE. При неаллергическом варианте сенсибилизация в ходе обследования не выявляется, имеет место низкий уровень сывороточного IgE. В последнем случае заболевание развивается, как правило, в более позднем возрасте, чем когда имеет место аллергический вариант (неаллергический вариант не характерен для детей).
Предлагается выделять аллергическое IgE-опосредованное и аллергическое не IgE-опосредованное заболевание. У большинства пациентов аллергическая реакция связана с IgE-антитела-ми, то есть у них имеет место IgE-опосредованная аллергия, или атопия. Атопия определяется как способность организма к выработке повышенного количества IgE в ответ на воздействие аллергенов окружающей среды и выявляется по возрастанию уровня общего или специфического IgE в сыворотке, положительным результатам кожного прик-теста со стандартизированными аллергенами. В типичных случаях атопии доза ингаляционного аллергена, необходимая для появления сенсибилизации и симптомов, чрезвычайно мала. У некоторых людей, которые не могут быть охарактеризованы как атопики и не имеют сенсибилизации (в раннем возрасте) на распространенные аллергены, позднее наступает развитие IgE-опосредованной аллергии при экспозиции высоких доз аллергенов, часто в сочетании с адъювантами, такими как табачный дым. В этой связи термин "аллергическая астма" является более широким по сравнению с термином "атопическая астма".
IV. Классификация в зависимости от периода болезни.
Обострение - это эпизоды нарастающей одышки, кашля, свистящих хрипов или заложенности в грудной клетке, или какой-либо комбинации перечисленных симптомов. Стоит отметить, что наличие симптомов у пациентов с астмой, в соответствии с критериями, приведенными в таблицах 1 и 2, является проявлением заболевания, а не обострением. Так, например, если пациент имеет ежедневные дневные симптомы, два ночных симптома в неделю и ОФВ1 = 80%, врач констатирует факт наличия у больного БА средней степени тяжести, поскольку все перечисленное является критериями этой формы заболевания (а не обострения). В том случае, когда у пациента к имеющимся симптомам добавляется дополнительная (сверх имеющейся) потребность в бронхолитиках короткого действия, увеличивается количество дневных и ночных симптомов, появляется выраженная одышка, -констатируется обострение БА, которое также необходимо классифицировать по степени тяжести (см. раздел - "Определение степени тяжести обострений").
Контроль - это устранение проявлений заболевания на фоне текущей базисной противовоспалительной терапии БА. Полный контроль (контролируемая астма) сегодня определен экспертами GINA как основная цель лечения астмы (табл. 2).
Ремиссия - это полное отсутствие симптомов болезни на фоне отмены базисной противовоспалительной терапии. Так, например, назначение соответствующего степени тяжести астмы фармакотерапевтического режима в течение некоторого времени приводит к уменьшению (а возможно, и к полному отсутствию) клинических проявлений болезни и восстановлению функциональных параметров легких. Такое состояние необходимо воспринимать как контроль над заболеванием. В случае же, если функция легких остается неизмененной, а симптомов БА нет и после отмены терапии, следует констатировать ремиссию. Необходимо отметить, что у детей в пубертатном периоде иногда регистрируется спонтанная ремиссия заболевания. Примеры диагноза:
Бронхиальная астма, аллергическая (атопическая), средней степени, персистирующая, частично контролируемая (J 45.0).
Бронхиальная астма, атопическая, средней степени, персистирующая, обострение средней степени тяжести (J 45.0).
Бронхиальная астма, неаллергическая, тяжелая, персистирующая, контролируемая (J 45.1).
ДИАГНОСТИКА
Анамнез и физикальное обследование
* Указаны показатели для детей школьного возраста и подростков, в каждом конкретном случае необходимо ориентироваться на возрастную норму.
Нормальная частота дыхания у детей: < 2 месяцев - < 60 в минуту; 2-12 месяцев - < 50 в минуту; 1-5 лет - < 40 в минуту; 6-8 лет -< 30 в минуту.
Нормальная частота пульса у детей: 2-12 месяцев - < 160 в минуту; 1-2 года - < 120 в минуту; 2-8 лет - < 110 в минуту.
Бронхиальная астма у детей – это хроническое аллергическое заболевание дыхательных путей, сопровождающееся воспалением и изменением реактивности бронхов, а также возникающей на этом фоне бронхиальной обструкцией. Бронхиальная астма у детей протекает с явлениями экспираторной одышки, свистящими хрипами, приступообразным кашлем, эпизодами удушья. Диагноз бронхиальной астмы у детей устанавливается с учетом аллергологического анамнеза; проведения спирометрии, пикфлоуметрии, рентгенографии органов грудной клетки, кожных аллергопроб; определения IgE, газового состава крови, исследования мокроты. Лечение бронхиальной астмы у детей предполагает элиминацию аллергенов, использование аэрозольных бронхолитиков и противовоспалительных препаратов, антигистаминных средств, проведение специфической иммунотерапии.
МКБ-10
Общие сведения
Бронхиальная астма у детей – хронический аллергический (инфекционно-аллергический) воспалительный процесс в бронхах, приводящий к обратимому нарушению бронхиальной проходимости. Бронхиальная астма встречается у детей разных географических регионов в 5-10% случаев. Бронхиальная астма у детей чаще развивается в дошкольном возрасте (80%); нередко первые приступы возникают уже на первом году жизни. Изучение особенностей возникновения, течения, диагностики и лечения бронхиальной астмы у детей требует междисциплинарного взаимодействия педиатрии, детской пульмонологии и аллергологии-иммунологии.

Причины
Бронхиальная астма у ребенка возникает при участии генетической предрасположенности и факторов окружающей среды. У большинства детей с бронхиальной астмой имеется отягощенная наследственность по аллергическим заболеваниям - поллинозу, атопическому дерматиту, пищевой аллергии и др.
Сенсибилизирующими факторами окружающей среды могут выступать ингаляционные и пищевые аллергены, бактериальные и вирусные инфекции, химические и лекарственные вещества. Ингаляционными аллергенами, провоцирующими бронхиальную астму у детей, чаще выступают домашняя и книжная пыль, шерсть животных, продукты жизнедеятельности домашних клещей, плесневые грибки, сухой корм для животных или рыб, пыльца цветущих деревьев и трав.
Пищевая аллергия служит причиной бронхиальной астмы у детей в 4-6% случаев. Чаще всего этому способствует ранний перевод на искусственное вскармливание, непереносимость животного белка, продуктов растительного происхождения, искусственных красителей и др. Пищевая аллергия у детей часто развивается на фоне заболеваний ЖКТ: гастрита, энтероколита, панкреатита, дисбактериоза кишечника.
Триггерами бронхиальной астмы у детей могут являться вирусы – возбудители гриппа, парагриппа, ОРВИ, а также бактериальная инфекция (стрептококк, стафилококк, пневмококк, клебсиелла, нейссерия), хламидии, микоплазмы и другие микроорганизмы, колонизирующие слизистую бронхов. У некоторых детей с бронхиальной астмой сенсибилизация может вызываться промышленными аллергенами, приемом лекарственных средств (антибиотиков, сульфаниламидов, витаминов и др.).
Факторами обострения бронхиальной астмы у детей, провоцирующими развитие бронхоспазма, могут выступать инфекции, холодный воздух, метеочувствительность, табачный дым, физические нагрузки, эмоциональный стресс.
Патогенез
В патогенезе бронхиальной астмы у детей выделяют: иммунологическую, иммунохимическую, патофизиологическую и условно-рефлекторную фазы. В иммунологической стадии под влиянием аллергена продуцируются антитела класса IgE, которые фиксируются на клетках-мишенях (главным образом, тучных клетках слизистой бронхов). В иммунохимическую стадию повторный контакт с аллергеном сопровождается его связыванием с IgE на поверхности клеток-мишеней. Этот процесс протекает с дегрануляцией тучных клеток, активацией эозинофилов и выделением медиаторов, обладающих вазоактивным и бронхоспастическим эффектом. В патофизиологическую стадию бронхиальной астмы у детей под влиянием медиаторов возникает отек слизистой оболочки бронхов, бронхоспазм, воспаление и гиперсекреция слизи. В дальнейшем приступы бронхиальной астмы у детей возникают по условно-рефлекторному механизму.
Симптомы
Течение бронхиальной астмы у детей имеет циклический характер, в котором выделяют периоды предвестников, приступов удушья, послеприступный и межприступный периоды. Во время периода предвестников у детей с бронхиальной астмой может отмечаться беспокойство, нарушение сна, головная боль, зуд кожи и глаз, заложенность носа, сухой кашель. Продолжительность периода предвестников – от нескольких минут до нескольких суток.
Собственно приступ удушья сопровождается ощущением сдавления в груди и нехватки воздуха, одышкой экспираторного типа. Дыхание становится свистящим, с участием вспомогательной мускулатуры; на расстоянии слышны хрипы. Во время приступа бронхиальной астмы ребенок испуган, принимает положение ортопноэ, не может разговаривать, ловит воздух ртом. Кожа лица становится бледной с выраженным цианозом носогубного треугольника и ушных раковин, покрывается холодным потом. Во время приступа бронхиальной астмы у детей отмечается малопродуктивный кашель с трудноотделяемой густой, вязкой мокротой.
При аускультации определяется жесткое или ослабленное дыхание с большим количеством сухих свистящих хрипов; при перкуссии - коробочный звук. Со стороны сердечно-сосудистой системы выявляется тахикардия, повышение АД, приглушение сердечных тонов. При длительности приступа бронхиальной астмы от 6 часов и более, говорят о развитии у детей астматического статуса.
Приступ бронхиальной астмы у детей завершается отхождением густой мокроты, что приводит к облегчению дыхания. Сразу после приступа ребенок ощущает сонливость, общую слабость; он заторможен и вял. Тахикардия сменяется брадикардией, повышенное АД – артериальной гипотонией.
Во время межприступных периодов дети с бронхиальной астмой могут чувствовать себя практически нормально. По тяжести клинического течения различают 3 степени бронхиальной астмы у детей (на основании частоты приступов и показателей ФВД). При легкой степени бронхиальной астмы у детей приступы удушья редкие (реже 1 раза в месяц) и быстро купируются. В межприступные периоды общее самочувствие не нарушено, показатели спирометрии соответствуют возрастной норме.
Среднетяжелая степень бронхиальной астмы у детей протекает с частотой обострений 3-4 раза в месяц; скоростные показатели спирометрии составляют 80-60% от нормы. При тяжелой степени бронхиальной астмы приступы удушья у детей возникают 3-4 раза в месяц; показатели ФВД составляют менее 60% от возрастной нормы.
Диагностика
При постановке диагноза бронхиальной астмы у детей учитывают данные семейного и аллергологического анамнеза, физикального, инструментального и лабораторного обследования. Диагностика бронхиальной астмы у детей требует участия различных специалистов: педиатра, детского пульмонолога, детского аллерголога-иммунолога.
В комплекс инструментального обследования входит проведение спирометрии (детям старше 5 лет), тестов с бронхолитиками и физической нагрузкой (велоэргометрией), пикфлоуметрии, рентгенографии легких и органов грудной клетки.
Лабораторные исследования при подозрении на бронхиальную астму у детей включают клинический анализ крови и мочи, общий анализ мокроты, определение общего и специфических IgE, исследование газового состава крови. Важным звеном диагностики бронхиальной астмы у детей служит постановка кожных аллергических проб.
В процессе диагностики требуется исключение других заболеваний у детей, протекающих с бронхообструкцией: инородных тел бронхов, трахео- и бронхомаляции, муковисцидоза, облитерирующего бронхиолита, обструктивного бронхита, бронхогенных кист и др.
Лечение бронхиальной астмы у детей
К основным направлениям лечения бронхиальной астмы у детей относятся: выявление и элиминация аллергенов, рациональная медикаментозная терапия, направленная на снижение количества обострений и купирование приступов удушья, немедикаментозная восстановительная терапия.
При выявлении бронхиальной астмы у детей, прежде всего, необходимо исключить контакт с факторами, провоцирующими обострение заболевания. С этой целью может рекомендоваться гипоаллергенная диета, организация гипоаллергенного быта, отмена лекарственных препаратов, расставание с домашними питомцами, смена места жительства и др. Показан длительный профилактический прием антигистаминных средств. При невозможности избавиться от потенциальных аллергенов проводится специфическая иммунотерапия, предполагающая гипосенсибилизацию организма путем введении (сублингвального, перорального или парентерального) постепенно возрастающих доз причинно значимого аллергена.
Основу лекарственной терапии бронхиальной астмы у детей составляют ингаляции стабилизаторов мембран тучных клеток (недокромила, кромоглициевой кислоты), глюкокортикоидов (беклометазона, флутиказона, флунизолида, будезонида и др.), бронхолитиков (сальбутамола, фенотерола), комбинированных препаратов. Подбор схемы лечения, сочетания препаратов и дозировки осуществляет врач. Показателем эффективности терапии бронхиальной астмы у детей служит длительная ремиссия и отсутствие прогрессирования заболевания.
При развитии приступа бронхиальной астмы у детей проводятся повторные ингаляции бронхолитиков, кислородотерапия, небулайзерная терапия, парентеральное введение глюкокортикоидов.
В межприступный период детям с бронхиальной астмой назначаются курсы физиотерапии (аэроионотерапии, индуктотермии, ДМВ-терапии, магнитотерапии, электрофореза, ультрафонофореза), водолечения, массажа грудной клетки, точечного массажа, дыхательной гимнастики, спелеотерапии и др. Гомеопатическая терапия в ряде случаев позволяет предупредить рецидивы заболевания и снизить дозу гормональных препаратов. Подбор и назначение препаратов осуществляется детским гомеопатом.
Прогноз и профилактика
Проявления бронхиальной астмы у детей могут уменьшиться, исчезнуть или усилиться после полового созревания. У 60-80% детей бронхиальная астма остается на всю жизнь. Тяжелое течение бронхиальной астмы у детей приводит к гормональной зависимости и инвалидизации. На течение и прогноз бронхиальной астмы влияют сроки начала и систематичность лечения.
Профилактика бронхиальной астмы у детей включает своевременное выявление и исключение причинно значимых аллергенов, специфическую и неспецифическую иммунопрофилактику, лечение аллергозов. Необходимо обучение родителей и детей методам регулярного контроля состояния бронхиальной проходимости при помощи пикфлоуметрии.
2. Бронхиальная асмта: Учебно-методические рекомендации/ Олейников В.Э., Бондаренко Л.А., Герасимова А.С. – 2003.
Читайте также:

