Инфекционные осложнения в эндоскопии их
Обновлено: 19.04.2024
Колоноскопия при высоком риске инфекционных осложнений. Принципы
При инфекционной патологии следует различать противоинфекционную защиту больных и самого медицинского персонала. Хотя при выполнении колоноскопии прежде всего думают о профилактике передачи инфекции через эндоскоп и медицинские принадлежности, подход должен быть более широким и рассматривать все возможности передачи инфекции.
В частности, следует позаботиться о том, чтобы подготовка оборудования проводилась в соответствии с рекомендациями Комиссии по гигиене больных и профилактике инфекций при Robert Koch-Institut. При ряде известных инфекционных заболеваний, таких как гепатит В, гепатит С и ВИЧ-инфекция, пользование одноразовым расходным материалом исключает передачу инфекции от пациента к пациенту.
Медицинский персонал при налаживании венозного доступа для введения седативных препаратов должен использовать безопасные материалы. При исследовании больного с бактериальной инфекцией, характеризующейся особой резистентностью (метициллин-резистентные штаммы золотистого стафилококка и бактерии с широким спектром b-лактамаз), к соблюдению принципов гигиены следует подходить особенно строго. Рекомендуется носить маску, чтобы защититься от заражения воздушно-капельным путем, а если больной кашляет, то ношение маски обязательно.
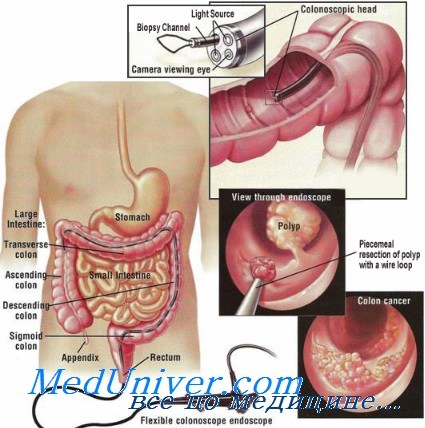
Эндоскопы, которые применялись при исследовании таких больных, требуют особой обработки. Источники в Интернете рекомендуют брать эндоскопы для исследования напрокат в головном центре в Геттингене. Однако и здесь выбор эндоскопов, поступающих на рынок от всех современных производителей, ограничен. При подготовке использованных колоноскопов их не следует обрабатывать альдегидсодержащим антисептиком, так как это ведет к перестройке приона и более прочному склеиванию его с рабочей поверхностью инструмента.
Кроме того, материалы, используемые при эндоскопии, подлежат автоматизированной очистке и дезинфекции. Последнюю осуществляют 4-молярным раствором гуанидиния изотиоцианата в течение 60 мин. Гуанидиния изотиоцианат по своей токсичности принадлежит к IV классу веществ (малоопасное). Обращаться с ним следует осторожно, обязательно применяя защитные средства, такие как перчатки, стойкие к действию щелочей, защитные очки, рабочий халат. Однако риск передачи инфекции при эндоскопии невысок.
Болезнь Крейтцфельда-Якоба, спорадическое инфекционное заболевание, следует отличать от губчатой энцефалопатии и ассоциированного с ней варианта. Пока не удалось доказать, что при болезни Крейтцфельда-Якоба, помимо ЦНС, поражается также лимфатическая система.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гнойная инфекция - наиболее распространенный вид осложнений в хирургической практике, включающий раневую, внутри- или забрюшинную инфекцию, инфекции мочевыводящих путей, легочных осложнений, гнойный тромбофлебит и другие. Ее частота варьирует в зависимости от характера операции и способа профилактики. За счет относительной герметичности брюшной полости и снижения травматичности вмешательства в эндоскопической хирургии инфицирование ран встречается относительно редко. Однако полностью избежать подобных осложнений невозможно. В зависимости от потенциальной вероятности инфицирования раны принята следующая классификация оперативных вмешательств:
1. Чистые (асептичные) - операции при отсутствии воспаления и без вмешательства на желудочно-кишечном тракте, дыхательных и мочевыводящих путях. Рану при этом не дренируют, накладывают первичные швы.
2. Условно-инфицированные - операции на дыхательном или желудочно-кишечном трактах без загрязнения раны их содержимым, вмешательства на влагалище, моче- и желчевыводящих путях, не сопровождающиеся воспалением, аппендэктомия с минимальными нарушениями правил асептики.
3. Инфицированные - вмешательства, при которых имеет место значительное нарушение правил асептики с массивным истечением кишечного содержимого в рану, и операции, сопровождающиеся травмой или вскрытием мочевого пузыря или желчных протоков с инфицированным содержимым.
4. Гнойные - вмешательства, которые сопряжены с острым воспалением (даже если нет гноя), перфорацией внутренних органов, травматические раны с некрозом тканей, присутствием инородных тел, кишечного содержимого, а также случаи, когда лечение воспалительного заболевания было начато поздно.
Патогенные микроорганизмы, вызывающие инфекцию, обычно проникают в рану интраоперационно. Возбудителями могут быть бактерии самого пациента и/или штаммы, находящиеся в окружающей среде.
Для профилактики гнойных осложнений рекомендуется:
1. Дооперационная санация местных очагов инфекции.
2. Сокращение периода пребывания пациента в стационаре перед операцией (профилактика госпитальной инфекции).
3. Подготовку операционного поля следует проводить с минимальной травматизацией наружного слоя эпителия (электрической бритвой или методом химической эпиляции).
4. Тщательно контролировать полноту гемостаза.
5. При катетеризации мочевого пузыря использовать закрытые дренажные системы. Продолжительность дренирования, в зависимости от ситуации, следует сократить до минимума.
6. Разумная и обоснованная антибиотикотерапия.
7. Профилактическая антибиотикотерапия. Профилактическая антибиотикотерапия рекомендуется при следующих эндохирургических (лапароскопических) вмешательствах:
- холецистэктомия при остром холецистите или эмпиеме желчного пузыря;
- холецистэктомия, сопровождающаяся вскрытием просвета желчного пузыря по ходу вмешательства;
- аппендэктомия при остром аппендиците;
- операции на толстой кишке;
- гнойно-воспалительные заболевания брюшной полости ("second-look" в лечении перитонита, ушивание перфоративной язвы, покрытие внутрибрюшных абсцессов и др.);
- гнойно-воспалительные заболевания придатков матки;
- цистэктомия, сопровождающаяся вскрытием дермоидной или любой инфицированной кисты придатков матки;
- при исходной анемии,
- при гипопротеинемии,
- при снижении иммунитета вследствие длительной болезни,
- при локальных травмах тканей с образованием гематомы, некроза.
Известно, что профилактическое использование антибиотиков сокращает в послеоперационном периоде:
- в 2 раза - количество больных с лихорадкой,
- в 3 раза - частоту гнойных осложнений.
С.В. ЯКОВЛЕВ, кандидат медицинских наук, старший научный сотрудник кафедры внутренних болезней № 4 лечебного факультета. ЭТИОЛОГИЯ, КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И ПОДХОДЫ К АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Инфекции являются наиболее частым осложнением у пациентов, находящихся в отделениях интенсивной терапии (ОИТ) и ведущей причиной летальности у этих больных. Частота развития инфекционных осложнений существенно возрастает при увеличении сроков пребывания больного в ОИТ. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов, результаты лечения инфекций остаются неудовлетворительными.
Сложности лечения бактериальных инфекций в ОИТ определяются многими факторами, среди которых следует отметить тяжесть состояния больных, как правило полимикробный характер инфекции, частое выделение так называемых проблемных микроорганизмов, высокий уровень резистентности микробов к традиционным антибиотикам, быстрое развитие устойчивости микробов в процессе лечения, частые рецидивы инфекции во время и после окончания антибактериальной терапии. Кроме того, необоснованное, бессистемное применение антибактериальных препаратов ведет к быстрой селекции и распространению по больнице устойчивых штаммов микроорганизмов.
В связи с тяжестью состояния больных и опасностью для них инфекционных осложнений антибактериальную терапию следует начинать неотложно при первых признаках инфекции, не дожидаясь результатов бактериологического исследования, так как промедление с назначением антибиотика у этих больных может иметь фатальные последствия. В таких случаях обычно назначают комбинацию двух или более антибактериальных средств, чтобы охватить максимально возможный спектр потенциальных возбудителей.
Среди факторов, способствующих развитию инфекции у больных в ОИТ, следует выделить:
основное заболевание
тяжесть состояния больного (АРАСНЕ II > 20)
возраст старше 60 лет
диагностические и лечебные инвазивные процедуры (интубация, ИВЛ, катетеризация мочевого пузыря, катетеризация центральных и периферических вен)
использование антацидов и Н2-блокаторов
длительность нахождения в ОИТ
бессистемное или широкое профилактическое использование антибиотиков.
Источником инфекции является либо сам пациент (эндогенная инфекция в результате орофарингеальной колонизации или аспирации), либо экзогенный источник (дыхательная аппаратура, катетеры, медицинский персонал, другие больные).
Распределение инфекций в ОИТ отличается от других отделений. В отделениях общего профиля превалируют инфекции мочевыводящих путей и раневая инфекция, в то время как в ОИТ наиболее частой является инфекция нижних дыхательных путей (45%), и прежде всего пневмония (около 30%). Сходные данные о преобладании в ОИТ инфекций нижних дыхательных путей получены 29 апреля 1992 года в ходе многоцентрового исследования, проведенного в 1417 отделениях интенсивной терапии в 17 странах Европы - EPIC Study (Evropean Prevalence of Infection in Intensive Care). Примерно с одинаковой частотой (10-15%) в ОИТ встречаются инфекции других локализаций (мочевыводящих путей, интраабдоминальная, кожи и мягких тканей).
Наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам.
Наиболее частыми возбудителями инфекций в реанимации, по данным EPIC Study, являются различные стафилококки (Staphylococcus aureus - 30%, Staphylococcus spp. - 19%) и P. aeruginosa (29%). Частыми патогенами являются также другие грамотрицательные бактерии, прежде всего Escherichia coli (13%), Acinetobacter spp. (9%), Klebsiella spp. (8%), Enterobacter spp. (7%), Proteus spp. (6%). Среди грамположительных микроорганизмов большое значение имеют также Enterococcus spp. (12%) и Streptococcus spp. (7%). Возбудители различных инфекций в отделениях общего профиля и в отделениях реанимации во многих случаях существенно различаются. В ОИТ преобладают так называемые проблемные микроорганизмы, к которым относятся прежде всего S. aureus и коагулазонегативные стафилококки, энтерококки, некоторые грамотрицательные энтеробактерии (Enterobacter cloaceae, Serratia spp., Proteus vulgaris, Klebsiella spp.), неферментирующие грамотрицательные палочки (P. aeruginosa и Pseuctomonas spp., Acinetobacter spp., Stenotrophomonas, maltophilia), а также некоторые анаэробы (Bacteroides fragilis). Эти микроорганизмы, как правило, характеризуются устойчивостью ко многим антибактериальным средствам.
Большинство штаммов S. aureus (85-95%) продуцирует пенициллиназу и устойчиво к бензилпенициллину и пенициллинам широкого спектра, но чувствительно к оксациллину и цефалоспоринам. Частота метициллинрезистентных штаммов S. aureus варьирует в различных регионах и в ОИТ в среднем составляет от 10 до 30%. Эти штаммы стафилококка характеризуются устойчивостью к оксациллину и другим бета-лактамным антибиотикам, а также в большинстве случаев к антибактериальным средствам других классов (макролидам, аминогликозидам, фторхинолонам). Гликопептидные антибиотики (ванкомицин, тейкопланин) являются единственными средствами, сохраняющими высокую активность в отношении этих микроорганизмов.
Коагулазонегативные стафилококки (S. epiderminis, S. haemolyticus, S. hominis) в последние годы стали значительно чаще выделяться у больных в ОИТ в связи с широким использованием внутрисосудистых катетеров. Для этих стафилококков характерна продукция пенициллиназ и более частое, чем у S. aureus, развитие резистентности к метициллину.
P. aeruginosa, второй по частоте микроорганизм, вызывающий инфекции в ОИТ, характеризуется множественной резистентностью. Многие штаммы продуцируют хромосомальные цефалоспориназы, гидролизующие цефалоспорины 3-го поколения, в том числе цефтазидим. Кроме того, Р. aeruginosa может продуцировать бета-лактамазы класса ТЕМ-1, разрушающие антисинегнойные пенициллины, и плазмидные бета-лактамазы, определяющие устойчивость микроорганизма к большинству пенициллинов и цефалоспоринов.
Acinetobacter spp., как правило, проявляет устойчивость к большинству бета-лактамов, аминогликозидам и фторхинолонам. Xanthomonas maltophilia продуцирует металлоэнзимы, разрушающие все бета-лактамы, в том числе карбапенемы. Таким образом, наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам, что определяет сложности лечения этих больных.
Принципы антибактериальной терапии
Учитывая указанные сложности лечения инфекций у больных в ОИТ (тяжесть состояния пациентов, полимикробный характер инфекции, частое выделение возбудителей с множественной устойчивостью к антибактериальным средствам), для проведения адекватной и эффективной антибактериальной терапии необходимо соблюдать следующие положения:
лечение следует начинать неотложно при первых признаках инфекции или наличии лихорадки выше 38°С;
лечение должно быть обязательно программируемым и стандартизованным;
лечение, как правило, эмпирическое, по крайней мере на начальном этапе;
первичная оценка эффективности антибактериальной терапии проводится в течение 48 часов после начала лечения по уменьшению выраженности лихорадки и интоксикации;
лечение должно проводиться под строгим бактериологическим контролем (мокрота, кровь, моча);
на первом этапе предпочтительна монотерапия.
Преимущества монотерапии перед комбинированным использованием антибактериальных средств:
уменьшение риска неадекватного взаимодействия антибактериальных средств;
уменьшение риска нежелательных взаимодействий с другими лекарственными средствами;
уменьшение риска развития токсических явлений;
уменьшение времени введения лекарств;
облегчение работы медперсонала;
уменьшение использования антибиотиков и их попадания в окружающую среду;
уменьшение стоимости лечения.
Как правило, лечение больных, находящихся в ОИТ, имеет эмпирический характер, т.к. должно начинаться неотложно при первых признаках инфекции. До настоящего времени общепринятым подходом к лечению этих больных было назначение бета-лактамного антибиотика (уреидопенициллин или цефалоспорин 2-3-го поколения) в комбинации с аминогликозидом. В последние годы в клиническую практику внедрены новые антибактериальные средства с широким спектром антимикробной активности, позволяющие проводить монотерапию и избегать использования высокотоксичных аминогликозидных антибиотиков. К таким препаратам относятся некоторые цефалоспорины 3-го поколения (цефтазидим) и 4-го поколения (цефепим, цефпиром), фторхинолоны (ципрофлоксацин), защищенные пенициллины широкого спектра с антисинегнойной активностью (пиперациллин/тазобактам, тикарциллин/ клавулановая кислота) и карбапенемовые антибиотики - меропенем и имипенем.
Антибактериальный препарат, назначаемый в режиме монотерапии, должен удовлетворять определенным требованиям:
широкий спектр бактерицидного действия, включающий Staphilococcus spp., P.aeruginosa, Enterobacteriaceae;
стабильность к бета-лактамазам;
невысокий уровень резистентности бактерий, выделяемых у больных в ОИТ;
благоприятная фармакокинетика, хорошее проникновение в ткани;
удобство дозирования и применения;
хорошая переносимость в больших дозах;
хорошее соотношение стоимость-эффективность;
доказанная эффективность в контролируемых клинических исследованиях.
Программа эмпирической антибактериальной терапии инфекций в ОИТ
В кратком обзоре нет возможности подробно рассмотреть все инфекции, встречающиеся в ОИТ. Поэтому представляется целесообразным привести рекомендации по антибактериальной терапии наиболее частых и тяжелых инфекций - пневмонии и интраабдоминальных инфекций.
1. Внебольничная пневмония. Наиболее частыми возбудителями внебольничной пневмонии тяжелого течения у больных, госпитализированных в ОИТ, являются S. pneumoniae, Legionella pneumoniae, Enterobacteriaceae, реже наблюдаются S. aureus и Mycoplasma pneumoniae. Эта пневмония характеризуется быстропрогрессирующим течением и высокой летальностью: по данным British Thoracic Society, летальность может достигать 50-75%. К сожалению, на основании анамнестических данных и клинической картины не представляется возможным установить этиологию пневмонии. В то же время для уточнение возбудителя заболевания или требуется несколько дней, или необходимы специальные и дорогостоящие серологические исследования. В связи с этим выбор схем антибактериальной терапии внебольничной пневмонии тяжелого течения основан на эмпирическом подходе с учетом наиболее вероятных возбудителей.
В настоящее время стандартной схемой начальной эмпирической терапии внебольничной пневмонии в ОИТ является комбинированное применение парентерального цефалоспорина 3-го поколения (высокоактивного в отношении пневмококка и грамотрицательных энтеробактерий) и парентерального макролидного антибиотика (активного в отношении легионеллы и микоплазмы). Среди цефалоспоринов 3-го поколения предпочтительны цефтриаксон (1 г с интервалом 24 ч) или цефотаксим (1-2 г с интервалом 8 ч); к парентеральным макролидам относятся эритромицин (1 г с интервалом 6 ч), спирамицин (1,5 млн ME с интервалом 8 ч) и кларитромицин (0,5 г с интервалом 12 ч). В качестве альтернативы цефалоспоринам 3-го поколения могут быть использованы фторхинолоны (ципрофлоксацин 0,2 г с интервалом 12 ч или офлоксацин 0,2 г с интервалом 12 ч) или цефалоспорины 4-го поколения (цефепим 1 г с интервалом 12 ч или цефпиром 1 г с интервалом 12 ч). При установленной легионеллезной этиологии пневмонии к лечению добавляют рифампицин в/в 0,5 г с интервалом 12 ч.
2. Госпитальная пневмония. Является наиболее частым инфекционным осложнением в ОИТ, особенно у больных, находящихся на ИВЛ. Риск развития вентилятор-ассоциированной пневмонии (ВАЛ) значительно увеличивается при продолжительности ИВЛ более 48 ч. Наиболее важньми факторами для прогнозирования этиологии ВАП являются предшествующая антибактериальная терапия и продолжительность механической вентиляции. У больных с ранней ВАП (к ней относятся случаи пневмонии, развившейся при искусственной вентиляции менее 7 дней), не получавших предшествующей антибактериальной терапии, ведущими этиологическими агентами являются микроорганизмы, обычно колонизирующие верхние дыхательные пути и верхние отделы ЖКТ, такие, как S. pneumoniae, Н. influenzae, S. aureus, Enterobacteriaceae. Для этих микроорганизмов характерен естественный уровень антибиотикочувствительности. В этиологии поздних ВАП (развитие пневмонии при продолжительности ИВЛ свыше 7 суток) ведущую роль играют P. aeruginosa, Acinetobacter spp., S. aureus (в том числе метициллинрезистентные штаммы), Enterobacteriaceae (см. табл. 1). Практически все возбудители поздних ВАП характеризуются множественной резистентностью к антибактериальным препаратам, поскольку такие пневмонии, как правило, развиваются на фоне длительной антибактериальной терапии или профилактики.
Таблица 1
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ГОСПИТАЛЬНОЙ ПНЕВМОНИИ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Раннее начало | ||
| Enterobacteriaceae S.pneumoniae Н.influenzae S.aureus | Цефалоспорин III 1) Фторхинолон | Цефалоспорин II 2) + аминогликозид Ко-амоксиклав + аминогликозид Оксациллин + аминогликозид АСПен 3) + аминогликозид |
| 2. Позднее начало | ||
| S.pneumoniae S.aureus Enterobacteriaceae | Цефтазидим Цефалоспорин IV 4) Ципрофлоксацин Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III + аминогликозид АСПен 3) + аминогликозид Фторхинолон + аминогликозид Ванкомицин + амикацин |
2)цефуроксим, цефамандол
3)тикарциллин, пиперациллин, азлоциллин
4)цефепим, цефпиром
Начальная антибактериальная терапия ВАП основана на эмпирическом подходе, однако до назначения антибактериального препарата обязательным является забор мокроты (желательно получение материала инвазивными методами с количественной оценкой результатов) и крови для микробиологического исследования.
В качестве начальной терапии ранней ВАП может быть использована монотерапия цефалоспоринами 3-го поколения (цефтриаксон 2 г с интервалом 24 ч или цефотаксим 2 г с интервалом 6-8 ч) или фторхинолонами (ципрофлоксацин 0,2-0,4 г с интервалом 12 ч или офлоксацин 0,2-0,4 г с интервалом 12 ч). В качестве альтернативных режимов терапии применяют комбинацию аминогликозидного антибиотика с цефалоспоринами 2-го поколения, ко-амоксиклавом или антисинегнойными пенициллинами. При назначении аминогликозидов следует учитывать высокую частоту устойчивых штаммов бактерий к гентамицину; предпочтительнее использовать амикацин 7,5 мг/кг с интервалом 12 ч или нетилмицин в суточной дозе 4-6 мг/кг (в 2-3 введения).
3. Интраабдоминальные инфекции. Являются одной из наиболее частых причин сепсиса в ОИТ и характеризуются неудовлетворительным прогнозом: частота летального исхода при абдоминальном сепсисе составляет 30-60%. Фактором, определяющим тяжесть течения абдоминального сепсиса, является количественная оценка по АРАСНЕ II: при количестве баллов до начала антибактериальной терапии 20 летальность составила
Возбудителями первичного перитонита, как правило, являются грамотрицательные энтеробактерии. Наиболее часто в ОИТ наблюдается вторичный перитонит, имеющий смешанную аэробно-анаэробную этиологию (см. табл. 2).
Таблица 2
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Перитонит первичный | ||
| Е. coli Klebsiella spp. Proteus spp. Enterobacter spp. S. pneumoniae Enterococcus spp. | Цефалоспорин III 1) Цефалоспорин IV 2) Фторхинолон Пиперациллин/тазобактам Тикарциллин/клавуланат | АСПен 3) + аминогликозид АМП/СБ + аминогликозид Цефалоспорин II 4) + аминогликозид Цефокситин + аминогликозид |
| 2. Перитонит вторичный | ||
| Как правило, полимикробной этиологии: Enterobacteriaceae P. aeruginosa Enterococcus spp. Анаэробы | Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III 1) + клиндамицин Цефалоспорин IV 2) + клиндамицин Фторхинолон + метронидазол Аминогликозид + клиндамицин АСПен 3) + аминогликозид АМП/СБ + аминогликозид |
2)Цефепим, цефпиром
3)Тикарциллин, пиперациплин, азлоциллин
4)Цефуроксим, цефамандол
5)АМП/СБ - ампициллин/сульбактам
В качестве стандартной схемы начальной эмпирической терапии перитонита обычно используют комбинацию аминогликозидного антибиотика (гентамицин, тобрамицин, нетилмицин или амикацин) и препарата с антианаэробной активностью (метронидазол или клиндамицин). В качестве альтернативы могут применяться цефалоспорины 3-го поколения (цефотаксим, цефтриаксон, цефтазидим или цефоперазон) или фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин) в сочетании с антианаэробными средствами.
В последние годы в клинической практике появились антибактериальные средства, обладающие широким спектром в отношении аэробных грамположительных и грамотрицательных бактерий в сочетании с высокой антианаэробной активностью. К ним относятся защищенные антисинегнойные пенициллины (пиперациллин/тазобактам и тикарциллин/клавуланат) и карбапенемы (имипенем, меропенем). Наличие у этих препаратов аэробной и анаэробной активности позволяет применять их в режиме монотерапии при лечении тяжелых интраабдоминальных инфекций в ОИТ, в том числе при абдоминальном сепсисе. В многочисленных контролируемых исследованиях показано, что монотерапия указанными препаратами не уступает по эффективности стандартным схемам комбинированной терапии.
Полученные в зарубежных и отечественных исследованиях данные свидетельствуют о возможности проведения монотерапии тяжелых интраабдоминальных инфекций в ОИТ.
Приведенные рекомендации по антибактериальной терапии наиболее тяжелых инфекций позволяют оптимизировать лечение и улучшить прогноз больных в ОИТ. В то же время следует подчеркнуть, что представленные схемы терапии являются наиболее общими рекомендациями. Программа эмпирической антибактериальной терапии инфекций в ОИТ в конкретном медицинском учреждении должна разрабатываться и корректироваться на основании локальных данных о возбудителях и их чувствительности к антибиотикам.
К.м.н. Е.А. ЛЯЛИНА, д.м.н. Н.П. ЛАПОЧКИНА, асп. М.В. КОЗИНА
Кафедра акушерства, гинекологии и неонатологии педиатрического факультета (зав. — канд. мед. наук Н.В. Керимкулова) Ивановской государственной медицинской академии
Prevention of infectious and inflammatory complications after organ-sparing surgery for ectopic pregnancy
E.A. LYALINA, N.P. LAPOCHKINA, M.V. KOZINA
Department of Obstetrics, Gynecology, and Neonatology, Faculty of Pediatrics, Ivanovo State Medical Academy
Изучена эффективность полижинакса в комплексе профилактической терапии инфекционных осложнений после органосохраняющих операций при внематочной беременности. Обследованы 82 женщины, которым по экстренным показаниям выполнены органосохраняющие операции при эктопической (трубной) беременности. Результаты проведенных исследований свидетельствуют об усилении эффекта профилактики инфекционно-воспалительных осложнений при экстренных оперативных вмешательствах в случае использования местной антибактериальной терапии. Так, в группе женщин, использующих местную противовоспалительную терапию (полижинакс), недостаточный профилактический эффект антибактериальной терапии отмечен только в 13,5%, а без ее использования — в 43,3% (pКлючевые слова: трубная беременность, органосохраняющие операции, профилактика инфекционно-воспалительных осложнений, полижинакс.
The authors studied the efficacy of polygynax used in complex preventive therapy for infectious complications after organ-sparing surgery for ectopic pregnancy. Eighty-two women who had undergone emergency organ-sparing surgery for ectopic (tubal) pregnancy were examined. The results of the investigation are suggestive of the potentiated effect of prevention of infectious and inflammatory complications during emergency surgical interventions if local antibacterial therapy was used. Thus, an inadequate prophylactic effect of antibacterial therapy was observed only in 13.5% in the women using local anti-inflammatory therapy (polygynax) and in 43.3% among those without receiving the latter (pKey words: ectopic pregnancy, organ-sparing surgery, prevention of infectious and inflammatory complications, polygynax.
В последние годы отмечается увеличение числа случаев эктопической беременности (ЭБ) в экономически развитых странах, которая составляет до 2% от общего числа всех беременностей, а согласно результатам мировой статистики, фиксирующей увеличение частоты ЭБ во всех странах, в настоящее время около 1% всех беременностей — внематочные. Несмотря на то что смертность при ЭБ снижается, она все еще является одной из ведущих предотвратимых причин материнской смертности и основной — в I триместре беременности. В большинстве случаев эту группу составляют женщины репродуктивного возраста с трубной локализацией плодного яйца (98%), для которых большое значение имеет сохранение функциональной активности маточных труб для последующей реализации генеративной функции [1, 3, 6].
Наиболее распространенной формой ЭБ является трубная — 93—98,5% [2, 5, 7].
Основу механизма формирования внематочной беременности составляют различные патологические процессы, нарушающие транспорт оплодотворенной яйцеклетки по маточной трубе и изменяющие свойства плодного яйца. Наиболее важный фактор риска — предшествующее воспалительное заболевание органов малого таза, особенно вызванное Chlamidya trachomatis. Риск внематочной беременности увеличивается в 4 раза после применения метода внутриматочной контрацепции продолжительностью более 2 лет, после операций на маточных трубах (сальпингостомии, сальпингонеостомии, фимбриопластики, наложения сальпинго-сальпинго-анастомоза, разделения спаек) повышается в 4—5 раз. Внематочными оказываются от 1,1 до 10% беременностей, наступивших после индукции овуляции. От 2 до 8% беременностей, наступающих после экстракорпорального оплодотворения, являются внематочными. Курение, по данным ВОЗ, повышает риск развития трубной беременности у женщин до 2,2—4% [3, 4].
При ЭБ внедрение бластоцисты в эндосальпинкс завершается формированием плодовместилища из оболочек маточной трубы. Неизбежный финал — прерывание трубной беременности — обеспечивается неприспособленностью маточной трубы к дальнейшему прогрессированию беременности, так как эндосальпинкс лишен трубчатых желез и дифференцировки на базальный и функциональный слои; в нем отсутствует децидуальная трансформация.
Эктопический трофобласт, пролиферативная активность которого значительно выше, чем при маточной беременности, оказывает разрушительное действие [8, 9].
У 45—86% больных с ЭБ имеют место нарушения микробиоценоза влагалища, что может быть причиной инфекционно-воспалительных осложнений после хирургических вмешательств. Поврежденный экологический барьер способствует снижению местного иммунитета и возрастанию вероятности восходящего пути инфицирования в послеоперационном периоде, многократно увеличивает риск развития гнойно-воспалительных осложнений в отдаленном периоде [5, 7].
В условиях операционного стресса, кровопотери, механической травматизации органов малого таза особую роль в развитии гнойных воспалительных осложнений послеоперационного периода приобретает условно-патогенная микрофлора цервикального канала и влагалища [3].
Учитывая, что основным фактором риска развития внематочной беременности является воспалительный процесс в органах малого таза, в послеоперационном периоде необходимо проводить не только профилактику, но и превентивное лечение воспалительных заболеваний. Учитывая высокий риск контаминации раны анаэробами, предпочтение отдавали комбинации метронидазола и цефалоспоринов разных поколений в зависимости от степени риска инфекционных осложнений. В качестве местного профилактического средства использовали полижинакс.
Цель исследования — оценка эффективности полижинакса в комплексе профилактической терапии инфекционно-воспалительных осложнений после органосохраняющих операций на маточных трубах при эктопической беременности.
Материал и методы
Обследованы 82 женщины, средний возраст которых составил 22,7±1,9 года. Всем больным, вошедшим в исследование, по экстренным показаниям выполнены различные органосохраняющие операции: туботомия — у 62 пациенток, резекция маточной трубы — у 14, выдавливание плодного яйца из маточной трубы — у 6. Всем обследуемым после проведения экстренных оперативных вмешательств в течение 1—3 сут вводили антибиотики цефалоспоринового ряда 1—2 раза в сутки, а также метронидазол в дозе 500 мг 3 раза в сутки. Все пациентки были разделены на две группы. Основную группу составили 52 женщины, получавшие в составе профилактической антибактериальной терапии полижинакс. В группу сравнения вошли 30 больных, не получавших местного профилактического лечения. Продолжение антибактериальной терапии до 7 дней потребовалось 7 (13,5%) женщинам основной группы исследования и 13 (43%) пациенткам из группы сравнения (рРезультаты и обсуждение
Сравнительный анализ эффективности превентивной терапии инфекционно-воспалительных осложнений экстренных операций по поводу внематочной беременности проводился на основании данных клинического течения послеоперационного периода, лабораторных данных, результатов бактериологического и бактериоскопического исследований.
Необходимость в продолжении антибактериальной терапии до 5—7 дней возникла на основании следующих данных: повышение температуры более 37,5 °С через 48 ч после оперативного вмешательства у 4 (7,7%) больных из основной группы исследования и у 7 (23,3%) — из группы сравнения; наличие лейкоцитоза в анализе крови более 10,5•109/л и сдвига лейкоцитарной формулы влево у 3 (5,8%) из основной группы и у 6 (20%) женщин из группы сравнения. Таким образом, продолжение антибактериальной терапии было необходимо в основной группе у 13,5% (7) пациенток и у 43,3% (13) в группе, не получавшей местного превентивного лечения (pСопоставимость обследуемых групп к моменту проведения экстренного оперативного вмешательства подтверждают результаты бактериологического исследования содержимого влагалища (табл. 1).
Таблица 1. Результаты бактериологического исследования содержимого влагалища у пациенток обследованных групп до проведения превентивной терапии и после нее
| Показатель, КОЕ/мл | Основная группа (n=52) | Группа сравнения (n=30) | ||
| 1-е сутки | 5-е сутки | 1-е сутки | 5-е сутки | |
| абс. (%) | абс. (%) | абс. (%) | абс. (%) | |
| Стафилококк золотистый | 7 (13,5) | 7 (13,5) | 4 (12,5) | 4 (12,5) |
| Стафилококк эпидермальный | 12 (23) | 4 (7,7) | 9 (28,1) | 8 (25) |
| Стрептококк | 7 (7,7) | 3 (5,8) | 6 (18,8) | 5 (15,6) |
| Дифтероиды | 9 (17,3) | 4 (7,7) | 5 (15,6) | 3 (9,4) |
| Энтерококки | 15 (28,8) | 3 (5,8) | 9 (28,1) | 6 (18,8) |
| Грибы рода Candida | 20 (38,5) | 2 (3,8) | 12 (37,5) | 18 (56,2) |
Результаты бактериологического исследования на 5-е сутки пребывания в стационаре свидетельствуют о более высоком профилактическом эффекте терапии, включающей применение полижинакса. Согласно данным, приведенным в табл. 1, в основной группе на 5-е сутки уменьшилось количество эпидермального стафилококка с 23 до 7,7%, стрептококка — с 7,7 до 5,8%, дифтероидов — с 17,3 до 7,7%, энтерококков — с 28,8 до 5,8% и грибов рода Candida c 38,5 до 3,8%.
Результаты бактериоскопического исследования также различались в основной группе и в группе сравнения (табл. 2). Использование полижинакса в составе превентивной терапии после экстренных органосохраняющих операций по поводу внематочной беременности способствует профилактике и лечению дрожжевого вагинита: присутствие дрожжевого гриба на 5-е сутки отмечалось лишь у 7,7% больных в основной группе и у 66,7% пациенток в группе сравнения.
| Показатель | Основная группа (n=52) | Группа сравнения (n=30) | ||
| 1-е сутки | 5-е сутки | 1-е сутки | 5-е сутки | |
| абс. (%) | абс. (%) | абс. (%) | абс. (%) | |
| Дрожжевой гриб и его мицелий | 32 (61,5) | 4 (7,7) | 18 (56,3) | 20 (66,7) |
| Лейкоциты в слизи цервикального канала от 10 до сплошного покрытия поля зрения | 47 (90,4) | 14 (26,9) | 30 (100) | 21 (70) |
| Лейкоциты в содержимом влагалища: от 40 до сплошного покрытия поля зрения | 34 (65,4) | 4 (7,7) | 26 (86,7) | 19 (63,3) |
| Палочки Додерлейна в большом количестве | 42 (80,8) | 32 (76) | 28 (93,3) | 14 (46,7) |
| Фагоцитоз | 19 (36,5) | 2 (38) | 6 (20) | 1 (3,3) |
При применении полижинакса в основной группе установлено резкое уменьшение пациенток с высоким количеством лейкоцитов в содержимом влагалища: с 65,4% больных в 1-е сутки до 7,7% на 5-е сутки, в то время как в группе сравнения число таких больных оставалось высоким (63,3% на 5-е сутки после операции).
При этом сохранялась стабильность естественной микрофлоры влагалища у 76% пациенток основной группы и у 46,7% больных группы сравнения.
Таким образом, проведенное исследование свидетельствует об усилении эффекта профилактики инфекционно-воспалительных осложнений при проведении экстренных органосохраняющих операций по поводу внематочной беременности при использовании местной антибактериальной терапии. Так, в группе женщин, использующих местную антибактериальную терапию, недостаточный профилактический эффект такой терапии отмечен только в 7 (13,5%), а без применения местной профилактики — в 13 (43,3%) случаях (pБолее высокий профилактический эффект антибактериальных средств (полижинакса) при использовании их для местного лечения обусловлен следующими факторами:
- ограничением вероятности восходящего пути инфицирования;
- лечением больных со смешанным и дрожжевым вагинитом в условиях экстренной госпитализации;
- уменьшением развития местного дрожжевого вагинита на фоне превентивной антибактериальной терапии;
- сохранением естественной микрофлоры влагалища и поддержанием местного иммунитета.
Таким образом, хорошая переносимость и высокая эффективность полижинакса позволяют рекомендовать его для широкого применения в комплексной превентивной терапии инфекционно-воспалительных осложнений у больных, перенесших органосохраняющие экстренные операции при внематочной беременности.
Выводы
- Проведенное исследование свидетельствует об усилении эффекта профилактики инфекционно-воспалительных осложнений при проведении экстренных органосохраняющих операций у больных с трубной беременностью при использовании местной антибактериальной терапии — полижинакса.
- Целесообразно использовать полижинакс для широкого применения в составе комплексной профилактики инфекционно-воспалительных осложнений у больных, перенесших экстренные органосохраняющие операции при трубной беременности.
ЛИТЕРАТУРА
1. Акушерство и гинекология: Клинические рекомендации. Выпуск 2. Под ред. В.И. Кулакова. М 2006; 58.
2. Гаспаров А.С., Бабичева И.А., Косаченко А.Г. Экстренная помощь в гинекологии. Органосохраняющие операции. М 2000; 3—21.
3. Гаспаров А.С. Оптимизация тактики ведения больных с острыми гинекологическими заболеваниями. Лапароскопия и гистероскопия в гинекологии и акушерстве. М: Пантори 2002; 200—203.
4. Гинекология: Национальное руководство. Под ред. В.И. Кулакова, И.Б. Манухина, Г.М. Савельевой. М: ГЭОТАР-Ме-диа 2009; 1088.
5. Кулаков В.И., Адамян Л.В. Эндоскопия в гинекологии. М: Медицина 2000; 383.
6. Кулаков В.И., Гаспаров А.С. Эндоскопия в гинекологии: Общие положения. М 2000; 3—18.
7. Кулаков В.И., Гаспаров А.С., Косаченко А.Г. Ургентная гинекология: новый взгляд. Журн акуш и жен бол 2001; 3: 1: 15—18.
8. Современные технологии в диагностике и лечении гинекологических заболеваний. М 2005; 272—274.
9. Цвелев Ю.В., Беженарь В.Ф., Берлев И.В. Ургентная гинекология: Практическое руководство для врачей. СПб: Фолиант 2004; 384.
Послеоперационный период эндоскопических операций. Осложнения операций.
В большинстве клиник мира эндоскопические операции, проводимые пункционным (задним и заднебоковым) доступом, являются амбулаторными. Больные после проведенного вмешательства активизируются в тот же день и могут быть выписаны, однако, как правило, врачи рекомендуют им остаться в стационаре в течение следующих суток. Некоторые больные после операции могут ощущать незначительные мышечные боли, которые требуют назначения анальгетиков. Обычно пациенты возвращаются к работе в течение 1-4 дней после операции, для чего выбирают операционным днем пятницу.
Они должны соблюдать соответствующий режим, ограничивающий физические нагрузки и спорт в течение двух недель.
Больные после торакоскопических или лапароскопических вмешательств транспортируются в палаты интенсивной терапии. В ранний послеоперационный период продолжается контроль артериального давления, частоты сердечных сокращений, характеристик пульса, оксигенации крови, диуреза. После операции выполняется рентгенография того отдела позвоночника, на котором проводилось оперативное вмешательство, а при торакоскопических операциях обязательно выполняется рентгенография легких. Дренажные системы в неосложненных случаях чаще всего удаляются на следующий день.
В остальном ведение больных после эндоскопических спинальных операций не отличается от такового после традиционных спинальных вмешательств. После неосложненных полостных операций больные выписываются из стационара в срок от 5 до 10 дней.
Во время проведения эндоскопических операций (в том числе и спинальных) возможно развитие осложнений. Тщательно проведенное предоперационное обследование и подготовка позволяют избежать большинства из них.
Осложнения, возникающие при выполнении эндоскопических спинальных операций, можно разделить на две группы:
1. Осложнения, зависящие от особенностей оперативного вмешательства.
2. Осложнения, не зависящие от особенностей эндохирургическои операции (инфекционные и тромбоэмболические).
Осложнения, возникающие при выполнении эндоскопических спинальных операций, целесообразно разделить на следующие группы:
По степени тяжести: опасные для жизни, не опасные для жизни.
По срокам возникновения: интраоперационные, послеоперационные.
По локализации: общие, местные.
По характеру процесса: повреждения, инфекции и др.
Основными причинами возникающих осложнений являются:
1 - недостаток у врача хирургического опыта;
2 - нарушение технических принципов проведения оперативного вмешательства;
3 - аномалии развития;
4 - топографическое изменение органов и тканей у пациента в результате болезни;
5 - недостаточная техническая оснащенность операционной.
Меры профилактики осложнений во время проведения эндоскопических операций разрабатываются в соответствии с причинами, обусловливающими их возникновение. Они состоят из следующих групп мероприятий (А.Уханов, 1999).
Лечебно-тактические, которые делятся на три группы.
Проводимые перед операцией:
• тщательное предоперационное исследование больного;
• подготовка больного к оперативному вмешательству;
• адекватная оценка показаний и противопоказаний к оперативному вмешательству с учетом технических возможностей и оснащенности операционной;
• профилактика гнойно-септических и тромбоэмболических осложнений.
Проводимые во время операции:
• соблюдение техники оперативного вмешательства;
• индивидуальный подход к операции с учетом особенностей заболевания конкретного пациента.
Проводимые в послеоперационном периоде:
• ранняя активизация больных;
• профилактика осложнений со стороны дыхательной и сердечно-сосудистой систем.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

