Инфекционные заболевания в послеоперационном периоде
Обновлено: 19.04.2024
Гнойная инфекция - наиболее распространенный вид осложнений в хирургической практике, включающий раневую, внутри- или забрюшинную инфекцию, инфекции мочевыводящих путей, легочных осложнений, гнойный тромбофлебит и другие. Ее частота варьирует в зависимости от характера операции и способа профилактики. За счет относительной герметичности брюшной полости и снижения травматичности вмешательства в эндоскопической хирургии инфицирование ран встречается относительно редко. Однако полностью избежать подобных осложнений невозможно. В зависимости от потенциальной вероятности инфицирования раны принята следующая классификация оперативных вмешательств:
1. Чистые (асептичные) - операции при отсутствии воспаления и без вмешательства на желудочно-кишечном тракте, дыхательных и мочевыводящих путях. Рану при этом не дренируют, накладывают первичные швы.
2. Условно-инфицированные - операции на дыхательном или желудочно-кишечном трактах без загрязнения раны их содержимым, вмешательства на влагалище, моче- и желчевыводящих путях, не сопровождающиеся воспалением, аппендэктомия с минимальными нарушениями правил асептики.
3. Инфицированные - вмешательства, при которых имеет место значительное нарушение правил асептики с массивным истечением кишечного содержимого в рану, и операции, сопровождающиеся травмой или вскрытием мочевого пузыря или желчных протоков с инфицированным содержимым.
4. Гнойные - вмешательства, которые сопряжены с острым воспалением (даже если нет гноя), перфорацией внутренних органов, травматические раны с некрозом тканей, присутствием инородных тел, кишечного содержимого, а также случаи, когда лечение воспалительного заболевания было начато поздно.
Патогенные микроорганизмы, вызывающие инфекцию, обычно проникают в рану интраоперационно. Возбудителями могут быть бактерии самого пациента и/или штаммы, находящиеся в окружающей среде.
Для профилактики гнойных осложнений рекомендуется:
1. Дооперационная санация местных очагов инфекции.
2. Сокращение периода пребывания пациента в стационаре перед операцией (профилактика госпитальной инфекции).
3. Подготовку операционного поля следует проводить с минимальной травматизацией наружного слоя эпителия (электрической бритвой или методом химической эпиляции).
4. Тщательно контролировать полноту гемостаза.
5. При катетеризации мочевого пузыря использовать закрытые дренажные системы. Продолжительность дренирования, в зависимости от ситуации, следует сократить до минимума.
6. Разумная и обоснованная антибиотикотерапия.
7. Профилактическая антибиотикотерапия. Профилактическая антибиотикотерапия рекомендуется при следующих эндохирургических (лапароскопических) вмешательствах:
- холецистэктомия при остром холецистите или эмпиеме желчного пузыря;
- холецистэктомия, сопровождающаяся вскрытием просвета желчного пузыря по ходу вмешательства;
- аппендэктомия при остром аппендиците;
- операции на толстой кишке;
- гнойно-воспалительные заболевания брюшной полости ("second-look" в лечении перитонита, ушивание перфоративной язвы, покрытие внутрибрюшных абсцессов и др.);
- гнойно-воспалительные заболевания придатков матки;
- цистэктомия, сопровождающаяся вскрытием дермоидной или любой инфицированной кисты придатков матки;
- при исходной анемии,
- при гипопротеинемии,
- при снижении иммунитета вследствие длительной болезни,
- при локальных травмах тканей с образованием гематомы, некроза.
Известно, что профилактическое использование антибиотиков сокращает в послеоперационном периоде:
- в 2 раза - количество больных с лихорадкой,
- в 3 раза - частоту гнойных осложнений.
Послеоперационные раневые инфекции. Факторы риска
Анализ данных Национальной сети по безопасности в здравоохранении США (NHSN) показал, что на 26,6 млн хирургических операций, выполняемых ежегодно в США, приходится 250 000-1 000 000 раневая инфекция (РИ). При этом РИ добавляют 3,7 млн койко-дней и увеличивают затраты на 1,6 млрд долларов. Пациент, у которого во время госпитализации развивается раневая инфекция (РИ), имеет более 60% риск поступления в отделение реанимации и в 15 раз больший риск повторного поступления в стационар в течение 30 дней после выписки.
При этом пребывание больного в стационаре увеличивается в среднем на 6,5 дня, а стоимость лечения возрастает более чем на 3000 долларов.
Послеоперационная инфекция никогда не возникает случайно. Она зависит от присутствия различных, в большей или меньшей степени влияющих на риск РИ факторов.
В группу факторов риска, связанных с макроорганизмом, входит пожилой возраст (> 60 лет), нарушение питания (кахексия, ожирение), курение (вызывает вазоконстрикцию и замедляет заживление раны), алкоголизм, наличие сопутствующих заболеваний и др.
К важнейшим факторам риска относятся сахарный диабет/периоперационная гипергликемия, низкий сывороточный альбумин, антибиотикотерапия в дооперационном периоде, длительная предшествующая госпитализация, наличие отдаленного очага инфекции в момент операции и колонизация кожи и слизистых оболочек золотистым стафилококком.
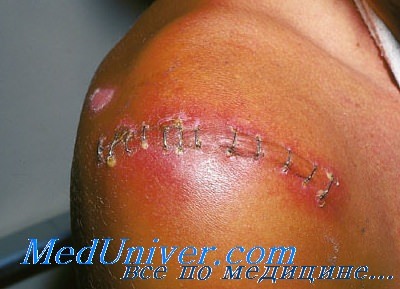
Важные факторы риска у онкологических больных — наличие злокачественной опухоли (независимый фактор раневых инфекций (РИ)), угнетение иммунитета из-за наличия новообразования и проводимого противоопухолевого лечения (химио- и лучевая терапия), осложнения противоопухолевого лечения (лейкопения, нейтропения, лучевые дерматиты и др.).
Колонизация золотистым стафилококком носовых ходов пациента — важнейший фактор риска раневых инфекций (РИ), вызванной данным микроорганизмом, особенно у больных сахарным диабетом или на фоне гемодиализа, у которых подобная колонизация превышает 50%. Исследование у больных, подвергнутых плановым операциям в кардиоторакальных, общехирургических, онкологических, гинекологических и неврологических отделениях, показало 4-кратное увеличение риска РИ, вызванной золотистым стафилококком у больных с колонизацией по сравнению с отсутствием таковой.
Под факторами, связанными с операцией, подразумевается нерациональная обработка кожи операционного поля (использование бритвы для удаления волос вызывает микроабразии), удаление волос вечером перед операцией (разумнее — утром в день операции), неправильная обработка кожи и многое другое.
Некоторые авторы к факторам риска раневых инфекций (РИ) относят отсутствие периоперационной АБП. Если последнее встречается нечасто, то нерациональное назначение профилактического антибиотика (несвоевременное введение, отсутствие дополнительной дозы, неадекватная доза, неправильно выбранный антибиотик) тоже может способствовать развитию РИ.
К факторам риска также относятся периоперационная гипотермия и гипоксия тканей, а также переливание крови во время операции. Периоперационная гипотермия в результате нарушения терморегуляции под действием анестетиков запускает вазоконстрикцию и приводит к низкому напряжению кислорода в тканях, что само по себе служит фактором риска, а также воздействует на нейтрофилы, уменьшая хемотаксис, снижая продукцию супероксида, и т. д.
Роль переливаний крови в развитии раневых инфекций (РИ), возможно, связана с тем, что лейкоциты донора индуцируют иммуносуирессию, однако эти исследования не раз критиковались, т. к. не были стандартизованными и проводился только однофакторный анализ.
Неадекватная вентиляция операционной, нарушение стерильности и асептики, неправильная стерилизация инструментов, пребывание большого количества людей в операционной в процессе операции также играют роль в развитии РИ. В частности, исследование, включавшее около 3000 операций, показало 4-кратное увеличение частоты РИ, если во время операции в операционной находилось более 17 человек (по сравнению с 0-8 человек).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционные осложнения. Эпидемиология нозокомиальных инфекций
Инфекционные осложнения, развивающиеся в разный срок после операций, травм и ранений, составляют значительное число и имеют важное общемедицинское значение.
По данным зарубежных исследований, средняя частота нозокомиального инфицирования (НКИ) в лечебных учреждениях составляет 5-10%, а в ОРИТ достигает 25-49%.
Исследования, выполненные специалистами ЦНИИ эпидемиологии, показали, что в Российской Федерации ежегодное количество случаев нозокомиальной инфекции (НКИ) достигает 2,5 млн. Присоединение инфекционных осложнений к основному заболеванию увеличивает в среднем на 6-8 дней продолжительность пребывания пациента в стационаре, приводит к неоправданным экономическим затратам.

Хирургическая нозокомиальная инфекция (НКИ) увеличивала койко-день в США в среднем на 7,4 дня, в лечебных учреждениях России — на 6-10 дней, в отдельных стационарах (травматология, кардиохирургия) — до 38 дней.
Как известно, нозокомиальные инфекции (НКИ) могут быть вызваны широким кругом микроорганизмов: бактериями, вирусами, плесневыми и дрожжевыми грибами, простейшими. Число потенциальных возбудителей НКИ с каждым годом растет за счет условно-патогенных бактерий, а также микроорганизмов, которых раньше считали сапрофитами.
Нозокомиальные инфекции (НКИ) чаще всего вызываются госпитальными штаммами условно-патогенных грамположительных и грамотрицательных бактерий, отличающихся но своим биологическим характеристикам от негоспитальных штаммов и обладающих множественной лекарственной резистентностью, более высокой устойчивостью к факторам окружающей среды. Долевое участие различных микроорганизмов в развитии инфекции определяется рядом факторов, в первую очередь локализацией патологического процесса, профилем стационара, уровнем развития лабораторной службы. Вместе с тем спектр микроорганизмов, вызывающих послеоперационные осложнения, постоянно меняется в каждой клинике.
Наличие микробных ассоциаций нередко маскирует истинное значение возбудителя НКИ, провоцирует на неправильные лечебные и профилактические действия. Выявление микст-возбудителей у пациентов с НКИ всегда должно быть предметом особого внимания госпитального эпидемиолога, чтобы принять адекватные меры против возможной контаминации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционные осложнения послеоперационного периода. Оксигенотерапия в послеоперационном периоде
Опасность развития инфекционных осложнений у больных, находящихся в критическом состоянии, дает основание для создания в отделениях интенсивной терапии определенного гигиенического режима. При этом необходимо учитывать, что путями проникновения инфекции чаще всего являются полиэтиленовые катетеры, трахеостомические трубки, катетеры, а источниками инфекции — воздух, кожа, персонал, приборы, вентиляторы, белье. Для защиты больных от перекрестной инфекции целесообразно создание боксированных одноместных палат, куда направляются больные из числа находившихся в отделении интенсивной терапии, у которых возникло инфекционное осложнение, или заведомо инфицированные пациенты, нуждающиеся в интенсивном лечении. Хоти и отделении интенсивной терапии могут встречаться вес виды бактерий, однако вес чаще отмечаются грамотрицательные формы. Все шире обсуждается вопрос о том, что в этом определенную роль играет не всегда оправданное профилактическое применение антибиотиков.
Кондиционирование воздуха, использование бактериальных фильтров для вентиляторов, создание подпора воздуха в палатах интенсивной терапии—важные гигиенические требования. В отделениях реанимации нельзя допускать чрезмерного скопления больных, пребывания больных, не нуждающихся в мероприятиях по интенсивному лечению и уходу. Не следует стремиться заполнить весь конечный фонд отделения интенсивной терапии н не только из-за необходимости создания оптимальных гигиенических условий его работы, но и для обеспечения возможности беспрепятственного поступления ургентных больных. Администрация лечебного учреждения должна заботиться об обеспечении беспрепятственного перевода больных из отделения интенсивной терапии, не нуждающихся в дальнейшем пребывании в нем. Необходимо резко ограничить посещение отделении персоналом других подразделений больничного учреждения.
Оксигенотерапия является одним из методов специфической патогенетической терапии гипоксии, находит широкое распространение в практике современного здравоохранения. Однако возможности оксигенотерапии, проводимой при обычном атмосферном давлении, относительно невелики. Даже при здоровых легких и нормально функционирующей сердечно-сосудистой системе нормобарическая оксигенация (рО2 вдыхаемого кислорода до 1 атм) далеко не всегда ликвидирует гипоксию, так как кислородная емкость переносчика кислорода — гемоглобина ограничена, а растворимость кислорода в плазме при этом возрастает ненамного. Лишь применение значительных парциальных давлений кислорода, что возможно только при дыхании им под давлением, превышающим 1 атм, т. е. при гипербарической оксигенации (ГБО). Регулируя давление кислорода во вдыхаемой газовой смеси, можно дозированно увеличить его концентрацию и во внутренних средах организма.
История ГБО практически начинается со второй половины XX века, хотя экспериментальное и клиническое изучение терапевтического эффекта сжатого воздуха широко проводилось уже в XIX веке, а первая лечебная барокамера была построена в Англии еще в 1662 г.
В основе дыхания, как известно, лежит газообмен между окружающей газовой средой (вдыхаемой газовой смесью) и тканями тела. В результате вдыхания клетки организма получают кислород и из них удаляется конечный продукт окисления — СО2. Однако прежде чем молекулы кислорода проникнут в митохондрии клеток, они должны проделать в организме человека длинный и сложный путь. Схематично его можно представить состоящим из отдельных этапов. При этом PO2 каждого последующего этапа меньше предыдущего, т. е. здесь мы имеем дело с каскадом постепенно и непрерывно снижающихся уровней нормальных давлений кислорода. Именно эта разность давлений определяет степень диффузионного напора кислорода, обусловливая тем самым направленность и скорость диффузии газа в различных физических средах организма.
В условиях ГБО также отмечается неуклонное падение РО2, но кислородный каскад при ГБО имеет характерные черты.
Давление воздуха в альвеолах равно окружающему (атмосферному) и в соответствии с законом Дальтона представляет собой сумму парциальных давлений отдельных газов (кислорода, азота, углекислоты, паров воды). При повышении давления внешней среды парциальное давление кислорода, азота и других газов в легких увеличивается пропорционально их нарастанию во вдыхаемом воздухе.
Дыхание чистым кислородом приводит к вымыванию азота из альвеол, и альвеолярное р02 при этом зависит не только от величины рО2 во вдыхаемой смеси, но и от уровня PСО2 и РH2O в альвеолах (это более или менее стабильные величины, практически не изменяющиеся при перемене окружающего давления и не зависящие от того, дышит ли человек кислородом, воздухом или иной газовой смесью). Увеличение давления вдыхаемого кислорода до 1, 2, 3, 4 ата (ата — атмосфера абсолютная, представляющая собой сумму атмосферного и избыточного давления) обусловливает подъем альвеолярного рО2 до 90, 191, 292, 393 кПа. (при дыхании воздухом под атмосферным давлением р02 альвеолярного равно примерно 13,3 кПа. Повышение рО2 в легких в свою очередь ведет к нарастанию напряжения кислорода в артериальной крови: до 146,6—186,6 кПа при 2 ата и до 226,6— 253,3 кПа при 3 ата (исходное артериальное рО2 12,0—12,5 кПа). При обычных условиях дыхания оксигенацня гемоглобина достигает 96—97%. Для полного насыщения гемоглобина у здоровых людей, но расчетам Дугласа и соавт. (1949), достаточно повысить парциальное давление кислорода в альвеолах в среднем до 28,4 кПа, что соответствует 35% кислорода во вдыхаемом воздухе.
Содержание кислорода в клетках можно повысить не только при усилении его доставки, но и в результате снижения уровня потребности кислорода тканями. Это достигается при помощи лекарственных препаратов (например, наркотиков) и гипотермии, которая наряду с уменьшением утилизации кислорода клеткой увеличивает также его растворимость в жидких средах организма. Уменьшая метаболизм клетки, наркотики и гипотермия вместе с тем обусловливают и значительное удлинение расстояния эффективной диффузии кислорода в тканях. Однако нужно помнить, что применение гипотермии и наркотиков, если они не вызывают соответствующего снижения интенсивности окислительных процессов в клетке, может привести в условиях ГБО к развитию кислородной интоксикации.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (< 1200 в 1 мкл), восстановления функции кишечника (обычно примерно после недельного курса лечения).
Инфицирование послеоперационных ран относится к разряду внутрибольничных инфекций, где возможны разные варианты эмпирической антибиотикотерапии в зависимости от тяжести течения раневой инфекции и особенностей формирования резистентности бактерий к антибиотикам. При неосложненных инфекциях мягких тканей, как правило, обходятся монотерапией, в то время как осложненные инфекции, требующие повторных оперативных вмешательств и нередко приобретающие системный характер, чаще нуждаются в назначении антибиотиков более широкого спектра действия или проведении комбинированной антибиотикотерапии.
При лечении тяжелых и жизнеугрожающих инфекций препаратами выбора становятся аминогликозиды, спектр действия которых охватывает подавляющее большинство аэробных грам(-) и грам(+) бактерий (за исключением стрептококков и пневмококков), а в комбинации с пенициллином они оказывают синергическое бактерицидное действие на энтерококки. Однако, несмотря на их активность против Staphylococcus spp., аминогликозиды не следует применять в качестве стартовой монотерапии при стафилококковой инфекции. Гентамицин наиболее широко применяется в практике, однако имеется много свидетельств о высоком удельном весе резистентных к нему микробных изолятов от стационарных больных, что снижает эффективность лечения хирургической инфекции. Наиболее активным среди аминогликозидов является нетилмицин (нетромицин), который, по нашим данным, превосходит другие антибиотики этой группы и некоторые цефалоспорины 3-го поколения и сопоставим по антимикробной эффективности лишь с фторхинолонами (см. табл. 2). У него наименее выражен ото- и нефротоксический эффект, что позволяет вводить суточную дозу препарата однократно без увеличения частоты побочных осложнений. Такой режим введения существенно увеличивает ударное антимикробное действие нетилмицина и имеет экономические преимущества. По стоимости он гораздо доступнее амикацина и, по нашему опыту, должен занять первостепенное положение среди аминогликозидов в лечении оппортунистических инфекций.
Таблица 2
АНТИБИОТИКОЧУВСТВИТЕЛЬНОСТЬ ГРАМ(-) БАКТЕРИЙ ПРИ ИНФЕКЦИЯХ КОСТЕЙ И МЯГКИХ ТКАНЕЙ (%)
| Антибиотики | E.col (n=28) | KES* (n=48) | Proteus spp. (n=22) | P.aeruginoza (n=37) | Acinetobacter (n=19) |
| Нетромицин | 100 | 90 | 73 | 74 | 88 |
| Амикацин | 75 | 40 | 57 | 67 | 75 |
| Тобрамицин | 58 | 34 | 22 | 63 | 43 |
| Гентамицин | 50 | 36 | 30 | 58 | 27 |
| Цефтазидим | 83 | 40 | 70 | 57 | 40 |
| Ципрофлоксацин | 100 | 88 | 79 | 83 | 80 |
Нельзя обойти вниманием и фторхинолоны, которые все чаще становятся препаратами выбора при системных инфекциях. Среди них ципрофлоксацин (ципробай, ципринол) занял прочное место в хирургической практике, в то время как другие препараты этой группы чаще используются для лечения больных терапевтического профиля. Наличие инфузионной формы препарата существенно повышает его конкурентоспособность при лечении больных в реанимационных отделениях, а возможность проведения так называемой ступенчатой терапии с переходом на пероральный прием антибиотика (без существенного снижения его концентрации в крови из-за высокой биоусвояемости при всасывании) значительно снижает стоимость курса лечения. Область применения ципрофлоксацина в хирургии с одинаковым успехом распространяется на инфекции костей и мягких тканей, интраабдоминальные инфекции, инфекции органов грудной полости и малого таза и, конечно, при лечении сепсиса.
Таким образом, применение антибиотиков в хирургии с профилактической и лечебной целью имеет свои особенности, а знание спектра возбудителей хирургических инфекций и антимикробного действия химиопрепаратов является основой правильного их применения в клинике.
Читайте также:

