Инфекционный эндокардит группы инвалидности
Обновлено: 24.04.2024
Мой вопрос, какую годность имеет результат ЭхоКГ ( УЗИ сердца ) для комиссии ? Комиссия в октябре будет. Есть результат ЭхоКГ от 31.03.15, это будет считаться старым или нет ?
Вообще же - есть общее ориентировочное правило, согласно которому "срок годности" анализов и обследований для МСЭ не должен превышать 1-1,5 месяцев.
Если я к примеру сейчас сделаю, то пройдет 2 месяца. Мне нужно строго не больше 1-1,5 месяца или все таки допускается не большая погрешность ?
УЗИ на комиссии давностью 7 месяцев я так понимаю уже не примут ? Если же принесу УЗИ давностью 2 месяца,оно подойдет ?
Еще вопрос играет ли роль, сделаю я его в областной больнице или в платной клинике у себя в городе ?
Если я к примеру сейчас сделаю, то пройдет 2 месяца. Мне нужно строго не больше 1-1,5 месяца или все таки допускается не большая погрешность ?
Принять могут, но существенного значения для перспектив установления инвалидности такое явно устаревшее обследование иметь не будет.
В стационар больных госпитализируют при наличии для этого оснований (показаний), а не по их личным пожеланиям.
Поэтому - жестких требований к срокам лечения в стационаре в бюро МСЭ при Вашей патологии не предъявляют.
Здравствуйте, mode-usb.
Сам по себе факт протезирования клапана сердца - не является безусловными основанием для установления инвалидности. т.е. не все такие больные признаются инвалидами.
Этот диагноз:
вторичный инфекционный эндокардит, ремиссия. Оперированный порок сердца - протезирование митрального клапана. Нормальная функция протеза. Перевязка ОАП в 2005г. 2 ФК по NYHA Н 1.
не является основанием для установления инвалидности.
Не все больные (в том числе и с протезами клапанов сердца) признаются инвалидами.
При патологии ССС (сердечно-сосудистой системы) решающим критерием установления конкретной группы инвалидности является степень НК (недостаточности кровообращения).
Обычно соотношения степеней НК и групп инвалидности следующие:
При НК 0, НК 0-1 и НК 1ст. - инвалидность не устанавливается.
При НК 2Аст. - 3-я группа инвалидности.
При НК 2Бст. - 2-я группа инвалидности.
При НК 3ст. - 1-я группа инвалидности.
Вышеприведенные соотношения действуют при условии наличия у больного СТОЙКОЙ (не поддающейся лечению) соответствующей стадии НК.
СТОЙКОЙ НК считается, если она не поддается лечению на протяжении не менее, чем последних 4-6 мес. перед МСЭ.
В вашем случае - ремиссия по эндокардиту и НК 1ст. (" Н 1 ").
НК 1ст. расценивается в практике МСЭ, как легкое, незначительно выраженное нарушение функции ССС (незначительно выраженные нарушения функций организма не являются основанием для установления инвалидности).
Никто не запрещает вам попытаться пройти МСЭ (свое мнение по вашей ситуации я изложил выше) и получить официальное заключение о наличии (или отсутствии) оснований для установления группы инвалидности в вашем случае.
Здравствуйте, i418092.
Требуется указать точные даты:
- операции репротезирования клапана;
- отказа в установлении инвалидности в бюро МСЭ.
Если на момент отказа в установлении инвалидности в бюро МСЭ у вас еще не истек срок в 4 месяца от даты операции репротезирования клапана, то данный отказ можно расценивать, как правомерный.
Проще говоря, СНАЧАЛА больного надо пролечить в течении определенного периода (для каждой патологии этот период свой), и уже только ПОСЛЕ проведенного лечения - по его результатам решать вопрос о наличии (или отсутствии) у него признаков инвалидности.
В вашем случае судить о наличии (или отсутствии) признаков инвалидности можно в сроки не ранее 4 мес. от даты операции репротезирования клапана.
В случае прохождения МСЭ ДО истечения вышеуказанных ориентировочных сроков - высоковероятен отказ в установлении инвалидности, ввиду незавершенности этапа медицинской реабилитации (и направление на МСЭ будет расценено как преждевременное, необоснованное, т.е. - слишком раннее).
После истечения вышеуказанных ориентировочных сроков можно рассматривать вопрос о наличии (или отсутствии) у больного признаков инвалидности - в зависимости от результатов проведенного лечения (на тот период времени, а не в более ранний послеоперационный период).
Если же на момент отказа в установлении инвалидности срок в 4 мес. от даты операции у вас уже истек, то тут требуется ваш объективный (внешний) осмотр - для проверки соответствия действительности указанной вами стадии ХСН (" ХСН 2Б "), подробнее по этой теме - см. пост № 10 в этой ветке форума о ГИПЕРДИАГНОСТИКЕ.
При наличии у больного стойкой (не поддающейся лечению на протяжении не менее, чем последних 4-6 мес. перед МСЭ) ХСН 2Б - устанавливается инвалидность 2-й группы.
Решение о целесообразности обжалования принимайте самостоятельно - с учетом вышеизложенной информации.
В любом случае - при наличии у вас сомнений в правильности принятого первичным бюро МСЭ решения, вы имеете право обжаловать его в вышестоящее Главное бюро МСЭ вашего региона (в срок не позднее 1 месяца), затем (при необходимости) и выше - в ФБМСЭ.
По действующему законодательству гражданин (его законный или уполномоченный представитель) имеет право подать заявление по обжалованию решения первичного бюро МСЭ как в регистратуру этого же первичного бюро МСЭ, так и в регистратуру вышестоящего Главного бюро МСЭ своего региона - как ему удобнее (в срок не позднее 1 месяца со дня вынесения решения в первичном бюро МСЭ).
Мой вопрос, какую годность имеет результат ЭхоКГ ( УЗИ сердца ) для комиссии ? Комиссия в октябре будет. Есть результат ЭхоКГ от 31.03.15, это будет считаться старым или нет ?
Вообще же - есть общее ориентировочное правило, согласно которому "срок годности" анализов и обследований для МСЭ не должен превышать 1-1,5 месяцев.
Если я к примеру сейчас сделаю, то пройдет 2 месяца. Мне нужно строго не больше 1-1,5 месяца или все таки допускается не большая погрешность ?
УЗИ на комиссии давностью 7 месяцев я так понимаю уже не примут ? Если же принесу УЗИ давностью 2 месяца,оно подойдет ?
Еще вопрос играет ли роль, сделаю я его в областной больнице или в платной клинике у себя в городе ?
Если я к примеру сейчас сделаю, то пройдет 2 месяца. Мне нужно строго не больше 1-1,5 месяца или все таки допускается не большая погрешность ?
Принять могут, но существенного значения для перспектив установления инвалидности такое явно устаревшее обследование иметь не будет.
В стационар больных госпитализируют при наличии для этого оснований (показаний), а не по их личным пожеланиям.
Поэтому - жестких требований к срокам лечения в стационаре в бюро МСЭ при Вашей патологии не предъявляют.
Здравствуйте, mode-usb.
Сам по себе факт протезирования клапана сердца - не является безусловными основанием для установления инвалидности. т.е. не все такие больные признаются инвалидами.
Этот диагноз:
вторичный инфекционный эндокардит, ремиссия. Оперированный порок сердца - протезирование митрального клапана. Нормальная функция протеза. Перевязка ОАП в 2005г. 2 ФК по NYHA Н 1.
не является основанием для установления инвалидности.
Не все больные (в том числе и с протезами клапанов сердца) признаются инвалидами.
При патологии ССС (сердечно-сосудистой системы) решающим критерием установления конкретной группы инвалидности является степень НК (недостаточности кровообращения).
Обычно соотношения степеней НК и групп инвалидности следующие:
При НК 0, НК 0-1 и НК 1ст. - инвалидность не устанавливается.
При НК 2Аст. - 3-я группа инвалидности.
При НК 2Бст. - 2-я группа инвалидности.
При НК 3ст. - 1-я группа инвалидности.
Вышеприведенные соотношения действуют при условии наличия у больного СТОЙКОЙ (не поддающейся лечению) соответствующей стадии НК.
СТОЙКОЙ НК считается, если она не поддается лечению на протяжении не менее, чем последних 4-6 мес. перед МСЭ.
В вашем случае - ремиссия по эндокардиту и НК 1ст. (" Н 1 ").
НК 1ст. расценивается в практике МСЭ, как легкое, незначительно выраженное нарушение функции ССС (незначительно выраженные нарушения функций организма не являются основанием для установления инвалидности).
Никто не запрещает вам попытаться пройти МСЭ (свое мнение по вашей ситуации я изложил выше) и получить официальное заключение о наличии (или отсутствии) оснований для установления группы инвалидности в вашем случае.
Здравствуйте, i418092.
Требуется указать точные даты:
- операции репротезирования клапана;
- отказа в установлении инвалидности в бюро МСЭ.
Если на момент отказа в установлении инвалидности в бюро МСЭ у вас еще не истек срок в 4 месяца от даты операции репротезирования клапана, то данный отказ можно расценивать, как правомерный.
Проще говоря, СНАЧАЛА больного надо пролечить в течении определенного периода (для каждой патологии этот период свой), и уже только ПОСЛЕ проведенного лечения - по его результатам решать вопрос о наличии (или отсутствии) у него признаков инвалидности.
В вашем случае судить о наличии (или отсутствии) признаков инвалидности можно в сроки не ранее 4 мес. от даты операции репротезирования клапана.
В случае прохождения МСЭ ДО истечения вышеуказанных ориентировочных сроков - высоковероятен отказ в установлении инвалидности, ввиду незавершенности этапа медицинской реабилитации (и направление на МСЭ будет расценено как преждевременное, необоснованное, т.е. - слишком раннее).
После истечения вышеуказанных ориентировочных сроков можно рассматривать вопрос о наличии (или отсутствии) у больного признаков инвалидности - в зависимости от результатов проведенного лечения (на тот период времени, а не в более ранний послеоперационный период).
Если же на момент отказа в установлении инвалидности срок в 4 мес. от даты операции у вас уже истек, то тут требуется ваш объективный (внешний) осмотр - для проверки соответствия действительности указанной вами стадии ХСН (" ХСН 2Б "), подробнее по этой теме - см. пост № 10 в этой ветке форума о ГИПЕРДИАГНОСТИКЕ.
При наличии у больного стойкой (не поддающейся лечению на протяжении не менее, чем последних 4-6 мес. перед МСЭ) ХСН 2Б - устанавливается инвалидность 2-й группы.
Решение о целесообразности обжалования принимайте самостоятельно - с учетом вышеизложенной информации.
В любом случае - при наличии у вас сомнений в правильности принятого первичным бюро МСЭ решения, вы имеете право обжаловать его в вышестоящее Главное бюро МСЭ вашего региона (в срок не позднее 1 месяца), затем (при необходимости) и выше - в ФБМСЭ.
По действующему законодательству гражданин (его законный или уполномоченный представитель) имеет право подать заявление по обжалованию решения первичного бюро МСЭ как в регистратуру этого же первичного бюро МСЭ, так и в регистратуру вышестоящего Главного бюро МСЭ своего региона - как ему удобнее (в срок не позднее 1 месяца со дня вынесения решения в первичном бюро МСЭ).
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
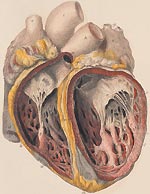
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки.
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки. По современным представлениям синдром соединительнотканной дисплазии определяют как самостоятельный синдром полигенно-мультифакториальной природы, проявляющийся внешними фенотипическими признаками в сочетании с диспластическими изменениями соединительной ткани и клинически значимой дисфункцией одного или нескольких внутренних органов (В. А. Гаврилова, 2002).
Частота диспластического сердца составляет 86% среди лиц с первичной недифференцированной ДСТ (Г. Н. Верещагина, 2008).
По современным представлениям к синдрому ДСТС относят пролапсы клапанов сердца, аневризмы межпредсердной перегородки и синусов Вальсальвы, эктопически крепящиеся хорды митрального клапана и многие другие.
В основе патологии лежит неполноценность внеклеточного матрикса, его коллагеновых структур.
Диспластическое сердце формируют:
вентрикуло-септальные особенности ЛЖ: транзиторный систолический валик верхней трети межжелудочковой перегородки (МЖП), S-образный изгиб МЖП;
системная несостоятельность венозной стенки — варикозное расширение вен верхних и нижних конечностей, малого таза, вульвы, варикоцеле.
IV. Патология органов дыхания со снижением жизненной емкости легких:
Миксоматозная дегенерация створок, хорд, подклапанных структур — генетически детерминированный процесс разрушения и утраты архитектоники коллагеновых и эластических структур соединительной ткани с накоплением в рыхлом фиброзном слое кислых мукополисахаридов. При этом признаки воспаления отсутствуют. В основе — дефект синтеза коллагена III типа, что приводит к истончению фиброзного слоя, створки увеличены, рыхлые, избыточные, края закручены, иногда определяется бахрома. Первичный локус аутосомно-доминантного миксоматоза при ПМК локализован в хромосоме 16. Morales A. B. (1992) выделяет миксоидную болезнь сердца.
В популяционных исследованиях феномен ПМК выявлен у 22,5% детей в возрасте до 12 лет. У детей с ДСТ ПМК обнаруживается значительно чаще — у 45–68%.
Клинические проявления ПМК у детей варьируют от минимальных до значительных и определяются степенью соединительнотканной дисплазии сердца, вегетативными и психоневрологическими отклонениями.
При аускультации характерными признаками пролапса митрального клапана являются изолированные щелчки (клики), сочетание щелчков с позднесистолическим шумом, изолированный позднесистолический шум, голосистолический шум.
Происхождение шума связано с турбулентным током крови, связанным с выбуханием створок и вибрацией натянутых хорд. Позднесистолический шум выслушивается лучше в положении лежа на левом боку, усиливается при проведении пробы Вальсальвы. Характер шума может меняться при глубоком дыхании. На выдохе шум усиливается и иногда приобретает музыкальный оттенок. Нередко сочетание систолических щелчков и позднего шума наиболее отчетливо выявляется в вертикальном положении после физической нагрузки. Иногда при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
Голосистолический шум при первичном пролапсе митрального клапана наблюдается редко и свидетельствует о наличии митральной регургитации. Этот шум занимает всю систолу и практически не меняется по интенсивности при перемене положения тела, проводится в подмышечную область, усиливается при проведении пробы Вальсальвы.
Основными методами диагностики ПМК являются двухмерная Эхо-КГ и допплерография. ПМК диагностируют при максимальном систолическом смещении створок митрального клапана за линию кольца митрального клапана в парастернальной продольной позиции на 3 мм и более. Наличия изолированного смещения передней створки за линию кольца митрального клапана в четырехкамерной верхушечной позиции недостаточно для диагностики ПМК, это служит основной причиной его гипердиагностики.
Эхо-КГ-классификация миксоматозной дегенерации (МД) (Г. И. Сторожаков, 2004):
МД I — минимально выраженная: утолщение створок 3–5 мм, аркообразная деформация митрального отверстия в пределах 1–2 сегментов. Смыкание створок сохранено.
МД II — умеренно выраженная: утолщение створок 5–8 мм, удлинение створок, деформация контура митрального отверстия, его растяжение, нарушение смыкания створок. Митральная регургитация.
МД III — резко выраженная: утолщение створок больше 8 мм, створки удлинены, множественные разрывы хорд, значительное расширение митрального кольца, смыкание створок отсутствует. Многоклапанное поражение. Дилятация корня аорты. Митральная регургитация.
Степень регургитации при ПМК зависит от наличия и выраженности миксоматозной дегенерации, количества пролабирующих створок и глубины пролабирования.
I — минимальная — струя регургитации проникает в полость левого предсердия не более чем на одну треть предсердия.
В состоянии покоя митральная регургитация (МР) первой степени диагностируется у 16–20%, вторая степень — у 7–10% и третья степень — у 3–5% детей с ПМК.
Прогноз больного с ПМК определяет степень митральной регургитации. При этом любая степень пролабирования приводит к изменениям перфузии миокарда, изменениям чаще в области передней стенки ЛЖ и межжелудочковой перегородки (Нечаева Г. И., Викторова И. А., 2007)).
Тяжелые осложнения при ПМК у детей встречаются нечасто. Ими являются: жизнеугрожаемые аритмии, инфекционный эндокардит, тромбоэмболия, острая либо хроническая митральная недостаточность и даже внезапная смерть.
У детей митральная недостаточность при ПМК протекает чаще всего бессимптомно и диагностируется при допплерэхокардиографическом исследовании. В последующем при прогрессировании регургитации появляются жалобы на одышку при физической нагрузке, снижение физической работоспособности, слабость, отставание в физическом развитии.
ПМК является высоким фактором риска возникновения инфекционного эндокардита. Абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза.
Диагностика инфекционного эндокардита при ПМК представляет определенные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита играют: 1) клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, и другие симптомы), 2) появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Частота внезапной смерти при синдроме ПМК зависит от многих факторов, основными из которых являются электрическая нестабильность миокарда при наличии синдрома удлиненного интервала QT, желудочковых аритмий, сопутствующая митральная недостаточность, нейрогуморальный дисбаланс.
Риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз.
В большинстве случаев внезапная смерть у больных с ПМК носит аритмогенный генез и обусловлена внезапным возникновением идиопатической желудочковой тахикардии (фибрилляции) или на фоне синдрома удлиненного интервала QT.
В редких случаях в основе внезапной сердечной смерти у больных с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу.
Таким образом, основными факторами риска внезапной смерти у детей с синдромом ПМК являются: желудочковые аритмии III–V градации по Lown; удлинение корригированного интервала QT более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки; кардиогенные обморочные состояния в анамнезе.
ДСТС являются одними из неблагоприятных факторов, предрасполагающих к развитию аритмических осложнений в детском и подростковом возрасте, в том числе гемодинамически значимых. В структуре нарушений ритма у детей с ДСТС чаще выявляются наджелудочковая экстрасистолия в патологическом количестве и желудочковая экстрасистолия, взаимосвязанные со степенью кардиальной дисплазии (Гнусаев С. Ф., соавт., 2006).
Морфологическими проявлениями синдрома ДСТС у детей с сопутствующей патологией почек, по данным Домницкой Т. М., Гавриловой В. А. (2000), являются: шаровидная или треугольная форма сердца, закругление верхушки сердца, увеличение массы сердца в 1,4–2,5 раза, утолщение и укорочение хорд митрального клапана, отхождение хорд в виде веера, гипертрофия сосочковых мышц, воронкообразная форма митрального клапана, открытое овальное окно. Миксоматозная дегенерация створок атриовентрикулярных клапанов наблюдалась у большинства больных с синдромом ДСТС и заболеваниями органов мочевой системы (частота ее колебалась от 66,7% до 77%). Фиброэластоз эндокарда был выявлен у 10 детей анализируемой группы.
В популяции детей наиболее часто выявлялись смещение септальной створки трехстворчатого клапана в полость желудочка в пределах 10 мм, нарушенное распределение хорд передней створки митрального клапана, дилятация синусов Вальсальвы, увеличенная евстахиева заслонка более 1 см, дилятация ствола легочной артерии, ПМК, диагонально расположенные трабекулы в полости левого желудочка.
Тактика ведения детей с первичным ПМК различается в зависимости от степени выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений. Основными принципами лечения являются: 1) комплексность; 2) длительность; 3) учет направленности функционирования вегетативной нервной системы.
Обязательным является нормализация труда, отдыха, распорядка дня, соблюдение правильного режима с достаточным по продолжительности сном.
Вопрос о занятиях физкультурой и спортом решается индивидуально после оценки врачом показателей физической работоспособности и адаптивности к физической нагрузке. Большинство детей при отсутствии митральной регургитации, выраженных нарушений процесса реполяризации и желудочковых аритмий удовлетворительно переносят физическую нагрузку. При наличии врачебного контроля им можно вести активный образ жизни без каких-либо ограничений физической активности. Детям можно рекомендовать плавание, лыжи, коньки, катание на велосипеде. Не рекомендуются спортивные занятия, связанные с толчкообразным характером движений (прыжки, борьба каратэ и др.). Обнаружение у ребенка митральной регургитации, желудочковых аритмий, изменений обменных процессов в миокарде, удлинения интервала QT диктует необходимость ограничения физической активности и занятий спортом. Этим детям разрешается занятие лечебной физкультурой под контролем врача.
Лечение строится по принципу общеукрепляющей и вегетотропной терапии. Весь комплекс терапевтических мероприятий должен строиться с учетом индивидуальных особенностей личности больного и функционального состояния вегетативной нервной системы.
Важной частью комплексного лечения детей с ДСТС является немедикаментозная терапия: психотерапия, аутотренинг, физиотерапия (электрофорез с магнием, бромом в области верхнешейного отдела позвоночника), водные процедуры, иглорефлексотерапия, массаж позвоночника. Внимание врача должно быть направлено на санацию хронических очагов инфекции, по показаниям проводится тонзиллэктомия.
Медикаментозная терапия должна быть направлена на: 1) лечение вегетативно-сосудистой дистонии; 2) предупреждение возникновения нейродистрофии миокарда; 3) психотерапию; 4) антибактериальную профилактику инфекционного эндокардита.
При умеренных проявлениях симпатикотонии назначается фитотерапия седативными травами, настойка валерианы, пустырника, сбор трав (шалфей, багульник, зверобой, пустырник, валериана, боярышник), обладающий одновременно легким дегидратационным эффектом. При наличии изменений процесса реполяризации на ЭКГ, нарушениях ритма проводятся курсы лечения препаратами, улучшающими обменные процессы в миокарде (панангин, карнитин, Кудесан, витамины). Карнитин назначают в дозе 50 мг/кг в сутки на 2–3 мес. Карнитин выполняет центральную роль в липидном и энергетическом обмене.
Являясь кофактором бета-окисления жирных кислот, он переносит ацильные соединения (жирные кислоты) через митохондриальные мембраны, предупреждает развитие нейродистрофии миокарда, улучшает его энергетический обмен. В наших исследованиях 35 детям с экстрасистолией (более 15 в одну минуту) в состав комплексной терапии был включен карнитин. По окончании лечения у 25 детей экстрасистолия значительно уменьшилась, у 10 детей — не определялась.
Отмечен благоприятный эффект от применения препарата Коэнзим Q10®, который значительно улучшает биоэнергетические процессы в миокарде и особенно эффективен при вторичной митохондриальной недостаточности.
Ранняя диагностика ДСТ у детей позволяет осуществлять соответствующую реабилитационную терапию и предотвращать прогрессирование заболевания. Одним из наиболее ярких терапевтических результатов является эффективное лечение детей с ДСТ (главным образом с ПМК) при помощи магнийсодержащего препарата магния оротата — Магнерот®. Выбор препарата был обусловлен известными свойствами иона магния, отмечающимися у антиаритмических препаратов I и IV класса (мембраностабилизирующие и антагонисты кальция), а также отсутствием побочных эффектов, которые могут появляться при применении традиционной антиаритмической терапии. Учитывалось также и то, что действующим веществом препарата является магния оротат, который, индуцируя синтез протеинов, участвуя в обмене фосфолипидов, являющихся составной частью клеточных мембран, необходим для фиксации внутриклеточного магния (Громова О. А., 2007).
Препарат Магнерот® применялся в виде монотерапии в дозе 40 мг/кг в сутки в течение первых 7 дней приема, затем по 20 мг/кг в сутки в течение 6 месяцев. Результатом лечения явилось уменьшение на 20–25% глубины пролабирования створок митрального клапана и уменьшение степени регургитации на 15–17%. Терапия препаратом Магнерот® не влияла на размеры левых отделов сердца и сократимость миокарда, показатели которых до лечения находились в пределах нормы.
В исследованиях, проведенных Е. Н. Басаргиной (2008), выявлен антиаритмический эффект препарата Магнерот®. При проведении суточного мониторирования ЭКГ у детей 2-й и 3-й групп было отмечено уменьшение количества желудочковых комплексов на 50% и более у 18 (27,7%) больных. Причем у 6 детей отмечено исчезновение желудочковой аритмии или уменьшение количества желудочковых комплексов до 30–312 за сутки. У 14 (21,5%) детей количество желудочковых комплексов уменьшилось не менее чем на 30%. У двух больных отмечено увеличение количества желудочковых экстрасистол до 30% от исходного уровня. Таким образом, антиаритмическая эффективность препарата Магнерот® составила 27,7%. Подобные результаты ранее получены и в других исследованиях (Домницкая Т. М. и соавт., 2005).
В то же время редкие суправентрикулярные и желудочковые экстрасистолы, если не сочетаются с синдромом удлиненного интервала QT, как правило, не требуют назначения каких-либо антиаритмических препаратов.
Таким образом, дети с синдромом ДСТС нуждаются в своевременной диагностике с использованием допплерэхокардиографии, электрокардиографии, в ряде случаев суточного мониторирования ЭКГ, назначении индивидуальной терапии и наблюдении детским кардиологом.
Терапия препаратом Магнерот® у детей с синдромом ДСТС приводит к уменьшению признаков пролапса клапанов, частоты выявления митральной регургитации, уменьшению выраженности клинических проявлений вегетативной дисфунуции, частоты желудочковых аритмий, сопровождается повышением уровня внутриэритроцитарного магния.
Литература
Гаврилова В. А. Синдром дисплазии соединительной ткани сердца у детей с заболеваниями органов мочевой системы. Автореф. дисс. д.м.н. М., 2002.
Morales A. B., Romanelli B., Boucek R. J. et al. Myxoid heart disease: an assessment of extravalvular cardiac pathology in severe mitrae valve prolapse // Hum.Pathol. 1992, v. 23, № 2, p. 129–137.
Верещагина Г. Н. Системная дисплазия соединительной ткани. Клинические синдромы, диагностика, подходы к лечению. Методическое пособие для врачей. Новосибирск, 2008, 37 с.
Гнусаев С. Ф. Значение малых аномалий сердца у здоровых детей и при сердечно-сосудистой патологии. Автореф. дисс. д.м.н., М., 1996.
Сторожаков Г. И., Верещагина Г. С., Малышева Н. В. Оценка индивидуального прогноза при пролапсе митрального клапана // Кардиология, 2004, 4, с. 14–18.
Гнусаев С. Ф., Белозеров Ю. М., Виноградов А. Ф. Клиническое значение малых аномалий сердца у детей // Российский вестник перинатологии и педиатрии. 2006, № 4. С. 20–24.
Домницкая Т. М., Гаврилова В. А. Синдром дисплазии соединительной ткани сердца у детей с заболеваниями мочевой системы / Материалы Второго Съезда педиатров-нефрологов России. М., 2000. С. 159.
Громова О. А, Гоголева И. В. Применение магния в зеркале доказательной медицины и фундаментальных исследований в терапии // Фарматека. 2007, т. 146, № 12, с. 3–6.
Басаргина Е. Н. Синдром дисплазии соединительной ткани сердца у детей // Вопросы современной педиатрии. 2008, т. 7, № 1, 129–133.
Домницкая Т. М., Дьяченко А. В., Куприянова О. О., Домницкий М. В. Клиническая оценка использования оротата магния улиц молодого возраста с синдромом дисплазии соединительной ткани сердца // Кардиология. 2005; 45 (3): 76–81.
С. Ф. Гнусаев, доктор медицинских наук, профессор
ГОУ ВПО Тверская ГМА Росздрава, Тверь
Читайте также:

