Инфекционный эндокардит можно ли им заразиться от больного
Обновлено: 24.04.2024
Как показывают наши примеры, встречаемость инфекционного эндокардита среди наркоманов увеличивается в связи с широким распространением внутривенного употребления наркотиков. Наиболее часто поражается трикуспидальный клапан. По данным литературы, в процесс могут также вовлекаться и другие клапаны [3]. В кантональном госпитале Цюриха было проведено проспективное исследование 22 пациентов с инфекционным эндокардитом (средний возраст 23 года). Период наблюдения составил три года [3]. Трикуспидальный клапан был поражен у 13 человек, митральный клапан — у четырех, комбинированное трикуспидально-митральное поражение наблюдалось у пяти пациентов и аортальный клапан был поражен у одного больного. Золотистый стафилококк оказался наиболее частым возбудителем (у 15 человек). Потенциальными факторами его патогенности, определяющими клиническую картину септического процесса, являются следующие энтеротоксины: SEA, SEB, SEC, SED и токсин синдрома токсического шока (TSST-1). Эти вещества связываются белками интерстицильного матрикса: фибронектином, колллагеном I и II типа и костным сиалопротеином (BSP). Однако эти факторы не являются преобладающими среди больных с инфекционным эндокардитом, вызванным Staphylococcus aureus [2]. BSP преобладает у больных с кожными поражениями, в то время, как у больных с эндокардитом чаще всего выделяются штаммы микроорганизмов, не вырабатывающие энтеротоксины. На наш взгляд, исходя из такой особенности выработки патогенов, можно предположить, что клинические проявления септического процесса, связанные с первичным очагом инфекции в коже (например, фурункулез), являются по своей картине однородными, в то время как при стафилококковом эндокардите факторы патогенности разнородны или вообще отсутствуют. Это может быть причиной отрицательного результата посевов крови.
Streptococci, по данным швейцарских врачей, являлись причиной бактериального эндокардита у четыреx пациентов, Corynebacteria — у двуx и в одном случае имелась смешанная инфекция [3]. Шесть пациентов были ВИЧ-инфицированы и 17 имели хронический вирусный гепатит. Десять пациентов (трое из них ВИЧ-инфицированные) подверглись хирургическому лечению. При кардиохирургическом лечении было проведено: рассечение трикуспидального клапана с заменой (у одного больного) или без замены (у четыреx больных) клапана, удаление вегетаций и замена клапана (у двух больных), замена митрального клапана (у двуx больных), протезирование аортального клапана (у одного больного). В случае эндокардита трехстворчатого клапана тактика оперативного вмешательства (выполнить резекцию, удалить вегетации или осуществить замену клапана) была выбрана с учетом тяжести поражения клапана и состояния психосоциального статуса пациента. В случае если вегетации присутствуют только на одной створке клапана и могут быть легко удалены, используется вегетоэктомия с аннулопластикой аутологичным перикардом. Удаление клапана без его протезирования является средством выбора среди тех пациентов, у которых нельзя исключить употребление наркотиков в будущем. Протезирование биопротезом используется в том случае, когда налицо полное разрушение клапана и доказано, что пациент воздерживался от употребления наркотиков в течение длительного времени до операции.
Литература
1. Медицинская микробиология / Гл. ред. В. И. Покровский, О. К. Поздеев. М.: Гэотар Медицина, 1999. 1200 с.
2. Carrel T., Schaffner A., Pasic M. et al. Surgery of endocarditis in the drug dependent and HIV patient. A prospective comparison with conservative treatment // Helv. Chir. Acta. 1993. Vol. 60. №3. Р. 439-445.
3. Hogevik H., Soderquist B., Tung H. S. et al. Virulence factors of Staphylococcus aureus strains causing infective endocarditis a comparison with strains from skin infections // APMIS. 1998. Vol. 106. № 9. P. 901-908.

За последние десять лет в России увеличилось в три раза количество случаев заболевания инфекционным эндокардитом. Это воспаление внутренней оболочки сердца, которое может вызвать серьезные осложнения вплоть до летального исхода.
Сниженный иммунитет и аномалии
Ренат Муратов: Причин несколько. Растет число имплантируемых материалов, электрокардиостимуляторов, становится больше открытых операций на сердце, все больше используются искусственные сосуды и клапаны. Увеличение числа людей, живущих с этими устройствами, приводит к обязательному росту инфекционных проблем у пациентов. Смертность от таких осложнений крайне высока. Но инфекционный эндокардит может развиться и у человека, у которого нет никаких имплантируемых устройств, и даже при хирургическом вмешательстве летальность составляет 20%. При развитии инфекции на имплантируемых устройствах смертность еще выше. Важна профилактика осложнений и своевременное распознавание болезни.
- На фоне чего еще может развиться заболевание? И можно ли его как-то распознать?
- Получается, что, если вовремя поставить диагноз, то пациента можно до конца вылечить?
- Совершенно верно. Чем раньше вмешается специалист, тем больший эффект будет достигнут. Важно, чтобы врачи как можно быстрей отправляли пациента за хирургической помощью. На ранних стадиях операция проходит довольно гладко, и смертность крайне низкая. А при нерациональном и запоздалом лечении шансов на удачный исход с каждой неделей становится все меньше.
- Какие категории населения находятся в группе риска развития инфекционного эндокардита?
- Влияют социальные факторы риска. Заболевание может развиться у людей, живущих за чертой бедности, а также у тех, кто страдает алкогольной зависимостью. В первую очередь, причина заболевания кроется в сниженном иммунитете. Более подвержен заболеванию ослабленный человек. Кроме того, в группе риска – люди с небольшими аномалиями строения сердца. Казалось бы, порока нет, качество жизни не страдает, но есть пролапс (выпячивание органа или его части через естественные отверстия – ред.). И эта категория людей уязвима для развития инфекции на фоне провоцирующих факторов – например, тяжелого гриппа, гнойных ран или даже при проведении такой урологической процедуры, как уретроскопия.


- К каким болезням может привести несвоевременное лечение инфекционного эндокардита?
Сергей Ковалев: Когда инфекционный очаг находится на сердечном клапане, то может вызвать образование тромбов. Осложнения могут привести к инсульту. Эти процессы сегодня довольно распространены и существуют определенные проблемы в их лечении.
- Какие именно?
- Люди, которые думают, что знают все о медицине, бездумно пьют антибиотики. Поднялась температура, они попили один день антибиотик и бросили лечение. А возбудитель на этот антибиотик уже реагировать не будет. Да и вообще все современные подходы основаны на том, чтобы как можно меньше пичкать больных антибиотиками. Надо искать первопричину – вот что важно.
- Какие еще ошибки совершают пациенты?
- Нежелание заниматься профилактикой заболеваний. Температура может подняться не только при ОРВИ. А вдруг это, например, почечная инфекция? Или появился рубец на коже – в организме может зреть инфекция. Иммунитет упал, и на этом фоне инфекция может получить более сильное развитие и дать осложнение на другие органы. Если пациенты с имплантируемыми устройствами заболели гриппом, то они должны в течение 48 часов провести очень серьезную антибактериальную терапию. Это тоже необходимо для того, чтобы избежать осложнений.
- В целом, число пациентов с заболеваниями сердца растет. С чем это связано?
Инфекционный эндокардит – это воспаление внутренней оболочки сердца: эндокарда, с вовлечением в процесс в первую очередь сердечных клапанов, реже поражаются стенки камер и дефекты перегородок. Синонимом этого заболевания является бактериальный эндокардит.
Симптомы бактериального эндокардита Обычно начинают проявляться спустя 2 недели от момента внедрения инфекционного агента. Клиника может быть стертой, а может быть резко выражена.
У части больных в течение суток может быть нормальная или умеренно повышенная температура, и только в определенное время отмечаются характерные подъемы. Именно поэтому при подозрении на инфекционный эндокардит необходимо повторное, через каждые 3 часа, измерение температуры.
К ранним клиническим проявлениям можно отнести нарушение сознания, снижение артериального давления, рвота, диарея.
Как правило, больных беспокоят симптомы хронической интоксикации: слабость, головные боли; пациенты отмечают мышечные и суставные боли, снижение аппетита, похудание.
Точечные кровоизлияния на коже определяются примерно у половины больных.
По мере развития патологического процесса присоединяются симптомы сердечной недостаточности, которые возникают в результате нарушения функции пораженных клапанов. Это преимущественно одышка, положение больного сидя, отеки на ногах, набухание шейных вен, тяжесть в правом подреберье и другие.
Если же патологический процесс зашёл настолько далеко, что появились тромбоэмболические осложнения (в результате отрыва части бактериальных разрастаний на клапанах), то появляются соответствующие дополнительные симптомы характерные для инсульта, тромбоэмболия легочной артерии и других органов.
Самым тяжёлым вариантом развития заболевания является септический шок. он значительно осложняет течение болезни и сопровождается высокой смертностью.
Впервые заподозрить диагноз врач может при анализе жалоб пациента. После тщательной беседы с больным врач обязательно переходит к осмотру. При выслушивании сердца врач может обнаружить шумы, которые могут говорить о структурном поражение сердца. в результате всех собранных данных назначаются лабораторные и инструментальные методы обследования.
Изменения в общем анализе крови неспецифические: лейкоцитоз, анемия, повышенная скорость оседания эритроцитов.
Большую диагностическую ценность при эндокардитах имеет многократное исследование посева крови на стерильную среду. Вероятность высевания возбудителя увеличивается при взятии крови на высоте лихорадки.
Биохимические показатели крови также могут быть изменены в широких пределах в зависимости от поражения тех или иных внутренних органов. Могут быть повышены С-реактивный белок, ревматоидный фактор. Следует обращать внимание на изменение белкового спектра крови с ранним увеличением альфа-1 и альфа-2 глобулинов и более поздним нарастанием гамма-глобулинов.
Большое значение имеет определение показателей иммунного статуса, прежде всего увеличение уровня ЦИК, реакции и бласттрансформации лейкоцитов с бактериальными антигенами, увеличение иммуноглобулина М; снижение общей гемолитической активности комплемента; нарастание уровня противотканевых антител. Определенное диагностическое значение имеет сохранение нормальных титров антигиалуронидазы и антистрептолизина-О (при нестрептококковой природе ИЭ).
Наиболее ценным из инструментальных исследований является УЗИ сердца. Прямой признак инфекционного эндокардита – обнаружение вегетаций (бактериальных разрастаний) на клапанах сердца.
Одни и те же симптомы могут быть признаками разных заболеваний, а болезнь может протекать не по учебнику. Не пытайтесь лечиться сами — посоветуйтесь с врачом.
В комплексе лечебных мероприятий при инфекционном эндокардите, конечно же, на первом месте стоит адекватная противомикробная терапия.
Учитывая, что наиболее часто встречающимися возбудителями является грамположительная флора, лечение можно начинать с бензилпенициллина в дозе 12–30 ЕД /сут. Курс в среднем составляет 4 недели. Хороший эффект, особенно при инфекционном эндокардите, вызванном зеленящим стрептококком, оказывает комбинация пенициллина с аминогликозидами, в частности с гентамицином в дозе 1 мг/кг веса больного каждые 8 часов. Из других антибиотиков используют полусинтетические пенициллины, ванкомицин 30 мг/сут. в 2 приема внутривенно; цефтриаксон в дозе 2 г/сут.
При энтерококковом эндокардите, развивающемся, как правило, после вмешательств на желудочно-кишечном тракте или мочеполовых путях, в связи с неэффективностью цефалоспоринов чаще используют ампициллин (12 г/сут.) или ванкомицин в сочетании с аминогликозидами.
Большие трудности связаны с лечением больных инфекционным эндокардитом, возбудителями которого является грамотрицательная флора, кишечная палочка, протей, синегнойная палочка и др. В подобных случаях назначают цефалоспорины второго и третьего поколения (цефотаксим, цефтриаксон), ампициллин (8–12 г/сут.), карбенициллин (30 г/сут.) в сочетании с аминогликозидами. Используют большие дозировки для длительного (в течение 4–6 недель) внутривенного или внутримышечного введения.
В лечении используют другие средства с антибактериальными свойствами, например диоксидин 60–100 мл внутривенно капельно. Вводятся по показаниям антистафилококковая плазма, антистафилококковый глобулин и др.
Следует помнить о возможности и необходимости использования хирургических методов лечения инфекционного эндокардита. Показания к хирургическому лечению:
нарастающая сердечная недостаточность при грубых клапанных дефектах, устойчивая к лекарственной терапии;
прогрессирующая сердечная недостаточность на фоне длительно не контролируемой инфекции (как правило, при грамотрицательной флоре и грибах);
рецидивирующий тромбоэмболический синдром;
большие и очень подвижные вегетации на клапанах (по заключению УЗИ сердца);
абсцессы миокарда и клапанного кольца;
повторные ранние рецидивы инфекционного эндокардита.
Как правило, проводят иссечение пораженных участков с одновременным протезированием разрушенных клапанов.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
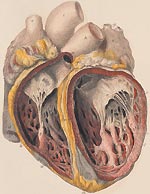
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


