Инфекционный генез сахарного диабета
Обновлено: 24.04.2024
Статья почвящена инфекционным факторам развития сахарного диабета у детей. Подчеркивается необходимость настороженности врачей в отношении энтеровирусной инфекции, полиморфизма ее проявлений, тяжелых поражений многих органов и систем с формированием сомат
The article is dedicated to infectious factors of diabetes mellitus in children. The need for doctors caution in respect of enteroviral infection, polymorphism of its representations, severe lesions of multiple organs and systems with formation of somatic problems were highlighted.
Сахарный диабет (СД) является одним из наиболее важных и сложных для современной медицины заболеваний, что обусловлено его широким распространением, клиническим полиморфизмом и тяжестью осложнений [1–6]. Летальность при СД выше в 2–3 раза по сравнению с больными без него. Всемирная организация здравоохранения (ВОЗ) характеризует инсулинзависимый СД (ИЗСД, или СД 1-го типа) как эпидемию неинфекционного генеза из-за значительного роста среди детей и подростков [2–5]. Прогнозируется, что заболеваемость ИСЗД за период с 2005 по 2020 гг. у детей младше 5 лет увеличится в 2 раза, а общая распространенность его у детей до 15 лет возрастет на 70%, поэтому госпитализация также увеличится [7].
В настоящее время смертность от острых осложнений СД (диабетической комы) не превышает 1%, но вместе с повышением продолжительности жизни больных возникла новая проблема — сосудистые осложнения СД [8]. Развитие СД сопровождается 3–4-кратным увеличением риска смерти от сердечно-сосудистых заболеваний (ССЗ) и уменьшением ожидаемой продолжительности жизни по сравнению с лицами, не имеющими СД. Возникающие кардиоваскулярные нарушения в детском возрасте при ИЗСД становятся основной причиной смертности у взрослых пациентов. Миокардиодистрофия в большинстве случаев приводит к развитию сердечной недостаточности, артериальной гипертензии (АГ), прогрессированию макро- и микрососудистых осложнений СД 1-го типа.
На сегодняшний день существуют только единичные работы, посвященные данной проблеме у детей. Основная же масса представленных работ касается взрослого контингента, хотя известно, что формирование осложнений начинается в детском возрасте, когда данные изменения еще обратимы и есть возможность предотвратить их прогрессирование. Кроме того, имеет место неоднозначная трактовка результатов исследования ввиду их малочисленности и отсутствия единой комплексной оценки всех звеньев патогенеза сосудистых осложнений.
Основным патогенетическим механизмом, участвующим в развитии кардиоваскулярных нарушений при СД 1-го типа, является диффузный генерализованный патологический процесс, который поражает всю систему микроциркуляции — микроангиопатия с нарушением метаболизма сердечной мышцы, изменение нервной регуляции сердца, развитие изменений в рамках кардиоренального синдрома и эндотелиальной дисфункции. У детей и подростков, больных СД 1-го типа, на ранних его стадиях происходит также развитие диабетической микроангиопатии зрительного анализатора, обусловленного хронической гипергликемией, хронической гипоксией, активизирующей процессы ангиогенеза [9]. Признанным механизмом повреждения миокарда при СД является уменьшение коронарного резерва вследствие гипергликемии (микроангиопатии), гипертриглицеридемии, эндотелиальной дисфункции.
Поражение сердца при СД развивается вследствие воздействия ряда неблагоприятных факторов, приводящих к повреждению миокарда, его реактивной гипертрофии, фиброзу на фоне функциональных и структурных изменений мелких сосудов, метаболических нарушений и кардиальной автономной нейропатии [10]. СД является мощным и независимым фактором риска развития мерцательной аритмии и трепетания предсердий. Следует отметить, что нередко асимптоматические пароксизмы и пароксизмы, сопровождающиеся клинической симптоматикой, находятся в соотношении 12:1, и задачей клиницистов является раннее предупреждение этих состояний [11]. СД и мерцательная аритмия тесно связаны между собой по ряду факторов, ускоренному развитию атеросклероза с формированием фибросклероза с ишемизирующим воздействием на миокард, ремоделированием иннервации предсердий и другие.
Клинический полиморфизм при энтеровирусной инфекции проявляется не только разнообразием клинических форм, но и тем, что у одного и того же больного данная инфекция может проявляться в различных вариантах.
Было проведено изучение морфологических маркеров вирусов при биопсии у 57 больных с аритмогенной кардиопатией правого желудочка (АКПЖ) (средний возраст пациентов 48 ± 12 лет). Результаты исследования (биопсийного и аутопсийного) свидетельствовали в пользу врожденного генеза кардиомиопатии. В преобладающем количестве случаев у пациентов были выявлены энтеровирусы. Экспрессия антигена энтеровирусов была обнаружена в цитоплазме кардиомиоцитов, гладкомышечных клетках, эндотелиоцитах сосудов [12].
Отечественная история изучения значения различных вирусов как причин манифестации ИЗСД относится к 1980-м гг. и связана с именами таких ученых, как Л. С. Лозовская, В. В. Смирнов, Н. А. Мазурина и др. [14, 15].
К энтеровирусной инфекции в последние годы приковано внимание специалистов всего мира. Преимущественно зарубежными учеными в последние годы были собраны метаанализы, разрабатываются программы, методы диагностики и профилактики энтеровирусной инфекции. Столь пристальное внимание обусловлено серьезностью и тяжестью последствий энтеровирусной инфекции во многих областях медицины и, в частности, в эндокринологии. ВОЗ характеризует ИЗСД как эпидемию. К сожалению, среди отечественных специалистов-эндокринологов пока нет такой настороженности и понимания значения этой инфекции как причины развития ИЗСД, хотя за рубежом уже создается вакцина от энтеровирусной инфекции для предупреждения развития СД [16, 17].
Учитывая важность настоящей проблемы, первоначально мы преследовали основную цель — выявить изменения со стороны сердечно-сосудистой системы у детей, умерших от ИЗСД за 20-летний период времени (1991–2011). Однако, принимая во внимание данные литературы последних лет, в ходе исследования был проведен анализ патологоанатомических данных и поиск этиотропных вирусов, которые обладают полиорганным поражением (сердца, бета-клеток поджелудочной железы и др. органов).
За данный период времени, по материалам вскрытий Морозовской ДГКБ, умерло 16 детей (8 мальчиков и 8 девочек) с диагнозом СД 1-го типа (рис. 1).
Как видно из рис. 1, большинство летальных исходов у детей с СД 1-го типа приходилось на 1991–2003 гг. В последующие годы, очевидно, в связи с отработкой методов лечения и контроля как во всем мире, так и у нас в стационаре, количество летальных исходов значительно уменьшилось.
ИЗСД впервые выявленный был у 11 детей, СД 1-го типа со стажем от 1,5 до 12,5 лет — у 5 детей (31,3%). Возраст детей был следующим: 1–3 года — 2 чел.; 3–6 лет — 3; 6–9 лет — 4; 9–12 лет — 1; 12–15 лет — 6. Таким образом, 56,3% детей были в возрасте от 1 до 9 лет и 43,7% — старше 9 лет. Основным диагнозом при поступлении у всех больных был СД 1-го типа, кетоацидотическая кома. Причина летального исхода — отек головного мозга.
Анализируя клиническую симптоматику дебюта заболевания и тех симптомов, с которыми дети поступали в стационар, следует сказать, что у 14 больных (87,5%) заболевание началось с характерных симптомов — жажды и похудания, однако у 11 детей (68,8%) имели место симптомы инфекционного заболевания, такие как острое респираторное заболевание (4 чел.), боль в горле (1 чел.), пневмония (1 чел.), энцефалит (1 чел.), аппендицит (?) (у детей с болями в животе) (табл. 1). У одного ребенка диагноз был установлен случайно во время диспансеризации, другой поступил в стационар в кардиологическое отделение с пароксизмальной тахикардией. Сложность диагностики во многом была связана с краткостью пребывания в стационаре. Так, 9 детей (56,3%) погибли в первые сутки пребывания в отделении реанимации и интенсивной терапии (ОРИТ), находясь в коме.
По данным патологоанатомического исследования оказалось, что у большего количества детей (14 из 16) имели место различные фетодисплазии, которые ни у одного ребенка, несмотря на возраст (многие из них старшего возраста) не были выявлены. Среди фетодисплазий выделены 2 группы: у 5 детей — нарушение лобуляции легких, у 8 — пороки развития (головного мозга — 3, сердца — 1, почек — 2, добавочная селезенка — 1, гепатобластома — 1).
Основными осложнениями были следующие:
- двухсторонняя пневмония — 10 (62,5%);
- панкреатит — 10 (62,5%);
- менингит, энцефалит — 6 (37,5%);
- миокардит — 6 (37,5%);
- вторичный иммунодефицит — 3 (18,8%).
Возбудители, выделенные по результатам патологоанатомических исследований, представлены в табл. 3.
У 12 детей были выделены следующие вирусы — энтеровирусы (у 8 пациентов), вирусы респираторной группы (аденовирусы, респираторно-синцитиальный вирус, парагрипп, грипп) — у 5 больных. У двух больных были обнаружены герпесвирусы.
Таким образом, преобладающими возбудителями были энтеровирусы, обнаруженные у 8 детей (50% случаев). Однако у 5 детей с неуточненной генерализованной инфекцией (им не было проведено вирусологическое обследование) изменения в органах были однотипны таковым у 8 больных с энтеровирусами, поэтому, возможно, энтеровирусная инфекция имела место у большего количества детей. Энтеровирусная инфекция была представлена следующими серотипами: Коксаки А (3, 4, 5) — у 6 детей; Коксаки В — у 4, энтеровирусы — у 3 детей; смешанное течение — у 4. Для энтеровирусной инфекции были характерны поражения следующих органов: сердца — 7 пациентов (87,5% случаев), головного мозга — 6 (75%), поджелудочной железы — 5 (62,5%), печени — 5 (62,5%), почек — 4 (50%), фетодисплазии — 6 (75%), желудочно-кишечного тракта — 2 (25%).
Изменения со стороны сердечно-сосудистой системы были оценены нами ретроспективно по анализу электрокардиограммы (ЭКГ) (прижизненно), а также после вскрытия (по его результатам и гистологии). По результатам ЭКГ регистрировалась перегрузка правых отделов сердца, аритмия, брадикардия, удлинение систолы желудочков, нарушение внутрижелудочковой проводимости. У одного ребенка имела место пароксизмальная тахикардия. Артериальная гипотензия превалировала и была выявлена у 6 детей, гипертензия — у 2.
У всех 16 детей с ИЗСД проводилась морфологическая и гистологическая оценка состояния сердечно-сосудистой системы по следующим параметрам: масса сердца, наличие гипертрофии камер сердца, фиброэластоз, состояние коронарных сосудов.
На вскрытии у 7 детей имело место увеличение размеров сердца, у 7 — уменьшение, причем эти изменения не зависели от давности течения СД. Дилатационная кардиомиопатия была выявлена у большинства — у 12 детей (75% случаев), фиброэластоз эндокарда — у 11 больных (68,7% случаев), миокардит — у 6 (37,5%). Коронарные сосуды изменены не были практически ни у кого из детей, за исключением одного ребенка, у которого обнаружено утолщение коронарных артерий (сочетание энтеро- и вирусов респираторной группы). Описаны общие следующие изменения миокарда: миокард дряблый, очаги гистиоцитарной инфильтрации, очаговый склероз, фиброз, миксоматоз клапанов, утолщение створок, их сращение, агломерация папиллярных мышц. Отмечается белковая дистрофия кардиомиоцитов, гибель клеток, распад миофибрилл. В сосудах — очаговый фиброз, дистрофия стенок. Выявленные изменения, в первую очередь, имели место у всех детей с энтеровирусной инфекцией.
Следует заметить, что изменения со стороны сердца и поджелудочной железы взаимосвязаны у детей. Наши данные аналогичны таковым, полученным авторами из г. Новосибирска А. В. Деминой и С. В. Нетесовым, которые выделяли формы энтеровирусной инфекции, связанные с серологическими штаммами. Например, перикардит и миокардит встречался при вирусах Коксаки В 1–5 типов, вирусах ЕСНО 1-го, 6-го, 9-го, 19-го типов; а диабет регистрировался при вирусах Коксаки А 9-го, В 1–5 типов [18].
Со слов мамы, ранее не болел, но врачи отмечали вегетососудистую дистонию по гипотоническому типу.
По результатам патологоанатомического исследования был установлен следующий диагноз: генерализованная смешанная инфекция: менингоэнцефалит с лейкомаляцией, мелкоочаговый продуктивный панкардит, продуктивный полиневрит, продуктивный гепатит, интерстициальный нефрит. Вирусологическое обследование: были выделены следующие вирусы: энтеровирусы групп А, В, С, а также вирусы респираторной группы (гриппа, парагриппа, аденовирус).
Выявлены следующие фетодисплазии: трехстворчатого клапана, гипоплазия хрящевых пластин субсегментарных бронхов, двудолевое правое легкое, добавочная селезенка, атрофия тимуса, внутренняя гидроцефалия.
Патологоанатомический эпикриз: смерть ребенка 3 лет с множественными дисплазиями, генерализованной смешанной инфекцией, СД 1-го типа впервые выявленным с развитием кетоацидоза и гиперосмолярной комой наступила от лейкомаляции вещества головного мозга.
Патологоанатомические исследования сердца: на разрезе — истончение миокарда правого желудочка до 0,2 см (норма — 0,27 см), расширение полостей желудочков, утолщение миокарда левого желудочка. Папиллярные мышцы в правом желудочке практически отсутствуют, хордальные нити прикрепляются к стенке желудочка, остальные укорочены, хаотически расположены, третьи — несколько удлинены. На створках клапанов мелкие мукоидные прозрачные узелки. Гистология сердца: утолщение коронарных артерий, мукоидное набухание клапанов, мелкие очаги лимфоидной инфильтрации в эпикарде, миокарде, эндокарде, отек интерстиция. В некоторых нервных стволах эпикарда — гибель клеточных элементов и гистиоцитарная инфильтрация.
На рис. 2 представлены гистологические изменения сердца ребенка.
_575.jpg)
Данный случай демонстрирует взаимосвязь поражений многих органов и систем, в частности, сердца и поджелудочной железы с энтеровирусной инфекцией. Принимая во внимание наличие фетодисплазий, заражение, вероятнее всего, произошло во внутриутробном периоде. Известно, что энтеровирусная инфекция может иметь персистирующее течение, принимать аутоиммунные формы и обостряться под действием вирусов респираторной группы, как, возможно, в данном случае.
Подводя итог данной работы, хочется еще раз подчеркнуть особую важность и необходимость настороженности врачей многих специальностей в отношении энтеровирусной инфекции, полиморфизма ее проявлений, тяжелых поражений многих органов и систем с формированием соматических проблем (миокардит, панкреатит, интерстициальный нефрит, ИЗСД, менингит и т. д.). На сегодняшний день необходимо развивать диагностику энтеровирусной инфекции, так как даже при большом желании мы не имеем возможности полноценного обследования на эту инфекцию не только в Москве, но и в России в целом. Увеличение количества случаев энтеровирусной инфекции в виде вспышек, эпидемий, рост заболеваемости менингитами, СД 1-го типа во всем мире — тому подтверждение.
Литература
Т. А. Полилова*
М. С. Савенкова*, доктор медицинских наук, профессор
В. В. Смирнов* , 1 , доктор медицинских наук, профессор
Е. Е. Петряйкина**, доктор медицинских наук, профессор
И. Е. Колтунов**, доктор медицинских наук, профессор
Л. Н. Каск**
Н. В. Бузина**
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГБУЗ Морозовская ДГКБ ДЗМ, Москва
Для цитирования: Торшхоева Х.М., Городецкий В.В., Верткин А.Л. Неотложные состояния при сахарном диабете на догоспитальном этапе. РМЖ. 2003;6:350.
Национальное научно-практическое общество скорой медицинской помощи, МГМСУ им. Н.А. Семашко
К омы являются острыми осложнениями сахарного диабета (СД) и часто приводят к летальным исходам. Это прямой результат изменений содержания глюкозы в крови в виде гипергликемии или гипогликемии и сопутствующими метаболическими нарушениями. Если не произвести коррекцию, то гипергликемия может привести к диабетическому кетоацидозу (ДКА) или некетоновой гиперосмолярной коме. Они характеризуются разными степенями инсулиновой недостаточности, избыточной продукцией контринсулиновых гормонов и обезвоживанием. В некоторых случаях признаки диабетического кетоацидоза и гиперосмолярной комы могут развиваться одновременно.
Гипогликемия связана с нарушением равновесия между лекарственным средством, применяемым в лечении диабета (инсулин или таблетированные сахороснижающие средства), и приемом пищи или физической нагрузкой. Резкое падение концентрации глюкозы приводит к потере сознания, так как нормальное функционирование головного мозга почти полностью зависит от глюкозы. У больных сахарным диабетом могут развиться следующие коматозные состояния, непосредственно связанные и специфически обусловленные основным заболеванием, – кетоацидотическая, гиперосмолярная и гипогликемическая.
Быстрота и своевременность оказания помощи больным в коматозном состоянии во многом определяют прогноз. Поэтому с этих позиций правильное ведение пациентов на догоспитальном этапе представляется наиболее важным.
Гипогликемическая кома занимает третье место (5,4%) в структуре ком на догоспитальном этапе, а диабетическая (3%) – пятое (данные ННПОСМП).
Диабетическая кетоацидотическая кома
Диабетическая кетоацидотическая кома (ДКА) – грозное осложнение сахарного диабета, характеризующееся метаболическим ацидозом (рН меньше 7,35 или концентрация бикарбоната меньше 15 ммоль/л), увеличением анионной разницы, гипергликемией выше 14 ммоль/л, кетонемией. Чаще развивается при СД 1 типа. Частота от 5 до 20 случаев на 1000 больных в год (2/100). Смертность 5–15%, для больных старше 60 лет – 20%. От кетоацидотической комы погибает более 16% пациентов с СД 1 типа. Причина развития ДКА – абсолютный или резко выраженный относительный дефицит инсулина вследствие неадекватной инсулиновой терапии или повышения потребности в инсулине.
Провоцирующие факторы:
- Недостаточная доза инсулина или пропуск инъекции инсулина (или приема таблетированных сахароснижающих средств).
- Самовольная отмена сахароснижающей терапии.
- Нарушение техники введения инсулина.
- Присоединение других заболеваний (инфекции, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.).
- Нарушения в диете (слишком большое количество углеводов).
- Физическая нагрузка при высокой гликемии.
- Злоупотребление алкоголем.
- Недостаточное проведение самоконтроля обмена веществ.
- Прием некоторых лекарственных препаратов (кортикостероиды, оральные контрацептивы, тиреоидные гормоны, кальцитонин, салуретики, этакриновая кислота, ацетазоламид, b -блокаторы, дилтиазем, адреналин, добутамин, диазоксид, никотиновая кислота, изониазид, аспарагиназа, циклофосфамид, дифенин, морфин, лития карбонат и др.).
Часто этиология ДКА остается неизвестной. Следует помнить, что до 25% случаев ДКА отмечается у пациентов с вновь выявленным сахарным диабетом.
Клиническая картина и классификация
Различают три стадии диабетического кетоацидоза (табл. 1):
1. Умеренный кетоацидоз.
2. Прекома, или декомпенсированный кетоацидоз.
3. Кома.
Осложнения кетоацидотической комы – тромбозы глубоких вен, легочная эмболия, артериальные тромбозы (инфаркт миокарда, инфаркт мозга, некрозы), аспирационная пневмония, отек мозга, отек легких, инфекции, редко – ЖКК и ишемический колит, эрозивный гастрит, поздняя гипогликемия. Отмечается тяжелая дыхательная недостаточность, олигурия и почечная недостаточность. Осложнения терапии – отек мозга и легких, гипогликемия, гипокалиемия, гипонатриемия, гипофосфатемия.
Диагностические критерии
1. Особенность ДКА – постепенное развитие, обычно на протяжении нескольких суток.
2. Наличие симптомов кетоацидоза (запах ацетона в выдыхаемом воздухе, дыхание Куссмауля, тошнота, рвота, анорексия, боли в животе).
3. Наличие симптомов дегидратации (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
Следует помнить, что при СД 2 типа всегда надо искать интеркуррентное заболевание, как причину декомпенсации СД.
Перечень вопросов, обязательных при диагностике ДКА на догоспитальном этапе:
– страдает ли пациент сахарным диабетом?
– была ли ДКА в анамнезе?
– получает ли пациент сахароснижающую терапию, какую, последний прием препарата?
– когда был последний прием пищи или неадекватный прием пищи или ее пропуск?
– была ли слишком тяжелая физическая нагрузка или прием алкоголя?
– какие недавно перенесенные заболевания предшествовали коме (инфекционные заболевания)?
– Была ли полиурия, полидипсия и слабость?
Возможные ошибки терапии и диагностики на догоспитальном этапе:
1. Инсулинотерапия на догоспитальном этапе без возможности определения уровня гликемии и ее контроля.
2. Акцент в лечении на интенсивную инсулинотерапию при отсутствии эффективной регидратации.
3. Введение недостаточного объема жидкостей.
4. Введение гипотонических растворов, особенно в начале лечения. Это может привести к отеку головного мозга и к внутрисосудистому гемолизу.
5. Применение форсированного диуреза вместо регидратации. Применение диуретиков одновременно с введением жидкостей только замедлит восстановление водного баланса, а при гиперосмолярной коме назначение мочегонных средств категорически противопаказано.
7. Введение раствора бикарбоната натрия без дополнительного введения препаратов калия, что обусловливает резко выраженную гипокалиемию, которая и становится причиной смерти больных.
8. Отмена или неназначение инсулина при ДКА больному, который не в состоянии принимать пищу.
9. Подкожное введение инсулина больным в диабетической коме, у которых всасывание инсулина нарушено вследствие нарушения микроциркуляции.
10. Внутривенно струйное введение инсулина. Период полураспада инсулина при внутривенном введении составляет 3–5 мин, и лишь первые 15–20 мин концентрация его в крови поддерживается на достаточном уровне, и поэтому такой путь введения неэффективен.
11. 3–4–х–кратное назначение инсулина короткого действия (ИКД) подкожно (на начальных этапах ДКА, когда состояние средней тяжести и нет потери сознания, возможно назначение инсулина подкожно). Эффективная продолжительность действия ИКД составляет 4–5 ч, особенно в условиях кетоацидоза. Поэтому ИКД надо назначать не менее 5–6 раз в сутки без ночного перерыва.
12. Применение для борьбы с коллапсом симпатотонических препаратов. Они, во–первых, являются контринсулиновыми гормонами и, во–вторых, у больных диабетом их стимулирующее влияние на секрецию глюкагона выражено значительно сильнее, чем у здоровых лиц.
Терапия на догоспитальном этапе представлена в таблице 2.
Гиперосмолярная кетоацидотическая кома
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Провоцирующие факторы:
- недостаточная доза инсулина или пропуск иньекции инсулина (или приема таблетированных сахароснижающих средств);
- самовольная отмена сахароснижающей терапии;
- нарушение техники введения инсулина;
- присоединение других заболеваний (инфекции, острый панкреатит, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.);
- нарушения в диете (слишком большое количество углеводов);
- прием некоторых лекарственных препаратов (диуретики, кортикостероиды, b -блокаторы и др.);
- охлаждение;
- невозможность утолить жажду;
- ожоги;
- рвота или диарея;
- гемодиализ или перитонеальный диализ.
Следует помнить, что одна треть пациентов с гиперосмолярной комой не имеет предшествующего диагноза сахарного диабета.
Клиническая картина
Нарастающая в течение нескольких дней или недель сильная жажда, полиурия, выраженная дегидратация, артериальная гипотония, тахикардия, фокальные или генерализованные судороги. Если при ДКА расстройства функции ЦНС и периферической нервной системы протекают по типу постепенного угасания сознания и угнетения сухожильных рефлексов, то гиперосмолярная кома сопровождается разнообразными психическими и неврологическими нарушениями. Кроме сопорозного состояния, также нередко отмечаемого при гиперосмолярной коме, психические нарушения часто протекают по типу делирия, острого галлюцинаторного психоза, катотонического синдрома. Неврологические нарушения проявляются очаговой неврологической симптоматикой (афазией, гемипарезом, тетрапарезом, полиморфными сенсорными нарушениями, патологическими сухожильными рефлексами и т. д.).
Диагностические критерии
1. Развивается более медленно (в течение 5–14 дней), чем ДКА.
Более выраженная дегидратация (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
2. Часто полиморфная неврологическая симптоматика, исчезающая при купировании гиперосмолярной комы.
3. Отсутствие кетоацидоза (запаха ацетона в выдыхаемом воздухе, отсутствие дыхания Куссмауля, тошноты, рвоты, анорексии, болей в животе).
4. Отсутствие или невыраженная кетонурия.
5. Раньше возникает анурия и азотемия.
6. Пожилой и старческий возраст.
Среди возможных ошибок в терапии и диагностике выделяются:
1. Введение гипотонических растворов на догоспитальном этапе.
2. Длительное введение гипотонических растворов.
3. Гиперосмолярный синдром нередко ошибочно расценивается, как реактивный психоз, цереброваскулярный пароксизм или другое острое психическое или неврологическое заболевание.
Терапия рассмотрена в таблице 3.
Гипогликемическая кома
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
– пропуск или неадекватный прием пищи
– повышенная физическая нагрузка
– избыточный прием алкоголя
– прием лекарственных средств ( b -блокаторы, салицилаты, сульфаниламиды, фенилбутазон, анаболические стероиды, препараты кальция, тетрациклин, литий карбонат, пиридоксин, ингибиторы MAO, клофибрат).
Клиническая картина
Симптомы гипогликемии делятся на ранние (холодный пот, особенно на лбу, бледность кожи, сильный приступообразный голод, дрожь в руках, раздражительность, слабость, головная боль, головокружение, онемение губ), промежуточные (неадекватное поведение, агрессивность, сердцебиение, плохая координация движений, двоение в глазах, спутанность сознания) и поздние (потеря сознания, судороги).
Диагностические критерии
1. Внезапное развитие, обычно на протяжении нескольких минут, реже часов.
2. Наличие характерных симптомов гипогликемии.
3. Гликемия ниже 3–3,5 ммоль/л.
Следует помнить, что отсутствие симптомов не исключает гипогликемии и у пациентов с сахарным диабетом симптомы гипогликемии могут быть при нормальной концентрации глюкозы в крови.
Стандартные вопросы врача на догоспитальном этапе:
– страдает ли пациент сахарным диабетом, его продолжительность;
– получает ли сахароснижающую терапию (какую, последний прием препарата);
– неадекватный прием пищи или ее пропуск, последний прием пищи;
– любые эпизоды гипогликемии в прошлом;
– слишком тяжелая физическая нагрузка;
– прием чрезмерного количества алкоголя.
Следует помнить – самой частой причиной потери сознания при сахарном диабете 1 типа является тяжелая гипогликемия.
После выведения больного из гипогликемической комы рекомендуется применять средства, улучшающие микроциркуляцию и метаболизм в клетках головного мозга в течение 3–6 недель. Повторные гипогликемии могут привести к поражению головного мозга.
Возможные ошибки диагностики и терапии:
1. Попытка ввести углевод–содержащие продукты (сахар и т.п.) в ротовую полость пациенту без сознания. Это часто приводит к аспирации и к асфиксии.
2. Применение для купирования гипогликемии непригодных для этого продуктов (хлеб, шоколад и т.п.). Эти продукты не обладают достаточным сахароповышающим действием или повышают сахар крови, но слишком медленно.
4. Часто не учитывают опасность рецидива после выведения из тяжелой гипогликемии. При передозировке препаратов инсулина продленного действия и препаратов сульфонилмочевины гипогликемия может повториться и поэтому больной требует интенсивного наблюдения, контроля уровня гликемии и при необходимости ее коррекции в течение нескольких суток.
Терапия гипогликемической комы представлена в таблице 4. Дифференциально–диагностические критерии коматозных состояний при СД представлены в таблице 5.
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
Во всех случаях, когда невозможно измерение гликемии немедленно эмпирически надо ввести высококонцентрированную глюкозу. Эстренно некупированная гипогликемия может быть смертельна.
Базисными препаратами для пациентов в коме при отсутствии возможности уточнения диагноза и скорой госпитализации считаются тиамин 100 мг в/в, глюкоза 40% 60 мл и налоксон 0,4–2 мг в/в. Эта комбинация эффективна и безопасна во многих случаях.
Для цитирования: Триголосова И.В. Стероид-индуцированный сахарный диабет. РМЖ. Медицинское обозрение. 2016;24(1):54-56.
Статья посвящена вопросам диагностики и лечения стероид-индуцированного сахарного диабета
Для цитирования. Триголосова И.В. Стероид-индуцированный сахарный диабет // РМЖ. 2016. No 1. С. 54–56.
Глюкокортикостероиды (ГКС) широко применяются практически во всех областях медицины. В большинстве случаев ГКС используются для кратковременного лечения (в среднем менее 5 дней): при хронических обструктивных заболеваниях легких, обострении подагры, в химиотерапии, при бактериальном менингите и во многих других случаях. В качестве постоянного или длительного лечения (в 22% случаев – более 6 мес., а в 4,3% случаев – более 5 лет) ГКС применяются при таких заболеваниях, как идиопатическая интерстициальная пневмония, гиперчувствительный пневмонит и саркоидоз, аутоиммунные и неврологические заболевания, воспалительные заболевания кишечника, заболевания кожи [1]. Терапия ГКС широко представлена в трансплантологии. Однако, кроме основного противовоспалительного и иммуносупрессивного действия, лечение ГКС ассоциировано с различными побочными эффектами, среди которых наиболее часто встречаются артериальная гипертензия, остеопороз и сахарный диабет (СД).
Стероид-индуцированный СД (ССД) – это состояние, характеризующееся увеличением уровня глюкозы в крови, связанное с экзогенным введением ГКС у пациентов, в анамнезе которых отсутствует СД 2-го типа. Критерии диагностики ССД и СД 2-го типа не отличаются.
Факторами риска развития ССД являются ожирение, генетическая предрасположенность к СД 2-го типа, гестационный СД в анамнезе, синдром поликистозных яичников, наличие ранних нарушений углеводного обмена (НУО) [2]. Также риск развития НУО на фоне терапии ГКС зависит от дозы и длительности терапии. Например, было показано, что среди 11 855 пациентов, получающих терапию ГКС, риск развития СД возрастал в 3,02, 5,82 и 10,35 раза в условиях приема гидрокортизона 50, 100, 120 мг соответственно [3, 4].
Распространенность ССД на фоне терапии ГКС превышает популяционную и составляет 12,7% у больных системной красной волчанкой, 14,7% у пациентов с респираторными заболеваниями, 23,5% – с заболеваниями кожи [5, 6]. В исследовании Donihi et al. было показано, что у 54% госпитализированных пациентов, у которых по разным причинам применялось лечение преднизолоном в дозе 40 мг не менее 2-х дней, более чем однократно наблюдались эпизоды гипергликемии [7].
Механизм развития ССД – многокомпонентный процесс. Рецепторы к ГКС обнаружены практически во всех клетках организма. Действие ГКС на клетки гипоталамуса, в частности активация нейропептида Y, ведет к увеличению аппетита [8]. Воздействие ГКС на рецепторы преадипоцитов повышает дифференцировку последних в адипоциты, что и определяет увеличение количества жировой ткани. Однако ГКС по-разному влияют на периферическую и висцеральную жировую ткань, определяя типичную картину висцерального ожирения при эссенциальной артериальной гипертонии (ЭГ) [9]. Увеличение уровня свободных жирных кислот, в избытке продуцируемых висцеральным жиром, обеспечивает потенцирование инсулинорезистентности (ИР), липотоксичности, замедление метаболизма инсулина в печени, с одной стороны. С другой стороны, усиление катаболических процессов (протеолиза и липолиза) в периферических тканях ведет к высвобождению большого количества субстратов для глюконеогенеза в печени. А активизация ферментов глюконеогенеза и повышение секреции глюкагона ведут к усилению глюконеогенеза и расщеплению гликогена. Это в совокупности обеспечивает повышение продукции глюкозы печенью. Снижение утилизации глюкозы в периферических тканях и подавление синтеза инсулина на фоне применения ГКС также являются причинами повышения уровня глюкозы в крови. Снижение секреции инсулина может быть связано как с прямым повреждающим эффектом ГКС на β-клетки поджелудочной железы, так и со снижением активности глюкагоноподобного пептида-1 (ГПП-1) (рис. 1) [10–13].

Эффекты ГКС в отношении вышеописанных механизмов развития СД могут различаться в зависимости от дозы и длительности их применения. Например, в одном из исследований было показано, что высокие дозы преднизолона (75 мг), введенные однократно, подавляли секрецию инсулина, в то время как длительное использование преднизолона 30 мг в течение 15 дней приводило к увеличению ИР без повреждения секреторной способности b-клеток [14]. В другом исследовании, проведенном в 2011 г. Hansen et al., показано, что на фоне введения ГКС увеличивается уровень глюкагона, при этом изменения элиминации глюкозы и секреции инсулина не происходит [15].
НУО на фоне терапии ГКС проявляются, прежде всего, повышением постпрандиального уровня гликемии, в то время как уровень глюкозы натощак, как правило, остается без изменений. Например, в исследовании влияния терапии ГКС на суточный ритм гликемии у больных с хроническими обструктивными заболеваниями легких было обнаружено, что через 8 ч после утреннего введения 20 мг преднизолона происходит увеличение уровня глюкозы как у лиц с нормогликемией, так и у больных СД 2-го типа (рис. 2) [14, 16].

Ввиду того что ГКС могут вводиться в различных режимах, дозах и формах, время проявления гипергликемии может варьировать. Например, введение преднизолона однократно утром будет приводить к увеличению уровня гликемии в полдень и вечером, в то время как в течение ночи и утром уровень глюкозы крови будет нормальным. В связи с этим для данного способа лечения рекомендуется исследование уровня глюкозы перед обедом и перед ужином, а терапия не должна вызывать сахароснижающего эффекта в ночные и утренние часы в целях предотвращения гипогликемии.
Несмотря на высокую распространенность СД при ЭГ и в условиях лечения ГКС, единые подходы к диагностике и терапии до сих пор не разработаны.
Например, Burt et al. рекомендуют ранний контроль гликемии – через 8 ч – после начала терапии преднизолоном [17]. По рекомендациям Канадской диабетологической ассоциации мониторинг уровня гликемии необходимо проводить через 48 ч после начала терапии ГКС [18].
Диабетологическая ассоциация Великобритании рекомендует проводить контроль уровня глюкозы в крови не менее 1 р./сут, желательно перед обедом или ужином или, в качестве альтернативы, спустя 1–2 ч после обеда или ужина. В том случае, если уровень глюкозы не превышает 12 ммоль/л, более частый контроль гликемии и инициация терапии не рекомендуются. Если же уровень глюкозы превышает 12 ммоль/л, то проводится мониторинг гликемии 4 р./сут: перед каждым основным приемом пищи и на ночь. В ситуации, когда уровень глюкозы за сутки дважды превышает 12 ммоль/л, пациенту выставляется диагноз ССД [19].
Профилактика и своевременное лечение ССД являются важными компонентами алгоритма лечения пациентов, получающих терапию ГКС, особенно в тех случаях, когда идет речь о необходимости постоянной терапии. Как и при СД 2-го типа, первым шагом в улучшении гликемического контроля является изменение образа жизни – выполнение необходимых диетических рекомендаций и увеличение физических нагрузок. Повышение аппетита на фоне применения ГКС делает малоосуществимым соблюдение диеты, а физические ограничения вследствие тяжести основного заболевания (например, при заболеваниях легких или поражениях костно-суставной системы) не позволяют увеличить физические нагрузки. В связи с этим медикаментозная терапия ССД становится основным компонентом лечения. Учитывая увеличение гликемии в постпрандиальном периоде и нормализацию показателей глюкозы крови в ночные и утренние часы, сахароснижающая терапия должна быть направлена на достижение нормогликемии в постпрандиальном периоде и не приводить к гипогликемии в ночное и утреннее время.
В 2001 г. было установлено, что терапия метформином и тиазолидиндионом (пиоглитазоном) не приводит к улучшению гликемического контроля у больных с СД, развившимся на фоне лечения ГКС. В то же время троглитазон (другой препарат из группы тиазолидиндионов) улучшал показатели гликемии за счет увеличения клиренса глюкагона [20].
Препараты сульфонилмочевины, особенно постпрандиальные регуляторы уровня глюкозы, также могут использоваться для лечения ССД, однако необходимо помнить о том, что препараты пролонгированного (суточного) действия также могут инициировать развитие гипогликемии, особенно в случае нерегулярного приема пищи [20].
Традиционные и интенсифицированные (базал-болюсные) схемы инсулинотерапии позволяют обеспечивать гибкий режим контроля гликемии, однако могут приводить к развитию гипогликемии в ночные часы [17]. Именно поэтому в случае необходимости применения инсулинотерапии целесообразно введение инсулина средней продолжительности действия утром и короткого (или ультракороткого) действия перед приемом пищи.
В 2007 г. впервые было обнаружено, что коррекция гипергликемии при вторичном СД препаратами ГПП-1 более эффективна, чем при СД 2-го типа [21]. Известно, что агонисты ГПП-1 снижают продукцию глюкозы печенью и увеличивают постпрандиальную секрецию инсулина [22, 23]. В исследовании, проведенном в 2011 г., обнаружено, что введение агонистов ГПП-1 пациентам, получающим терапию ГКС, ведет к восстановлению чувствительности к инсулину, подавляет постпрандиальную секрецию глюкагона, что в итоге предотвращает развитие НУО [24].
Ингибиторы дипептидилпептидазы-4 (ДПП-4), широко использующиеся в терапии СД 2-го типа, также чрезвычайно интересны для лечения ГКС-индуцированной гипергликемии, т.к. обладают постпрандиальным сахароснижающим действием и предотвращают кардиометаболические нарушения. В 2014 г были опубликованы результаты плацебо-контролируемого исследования эффективности применения ДПП4 ингибитора cитаглиптина для предотвращения развития НУО на фоне терапии ГКС. Участники в течение 14 дней получали терапию преднизолоном 30 мг в сочетании с ситаглиптином/плацебо. По результатам этого исследования было обнаружено увеличение секреции инсулина на фоне терапии ситаглиптином, однако значимого положительного эффекта, а именно предотвращения НУО, получено не было, что, вероятно, связано с крайне ограниченным сроком исследования [25]. У пациентов с подтвержденным СД, получающих терапию ГКС, ситаглиптин показал высокую эффективность в снижении уровня гликированного гемоглобина и веса, что позволяет рекомендовать его для лечения ССД [18, 26].
Широкое применение ГКС и высокая распространенность СД на фоне терапии ГКС, различия в патогенезе ССД и СД 2-го типа диктуют необходимость создания четких алгоритмов диагностики и лечения данных заболеваний.
Своевременная патогенетически оправданная профилактика и адекватное лечение позволяют предотвратить развитие микро- и макрососудистых осложнений, ведущих к ранней инвалидизации и смерти.
Что такое сахарный диабет 2 типа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Хитарьяна Александра Георгиевича, диабетолога со стажем в 31 год.
Над статьей доктора Хитарьяна Александра Георгиевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Эпидемия сахарного диабета (СД) длится уже достаточно долго. [9] По данным Всемирной организации здравоохранения (ВОЗ) в 1980 году на планете было около 150 миллионов человек, страдающих от СД, а в 2014 году — около 421 миллионов. К сожалению, тенденция к регрессу заболеваемости за последние десятилетия не наблюдается, и уже сегодня можно смело заявить, что СД является одним из распространённых и тяжёлых болезней.
Сахарный диабет II типа (Type 2 diabetes) — хроническое неинфекционное, эндокринное заболевание, которое проявляется глубокими нарушениями липидного, белкового и углеводного обменов, связанного с абсолютным или же относительным дефицитом гормона, производимого поджелудочной железой.
У пациентов с СД II типа поджелудочная железа продуцирует достаточное количество инсулина — гормона, регулирующего углеводный обмен в организме. Однако из-за нарушения метаболических реакций в ответ на действие инсулина возникает дефицит этого гормона.
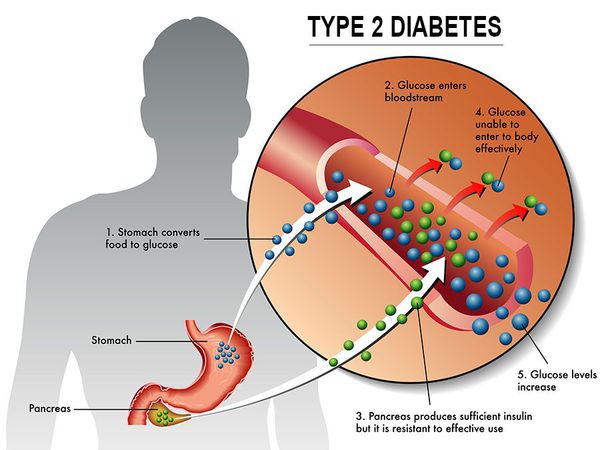
Инсулиннозависимый СД II типа имеет полигенную природу, а также является наследственным заболеванием.
Причиной возникновения данной патологии является совокупность определённых генов, а её развитие и симптоматика определяется сопутствующими факторами риска, такими как ожирение, несбалансированное питание, низкая физическая активность, постоянные стрессовые ситуации, возраст от 40 лет, бессонница. [1] [10]
Нарастающая пандемия ожирения и СД II типа тесно связаны и представляют основные глобальные угрозы здоровью в обществе. [3] Именно эти патологии являются причинами появления хронических заболеваний: ишемической болезни сердца, гипертонии, атеросклероза и гиперлипидемии.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сахарного диабета 2 типа
Чаще всего симптоматика при СД II типа выражена слабо, поэтому данное заболевание можно обнаружить благодаря результатам лабораторных исследований. Поэтому людям, относящимся к группе риска (наличие ожирения, высокого давления, различных метаболических синдромов, возраст от 40 лет), следует проходить плановое обследование для исключения или своевременного выявления болезни.
К основным симптомам СД II типа следует отнести:
- перманентную и немотивированную слабость, сонливость;
- постоянную жажду и сухость во рту;
- полиурию — учащённое мочеиспускание;
- усиленный аппетит (в период декомпенсации (прогрессирования и ухудшения) болезни аппетит резко снижается);
- кожный зуд (у женщин часто возникает в области промежности);
- медленно заживающие раны;
- затуманенное зрение;
- онемение конечностей.
Период декомпенсации заболевания проявляется сухостью кожи, снижением упругости и эластичности, грибковыми поражениями. В связи с аномально повышенным уровнем липидов возникает ксантоматоз кожи (доброкачественные новообразования).
У больных СД II типа ногти подвержены ломкости, потере цвета или же появлению желтизны, а 0,1 – 0,3% пациентов страдают липоидным некробиозом кожи (отложения жиров в разрушенных участках коллагенового слоя).
Помимо симптомов самого СД II типа дают о себе знать также симптомы поздних осложнений заболевания: язвы на ногах, снижение зрения, инфаркты, инсульты, поражения сосудов ног и другие патологии.
Патогенез сахарного диабета 2 типа
Основная причина возникновения СД II типа — это инсулинорезистентность (утрата реакции клеток на инсулин), обусловленная рядом факторов внешней среды и генетическими факторами, протекающая на фоне дисфункции β-клеток. Согласно исследовательским данным, при инсулинорезистентности снижается плотность инсулиновых рецепторов в тканях и происходит транслокация (хромосомная мутация) ГЛЮТ-4 (GLUT4).
Повышенный уровень инсулина в крови (гиперинсулинемия) приводит к уменьшению количества рецепторов на клетках-мишенях. Со временем β -клетки перестают реагировать на повышающийся уровень глюкозы. В итоге образуется относительный дефицит инсулина, при котором нарушается толерантность к углеводам.
Дефицит инсулина приводит к снижению утилизации глюкозы (сахара) в тканях, усилению процессов расщипления гликогена до глюкозы и образования сахара из неуглеводных компонентов в печени, тем самым повышая продукцию глюкозы и усугубляя гимергликемию — симптом, характеризующийся повышенным содержанием сахара в крови.
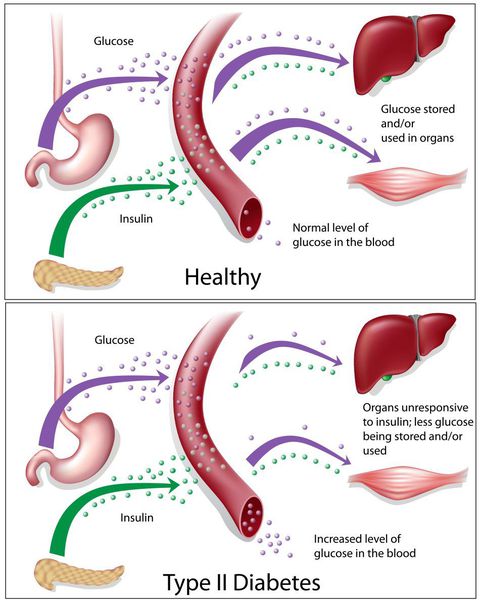
Окончания периферических двигательных нервов выделяют кальцитонин-подобный пептид. Он способствует подавлению секреции инсулина путём активизации АТФ-зависимых калиевых каналов (K+) в мембранах β-клеток, а также подавлению поглощения глюкозы скелетными мышцами.
Избыточный уровень лептина — главного регулятора энергетического обмена — способствует подавлению секреции инсулина, приводя к возникновению инсулинорезистентности скелетных мышц к жировой ткани.
Таким образом инсулинорезистентность включается в себя различные метаболические изменения: нарушение толерантности к углеводам, ожирение, артериальная гипертензия, дислипопротеидемия и атеросклероз. Главную роль в патогенезе этих нарушений играет гиперинсулинемия, как компенсаторное следствие инсулинорезистентности. [6]
Классификация и стадии развития сахарного диабета 2 типа
В настоящее время российские диабетологи классифицируют СД по степени тяжести, а также по состоянию углеводного обмена. Однако Международная Федерация диабета (МФД) довольно часто вносит изменения в цели лечения диабета и классификации его осложнений. По этой причине российские диабетологи вынуждены, постоянно изменять принятые в России классификации СД II типа по тяжести и степени декомпенсации заболевания.
Существуют три степени тяжести заболевания:
- I степень — наблюдаются симптомы осложнений, дисфункция некоторых внутренних органов и систем. Улучшение состояния достигается путём соблюдения диеты, назначается применение препаратов и инъекций.
- II степень — достаточно быстро появляются осложнения органа зрения, происходит активное выделение глюкозы с мочой, появляются проблемы с конечностями. Медикаментозная терапия и диеты не дают эффективных результатов.
- III степень - происходит выведение глюкозы и белка с мочой, развивается почечная недостаточность. В этой степени патология не поддаётся лечению.
По состоянию углеводного обмена выделяют следующие стадии СД II типа:
- компенсированная — нормальный уровень сахара в крови, достигнутый с помощью лечения, и отсутствие сахара в моче;
- субкомпенсированая — уровень глюкозы в крови (до 13,9 ммоль/л) и в моче (до 50 г/л) умеренный, при этом ацетон в урине отсутствует;
- декомпенсированная — все показатели, характерные для субкомпенсации, значительно повышены, в моче обнаруживается ацетон.
Осложнения сахарного диабета 2 типа
К острым осложнениям СД II типа относятся:
- Кетоацидотическая кома — опасное состояние, при котором происходит тотальная интоксикация организма кетоновыми телами, а также развивается метаболический ацидоз (увеличение кислотности), острая печёночная, почечная и сердечно-сосудистая недостаточность.
- Гипогликемическая кома — состояние угнетения сознания, развивающееся при резком уменьшении содержания глюкозы в крови ниже критической отметки.
- Гиперосмолярная кома — данное осложнение развивается в течение нескольких дней, в результате которого нарушается метаболизм, клетки обезвоживаются, резко увеличивается уровень глюкозы в крови.
Поздними осложнениями СД II типа являются:
- диабетическая нефропатия (патология почек);
- ретинопатия (поражение сетчатки глаза, способное привести к слепоте);
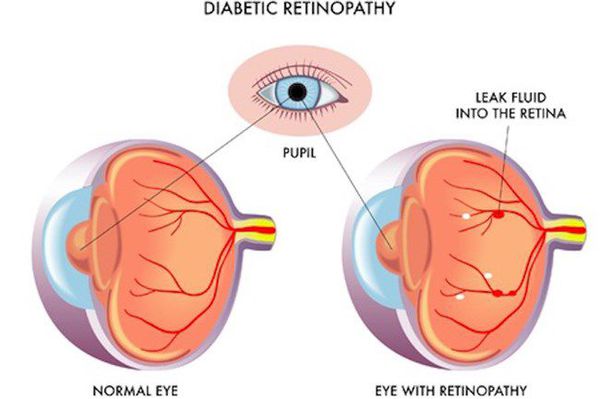
- полинейропатия (поражение периферических нервов, при котором конечности теряют чувствительность);
- синдром диабетической стопы (образование на нижних конечностях открытых язв, гнойных нарывов, некротических (отмирающих) тканей).
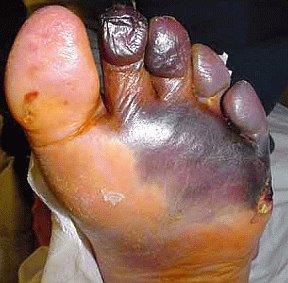
Диагностика сахарного диабета 2 типа
Для того чтобы диагностировать СД II типа необходимо оценить симптомы болезни и провести следующие исследования:
Лечение сахарного диабета 2 типа
Лечение СД II типа предполагает решение основных задач:
- компенсировать недостаток инсулина;
- скорректировать гормонально-метаболические нарушения;
- осуществление терапии и профилактики осложнений.
Для их решения применяется следующие методы лечения:
- диетотерапия;
- физические нагрузки;
- применение сахароснижающих препаратов;
- инсулинотерапия;
- хирургическое вмешательство.
Диетотерапия
Диета при СД II типа, как и обычная диета, предполагает оптимальное соотношение основных веществ, содержащихся в продуктах: белки должны составлять 16% суточного рациона, жиры — 24%, а углеводы — 60%. Отличие диеты при диабете II типа заключается в характере потребляемых углеводов: рафинированные сахара заменяются медленно усваиваемыми углеводами. Так как данное заболевание возникает у полных людей, потеря веса является важнейшим условием, нормализующим содержание глюкозы в крови. В связи с этим рекомендована калорийность диеты, при которой пациент еженедельно будет терять 500 г массы тела до момента достижения идеального веса. Однако при этом еженедельное уменьшение веса не должно превышать 2 кг, в противном случае это приведёт к избыточной потере мышечной, а не жировой ткани. Количество калорий, необходимое для суточного рациона пациентов с СД II типа, рассчитывается следующим образом: женщинам нужно умножить идеальный вес на 20 ккал, а мужчинам — на 25 ккал.
При соблюдении диеты необходимо принимать витамины, так как во время диетотерапии происходит избыточное выведение их с мочой. Нехватку витаминов в организме можно компенсировать при помощи рационального употребления полезных продуктов, таких как свежая зелень, овощи, фрукты и ягоды. В зимние и весенние периоды возможен приём витаминов в дрожжевой форме.
Физическая нагрузка
Верно подобранная система физических упражнений, с учётом течения заболевания, возраста и присутствующих осложнений, способствует значительному улучшению состояния больного СД. Эта методика лечения хороша тем, что необходимость применения инсулита практически отпадает, так как во время физических нагрузок глюкоза и липиды сгорают без его участия.
Лечение сахароснижающими препаратами
На сегодняшний день используют производные сахароснижающих препаратов:
- сульфонилмочевины (толбутамид, глибенкламид);
- бигуаниды, снижающие глюконеогенез в печени и повышающие чувствительность мышц и печени к инсулину (метформин);
- тиазолидиндионы (глитазоны), схожие по свойствам с бигуанидами (пиоглитазон, росиглитазон);
- ингибиторы альфа-глюкозидаз, снижающие темпы всасывания глюкозы в желудочно-кишечном тракте (акарбоза);
- агонисты рецепторов глюкагоноподобного пептида-1, стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, аппетит и массу тела, замедляющие эвакуацию пищевого комка из желудка (эксенатид, лираглутид);
- ингибиторы депептидил-пептидазы-4, также стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, не влияющие на скорость эвакуации пищи из желудка и оказывающие нейтральное действие на массу тела (ситаглиптин, вилдаглиптин);
- ингибиторы натрий-глюкозного котранспортера 2 типа (глифлозины), снижающие реабсорбцию (поглощение) глюкозы в почках, а также массу тела (дапаглифлозин,эмпаглифлозин).
Инсулинотерапия
В зависимости от тяжести болезни и возникающих осложнений врач назначает приём инсулина. Данный метод лечения показан примерно в 15-20% случаев. Показаниями к применению инсулинотерапии являются:
- быстрая потеря веса без видимой на то причины;
- возникновение осложнений;
- недостаточная эффективность других сахароснижающих препаратов.
Хирургическое лечение
Несмотря на множество гипогликемических препаратов, остаётся не решённым вопрос об их правильной дозировке, а также о приверженности пациентов к выбранному методу терапии. Это, в свою очередь, создаёт трудности при достижении длительной ремиссии СД II типа. Поэтому всё большую популярность в мире получает оперативная терапия данного заболевания — бариатрическая или метаболическая хирургия. МФД считает данный метод лечения пациентов с СД II типа эффективным. В настоящее время в мире проводится более 500 000 бариатрических операций в год. Существует несколько видов метаболической хирургии, самыми распространёнными являются шунтирование желудка и мини гастрошунтирование. [4]
Шунтирование желудка по Ру
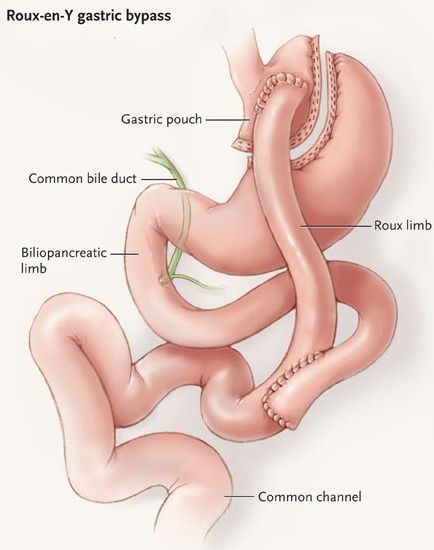
Во время шунтирования, желудок пересекается ниже пищевода таким образом, чтоб его объём сократился до 30 мл. Оставшаяся большая часть желудка не удаляется, а заглушается, предотвращая попадание в неё пищи. [5] В результате пересечения образуется маленький желудок, к которому затем пришивается тонкая кишка, отступив 1 м от её окончания. Таким образом пища будет прямиком попадать в толстую кишку, при этом обработка её пищеварительными соками снизится. Это, свою очередь, провоцирует раздражение L-клеток подвздошной кишки, способствующее снижению аппетита и увеличению роста клеток, синтезирующих инсулин.
Мини шунтирование желудка
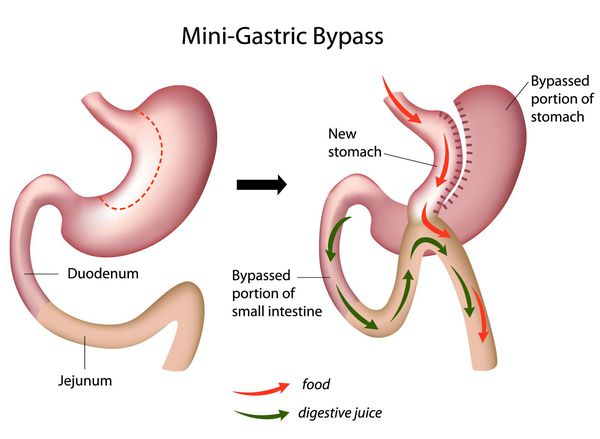
Главное отличие минигастрошунтирования от классического шунтирования желудка — сокращение количества анастомозов (соединений отрезков кишки). [2] При выполнении традиционной операции накладывается два анастомоза: соединение желудка и тонкой кишки и соединение разных отделов тонкой кишки. При минигастрошунтировании анастомоз один — между желудком и тонкой кишкой. Благодаря малому объёму вновь сформированного желудка и быстрому поступлению еды в тонкую кишку у пациента возникает чувство насыщения даже после приёма незначительных порций пищи.
К другим видам бариатрической хирургии относятся:
- гастропликация — ушивание желудка, предотвращающее его растягивание; [8]
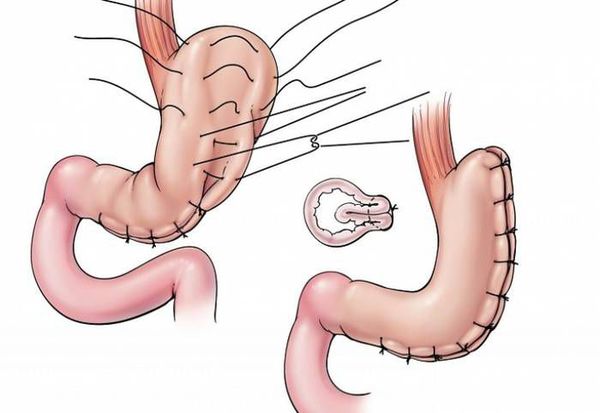
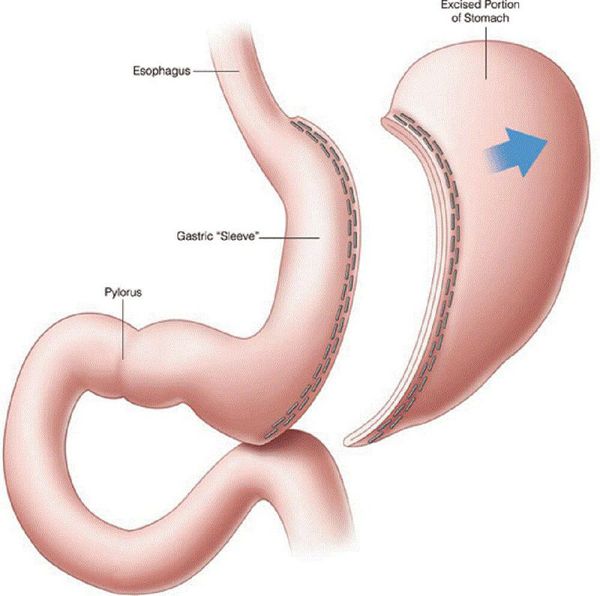
- рукавная гастропластика (иначе её называют лапароскопической продольной резекцией желудка) — отсечение большей части желудка и формирование желудочной трубки объёмом 30 мл, которое способствует быстрому насыщению, а также позволяет избежать соблюдения строгой диеты;
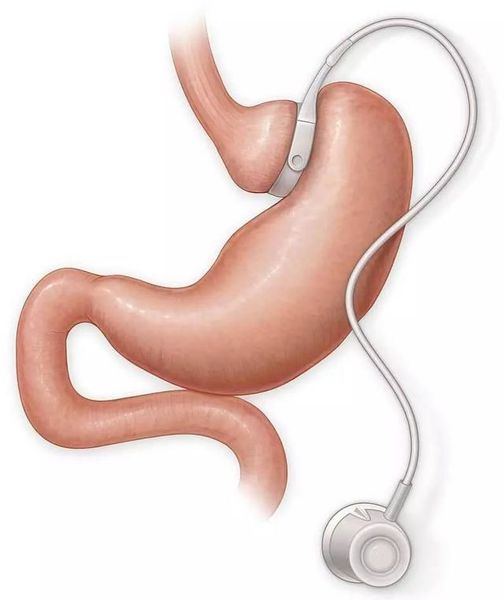
- бандажирование желудка — уменьшение объёма желудка с помощью специального кольца (бандажа), накладывающегося на верхнюю часть желудка (данное вмешательство обратимо).
Противопоказания к проведению хирургического лечения — наличие у пациента эзофагита (воспаления слизистой оболочки пищевода), варикозного расширения вен пищевода, портальной гипертенззи, цирозща печени, язвенной болезни желудка или двенадцатиперстной кишки, хронического панкреатита, беременности, алкоголизма, тяжёлых заболеваний сердечно-сосудистой системы или психических расстройств, а также длительное применение гормональных препаратов.
Прогноз. Профилактика
К сожалению, полностью излечиться от СД II типа невозможно. Однако существуют способы улучшения качества жизни пациентов с данным заболеванием.
На сегодняшний день существует большое количество “баз”, где специалисты-эндокринологи объясняют пациентам, каким должен быть их уклад жизни, как правильно питаться, какие продукты не следует употреблять, какими должны быть ежедневные физические нагрузки.
Также создано огромное количество сахароснижающих препаратов, которые ежегодно совершенствуются. Для того, чтобы они оказывали положительное влияние на организма, медикаменты необходимо принимать регулярно.
Практика показывает, что соблюдение всех рекомендаций эндокринологов улучшает процесс лечения СД II типа.
Оперативным методом, повышающим качество жизни при СД II типа по мнению МФД, является бариатрическая хирургия.
Значительно улучшить состояние пациентов с данным заболеванием позволяет проведение гастроинтестинальных операций (терапия морбидного ожирения), вследствие которой нормализуется уровень гликогемоглобина и глюкозы в крови, теряется необходимость применения антидиабетических препаратов и инсулина.
Бариатрическая хирургия может привести к значительной и устойчивой ремиссии, а также к улучшению течения СД II типа и других метаболических факторов риска у тучных пациентов. Хирургическое вмешательство в течение 5 лет после установления диагноза чаще всего приводит к долговременной ремиссии.
Для предупреждения возникновения СД II типа необходимо соблюдать следующие меры профилактики:
Читайте также:

