Инфекционный индекс что это
Обновлено: 12.05.2024
Одной из важнейших проблем современной перинатологии является прогрессирующий рост инфекционной патологии у плода и новорожденного. Целью данной работы являлась комплексная ультразвуковая оценка фето-плацентарной системы у беременных с высоким инфекционным индексом для прогнозирования степени тяжести внутриутробного инфицирования у новорожденного. Обследовано 123 беременных в сроке гестации 30-36 недель. В зависимости от тяжести состояния все новорожденные ретроспективно были разделены на 4 группы. В контрольную (1 группа) вошли новорожденные от матерей с неосложненной беременностью, состояние ребенка при рождении удовлетворительное. В основную (1 – 4 группы) вошли новорожденные от матерей с высоким инфекционным индексом, с локальными или генерализованными проявлениями внутриутробной инфекции. В результате проведенного исследования выявлены эхографические маркеры амнионита, плацентита и собственно инфекционного поражения плода, которое наиболее значимо для прогнозирования рождения ребенка с ВУИ. Патологические показатели биофизической активности, допплерометрия отражают системные нарушения в состоянии плода, его дисстресс. Таким образом, чем больше эхографических маркеров внутриутробного инфицирования встречается у плода, тем более вероятно рождение ребенка с признаками ВУИ.

Одной из важнейших проблем современной перинатологии является прогрессирующий рост инфекционной патологии у плода и новорожденного. В структуре заболеваемости новорожденных внутриутробные инфекции (ВУИ) занимают второе место после гипоксии и асфиксии в родах [4].
В структуре перинатальной смертности удельный вес ВУИ достигает 65,6% [11]. В настоящее время насчитывается более 2500 возбудителей, способных вызывать внутриутробное инфицирование плода, при этом количество их постоянно пополняется [14]. Чаще диагностируется смешанное инфицирование вирусно-бактериальной, вирусно-вирусной природы и их различные ассоциации с трихомонадами и дрожжевыми грибами рода Candida [12].
Возбудители этих инфекций обладают прямым и непрямым действием на фето-плацентарную систему. Дегтярев Д.Н. и соав. (1998) утверждают, что чем меньше гестационный возраст плода, тем более выражена альтерация тканей. В результате этого основным клиническим проявлением инфекции плода, возникающих на ранних сроках беременности являются пороки развития [2]. По мере увеличения сроков беременности в клинической картине инфекционного заболевания плода начинают преобладать симптомы классического системного воспаления, обусловленные выраженной пролиферацией и экссудацией, что проявляется в виде гепатита, пневмонии менингита, энтероколита и других заболеваний [6].
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика ее затруднена и возможна лишь в результате сочетания клинических и лабораторно-инструментальных методов исследования [5]. Метод ультразвуковой диагностики является доступным, высоко информативным, не инвазивным и позволяет провести эхографическую оценку структурной патологии плода, плаценты, амниона, а также определить степень гемодинамических нарушений фето-плацентарного комплекса у беременных с высоким инфекционным индексом [3,12].
Материалы и методы
Под наблюдением находились 123 беременных женщины, которым проводились все необходимые клинико-лабораторные обследования, а также ультразвуковое исследование в сроке 30-36 недель гестации. В зависимости от выраженности ВУИ и степени тяжести состояния все новорожденные разделены на 4 клинические группы.
1 группа (n=40) - контрольная, новорожденные от матерей с неосложненной беременностью, состояние ребенка при рождении удовлетворительное. 2-я группа (n=30) - состояние ребенка при рождении удовлетворительное или средней степени тяжести с локальными проявлениями ВУИ в виде пиодермии, ринита, отита, конъюнктивита, пневмонии. 3-я группа (n=25) - состояние ребенка при рождении тяжелое или средней степени тяжести с ухудшением в раннем неонатальном периоде с локальными формами ВУИ в виде пневмонии, энтероколита, менингита, фетального гепатита и др. заболеваний. 4-я группа (n=28) - состояние ребенка при рождении тяжелое или крайней степени тяжести с генерализованными или локальными проявлениями ВУИ, потребовавшими проведения искусственной вентиляции легких. Матери детей 2-4 групп имели высокий инфекционный индекс.
Таблица 1.
Фетометрия позволила установить соответствие размеров плода гестационному сроку, диагностировать задержку внутриутробного развития.
При исследовании сердечной деятельности плода использовали шкалу Фишера, 1976., основными показателями которой были: базальная частота сердечных сокращений, амплитуда осцилляций, частота осцилляций, акцелерации, децелерации. Критерии состояния плода следующие: 8 - 10 баллов - нормальное состояние; 5 - 7 баллов - сомнительное; 0 - 4 балла - неудовлетворительное.
Таблица 2. Заболеваемость беременных урогенитальными инфекциями
Диагностическими критериями нарушения маточно-плацентарного и плодово-плацентарного кровотока при доношенной беременности считали следующие числовые значения СДО: в артерии пуповины 3,0 и выше, а также нулевые и отрицательные значения диастолического кровотока; в маточных артериях 2,4 и выше; в аорте плода 8,0 и выше; для средней мозговой артерии менее 4 и более 7 у.е. [10].
Для оценки степени нарушений маточно-плацентарно-плодовой гемодинамики пользовались шкалой А.Н. Стрижакова (1991).
I А степень - изолированное нарушение кровотока в маточных артериях; I Б степень - изолированное нарушение кровотока в артерии пуповины; II степень - сочетанное нарушение кровотока в маточных артериях и артерии пуповины; III степень - критическое нарушение плодового кровотока, характеризующееся нулевым или ретроградным диастолическим компонентом в артерии пуповины.
Результаты исследований
На основании ранее проведенных исследований [1] выделяют 3 группы эхографических маркеров внутриутробного инфицирования: 1) маркеры внутри-утробного инфицирования плаценты (плацентит); 2) маркеры внутриутробного инфицирования околоплодных вод (амнионит); 3) маркеры внутриутробного
инфицирования плода (инфекционные фетопатии).
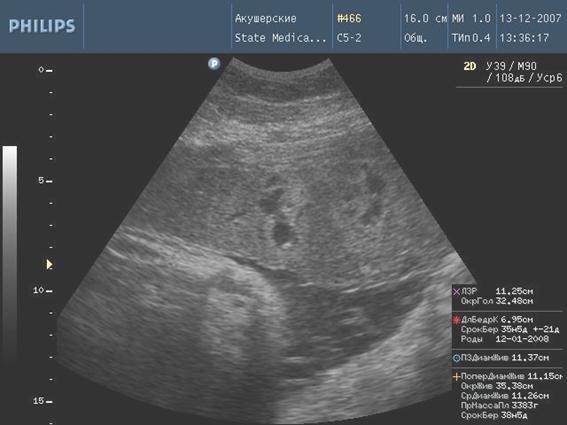
Рис. 1. Формирование псевдокист
Рис. 2. Эхографический маркер внутриутробного инфицирования околоплодных вод (свободно расположенный амниотический тяж)
Рис. 3. Эхографический маркер внутриутробного инфицирования плода (правосторонняя пиелоэктазия)
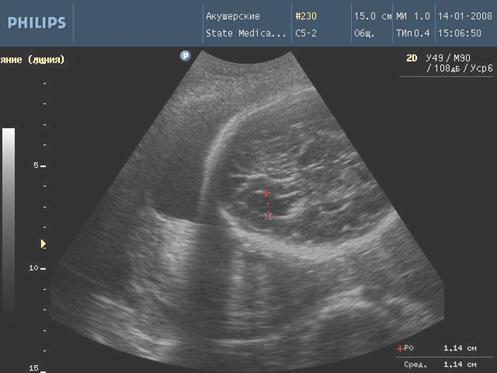
Рис. 4. Вентрикуломегалия
Во 2 клинической группе снижение дыхательной активности наблюдалось у 14 (46,6%) плодов, из них у 2 (6,6%) она не регистрировалась вообще. Снижение тонуса и двигательной активности отмечалось одномоментно у 3 (10%) плодов.
В 3 клинической группе снижение дыхательной активности наблюдалось у 16 (64%) плодов, из них у 11 (44%) продолжительность одного эпизода дыхательных движений составила от 30 до 60 сек., а у 5 (20%) плодов - менее 30 сек. В 4 группе в 82,1% случаев отмечалось снижение дыхательной активности, у 9 (32,1%) плодов - резкое снижение данного параметра. Тонус и двигательная активность плода являются наиболее точными маркерами тяжести внутриутробного страдания плода. Так в 3 клинической группе снижение данных показателей отмечалось у 17 (68%) плодов, в 4 группе - у 25 (89,2%) плодов, причем отсутствие общей двигательной активности за время наблюдения определялось у 6 (24%) плодов 3 группы и у 15 (53,5%) плодов 4 группы.
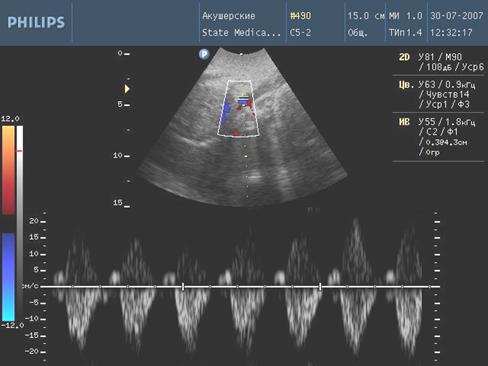
Рис. 5. Нарешение гемодинамики III ст. (ретроградный кровоток)
С целью изучения особенностей гемодинамических нарушений в фетоплацентарном комплексе у беременных с высоким инфекционным индексом были использованы значения систоло-диастолического отношения (СДО) в маточных артериях, артерии пуповины и средней мозговой артерии.
Таблица 3. Средние значения СДО в изучаемых сосудах
В1:В4 (p <0,005)
С1:С4 (p <0,001)
С2:С4 (p <0,05)
Средняя мозговая артерия
D1:D3 (p <0,05)
Таблица 4.
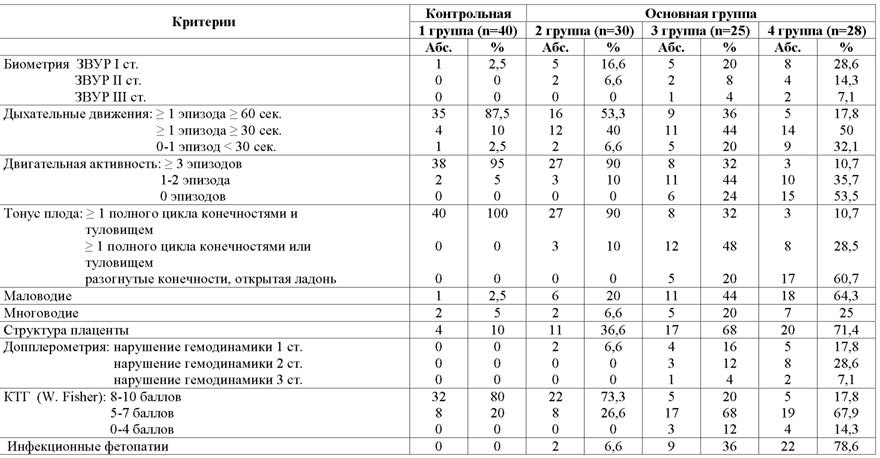
Сравнительный анализ полученных результатов показал, что чем более выражены инфекционные осложнения у новорожденных, тем чаще имеет место повышение сосудистой резистентности в артериях пуповины и маточных артериях.
Достоверность показателей в артериях пуповины определялась между 1 - 4 и 2 - 4 клиническими группами, а в маточных артериях только между 1 и 4 клиническими группами.
Увеличение мозгового кровотока является проявлением централизации плодового кровообращения в условиях сниженной плацентарной перфузии. Достоверность показателей в средней мозговой артерии отмечалось при сравнении 1 и 3 клинических групп.
Исходя из стадийности течения инфекционного процесса при внутриутробном инфицировании (амнионит, плацентит и собственно инфекционное поражение плода) эхографические маркеры в нашем исследовании разделились на 3 группы.
К ультразвуковым маркерам амнионита отнесены: многоводие, маловодие, гиперэхогенные включения в околоплодных водах. Аномальное количество околоплодных вод является типичным признаком внутриутробной инфекции плода. Многоводие встречается с частотой от 4,9 % (при инфекционно-воспалительных заболеваниях матери) до 67,2 % (при доказанной внутриматочной инфекции) [9]. Одной из причин возникновения многоводия является нарушение функции амниона - избыточная продукция околоплодных вод амниотическим эпителием и задержка их выведения [7]. Ж.Е. Пахомова (1996) делает акцент на уменьшении заглатывания околоплодных вод плодом, вследствие нарушения его функционального состояния и уменьшения основных параметров биофизического профиля. Механизм развития маловодия до конца не изучен, возможно, на фоне кислородной недостаточности происходит перераспределение кровотока для обеспечения жизненно важных органов, минуя легкие и почки, которые являются основными источниками продукции амниотической жидкости в конце беременности. Гиперэхогенная взвесь является фрагментами отторгшегося амнионального эпителия, она крупнодисперсная малоподвижная, в отличие от мелкодисперсных подвижных элементов сыровидной смазки плода, появляющиеся в норме после 32 недели беременности. Амниотические тяжи, несвязанные с мелкими частями плода, свободно располагающиеся в амниотической полости, также являются маркерами амнионита. В основной группе данный показатель определялся в 6 (7,2%) случаях, из них у двух детей после рождения был диагностирован врожденный порок развития конечностей в виде ампутаций пальцев на кистях, сочетающийся с расщелиной твердого неба.
К ультразвуковым маркерам плацентита отнесли увеличение толщины плаценты (отек) по сравнению с гестационной нормой; расширение межворсинчатого пространства; появление кистозных полостей в плаценте или формирование псевдокист, эхографическими особенностями которых является неправильная форма, наличие гиперэхогенного венчика по периферии кисты, отсутствие турбулентного движения жидкости во внутренней структуре. Ультразвуковая картина плацентита зависит от стадии процесса. Отек плаценты чаще всего носит транзиторный характер, наблюдается в период разгара заболевания, длится около 2 - 8 недель [12]. Обратные изменения в плаценте проявляются постепенным снижением ее эхогенности, нормализацией толщины и структуры.
Эхографическими маркерами собственно инфекционного поражения плода были пиелоэктазия, вентрикуломегалия, гепатомегалия, кардиомегалия с гидроперикардом, появление линейных гиперэхогенных включений перивентрикуляр-ных зон головного мозга плода. Именно эти маркеры наиболее значимы для прогнозирования рождения ребенка с ВУИ, так как мы видим, что при наличии эхо-признаков плацентата и амнионита у беременных далеко не всегда рождались дети с ВУИ.
Патологические допплерометрические показатели, также как и оценка дыхательной и двигательной активности, отражают системные нарушения в состоянии плода, его дистресс [13]. Они не являются специфичными и указывают на то, что в системе жизнеобеспечения плода произошел сбой, в связи с чем необходимо рассматривать вопрос о тактике ведения беременной женщины, а также о сроках и методах родоразрешения.
Пациенты с клиническими симптомами. Значение индекса стенокардии
Нагрузочное тестирование у пациентов с хронической ИБС (если оно выполнимо и отсутствуют противопоказания) следует проводить всегда перед КАГ. Пациенты с высокой ТФН (> 10 МЕТ) и соответствующей коррекцией риска атеросклероза обычно имеют благоприятный прогноз независимо от зон поражения при ИБС. ПФН обеспечивает оценку функциональной значимости ангиографически выявленного стеноза КА. Роль нагрузочного тестирования у пациентов с подозрением или диагностированной ИБС изучалась Weiner и соавт. В исследовании CASS у 4083 пациентов, находящихся на лекарственной терапии.
Были выделены пациенты высокого риска (12% популяции) с показателем среднегодовой смертности 5%, у которых ФН при тестировании не достигала 1 ступени по Bruce (< 4 МЕТ), но при этом сегмент ST снижался на > 0,1 мВ (1 мм). Среднегодовая смертность среди пациентов с низким риском (34% популяции), достигших III ступени и выше протокола по Bruce без изменений на ЭКГ, не превышала 1% в течение 4 лет наблюдения. Подобные ЭКГ-параметры и уровни ФН могут помочь при стратификации риска у пациентов с ИБС при трехсосудистом поражении, у которых, вероятно, будет эффективно АКШ.
Mark и соавт. разработали индекс нагрузки на тредмиле (ТМ-индекс) по данным 2842 пациентов с болями в груди из банка данных Duke; эти пациенты проходили ТрТ по Bruce с последующей катетеризацией. Были исключены пациенты с блокадой левой ножки пучка Гиса и те, у кого вследствие нагрузки развивалась депрессия сегмента ST в отведениях с зубцом Q. ТМ-индекс Duke вычисляли по формуле: ТМ-индекс = Время нагрузочной пробы - (5 х Смещение ST) - (4 х ТМ-индекс стенокардии).
Значение индекса стенокардии принимали равным 0 при отсутствии стенокардии, 1 — во время нагрузки развивался типичный ангинозный приступ, 2 стенокардитические боли явились причиной прекращения ПФН. Смещение ST при ПФН определяли как максимальное отклонение сегмента ST, полученное в любом отведении. 13% пациентов с ТМ-индексом +5. Индекс предоставляет независимую прогностическую информацию дополнительно к клиническим данным, анатомии коронарного русла и показателю ФВ ЛЖ.
Стратифицированный среднегодовой уровень смертности по ТМ-индексу у 613 амбулаторных пациентов, направленных на нагрузочное тестирование, был меньше. Индекс работает одинаково хорошо у мужчин и у женщин, хотя женщины имеют более низкий общий риск, чем мужчины, при равных его значениях. ТМ-индекс Duke не столь эффективен при определении риска у пациентов > 75 лет. Системы количественной оценки ФН могут быть использованы для определения прогноза у пациентов промежуточного и высокого риска, кому показана КАР для изучения анатомии коронарного русла.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Маркеры эндогенной интоксикации. Диагностика эндогеннной интоксикации.
1. Лейкоцитоз (увеличение количества лейкоцитов в венозной крови (более 10-10 /л). При оценке степени выраженности интоксикации лейкоцитоз следует учитывать наряду с другими признаками, свидетельствующими о длительности заболевания, распространенности патоло-ТОческого процесса и его динамики.
2. Лейкоцитарный индекс интоксикации (Кальф-Калиф Я. Я., 1941). Нормальные значения ЛИИ колеблются от 0,3 до 1,5.

3. Ядерный индекс интоксикации (Даштаянц Г. А., 1978). При ЯИИ, равном 0,05-0,08, состояние больного оценивается как удовлетворительное, 0,3-1,0 - средней степени тяжести, более 1,0 -тяжелое.
У больных в стадии токсемии ЛИИ и ЯИИ может снижаться, что свидетельствует о декомпенсации систем кроветворения и детоксикации. В этих случаях значительная часть токсичных продуктов белковой природы и эндотоксинов фиксируется на микросгустках и агрегатах и, выключаясь из общего кровотока, снижает токсичность крови.
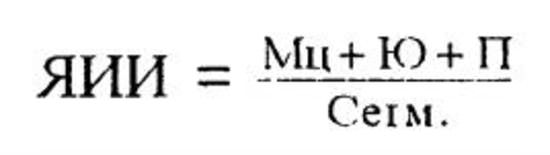
4. Индекс интоксикации (Гринев М. В., 1989). При ИИ, равном 35, прогноз заболевания неблагоприятный, при ИИ выше 45 в 100% случаев - летальный исход.
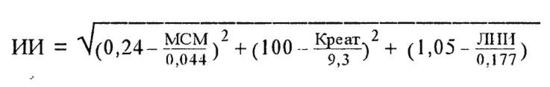
5. Концентрация общего белка в плазме крови.
- снижение уровня общего белка в плазме крови до 45 г/л указывает на тяжелую эндогенную интоксикацию и неблагоприятный исход болезни;
- уменьшение концентрации общего белка за счет альбуминовой фракции отражает использование альбумина как важнейшего фактора плазменной детоксикации, связывания и удаления токсинов;
- увеличение альфа-2-глобулинов в два раза огражает активность процесса с нарушением дезаминирования;
- увеличение гамма-глобулинов указывает на рост продукции грубодисперсных белков;
- снижение альбумино-глобулинового коэффициента (отношение количества альбуминов к количеству глобугашов) обусловливает при выраженной интоксикации переход альбуминов в ткани вследствие нарушенной проницаемости стенок сосудов, снижение интенсивности синтеза альбуминов в почечной ткани, ускорение их распада и превращения в другие белки, частично в глобулины, а также усиление синтеза альфа-2- и гамма-глобулинов. В норме атъбумино-глобулиновый коэффициент колеблется от 1,5 до 2,3.
6. Билирубин. Уровень билирубина более 30 ммоль/л вызывает выраженньш мембранотоксический эффект. Встраиваясь в мембраны и проникая в клетку, билирубин повреждает липиды митохондрий, вызывая их необратимое набухание, ингибирует утилизацию глюкозы, нарушает активность ферментов, ионную клеточную проницаемость. При эндогенной интоксикации билирубин плохо связывается с белками вследствие как гипоальбуминемии, так и вытеснения его из комплекса с альбумином лекарственными препаратами (гормонами, салуретиками).
7. Мочевина и креатинин. Увеличение уровня мочевины более 16 ммоль/л и креатинина более 0,2 ммоль/л указывает на наличие эндогенной интоксикации и сопровождается нарушением нейрогумо-рального контроля ЦНС.
8. Токсическая энзимопатия.
- увеличение уровней АЛТ, ACT, ЛДГ (изоферменты 1, 2, 5) указывает на нарушение проницаемости клеточных мембран;
- гипергликемия, увеличение концентрации лактата и пирувата отражает энергетическую несостоятельность клетки;
- увеличение концентрации молочной кислоты без повышения концентрации пировиноградной кислоты свидетельствует о повреждении ферментативных клеточных процессов;
- увеличение ДНКазы, РНКазы, кислой фосфатазы, катапрессина Д отражает степень деструкции клеток, лизиса внутриклеточных белков, а также энергодефицит клетки.
9. Молочная кислота. Увеличение концентрации молочной кислоты отражает уровень энергодефицита и гипоксии. Концентрация молочной кислоты более 4 ммоль/л расценивается как прогностически неблагоприятный признак.
10. Молекулы средней массы (МСМ) - являются олигопептидами с массой от 500 до 5000 Д, по своей природе относящимися к белковым токсинам с высоким содержанием дикарбоновых и низким - ароматических кислот.
МСМ обладают прямым мембранотоксическим действием и инициируют появление пептидов, близких по структуре к биорегуляторам. Среди них выделяют гепатоцеребральные, уремические, ишеми-ческие, ожоговые МСМ. На 80% МСМ состоят из белков и их метаболитов, в том числе продуктов гидролиза фибриногена и глобулинов, катаболизма глюкокортикоидов. В состав средних молекул входят биологически активные вещества (паратгормон, нейротоксин X, ингибиторы фагоцитоза, гемопоэза, хрупкости мембран эритроцитов, утилизации глюкозы и др.). Этим и определяется токсичность МСМ: нарушение эритропоэза, снижение розеткообразования, ингибирование дыхания митохондрий, нарушение синтеза ДНК в гепатопитах и лимфоцитах. Нейротоксические эффекты МСМ связаны с образованием ложных медиаторов: МСМ, взаимодействуя с инсулином, инактивируют гормон, ингибируя фосфорилирование, нарушают энергетический обмен в клетке.
Увеличение уровня МСМ - один из самых чувствительных признаков эндогенной интоксикации.
11. Коэффициент нейтрофилы/лимфоциты (отношение клеток неспецифической и специфической защиты). В норме коэффициент равен 2,0.
Увеличение коэффициента до 4,0 и более свидетельствует о нарастании тяжелой интоксикации.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
- КЛЮЧЕВЫЕ СЛОВА: ОРВИ у детей, Генферон, интерфероны
Как известно, часто болеющие дети (ЧБД) – не нозологическая форма и не диагноз. Это группа диспансерного наблюдения, включающая детей с частыми респираторными инфекциями, в большинстве случаев возникающими из-за транзиторных корригируемых отклонений в защитных системах организма. Таким образом, у ЧБД по сравнению со сверстниками уровень заболеваемости выше. Он оценивается по частоте эпизодов острой респираторной вирусной инфекции (ОРВИ).
Инфекционный индекс для детей старше трех лет рассчитывается как соотношение суммы всех случаев ОРВИ за год и возраста ребенка (годы). Инфекционный индекс ЧБД – 1,1–3,5.
ЧБД составляют 20–65% детской популяции. Данная категория пациентов отличается резистентностью к традиционным методам терапии.
На долю ЧБД приходится 50–60% всех регистрируемых заболеваний. Около 20% ЧБД страдают респираторными инфекциями практически ежемесячно. В 40% случаев к семи-восьми годам у них формируется хроническая патология.
Повышенная заболеваемость детей обусловлена незрелостью иммунной системы, сниженной продукцией цитокинов, дефицитом интерферона (ИФН), недостаточной выработкой иммуноглобулина (Ig) А, наличием хронических очагов инфекции, персистенцией вирусов. Кроме того, причинами частой заболеваемости могут быть фоновые заболевания, нерациональная антибиотикотерапия. Сегодня особое внимание исследователи уделяют наследственным факторам развития частой заболеваемости у детей.
Один из факторов, предрасполагающих к развитию частой заболеваемости у детей, – персистенция патогенных возбудителей, нередко протекающая под маской ОРВИ и сопровождаемая выраженным иммунным дисбалансом. Наиболее распространенными возбудителями являются микоплазмы, хламидии, вирусы герпеса. Персистенция патогенных возбудителей приводит к недостаточности симптоматической и адаптогенной терапии для купирования эпизодов ОРВИ у ЧБД.
Профессор Е.В. Михайлова представила результаты исследования, проведенного на базе детской инфекционной больницы № 5, детской поликлиники № 3 г. Саратова, с участием 200 детей в возрасте от одного до десяти лет 1 . Целью работы стало изучение клинических особенностей течения острого респираторного заболевания у ЧБД, оценка показателей иммунного статуса детей с определением уровня иммуноглобулинов, ИФН (альфа, гамма).
В исследовании применяли методы верификации диагноза. Этиологическую расшифровку ОРВИ выполняли с помощью иммунохроматографии носоглоточного смыва к вирусам гриппа, парагриппа, аденовирусам, респираторно-синцитиальным (РС) вирусам, иммуноферментного анализа (ИФА) крови на определение антител к вирусам парагриппа, аденовирусам, РС-вирусу, а также полимеразной цепной реакции (ПЦР) мазка из носоглотки и крови. Возбудителей оппортунистических инфекций выявляли методом ПЦР и ИФА крови с определением IgM, IgG – вирусов герпеса 1-го, 2-го и 6-го типов, Эпштейна – Барр, цитомегаловируса, Chlamydia pneumoniae, Pneumocystis carinii.
Пациентов разделили на две равные группы – часто болеющие и редко болеющие дети. Как показали результаты исследования, у ЧБД частота эпизодов заболеваний выше, чем у редко болеющих детей, – 7,4 ± 0,71 против 3,1 ± 0,80 соответственно. Инфекционный индекс у ЧБД – 2,03, у редко болеющих детей – 0,85. В группе ЧБД более трети пациентов имели антитела класса G к вирусам простого герпеса 1-го и 2-го типов, более половины – к цитомегаловирусу и вирусу Эпштейна – Барр. У 56% детей группы ЧБД в период манифестации ОРВИ обнаружены IgG к вирусу герпеса 6-го типа. У 37,5% детей из группы ЧБД имел место повышенный уровень антител к IgE, у 73,8% детей – дефицит ИФН-альфа и ИФН-гамма.
В группе ЧБД респираторная микст-инфекция встречалась в 61% случаев, моноинфекция – в 8% случаев. В группе редко болеющих детей только 20% имели фоновую патологию (анемию, отягощенный аллергологический анамнез). В группе ЧБД у 80% пациентов отмечалась фоновая патология, в том числе анемия, гипотрофия, ожирение, тимомегалия, отягощенный аллергологический анамнез, энцефалопатия.
Сопутствующие хронические заболевания в группе ЧБД выявлены в 30% случаев (хронический тонзиллит, пиелонефрит, бронхиальная астма, дисметаболическая нефропатия). В группе редко болеющих детей хронических заболеваний не обнаружено.
В группе ЧБД среднетяжелая форма ОРВИ встречалась в 70%, тяжелая – в 30% случаев. В группе редко болеющих детей эти показатели составили 90 и 10% случаев соответственно. В группе ЧБД частота поражения нижних дыхательных путей и симптомы дыхательной недостаточности наблюдались в 72 и 31% случаев соответственно, в группе редко болеющих детей – в 30 и 5%.
Таким образом, большинство пациентов из группы ЧБД (80%) имели сопутствующую соматическую патологию, более половины из них – патологию нескольких органов или систем. У 61% детей ОРВИ были вызваны несколькими возбудителями. У ЧБД тяжелая форма респираторных заболеваний встречалась в три раза чаще, поражения нижних дыхательных путей – в 2,2 раза чаще по сравнению с группой редко болеющих детей.
В ходе исследования отмечены иммунологические нарушения в группе ЧБД в период заболевания – снижение уровня IgА, повышение уровня IgЕ, дефицит продукции ИФН-альфа и ИФН-гамма.
При лечении ОРВИ в группе ЧБД на первом месте стоит этиотропная терапия. Однако у больных детей, часто страдающих ОРВИ, использования только этиотропных препаратов недостаточно. Максимальный клинический эффект может быть получен лишь при сочетанном применении препаратов с разным механизмом действия. В этом случае достигаются подавление репликации вируса и одновременная коррекция нарушения в системе иммунитета и ИФН.
ИФН обладают универсальными антивирусными свойствами подавления репликации ДНК- и РНК-содержащих вирусов. Существует несколько форм для применения рекомбинантных генно-инженерных ИФН у детей.
Препарат Генферон® лайт (ИФН-альфа-2b) выпускается в форме суппозиториев для лечения ОРВИ и других инфекционных заболеваний бактериальной и вирусной этиологии у детей и в форме назального дозированного спрея для профилактики и лечения гриппа и ОРВИ у взрослых и детей старше 14 лет.
Применение препарата Генферон® лайт в форме суппозиториев позволяет подобрать оптимальную дозу (125 000 или 250 000 МЕ) ИФН в зависимости от возраста ребенка.
Препарат отличается высокой эффективностью благодаря уравновешенному сочетанию ИФН-альфа и таурина, который потенцирует действие ИФН.
Отсутствие нежелательных явлений при лечении ОРВИ подтверждает благоприятный профиль безопасности, хорошую переносимость и эффективность использования иммунокорригирующей терапии препаратом Генферон® лайт в группах ЧБД.
Сочетанное использование препарата прямого противовирусного действия Арбидол® и препарата Генферон® лайт высоко эффективно у больных ОРВИ, гриппом, осложненных пневмонией. Это проявляется в более быстром (на два – четыре дня) купировании интоксикационного, катарального синдрома, нормализации температуры, восстановлении аппетита и улучшении общего состояния.
Профессор Е.В. Михайлова также привела данные сравнительного рандомизированного проспективного исследования эффективности и безопасности препаратов Генферон® лайт и Арбидол® в лечении и профилактике эпизодов ОРВИ в группе часто и длительно болеющих детей. Исследование проводили на базе четырех исследовательских центров – Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Первого Московского государственного медицинского университета им. И.М. Сеченова, Саратовского государственного медицинского университета им. В.И. Разумовского и детской городской поликлиники № 35 г. Санкт-Петербурга.
В исследовании приняли участие 64 ребенка в возрасте от трех до шести лет из группы ЧБД с диагнозом ОРВИ, получавших лечение в амбулаторных условиях. Длительность ОРВИ на момент включения в исследование не превышала 48 часов с момента появления основных симптомов (лихорадка, катаральные явления). Больные не принимали препараты цитокинов, их индукторы и глюкокортикостероиды. В исследование не включали детей с аутоиммунными заболеваниями, иммунодефицитными состояниями, гиперчувствительностью к препаратам ИФН. Длительность наблюдения составила 180 дней.
Пациентов рандомизировали на две равные группы, сопоставимые по половозрастным характеристикам, фоновой патологии, инфекционному индексу, сопутствующим и перенесенным заболеваниям, клиническим проявлениям ОРВИ на скрининге, исходным показателям иммунограммы, а также концентрации уровней IgЕ, ИФН-альфа и ИФН-гамма.
В основной группе пациенты получали препарат Генферон® лайт 125 000 МЕ ректально два раза в сутки в течение десяти дней одновременно со стандартной терапией, далее по профилактической схеме – по одному суппозиторию в сутки на ночь через день в течение трех недель. Пациенты контрольной группы принимали Арбидол® 50 мг внутрь четыре раза в сутки в течение пяти дней одновременно со стандартной терапией, далее – по 50 мг два раза в неделю в течение трех недель. Контроль терапии и ее эффективности проводили во время пяти визитов, а также в форме телефонных опросов.
Результаты исследования показали, что терапевтическая эффективность препаратов Генферон® лайт и Арбидол® в купировании эпизодов ОРВИ приблизительно одинакова. Однако повторных эпизодов ОРВИ в группе Генферона лайт к 140-му дню исследования было меньше (11 детей), чем в группе Арбидола (20 детей) (р = 0,04). В большинстве случаев в обеих группах имели место повторные эпизоды в виде ОРВИ легкой степени. Таким образом, при длительном наблюдении Генферон® лайт оказался более эффективным для предотвращения повторных эпизодов ОРВИ.
Данные исследования продемонстрировали, что применение препарата Генферон® лайт в острый период ОРВИ не менее эффективно, чем использование препарата прямого противовирусного действия Арбидол®. Генферон® лайт позволяет добиться купирования основных симптомов ОРВИ и статистически значимо снижает количество повторных эпизодов заболевания при длительном наблюдении (140 дней).
В заключение профессор Е.В. Михайлова отметила, что лечение ОРВИ в группе ЧБД требует более длительного назначения иммунокорригирующих препаратов с последующим переходом на поддерживающий режим с целью коррекции иммунологических нарушений и снижения числа повторных эпизодов ОРВИ. Рекомендуемый режим применения препарата Генферон® лайт у ЧБД – по одному суппозиторию два раза в сутки ректально в течение десяти дней одновременно со стандартной терапией, затем по одному суппозиторию один раз на ночь через день в течение трех недель.
Читайте также:

