Инфекционный мононуклеоз от кошки
Обновлено: 26.04.2024
Инфекционный мононуклеоз — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной, систем, костного мозга, печени, селе
New approaches to the therapy of infectious mononucleosis Yu. G. Pritulina, V. V. Kunina, A. A. Monastyrsky, T. N. Malyutkina, V. V. Malinovskaya, A. N. Shuvalov
Infectious mononucleosis is a viral, widely-spread disease characterized by systemacy of the lesion, with involvement of lymphoid organs and tissues, cardiovascular and immune systems, marrow, liver, spleen and other organs in the pathological process. Comparative study of clinical and laboratory indices in the acute period of infectious mononucleosis was conducted, including treatment with human recombinant interferon alpha-2b, along with highly active antioxidants — C and E vitamins.
Герпесвирусные инфекции широко распространены среди детей и взрослых. По данным Всемирной организации здравоохранения (ВОЗ) до 90% взрослого и детского населения планеты инфицировано герпесвирусами, причем у 50% из них отмечают манифестное, рецидивирующее течение вызываемых ими заболеваний. Инфекционный мононуклеоз является наиболее характерным типичным клиническим проявлением герпесвирусных инфекций [1]. Инфекционный мононуклеоз (ИМ) — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной систем, костного мозга, печени, селезенки и других органов [2, 3]. В мире инфекционным мононуклеозом ежегодно заболевают от 16 до 800 лиц на 100 тыс. населения. В России ежегодно регистрируют 40–80 случаев ИМ на 100 тыс. населения [1, 2, 4]. Установлена роль вируса Эпштейна–Барр в развитии злокачественных новообразований, аутоиммунных, неврологических заболеваний и синдрома хронической усталости. Показано, что после перенесенной инфекции новое поколение В-клеток содержит несколько генокопий вируса Эпштейна–Барр в латентной форме, в результате чего вирус может длительно персистировать в организме, вызывая иммунодефицитное состояние и повышая риск развития онкогематологических заболеваний [5–7]. В последние годы доказана гепатотропность герпетических вирусов, которые могут вызывать различные поражения печени — от бессимптомного гепатита до гепатоцеллюлярной карциномы [2].
В связи с этим назначение интерферона α-2b человеческого рекомбинантного в комплексе с высокоактивными антиоксидантами витаминами Е и С (препарата Виферон®), обладающего иммуномодулирующими, противовирусными, антипролиферативными свойствами, подавляющего репликацию РНК- и ДНК-содержащих вирусов, могло бы способствовать более быстрому клиническому выздоровлению, оказать положительное влияние на лабораторные показатели и тем самым предотвратить хроническое течение.
Целью данного исследования явилось сравнительное изучение клинико-лабораторных показателей в острый период ИМ при лечении препаратом Виферон®.
В задачи иследования входило:
1) оценить эффективность использования симптоматической и патогенетической терапии у пациентов с ИМ;
2) оценить эффективность применения препарата Виферон® у пациентов с ИМ на фоне симптоматической и патогенетической терапии;
3) исследовать сравнительную эффективность лечения препаратом Виферон® с базисной стандартной терапией у пациентов с ИМ.
Материал и методы исследования
Проведено открытое проспективное рандомизированное контролируемое исследование в группах больных с острым ИМ. В исследование были включены 40 пациентов, больных острым ИМ средней степени тяжести, проходивших стационарное лечение в Воронежской областной клинической инфекционной больнице. Основная группа (1-я группа) — 20 пациентов, наряду с базисной терапией получала препарат рекомбинантного интерферона α-2b в комплексе с высокоактивными антиоксидантами витаминами Е и С Виферон®, и группа сравнения (2-я группа) — 20 пациентов, которым проводили только базисную стандартную терапию. Критерии включения пациентов были: лечение в стационаре, верифицированный диагноз ИМ, возраст старше 18 лет, поступавших в клинику на 1–5 день от начала заболевания и не получавших в домашних условиях препаратов интерферона и иммуномодуляторов, наличие информированного согласия на участие в исследовании.
Лечение пациентов в группах на всех этапах исследования осуществляли согласно стандартным режимам лечения (на основании основных положений Федеральных клинических рекомендаций по диагностике и лечению инфекционного мононуклеоза, 2013), включающего базисную стандартную терапию (дезинтоксикационная, десенсибилизирующая и антибактериальная терапия).
- 1-й группе пациентов наряду с базисной терапией назначали Виферон® по следующей схеме: по 1 суппозиторию (1 000 000 МЕ) 2 раза в сутки в течение 10 дней.
- 2-я группа пациентов получала только базисную стандартную терапию.
Набор больных в группы осуществляли методом пар, рандомизация проводилась с помощью генератора случайных чисел, больные в группах были сопоставимы по полу и возрасту.
Для обработки полученных данных использовали пакеты программ Microsoft Excel 2007 и Statistica 6.0. Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, т. е. различие считали статистически значимым при p < 0,05.
- 1-я группа — 20 человек, из которых 9 мужчин и 11 женщин в возрасте от 18 до 47 лет.
- 2-я группа — 20 человек, из которых 10 мужчин и 10 женщин в возрасте от 18 до 47 лет (рис. 1).
Всем больным проводилось клиническое и лабораторное обследование, включающее в себя (на 1-й и 3-й неделе):
1) общий анализ крови, общий анализ мочи, биохимический анализ крови;
2) антитела (АТ) к капсидному антигену (VCA) вируса Эпштейна–Барр класса M, G; АТ к раннему антигену (ЕА) класса G; АТ к ядерному антигену (ЕВNA) класса G;
3) полимеразная цепная реакция (ПЦР): ДНК вируса Эпштейна–Барр (ЕВV).
Результаты и обсуждение
Среди клинических проявлений ИМ у всех больных при поступлении наблюдались лихорадка, синдром интоксикации, полилимфаденопатия, синдром ангины с преобладанием лакунарной формы, гепатомегалия, заложенность носа, спленомегалия.
С первого дня поступления в стационар пациенты получали различные виды терапии. При изучении клинической эффективности разных способов лечения оказалось, что в 1-й группе больных температура нормализовалась на 6,3 ± 0,29 дня, во 2-й группе пациентов, не получавших Виферон®, — 10,5 ± 0,6 дня соответственно (p ≤ 0,05).
У пациентов, получавших Виферон®, отмечалась тенденция к более быстрому купированию синдрома интоксикации, чем во 2-й группе, что проявлялось улучшением самочувствия, аппетита, исчезновением бледности кожных покровов и уменьшением лимфаденопатии.
Сокращение размеров шейной группы лимфоузлов в 1-й группе отмечалось на 3,4 ± 0,17 дня, а во 2-й группе пациентов на 6,8 ± 0,12 дня соответственно (p ≤ 0,05). Применение антибиотикотерапии в сочетании с препаратом Виферон® привело к достоверному сокращению продолжительности гнойно-воспалительных процессов в ротоглотке на 3,7 ± 0,12 дня, заложенности носа на 4,6 ± 0,2 (p ≤ 0,05) дня, а в группе только с антибиотикотерапией на 5,2 ± 0,14 и 5,7 ± 0,28 (p ≤ 0,05) дня соответственно.
Уменьшение размеров печени до нормальных показателей отмечалось на 9,5 ± 0,37 дня в 1-й группе, тогда как во 2-й группе — на 11,53 ± 0,25 (p ≤ 0,05) дня (рис. 2). Нормализация размеров селезенки наступала к 5–7 дню лечения, что не было статистически значимым для сравниваемых групп.
При анализе биохимических показателей крови на фоне лечения препаратом Виферон® и в группе только с патогенетической терапией выраженных различий найдено не было. Что касается основных показателей общего анализа крови на фоне проводимой терапии, то статистически значимым оказалось более быстрое исчезновение числа атипичных мононуклеаров на фоне лечения препаратом Виферон® по сравнению с группой получавших только патогенетическую терапию (6,2 ± 0,29 и 8,6 ± 0,32 дня (p ≤ 0,05) соответственно). Нормализация СОЭ наступила раньше в 1-й группе по сравнению со 2-й группой сравнения (5,2 ± 0,27 и 9,4 ± 0,55 дня (p ≤ 0,05) соответственно) (рис. 3).
Выводы
- При проведении терапии с применением препарата Виферон® по 1 суппозиторию (1 000 000 МЕ) 2 раза в сутки в течение 10 дней отмечается более быстрое, по сравнению с группой, не применявшей Виферон®, исчезновение ряда клинических симптомов: отмечалась тенденция к более быстрому купированию синдрома интоксикации, нормализация температуры в 1-й группе произошла в среднем на 4 дня быстрее, чем в группе, не принимавшей Виферон®, уменьшение размеров шейной группы лимфоузлов — более чем на 3 дня раньше в 1-й группе по сравнению со 2-й, не получавшей Виферон®, уменьшение размеров печени до нормальных показателей на 2 дня раньше, чем во 2-й группе. Применение антибиотикотерапии в сочетании с препаратом Виферон® привело к достоверному сокращению продолжительности гнойно-воспалительных процессов в ротоглотке и заложенности носа, чем у пациентов, получавших только антибиотикотерапию. Нормализация некоторых лабораторных показателей, больных острым инфекционным мононуклеозом, принимавших в комплексной терапии Виферон®, по сравнению с больными, получавшими только стандартную терапию.
- Дальнейшее изучение этого препарата у данных пациентов требует оценки эффективности лекарственных форм препарата Виферон® в дозе 3 000 000 МЕ по 1 суппозиторию 2 раза в день.
Литература
Ю. Г. Притулина* , 1 , доктор медицинских наук, профессор
В. В. Кунина*, кандидат медицинских наук
А. А. Монастырский**
Т. Н. Малюткина**
В. В. Малиновская***, доктор биологических наук, профессор
А. Н. Шувалов***, кандидат медицинских наук
* ФГБОУ ВО ВГМУ им. Н. Н. Бурденко Минздрава России, Воронеж
** БУЗ ВО ВОКИБ, Воронеж
*** ФГБУ НИЦЭМ им. Н. Ф. Гамалеи Минздрава России, Москва
Новые подходы к терапии инфекционного мононуклеоза/ Ю. Г. Притулина, В. В. Кунина, А. А. Монастырский, Т. Н. Малюткина, В. В. Малиновская, А. Н. Шувалов
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 57-59
Теги: герпесвирусные инфекции, иммунодефицитные состояния, интерферон
Коварный инфекционный мононуклеоз: разберемся, чем он опасен и как его обнаружить
Сейчас все чаще можно услышать сложное и несколько пугающее название болезни — инфекционный мононуклеоз (ИМ). Но даже если это название для вас ново, вероятность, что вы или ваш ребенок уже столкнулись с его возбудителем, достаточно велика. При том, что распространенность этой болезни весьма широка, она не всегда диагностируется правильно. Это связано с тем, что проявляться мононуклеоз может по-разному — как у детей, так и у взрослых. Он способен умело маскироваться и имеет тенденцию к хронитизации. Неудивительно, что мононуклеоз считается крайне коварным явлением.
Давайте разберемся с его причинами, симптомами и, что особенно важно, с его диагностикой!

Что вызывает мононуклеоз?
Мононуклеоз у детей: симптомы и течение
Чаще всего первые проявления инфекционного мононуклеоза возникают у детей раннего возраста и впоследствии у подростков в пубертатном периоде. В любом случае для детского возраста характерно острое начало инфекции.
Какие симптомы в этом случае можно заметить?
В целом острая фаза инфекционного мононуклеоза длится около двух-трех недель. Как и другие разновидности герпес-вирусов, вирус Эпштейна — Барр склонен к сохранению в организме в латентном состоянии на всю жизнь.

Проявления инфекционного мононуклеоза у взрослых
Каковы проявления инфекционного мононуклеоза у взрослых?
Чем хуже обстоят дела с иммунитетом, тем чаще и мощнее будут рецидивы инфекции.
Скрытые опасности вируса Эпштейна — Барр
Ученые выявили тесную связь вируса Эпштейна — Барр с развитием некоторых видов новообразований (назофарингеальной карциономы) и болезней крови (лимфомы Бёркитта). Своевременное лечение обострений инфекционного мононуклеоза может снизить риск подобных осложнений.
Зачем нужна проверка на вирус Эпштейна — Барр?
Частые ангины, признаки ухудшения работы печени и другие перечисленные выше проявления встречаются при многих заболеваниях, что вызывает трудности в постановке диагноза на основе клинических проявлений. Возможности современных лабораторных исследований позволяют быстро прояснить ситуацию и сделать дифференциальную диагностику намного проще и точней.
Заболевания, под которые может маскироваться инфекция, вызванная вирусом Эпштейна — Барр:
Лабораторные тесты — это единственный и надежный способ обеспечить такую реализацию диагностики инфекционного мононуклеоза, результат который будет точным и информативным.

Лабораторная диагностика инфекционного мононуклеоза
Существует три главных критерия для лабораторного подтверждения диагноза:
Первые два пункта оцениваются с помощью развернутого общего анализа крови с лейкоцитарной формулой. Такой анализ позволяет установить процентное соотношение разных видов белых кровяных телец, выявить мононуклеары — измененные на фоне активности вируса Эпштейна — Барр белые кровяные клетки.
Серологический тест включает определение иммуноглобулинов класса М и G к нескольким видам вирусных антигенов (в том числе к капсидному, раннему и ядерному антигену) и позволяет сделать вывод о давности заражения, переходе инфекции в хроническую форму и ее реактивации (новом обострении).
Существует еще один метод диагностики инфекционного мононуклеоза, вызванного вирусом Эпштейна — Барр, — метод полимеразной циклической реакции (ПЦР). Данный метод молекулярной биологии, основанный на выявлении ДНК возбудителей инфекции, является сегодня одним из самых точных и чувствительных методов диагностики инфекционных заболеваний. ПЦР позволяет определять не только наличие инфекции, признаки ее реактивации, но вирусную нагрузку, то есть количественное присутствие вирусной ДНК в крови. Применение метода ПЦР в настоящее время можно считать лучшим вариантом для выявления первичной инфекции ВЭБ у детей раннего возраста, а также у лиц с иммунодефицитными состояниями, когда серодиагностика малоэффективна.
Диагностика инфекционного мононуклеоза в LAB4U

В сухом остатке:
Для первичной диагностики вируса Эпштейна — Барр у детей раннего возраста (до 3-х лет) применяется метод ПЦР-диагностики. Это исследование и ряд других, которые могут потребоваться при комплексном обследовании при наличии инфекционного мононуклеоза, можно всегда найти в каталоге онлайн-лаборатории LAB4U.
Что такое болезнь кошачьих царапин (фелиноз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, дерматолога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Болезнь кошачьих царапин (лихорадка от кошачьих царапин, фелиноз или регионарный небактериальный лимфаденит) — это острая бактериальная зоонозная инфекция, передающаяся преимущественно от кошек. Она характеризуется региональным лимфаденитом (воспалением лимфоузлов), кожной сыпью и иногда поражением глаз, нервной системы и внутренних органов. [1]
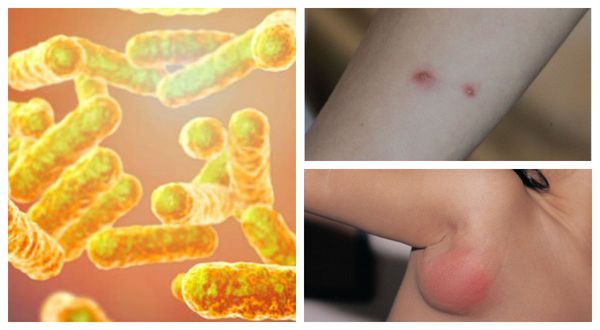
Причиной заболевания является инфицирование бактерией Bartonella henselae (бартонелла хенсели), которая была выделена у людей и млекопитающих и представляет собой мелкую плеоморфную, факультативную, грамотрицательную и внутриклеточную бациллу.
Источники инфекции
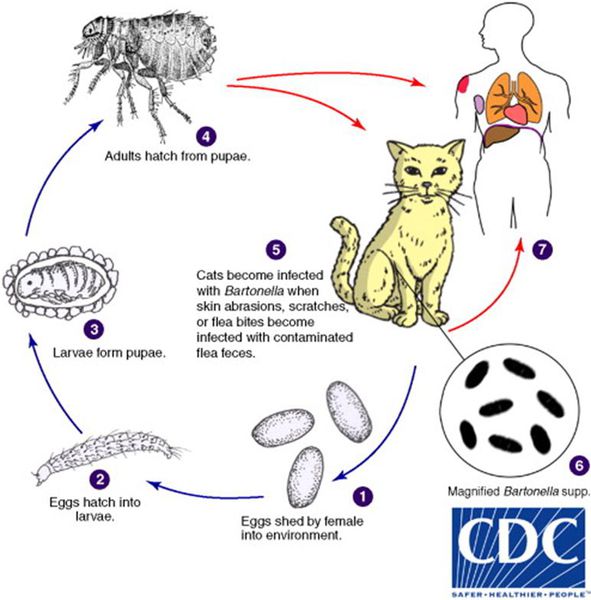
Кошки являются естественным резервуаром и переносчиком B. henselae, при этом сами животные от этого не страдают. В ряде исследований, проведённых в США, у 28% обследованных кошек были обнаружены антитела против причинной бактерии, причём из них 56% котят моложе года и 34% кошек от года и старше обладали иммунитетом к бациле. Также исследование показало, что у бездомных кошек (61%) B. henselae в крови выявлялись гораздо чаще, чем у домашних (21%). [2]
Котята моложе 12 месяцев в 15 раз чаще передают инфекцию, чем взрослые кошки, из-за наличия бактерии B. henselae в крови и большей склонностью к нанесению царапин.
Передача инфекции между кошками происходит при укусах кошачьей блохи Ctenocephalides felis или заглатывании их продуктов жизнедеятельности. Поэтому люди, у которых дома есть хотя бы один котёнок с блохами, имеют в 29 раз больше шансов заразиться бацилой, чем те, у чьих животных в шерсти не было блох. [3]
Собаки также являются источником заражения, но гораздо реже, чем кошки — всего в 5% случаев. [4] Также сообщается о единичных случаях возникновения заболевания при контактах людей с морскими свинками, кроликами и обезьянами. [1]
Помимо прочего, доказана роль в передачи инфекции иксодового клеща Ixodes ricinus (собачий клещ), который часто нападают и на людей. [5] Описан случай семейного заражения бартонеллами при их укусах. [6]
Варианты передачи инфекции человеку при укусах кошачьих блох и от человека к человеку не подтверждены. [2]
Пути передачи инфекции:
- Царапины. 75-90% пациентов с фелинозом незадолго до появления заболевания отмечали поверхностную травму кожи при контакте с кошкой. Дело в том, что блохи, находясь на животном, выделяют экскременты, которые содержат бактерии. Когда кошка царапает свою кожу (например, при почёсывании), её коготь загрязняется отходами жизнедеятельности, и в дальнейшем при нанесении травмы человеку происходит передача инфекции. [1]
- Укусы и ослюнения травмированной кожи — связаны с нахождением бактерий в слюне животных. [1]
Распространенность заболевания в мире и в Российской Федерации не известна. Заболеваемость в США среди амбулаторных пациентов составляет приблизительно 9,3 случая на 100 000 человек в год, причём ежегодно регистрируется до 20 000 новых случаев. [7] Примерно 70-90% случаев заболевания происходят в осенние и ранние зимние месяцы. Предполагается, что сезонность связана с повышением рождаемости котят в середине лета и с увеличением заражённости блохами. [8]
Группы риска
Заболевания чаще встречается у людей моложе 18 лет (от 55 до 80% случаев). Это связывают с тем, что именно дети и подростки чаще всего играют с котятами. [9]
Также стоит отметить, что заболевание чаще встречается у мужчин, чем у женщин, в соотношении 3:2. Одной из гипотез, объясняющих более высокую заболеваемость среди мужчин, является тенденция к более грубой игре с котятами и кошками и, следовательно, повышенному риску укусов и царапин. [1]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни кошачьих царапин
Первичный очаг (инокуляция) — наблюдается в 90% случаев и возникает на месте зажившей царапины. В основном располагается на кистях и предплечьях, реже на лице, туловище и ногах. Вначале отмечается эритематозное пятно, которое существует совсем недолго и трансформируется в плоскую папулу синюшно-красного или телесного цвета с чёткими неровными границами. Размером возникшая папула может быть от нескольких мм до 1-2 см в диаметре. Иногда несколько папул расположены линейно по ходу царапины. В некоторых случаях в основании папулы имеется болезненный инфильтрат до 3-5 см в поперечнике. У отдельных пациентов вместо папул возникают пузыри или пустулы. Примерно в половине случаев в последующем формируется эрозивный или язвенный дефект, заживающий с образованием рубца. [10]
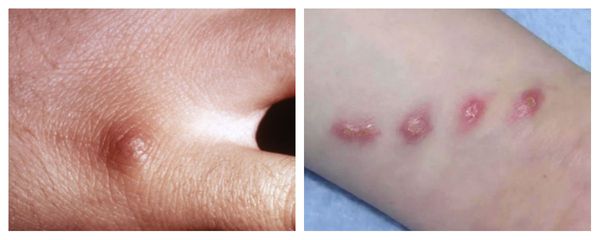
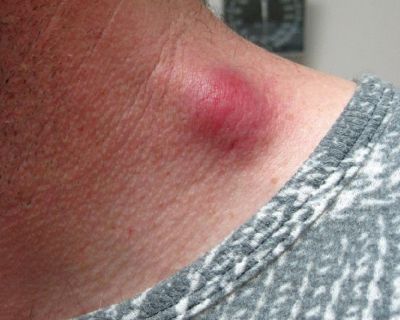
Региональный лимфаденит — основной симптом заболевания. При классической болезни кошачьих царапин регионарная лимфаденопатия возникает через 1-3 недели после появления первичного очага и продолжается до нескольких месяцев. У 85% пациентов поражается одна группа лимфоузлов: чаще всего подмышечные и эпитрохлеарные (46%), в области головы и шеи (26%), а также в паховой области (17,5%). В большинстве случаев воспаляются одиночные лимфоузлы, реже множественные, они могут располагаться как в границах одной анатомической области, так и в нескольких (генерализованная лимфаденопатия — редкое явление).
Поражённый лимфатический узел плотный, подвижный, при пальпации умеренно болезненный, в диаметре может достигать 1-5 см. Кожа над ним гиперемированна. В 10-50% случаев происходит спаивание лимфоузлов с окружающими тканями, их нагноение с образованием густого жёлто-зелёного гноя и последующим вскрытием с образованием язвенного дефекта. [11]
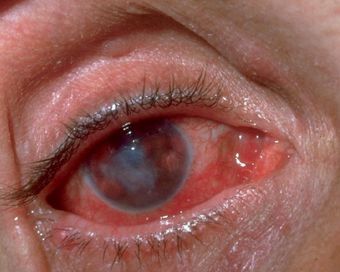
Окулогландулярный синдром Парино — одновременное образование одностороннего гранулематозного конъюнктивита (возникновение гранулём в виде жёлто-белых узелков от 1 до 5 мм) и увеличенного лимфатического узла перед ушной раковиной на той же стороне лица. Встречается в 2-8% случаев и связан с попаданием на конъюнктиву глаза слюны заражённых животных или фекалий блох. Конъюнктивит в течение нескольких недель регрессирует без рубцевания. [12]
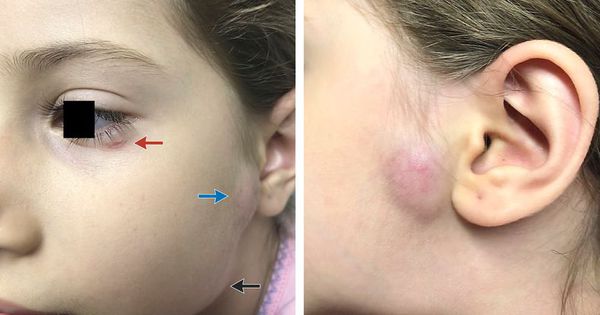
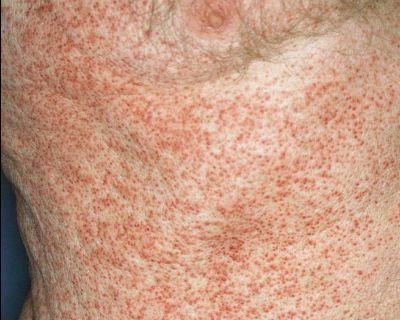
Генерализованная сыпь — скарлатино-, кореподобная или уртикарная сыпь на туловище, реже на конечностях. Наблюдается на фоне общих проявлений. В редких случаях возникает пятнисто-папулёзная сыпь или элементы по типу узловатой эритемы. Высыпания держатся от 2-5 дней до 2-5 недель. [10]
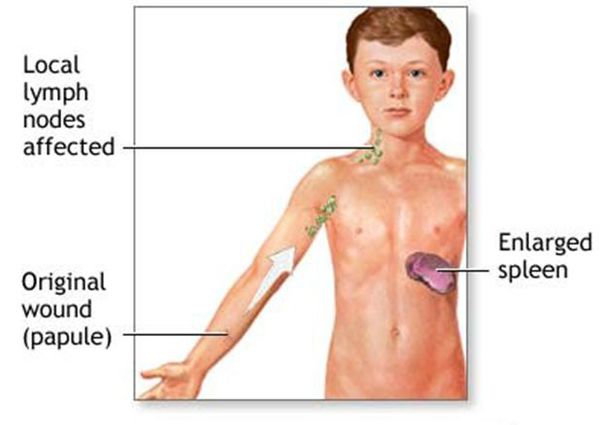
Патогенез болезни кошачьих царапин
При попадании в организм иммунокомпетентных пациентов Bartonella в местах инокуляции (заражения) вызывает гранулематозный и лейкоцитарно-лимфоцитарный ответ. Инфекция распространяется через лимфатические пути, вызывая воспаление в лимфатических узлах. В некоторых случаях происходит проникновение бактерий в кровь с развитием бактериемии и поражения нервной системы и внутренних органов.
Основным вирулентным агентом считается белок наружной мембраны OMP 43 кДа, который способен связывать эндотелиальные клетки.
Как показывают исследования, B. henselae проявляет более низкую биологическую активность по сравнению с классическими грамотрицательными микробами, что объясняет выживание, внутриклеточный рост и размножение бактерий внутри фагоцитарных клеток.
У пациентов с ослабленным иммунитетом (в частности, ВИЧ-инфицированных) ответ организма на заражение может привести к бациллярному ангиоматозу (избыточному разрастанию сосудов). Стимулировать ангио пролиферацию (появление новых кровеносных сосудов) бактерия B. henselae способна благодаря функции белка адгезина А, который может сцеплять поверхности клеток. [13]
Классификация и стадии развития болезни кошачьих царапин
Международная классификация болезней 10 пересмотра кодирует заболевание как A28.1 Лихорадка от кошачьих царапин.
Клиническая классификация предполагает выделение трёх форм болезни: [10] [14]
- классическая форма (кожно-железистая) — поражение кожи и лимфатических узлов;
- атипичные формы:
- глазной вариант (окуло-гландулярная форма) — поражение глаз;
- неврологический вариант (нейро-гландулярная форма) — поражение нервной системы;
- висцеральный вариант — поражение печени, селезёнки, сердца, реже лёгких и кишечника;
- бациллярный ангиоматоз — тяжёлое течение заболевания у лиц с ослабленным иммунитетом.
Стадии развития заболевания:
- инкубационный период — длится от 5 до 60 дней (в среднем — две недели);
- инокуляция — появление первичного очага, который существует на протяжении нескольких недель;
- стадия регионального лимфаденита — наступает через 1-3 недели после появления первичного очага и длится от нескольких недель до нескольких месяцев;
- регрессирование симптомов — может продолжаться около 3-6 месяцев, иногда дольше.
Осложнения болезни кошачьих царапин
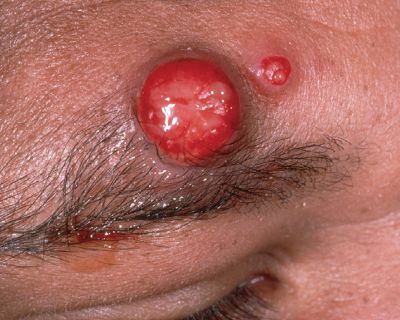
Бациллярный ангиоматоз
Наблюдается у людей с ВИЧ-инфекцией, после трансплантации сердца и почек и очень редко — у иммунокомпетентных лиц. Характеризуется длительной лихорадкой, болями в суставах, снижением массы тела и спленомегалией (увеличением селезёнки). На фоне этих проявлений возникает сыпь в виде: множественных распространённых ангиоматозных (сосудистых) и подкожных узлов, папул, похожих на пиогенную гранулёму, и эритематозных инфильтрированных бляшек диаметром от 1 мм до нескольких см. Течение тяжёлое, часто с летальным исходом. [15]
Подострый эндокардит
У части пациентов наблюдается поражение одного или несколько сердечных клапанов, эндокарда на внутренней поверхности стенок сердца или межжелудочковой перегородке, причем культуральное исследование крови не выявляет бактерий. [16] Это осложнение может сопровождаться повышением температуры, сердечной недостаточностью и одышкой.
Офтальмологические осложнения
Поражения глаз отмечаются у 2-6% пациентов и включают:
- нейроретинит — воспаление сетчатки глаза и зрительного нерва;
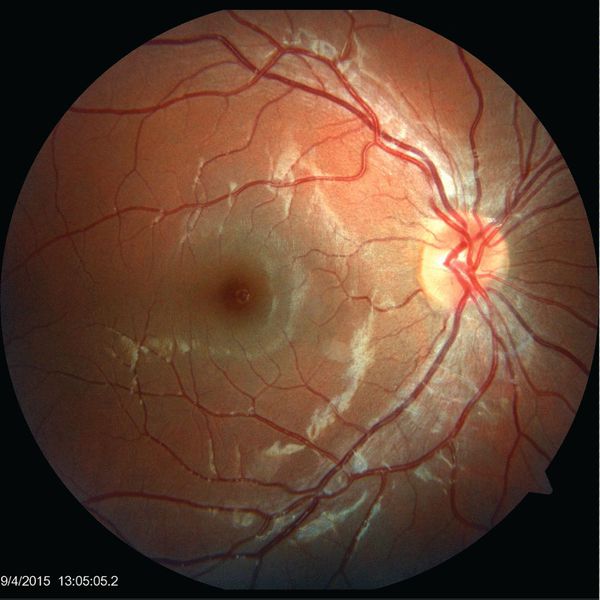
- папиллит — воспаление части зрительного нерва;
- неврит зрительного нерва;
- очаговый или многоочаговый ретинохориоидит — воспаление сосудистой оболочки глаза и сетчатки;
- панувеит — воспаление всех частей сосудистой оболочки галаза;
- окклюзию вен и артерий сетчатки, приводящую к её отслоению. [17]
Неврологические осложнения
Нарушения центральной нервной системы встречаются у 1-2% пациентов и включают атаксию, паралич черепных нервов и деменцию у пожилых людей. У детей обычно возникает энцефалит или асептический менингит. [18]
Гранулематозный гепатит и спленит (острое воспаление селезёнки)
Поражение печени и селезёнки, сопровождается генерализованной лимфаденопатией, длительной волнообразной лихорадкой, повышением уровней аминотрансфераз и множественными и диффузными гипоэхогенными зонами, определяемыми во время ультразвукового исследования и томографии. [19]
Диагностика болезни кошачьих царапин
Постановка диагноза основывается на данных анамнеза (наличие контакта с кошкой), клинических данных (присутствие первичного очага и регионального лимфаденита) и, при необходимости, данных лабораторных исследований:
- Общий анализ крови — при болезни кошачьи царапин обнаруживаются лейкоцитоз, лимфоцитоз и повышенная СОЭ.
- Полимеразная цепная реакция (ПЦР) — определение ДНК возбудителя на основе материала, взятого из первичного очага поражения или при биопсии лимфатического узла и крови. Специфичность данного обследования составляет почти 100%, но его чувствительность колеблется от 43% до 76%. [20]
- Культуральное исследование — посев материала из очагов поражения, аспирата из лимфатических узлов и крови. Специфичность анализа — 100%, чувствительность — 70-80%. [2] Метод требует специальных сред и времени (более трёх недель).
- Серологическое исследование — определение антител к B. henselae в крови методом ИФА (иммуноферментного анализа). Титры IgG менее 1:64 свидетельствуют о том, что у пациента нет текущей инфекции. Титры от 1:64 до 1:256 предполагают возможное наличие инфекции — рекомендовано повторное тестирование через 10-14 дней. Титры, превышающие 1:256, указывают на присутствие активной или недавней инфекции. Положительный тест на IgМ предполагает острое заболевание. [21]
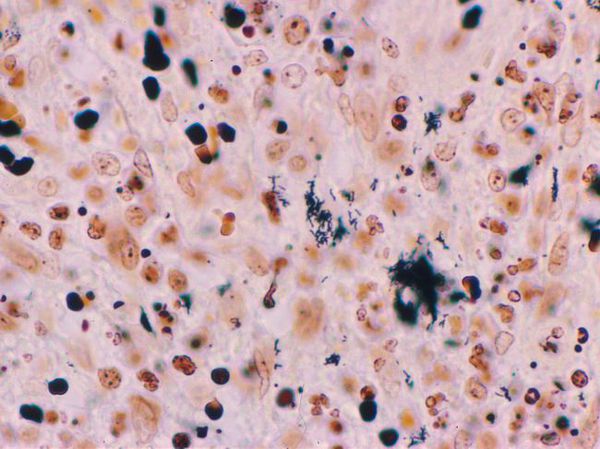
- Биопсия материала из первичного очага поражения — показывает выраженные очаги некроза в дерме, окружённые эпителиоидными и гигантскими клетками и эозинофилами. При окраске по Уортину — Старри определяются мелкие бактерии разной формы.
- Рентгенологическое исследование лимфатических узлов, УЗИ и томография печени и селезёнки — проводятся по показаниям.
- Исследование на ВИЧ-инфекцию и подсчёт количества СD4 клеток в крови — проводят при подозрении на бациллярный ангиоматоз.
Дифференциальная диагностика проводится со следующими заболеваниями:
- бактериальный гнойный лимфаденит, вызванный другими микроорганизмами;
- инфекция, вызванная атипичными микобактериями; ;
- споротрихоз;
- туляремия; ;
- саркоидоз;
- злокачественные новообразования.
Лечение болезни кошачьих царапин
Иногда в случаях стандартного течения заболевания применяют тепловой местный компресс или прибегают к физиотерапевтическому воздействию на область изменённых лимфоузлов (диатермии и УВЧ-терапии). Однако особого терапевтического эффекта эти метода не оказывают, так как большинство случаев фелиноза проходят самостоятельно, без лечения. Поэтому при классической форме болезни никаких действий предпринимать не нужно.
У некоторых пациентов могут развиться осложнения от распространения процесса. В таком случае рекомендовано назначение азитромицина, при применении которого лимфаденит регрессирует быстрее по сравнению с отсутствием лечения: [22]
- для взрослых и детей с весом > 45,5 кг: 500 мг в день, затем по 250 мг в течение четырёх дней;
- для детей с весом ≤ 45,5 кг: 10 мг/кг в первый день, затем по 5 мг/кг в течение четырёх дней.
При необходимости и наличии осложнений могут применяться другие антибиотики: пенициллины, тетрациклины, цефалоспорины и аминогликозиды и их комбинации.
Если есть нагноение, который сопровождается общими симптомами и лихорадкой, то показана аспирация гноя. Это позволит облегчить течение заболевания.
Прогноз. Профилактика
Прогноз благоприятный: при отсутствии осложнений заболевание спонтанно регрессирует без лечения в течение 3-4 месяцев. Тяжёлые формы заболевания встречаются крайне редко.
Меры профилактики, рекомендованные Центрами по контролю и профилактике заболеваний США: [23]
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований.
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований. Поскольку выделить возбудитель от больных не удавалось в течение длительного времени, первоначально предполагалась вирусная или хламидийная этиология заболевания. Первые убедительные сведения об идентификации возбудителя БКЦ были получены только в 1983 г., когда исследователи, используя метод окраски по Warthin-Starry (метод серебрения), обнаружили в ткани пораженных лимфатических узлов у 29 из 34 больных БКЦ мелкие полиморфные грамотрицательные бациллы, которые удалось культивировать лишь в 1988 г. Именно этот микроорганизм первоначально был признан возбудителем БКЦ и получил название Alipia felis.
Тем не менее многочисленные последующие исследования не подтвердили четкой взаимосвязи развития БКЦ с A. felis: в большинстве случаев у больных в пораженных тканях не только не обнаруживался указанный возбудитель, но и в сыворотке крови не выявлялись антитела к нему. Более того, из ткани пораженных лимфоузлов был изолирован еще один возбудитель — Bartonella henselae. Методом ПЦР с применением специфических праймеров к Bartonella spp. и A. felis у больных, у которых кожный тест на БКЦ оказался положительным, было установлено, что в 96% случаев у них обнаруживалась ДНК Bartonella, тогда как ДНК A. felis не выявлялась ни в одном случае (A. Bergmans et al., 1995). Сходные данные, подтверждающие ключевую роль B. henselae в развитии БКЦ, были получены и другими исследователями при использовании непрямой реакции флюоресцирующих антител.
В то же время первоначальный факт обнаружения A. felis в пораженных лимфатических узлах игнорироваться не должен. На сегодняшний день некоторые исследователи допускают, что A. felis способен вызывать заболевание, которое по своей клинической картине может напоминать БКЦ.
Болезнь кошачьей царапины (лимфоретикулез доброкачественный) относится к группе бартонеллезов и характеризуется как нетяжелое самокупирующееся заболевание с развитием одностороннего лимфаденита, регионарного по отношению к месту инокуляции возбудителя, и только в редких случаях возможна диссеминация возбудителя с поражением центральной нервной системы и висцеральных органов.
B. henselae характеризуется как небольшая плеоморфная, грамотрицательная бацилла, весьма требовательная к условиям культивирования (растет только на средах с 5% кровяного агара при температуре от 35 до 37°С, с 5—10% углекислого газа и 40-процентной влажностью). Кроме этого, колонии первичной культуры растут медленно и становятся видимыми только после 9—15 дней роста. При последующем пассаже рост колоний ускоряется. Идентификация выделенного возбудителя проводится с использованием специфических антисывороток, определением профиля жирных кислот клеточной стенки или молекулярно-генетическим методом. С помощью этого метода было идентифицировано два генотипа B. henselae, хотя до сих пор четкой зависимости между генотипами возбудителя и особенностями клинического течения вызываемых ими заболеваний не установлено.
B. henselae на сегодняшний день рассматривается как основной возбудитель БКЦ, однако у 5—15% больных с диагнозом, установленным на основании клинико-эпидемиологических данных, даже с помощью существующих современных методов лабораторной диагностики этиологическое значение B. henselae в развитии заболевания не подтверждается.
Один из необъяснимых парадоксов, связанных с B. henselae: в последние годы установлено, что данный возбудитель ответственен за развитие не только БКЦ, но и некоторых других заболеваний.
БКЦ имеет широкое географическое распространение и встречается практически повсеместно. Основным естественным резервуаром B. henselae являются кошки, инфицированность которых в значительной степени определяет распространенность БКЦ (K. M. Zangwill et al., 1993). По данным некоторых исследователей, у более чем 50% домашних и диких кошек обнаруживается бактериемия, обусловленная B. henselae. В ходе исследования, проведенного в США, установлено, что наиболее высокий процент инфицированности кошек и, соответственно, заболеваемости БКЦ среди людей регистрируется в южных штатах. Большинство исследователей подчеркивают особую роль котят в передаче возбудителя, указывая, что у взрослых кошек редко выявляется бактериемия B. henselae за счет наличия у них специфических антител, свидетельствующих о длительности их инфицирования. Особенностью течения бартонеллеза у кошек является его продолжительность (месяцы, годы) и бессимптомность (даже в случае подтверждаемой бактериемии).
В циркуляции B. henselae среди кошек исключительную роль играют блохи (Ctenocephalides felis). Экспериментальным путем было установлено, что при отсутствии блох инфицирования здоровых кошек не происходит.
B. henselae обнаруживается в кишечнике блох и их испражнениях в течение 9 дней после инфицирования, что свидетельствует о его репликации и персистенции в организме блох. Кроме этого, экспериментально была установлена возможность инфицирования кошек путем внутрикожной инокуляции инфицированных испражнений блох, в то же время оральное введение кошкам инфицированных блох и их испражнений к сероконверсии не приводило. Роль блох в передаче возбудителя от кошек к человеку в настоящее время категорически не отрицается. В последние годы исследователями в США и Италии (Y. O. Sanogo et al., 2003) молекулярно-генетическими методами было продемонстрировано, что ДНК B. henselae может обнаруживаться в иксодовых клещах, хотя их роль в качестве вектора передачи возбудителя БКЦ по-прежнему не изучена.
Эпидемиологические исследования показывают, что в сыворотке крови около 20% владельцев кошек и 3–4% общей популяции людей обнаруживаются антитела к B. henselae. Семейные случаи заболевания БКЦ не столь типичны и регистрируются менее чем у 5% пациентов. Хотя БКЦ может развиваться в любом возрасте, чаще заболевают молодые люди (до 18 лет).
Передача возбудителя БКЦ реализуется главным образом контактным путем через царапины, укусы или слюну инфицированных кошек. Подъем заболеваемости, как правило, отмечается с конца лета, что объясняется особенностями жизненного цикла у кошек и блох.
Поскольку возбудитель БКЦ был идентифицирован относительно недавно, многие аспекты, касающиеся патогенеза заболевания, до сих пор недостаточно изучены. Характер развивающегося инфекционного процесса, обусловленного действием B. henselae, в значительной степени зависит от иммунного статуса человека: в тех случаях, когда заболевание развивается у иммунокомпетентных пациентов, диссеминация возбудителя отсутствует, и процесс преимущественно ограничивается локальными или регионарными поражениями. В частности, БКЦ в большинстве случаев проявляется развитием регионарной лимфаденопатии. Поражение висцеральных органов описано только в отдельных случаях (Dunn et al., 1997), а бактериемия у иммунокомпетентных пациентов регистрируется исключительно редко (Slater et al., 1990). Напротив, у иммунокомпрометированных пациентов для инфекции B. henselae типично развитие бактериемии и других системных поражений, включая бациллярный ангиоматоз и бациллярный пелиозный гепатит, а у лиц с врожденными и приобретенными аномалиями клапанов сердца — эндокардит (Raoult et al., 1996).
Гистологические изменения в пораженных лимфатических узлах характеризуются пролиферацией гистиоцитов и B-лимфоцитов, приводящей к образованию гранулем с последующей нейтрофильной инфильтрацией и развитием центрального или звездчатого некроза.
Хотя B. henselae и считается одним из наиболее вероятных возбудителей БКЦ, тем не менее, согласно современным наблюдениям, данный возбудитель ответственен за развитие ряда других патологических состояний человека (табл. 1). При этом иммунный статус больных рассматривается как ключевой фактор, определяющий характер формирующегося заболевания, хотя известны случаи, когда даже у лиц с ВИЧ-инфекцией в стадии СПИДа БКЦ протекала в типичной форме.
Инкубационный период у больных с БКЦ может варьировать в достаточно широких пределах — от 3 до 20 дней и более, составляя в среднем 1–2 нед. Хотя общепринятой клинической классификации БКЦ нет, чаще всего выделяют типичную и атипичные формы заболевания (табл. 2), что определяется по доминирующему в клинической картине болезни синдромокомплексу.
В типичных случаях БКЦ проявляется развитием первичного аффекта и регионарного (к месту входных ворот инфекции) лимфаденита. Локализация первичного аффекта определяется местом первичной инокуляции возбудителя, а именно местом нанесения кошкой царапин и укусов. По истечении нескольких дней (от 3 до 10), когда нанесенные кошкой повреждения кожи уже заживают, в месте входных ворот формируется папула, которая, как правило, трансформируется в везикулу и далее в пустулу, а после вскрытия — в язвочку, покрытую корочкой. В некоторых случаях пустула может подсыхать без образования язвочки. В диаметре размер формирующейся папулы, как правило, составляет от 1–2 до 5 мм. Частота выявления первичного аффекта у больных БКЦ, по данным различных исследователей, может колебаться от 25 до 94%. Кожные проявления сохраняются в течение 1—3 нед и спонтанно разрешаются.
Регионарный лимфаденит является одним из наиболее постоянных и характерных клинических признаков БКЦ (табл. 3) и сохраняется в течение длительного времени: от 7 до 60 дней, а в отдельных случаях до 1 года и даже 3 лет. В большинстве случаев лимфаденит разрешается в течение 1—4 мес. Нередко он оказывается практически единственным проявлением БКЦ. В большинстве случаев (85%) у больных выявляются одиночные лимфатические узлы, реже множественные, в границах одной анатомической области. Несмотря на то что у больных регистрируется увеличение лимфатических узлов, осуществляющих дренаж места первичной инокуляции возбудителя, развитие лимфангоита не характерно для БКЦ. У 1/3 пациентов могут определяться увеличенные лимфатические узлы разных анатомических областей, хотя генерализованная лимфаденопатия встречается достаточно редко. Размером увеличенные лимфатические узлы чаще бывают от 1 до 5 см, в некоторых случаях до 8—10 см. При пальпации лимфатические узлы умеренно болезненные. Хотя они и не спаяны с окружающими тканями, нередко определяется гиперемия кожных покровов над ними. В 10—50% случаев у больных БКЦ развивается нагноение пораженных лимфатических узлов с образованием густого желто-зеленого гноя. В отдельных случаях при посеве гноя на питательные среды удается получить рост стафилококков и другой флоры, хотя роль условно-патогенной флоры (суперинфекция) в нагноении пораженных лимфатических узлов пока не установлена.
Общее состояние больных в большинстве случаев остается удовлетворительным. Только в трети случаев у больных отмечается повышение температуры тела свыше 38,3°С, которое сохраняется около недели и лишь иногда может затягиваться до месяца и более. Среди других клинических проявлений БКЦ могут отмечаться: слабость и недомогание (30%), головная боль (14%), тошнота и рвота (15%), спленомегалия (11%). В случае длительного течения заболевания у больных может наблюдаться потеря веса. Нередко заболевание приобретает волнообразное течение.
Поражение нервной системы (неврологический вариант) у больных БКЦ выявляется редко (~2% случаев), хотя диапазон клинических проявлений весьма разнообразен: у больных могут выявляться радикулиты, полиневриты, миелит, энцефалопатия, энцефалит, менингит и церебральная атаксия. Характерным признаком поражения нервной системы при БКЦ является то, что они развиваются спустя 1—6 нед (чаще 2–3 нед) от момента появления лимфаденопатии. Для развития энцефалита и менингита типично внезапно возникающее ухудшение состояния больного, сопровождающееся лихорадкой, головной болью, спутанностью сознания и дезориентацией. В некоторых случаях состояние может прогрессивно ухудшаться, вплоть до развития комы. В ликворе у таких больных определяется мононуклеарный плеоцитоз. Только в отдельных случаях у больных после перенесенного энцефалита могут отмечаться резидуальные явления.
Некоторые авторы (P. M. Delahoussaye, B. M. Osborne, 1990), указывая на возможность поражения печени и селезенки при БКЦ, выделяют висцеральный вариант заболевания, для которого характерны длительная волнообразная лихорадка, увеличение размеров печени и селезенки, повышение в сыворотке крови уровней аминотрансфераз, с определением при УЗИ и компьютерной томографии множественных, диффузных, гипоэхогенных дефектов. Довольно часто у таких больных отмечается генерализованная лимфаденопатия.
Кроме этого, в более редких случаях у больных БКЦ могут выявляться абсцесс селезенки, плеврит, эндокардит, пневмония, узловатая эритема, тромбоцитопеническая пурпура, остеомиелит (B. Dzelalija et al., 2001, C. V. Hulzebos et al., 1999).
В типичных случаях первичная диагностика БКЦ не представляет больших сложностей, поскольку основывается на характерных клинико-эпидемиологических данных (табл. 4).
Определенные сложности имеются при лабораторной верификации диагноза, что связано с отсутствием соответствующей лабораторной базы. В зарубежной практике длительное время в качестве основного диагностического критерия БКЦ использовался кожный тест, в котором в качестве аллергена применялся термоинактивированный пунктат, полученный из лимфоузлов больных с установленным (в соответствии с принятыми критериями) диагнозом БКЦ. По данным многих авторов, результативность такого теста достигала 95—98%, однако из-за риска передачи гемоконтактных инфекций использование данного теста ограничено, а кожного теста с использованием очищенных антигенов B. henselae пока не описано.
Микробиологические исследования в широкой практике не применяются ввиду длительности (от 2 до 6 нед) и сложности проведения анализа.
Достаточно информативным способом установления диагноза является биопсия папул и/или пораженных лимфатических узлов с последующим гистологическим исследованием (окрашивание срезов гематоксилин-эозином и серебром — метод Warthin-Starry), позволяющим выявить характерные гистологические признаки поражения и скопление мелких плеоморфных бактерий.
В последние годы большое внимание уделяется разработке специфических иммунологических (ИФА) и молекулярно-генетических (идентификация гена 16S рибосомальной РНК B. henselae) методов обнаружения возбудителя БКЦ в биопсийном материале больного, хотя пока для широкой практики они по-прежнему недоступны.
Дифференциальный диагноз необходимо проводить с заболеваниями, сопровождающимися развитием лимфаденопатии (табл. 5).
Несмотря на то что в редких случаях отмечаются варианты тяжелого течения БКЦ, у иммунокомпетентных лиц прогноз заболевания благоприятный. Повторных случаев и летальных исходов не описано.
Многочисленные клинические наблюдения показывают, что в большинстве случаев БКЦ протекает как самокупирующаяся инфекция, и применение антибактериальной терапии не оказывает существенного влияния на ее течение. Традиционные рекомендации по применению эритромицина (эритромицин-тева, зинерит) и доксициклина (юнидокс солютаб, медомицин, вибрамицин, тетрадокс) основаны на эффективности этих препаратов у больных с ВИЧ-инфекцией при развитии бациллярного ангиоматоза, вызываемого Bartonella quintana, тогда как у больных БКЦ терапевтическая эффективность указанных препаратов не подтверждена ни в одном исследовании. Весьма противоречивыми остаются данные по соответствию чувствительности in vitro возбудителя БКЦ к антибактериальным препаратам и их клинической эффективности. Единственным антибактериальным препаратом, клиническая эффективность которого была установлена в ходе рандомизированного плацебо-контролируемого исследования, является азитромицин (сумамед, хемомицин, азивок, сумазид), назначаемый в течение 5—10 дней. В неконтролируемых исследованиях (A. M. Margileth, 1992) из 18 антимикробных препаратов клиническая эффективность была установлена только при применении рифампицина (бенемицин, р-цин), ципрофлоксацина (ципросан, цифран, ципрова), гентамицина (гентамицин К, гентамицина сульфат) и триметопримсульфаметоксазола (бактрим, септрин). Антибактериальные препараты при БКЦ следует применять у иммунокомпрометированных лиц и при тяжелом течении заболевания, сопровождающегося поражением нервной системы и висцеральных органов.
В случае выявления флуктуации в пораженном лимфатическом узле требуется его пункция и аспирация гноя, что ускоряет последующий процесс склерозирования и рубцевания ткани лимфатического узла и влияет в конечном итоге на выздоровление пациента.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ).
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ). Практикующие врачи в своей повседневной практике чаще сталкиваются с клинически манифестными формами первичной Эпштейна–Барр-вирусной инфекции (ЭБВИ) в виде острой, как правило, не верифицированной респираторной инфекцией (более 40% случаев) или инфекционным мононуклеозом (около 18% всех заболеваний) [1, 2]. В большинстве случаев эти заболевания протекают доброкачественно и заканчиваются выздоровлением, но с пожизненной персистенцией ВЭБ в организме переболевшего [1, 3–5].
Однако в 10–25% случаев первичное инфицирование ВЭБ, протекающее бессимптомно, и острая ЭБВИ могут иметь неблагоприятные последствия [6–9] с формированием лимфопролиферативных и онкологических заболеваний, синдрома хронической усталости, ВЭБ-ассоциированного гемофагоцитарного синдрома и др. [7, 9, 11–14].
До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ВЭБ. Перед врачом, к которому обращается пациент с острой ЭБВИ, всегда встает вопрос: что предпринять в каждом конкретном случае, чтобы максимально снизить риск развития хронической ЭБВИ и ВЭБ-ассоциированных патологических состояний Этот вопрос не праздный, и ответить на него действительно очень трудно, т. к. до сих пор нет четкой патогенетически обоснованной схемы лечения больных, а имеющиеся рекомендации часто противоречат друг другу.
По мнению многих исследователей, лечение ЭБВИ-мононуклеоза (ЭБВИМ) не требует назначения специфической терапии [15–17]. Лечение больных, как правило, проводится в амбулаторных условиях, изоляция пациента не требуется. Показаниями к госпитализации следует считать длительную лихорадку, выраженный синдром тонзиллита и/или синдром ангины, полилимфаденопатию, желтуху, анемию, обструкцию дыхательных путей, боли в животе и развитие осложнений (хирургических, неврологических, гематологических, со стороны сердечно-сосудистой и дыхательной системы, синдром Рейе).
При легком и среднетяжелом течении ЭБВ ИМ больным целесообразно рекомендовать палатный или общий режим с возвращением к обычной деятельности на адекватном для каждого конкретного больного физическом и энергетическом уровне. Проведенное многоцентровое исследование показало, что необоснованно рекомендуемый строгий постельный режим удлиняет период выздоровления и сопровождается длительным астеническим синдромом, требующим нередко медикаментозного лечения [18].
При легком течении ЭБВ ИМ лечение больных ограничивается поддерживающей терапией, включающей адекватную гидратацию, полоскание ротоглотки раствором антисептиков (с добавлением 2% раствора лидокаина (ксилокаина) при выраженном дискомфорте в глотке), нестероидные противовоспалительные препараты, такие как парацетамол (Ацетаминофен, Тайленол). По мнению ряда авторов назначение блокаторов Н2 рецепторов, витаминов, гепатопротекторов и местная обработка миндалин различными антисептиками являются малоэффективными и необоснованными способами лечения [19, 20]. Из экзотических методов лечения следует упомянуть рекомендуемое Ф. Г. Боковым и соавт. (2006) применение мегадоз бифидобактерий при лечении больных острым мононуклеозом [21].
Мнения о целесообразности назначения антибактериальных препаратов при лечении ЭБВИМ весьма противоречивы. По мнению Gershburg E. (2005) тонзиллит при ИМ часто асептический и назначение антибактериальной терапии не оправдано. Также нет смысла в применении антибактериальных средств при катаральной ангине [4]. Показанием для назначения антибактериальных препаратов является присоединение вторичной бактериальной инфекции (развитие у больного лакунарной или некротической ангины, таких осложнений, как пневмония, плеврит и др.), о чем свидетельствуют сохраняющиеся более трех суток выраженные воспалительные изменения показателей крови и фебрильная лихорадка. Выбор препарата зависит от чувствительности микрофлоры на миндалинах больного к антибиотикам и возможных побочных реакций со стороны органов и систем.
По данным H. Fota-Markowcka et al. (2002) у больных чаще выделяют гемофильную палочку, стафилококк и пиогенный стрептококк, реже — грибы рода Candida [22], поэтому следует признать обоснованным назначение этим больным препаратов из группы цефалоспоринов 2–3 поколения, линкосамидов, макролидов и противогрибковых средств (флуконазол) в терапевтических дозах на 5–7 дней (реже — 10 дней) [4]. Некоторые авторы при наличии некротической ангины и гнилостном запахе изо рта, вызванных, вероятно, ассоциированной анаэробной флорой, рекомендуют использовать метронидазол по 0,75 г/сут, разделенных на 3 приема, в течение 7–10 дней.
Противопоказаны препараты из группы аминопенициллинов (ампициллин, амоксициллин (Флемоксин Солютаб, Хиконцил), амоксициллин с клавуланатом (Амоксиклав, Моксиклав, Аугментин)) из-за возможности развития аллергической реакции в виде экзантемы. Появление сыпи на аминопенициллины не является IgE-зависимой реакцией, поэтому применение блокаторов Н1 гистаминовых рецепторов не имеет ни профилактического, ни лечебного эффекта [19].
По мнению ряда авторов до настоящего времени сохраняется эмпирический подход к назначению глюкокортикостероидов больным с ЭБВИ [23]. Глюкокортикостероиды (преднизолон, преднизон (Делтазон, Метикортен, Оразон, Ликвид Пред), Солу Кортеф (гидрокортизон), дексаметазон) рекомендуются больным с тяжелым течением ЭБВИМ, с обструкцией дыхательных путей, неврологическими и гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [4, 24]. Суточная доза преднизолона составляет 60–80 мг в течение 3–5 дней (реже 7 дней) с последующей быстрой отменой препарата. Одинаковой точки зрения на назначение этим больным глюкокортикостероидов при развитии миокардита, перикардита и поражениях ЦНС нет.
При тяжелом течении ЭБВИМ показана внутривенная дезинтоксикационная терапия, при разрыве селезенки — хирургическое лечение.
Наиболее дискуссионным остается вопрос о назначении противовирусной терапии больным с ЭБВИ. В настоящее время известен большой перечень препаратов, являющихся ингибиторами ВЭБ репликации в культуре клеток [4, 25–27].
I. Подавляющие активность ДНК-полимеразы ВЭБ:
- ациклические аналоги нуклеозидов (ацикловир, ганцикловир, пенцикловир, валацикловир, валганцикловир, фамцикловир);
- ациклические аналоги нуклеотидов (цидофовир, адефовир);
- аналоги пирофосфатов (Фоскарнет (фоскавир), фосфоноацетиловая кислота);
- 4 оксо-дигидрохинолины (возможно).
II. Различные соединения, не ингибирующие вирусной ДНК-полимеразы (механизм изучается): марибавир, бета-L-5 урацил йододиоксолан, индолокарбазол.
Однако проведенный метаанализ пяти рандомизированных контролируемых испытаний с участием 339 больных ЭБВИМ, принимавших ацикловир (Зовиракс), показал неэффективность препарата [28, 29].
Одна из возможных причин кроется в цикле развития ВЭБ, в котором ДНК вируса имеет линейную либо циркулярную (эписома) структуру и размножается в ядре клетки хозяина. Активная репликация вируса происходит при продуктивной (литической) стадии инфекционного процесса (ДНК ВЭБ линейной формы). При острой ЭБВИ и активации хронической ЭБВИ происходит цитолитический цикл развития вируса, при котором он запускает экспрессию собственных ранних антигенов и активирует некоторые гены клеток макроорганизма, продукты которых участвуют в репликации ВЭБ. При латентной ЭБВИ ДНК вируса имеет вид эписомы (круговой суперспиральный геном), находящейся в ядре. Циркулярный геном ДНК ВЭБ характерен для CD21+ лимфоцитов, в которых даже при первичном инфицировании вирусом практически не наблюдается литической стадии инфекционного процесса, а ДНК воспроизводится в виде эписомы синхронно с клеточным делением инфицированных клеток. Гибель пораженных ВЭБ В лимфоцитов связана не с опосредованным вирусом цитолизом, а с действием цитотоксических лимфоцитов [4].
При назначении противовирусных препаратов при ЭБВИ врач должен помнить, что их клиническая эффективность зависит от правильной трактовки клинических проявлений болезни, стадии инфекционного процесса и цикла развития вируса на этой стадии. Однако не менее важным является и тот факт, что большинство симптомов ЭБВИ связаны не с прямым цитопатическим действием вируса в инфицированных тканях, а с опосредованным иммунопатологическим ответом ВЭБ-инфицированных В лимфоцитов, циркулирующих в крови и находящихся в клетках пораженных органов. Именно поэтому аналоги нуклеозидов (ацикловир, ганцикловир и др.) и ингибиторы полимеразы (Фоскарнет), подавляющие репликацию ВЭБ и уменьшающие содержание вируса в слюне (но не санирующие ее полностью [4], не оказывают клинического эффекта на тяжесть и продолжительность симптомов ЭБВИМ.
Показаниями для лечения ЭБВИМ противовирусными препаратами являются: тяжелое, осложненное течение болезни, необходимость профилактики ВЭБ-ассоциированной В-клеточной лимфопролиферации у иммунокомпрометированных пациентов, ВЭБ-ассоциированная лейкоплакия. Bannett N. J., Domachowske J. (2010) рекомендуют применять ацикловир (Зовиракс) внутрь в дозе 800 мг внутрь 5 раз в сутки в течение 10 дней (или 10 мг/кг каждые 8 часов в течение 7–10 дней). При поражениях нервной системы предпочтителен внутривенный способ введения препарата в дозе 30 мг/кг/сут 3 раза в сутки в течение 7–10 дней.
По мнению E. Gershburg, J. S. Pagano (2005), если под действием каких-либо факторов (например, иммуномодуляторов, при ВЭБ-ассоциированных злокачественных опухолях — применение лучевой терапии, гемцитабина, доксорубицина, аргинина бутирата и др.) удается перевести ДНК ВЭБ из эписомы в активную репликативную форму, т. е. активировать литический цикл вируса, то в этом случае можно ожидать клинический эффект от противовирусной терапии.
В комплексной терапии рекомендуется внутривенное введение иммуноглобулинов (Гаммар-П, Полигам, Сандоглобулин, Альфаглобин и др.) 400 мг/кг/сут, № 4–5.
В последние годы все чаще для лечения ЭБВИ стали применять рекомбинантные альфа-интерфероны (Интрон А, Роферон-А, Реаферон-ЕС) по 1 млн ME в/м в течение 5–7 дней или через день; при хронической активной ЭБВИ — 3 млн ME в/м 3 раза в неделю, курс 12–36 недель.
Медикаментозная коррекция астенического синдрома при хронической ЭБВИ включает назначение адаптогенов, высоких доз витаминов группы В, ноотропных препаратов, антидепрессантов, психостимуляторов, препаратов с прохолинергическим механизмом действия и корректоров клеточного метаболизма [30–32].
Залогом успешного лечения больного с ЭБВИ являются комплексная терапия и строго индивидуальная тактика ведения как в стационаре, так и во время диспансерного наблюдения.
Литература
И. В. Шестакова, доктор медицинских наук, доцент
Н. Д. Ющук, доктор медицинских наук, профессор, академик РАМН
МГМСУ, Москва
Читайте также:

