Инфекция головного мозга у новорожденных последствия
Обновлено: 25.04.2024
Острый бактериальный менингит у новорожденного и детей: причины, клиника, диагностика
Каждый год более 1,2 миллиона людей заболевают острым бактериальным менингитом, причем более чем 170 тысяч случаев имеют летальный исход, большинство из которых приходится на детский возраст (ВОЗ, 1998,2008). Несмотря на новые антибиотики и лечение, смертность за последние 20 лет по существу осталась неизменной. Среди выживших, примерно у половины имеются неврологические или другие осложнения после заболевания. Несколько факторов способствует этой неутешительной ситуации: отсроченная постановка диагноза из-за неспецифического характера симптомов, появление устойчивых штаммов болезнетворных микроорганизмов, слабость иммунологической защиты новорожденных детей, и отсутствие возможности предотвратить ущерб от воспалительного ответа хозяина посредством добавочных нейропротекторных или противовоспалительных механизмов.
а) Эпидемиология. Относительная заболеваемость острым бактериальным менингитом изменяется соответственно возрасту, социальным условиям жизни, географическому местоположению и политике иммунизации. В развитых странах за прошлое десятилетие эпидемиология острого бактериального менингита претерпела разительную перемену, и уровень заболеваемости снизился приблизительно до 4-5 случаев на 100000 населения, тогда как во многих развивающихся странах он остается высоким в пределах 40-50 случаев на 100000.
Вакцинация вызвала радикальное изменение в относительной частоте трех основных патогенных микроорганизмов — Haemophilus influenzae, Neisseria meningitidis и Streptococcus pneumoniae. H. influenzae тип В (HiB) был наиболее распространенным возбудителем детского бактериального менингита в Великобритании, с показателями заболеваемости в пределах 21-44 на 100000 среди детей до пяти лет, с пиковым возрастом 6-7 месяцев и коэффициентами смертности 2,4-4,3% (Вооу и Мохon, 1993; Вооу et al., 1993; Anderson et al., 1995; Heath и Me Vernon, 2002). После введения в начале 1990-х во многих странах комбинированной белково-полисахаридной вакцины против HiB, число случаев гемофильного менингита снизилось более чем на 90% (Schuchat et al., 1997), и S. pneumoniae и N. meningitides стали самыми обычными болезнетворными микроорганизмами.
В настоящее время в Европе уровень распространенности пневмококкового менингита составляет примерно 0,5 на 100000 населения; связанная с ним смертность 25%, но может достигать 45% среди очень молодых. Более чем у 30% выживших остаются постоянные неврологические осложнения (Lexau et al., 2005). Эта картина существенно хуже в развивающихся странах. Существует сезонное изменение с пиком в зимние месяцы. Дети младшего возраста наиболее подвержены риску, и 60% случаев приходится на возраст до двух лет. Комбинированная семивалентная белково-полисахаридная пневмококковая вакцина стала доступной в 2000 г. и была включена в британский национальный календарь прививок с 2006 г.
В тех странах, где эта вакцина включена в программу иммунизации, наблюдалось разительное снижение уровня инвазивной пневмококковой болезни, с сохранением N. meningitidis в качестве основного патогенного микроорганизма. Уровень заболеваемости N. meningitidis составляет около 1-3 на 100000 населения в Европе с самими обычными серотипами группы В и С. Вакцинация доступна, но пока еще только для групп А, С, Y и W135. C комбинированной полисахаридно-белковой вакциной против группы С. Она была включена в протокол иммунизации во многих развитых странах после введения в Великобритании в 1999 г. В Северной Америке недавно запущена 4-валентная вакцина для других групп (А, С, Y и W135) (Расе и Pollard, 2007).
Еще одной проблемой эпидемиологии стало появление резистентных к лекарственным средствам штаммов патогенных микроорганизмов, среди которых серьезную опасность представляет резистентный к пенициллину пневмококк (ПРП), встречающийся благодаря мутациям в одном или нескольких пенициллин-связывающих белках. Появление ПРП непосредственно связано распространением антибактериальных средств, и в определенных странах проблема больше, чем в других. В настоящее время в Великобритании менее 3% пневмококков являются ПРП, а в Испании, США и Южной Африке показатели выше. Резистентность пневмококков проверяется лабораторным анализом минимальной концентрации ингибитора (Minimum Inhibitory Concentration, MIC), и может быстро определяться с помощью специальных тестов с ПЦР для определения гена связывающего белка пенициллина 2b (ПРП2b). Устойчивость к пенициллину и хлорамфениколу при менингококковой инфекции также увеличивается, но к счастью, остается редкой.
б) Патофизиология и иммунология. Эффективная инвазия инфекции в ЦНС включает 4 стадии: в первой происходит, адгезия и колонизация патогенных микроорганизмов, часто из комменсалов носоглотки; вторая представляет собой инвазию в слизистую оболочку с последующим размножением и бактериемией; третья состоит в проникновении в подпаутинное пространство с преодолением ГЭБ, с пока еще не установленным механизмом; и наконец, размножение патогенов в подпаутинном пространстве, вызывающее воспалительный ответ хозяина.
• Адгезия и колонизация. Точные механизмы, посредством которых бактерии прикрепляются и проникают в слизистую оболочку, все еще неясны. Вовлекаются многочисленные поверхностные белки микроорганизмов (например, холиновые связывающие белки, сиаловая кислота и нейраминидаза на S. pneumoniae и К1-полисахарид на Е. coli) (Koedel et al„ 2002) и специфические рецепторы хозяина (например, pIgR). В случае менингококка пили прикрепляется к рецепторам CD46 и 66 клеток слизистой оболочки.
• Инвазия и размножение. Поверхностные белки (например, Psp А и С) и капсула пневмококков помогают сопротивляться фагоцитозу и разрушению комплиментом, для того, чтобы преодолеть защиту хозяина и выжить в пределах кровотока.
• Внедрение в ЦНС. Для проникновения патогенов в ЦНС должны быть нарушены ГЭБ и барьер между кровью и спинномозговой жидкостью (СМЖ). В этот процесс вовлечены различные гликоконъюгаты и рецепторы (например, фактор активации тромбоцитов). Было продемонстрировано, что количество бактерий в заражающем материале крови важно для возникновения менингита у экспериментальных животных, и это может также иметь место у людей (Moxon et al., 1974).
• Размножение. В СМЖ, в области ослабленной защиты хозяина, выживание и размножение патогенов наиболее вероятны. Тем не менее, их присутствие стимулирует перемещение лейкоцитов в СМЖ посредством многошагового процесса, включающего в себя различные адгезивные молекулы и лиганды (например, селектины и интегрины) с миграцией по градиенту хемотаксиса. При разрушении болезнетворных микроорганизмов запускается воспалительный каскад, который приводит к вторичному повреждению ткани. Стимуляция происходит через клеточую стенку (например, LPS у грамотрицательных микроорганизмов, таких как N. meningitidis и Н. influenzae и пептидогликаны у грамположительных микроорганизмов, таких как S. pneumoniae) (Tuomanen et al., 1985), прямо от пневмолизина (Friedland et al., 1995), и непосредственно через бактериальную ДНК (Deng et al., 2001). Через несколько часов запускаются провоспалительные цитокины, включая ФНО-α (TNFα) (Bazzoni и Beutler, 1996) и интерлейкины 1β, 6 и 8.
Они ускоряют каскад других цитокинов, хемокинов, протеолитических ферментов и реактивных кислородных радикалов и промежуточных форм азота из макрофагов, нейтрофилов и тромбоцитов. В экспериментах на крысах назначение дексаметазона и антиоксидантов показало частичное уменьшение эффекта (Auer et al, 2000). Гиперемия сосудов и повышение проницаемости кровеносных сосудов приводит к цитотоксическому и вазогенному отеку ткани мозга и увеличенному внутричерепному давлению (ВЧД), что в дальнейшем снижает церебральное перфузионное давление (ЦПД), увеличивая риск вклинения и необратимого повреждения головного мозга. Объем СМЖ увеличивается в течение первых двух или трех дней болезни (Ashwal et al., 1992), и уровни эндотоксинов (Mertsola, 1991) и других цитокинов (Arditi et al., 1989) коррелируют с тяжестью расстройств (Dulkerian et al., 1995). Частым осложнением является васкулит, приводящий к инфаркту в 2-19% случаев. Уровень мозгового кровообращения снижен на 30-70% у 30% пациентов (Ashwal et al., 1992), но авторегуляция кровообращения в основном сохранена (Ashwal et al., 1990).
Отек (цитотоксический, вазогенный и межуточный) встречается часто, как изолированно, так и с острой обструктивной гидроцефалией, обусловленной гнойным экссудатом в полостях, и может вызывать внутричерепную гипертензию и вторичное выбухание мозговой ткани. Это в свою очередь может еще больше препятствовать мозговому кровообращению (Minns et al., 1989), запуская порочный круг. Также происходит повреждение нейронов путем апоптоза, особенно в зубчатой извилине гиппокампа. Это имеет особое значение, поскольку есть доказательства, что это повреждение — причина связанных с менингитом трудностей в обучении (Loeffler et al., 2001). В экспериментах на животных гиппокампальное повреждение существенно уменьшалось в результате блокады активации каспазы-3 или управления специфическими каспаза-3-ингибиторами (Braun et al., 1999). Появление менингеального выпота может привести к хронической гидроцефалии, особенно у детей младшего возраста.
Гидроцефалия также может быть результатом стеноза сильвиева водопровода, который может возникнуть вследствие вентрикулита. Последний чрезвычайно распространен среди новорожденных и был выявлен в 92% патологоанатомических исследований (Berman и Banker, 1966), но также присутствует и у детей старшего возраста в более низкой пропорции (приблизительно 10%).

г) Клинические проявления и диагностика. Важность ранней постановки диагноза очевидна. Тем не менее, поздняя диагностика остается частой, потому что менингит относительно редко распознается в общей практике в сравнении с частыми, главным образом, вирусными, заболеваниями, сопровождающимися лихорадкой. Часто менингиту в течение нескольких дней предшествует лихорадка, поэтому невозможно определить его фактическое начало; в результате 33-40% пациентов до постановки диагноза получали антибиотики (Kaplan et al., 1986). Характер начала заболевания имеет важное прогностическое значение: прогрессирующее начало, сливающееся с предыдущими проявлениями болезни, часто прогнозирует благоприятный исход, в то время как молниеносное начало неблагоприятно (Radetsky, 1992, Kilpi et al., 1993). Лихорадка, тошнота, головная боль, сопровождающаяся рвотой, вялость и некоторое расстройство сознания (чаще умеренное оцепенение, чем кома) указывают на диагноз (Gururaj et al., 1973). Ригидность мышц шеи, а иногда также мышц спины, и симптом Кернига требуют выполнения люмбальной пункции.
На очень ранних стадиях единственными симптомами могут быть раздражительность и перемены настроения в сочетании с лихорадкой. Генерализованные припадки встречаются у 30-40% детей с острым бактериальным менингитом, особенно среди детей младше четырех лет. В одном исследовании 328 детей с первичными припадками на фоне лихорадки и без менингеальных знаков, менингит был диагностирован только у четырех детей по данным люмбальной пункции (1,2%), все они были в возрасте до 18 месяцев (Rutter и Smales, 1977). И хотя люмбальная пункция не должна быть рутинным методом исследования среди детей в возрасте до 18 месяцев, у которых могут отсутствовать менингеальные симптомы при лихорадочных припадках, она обязательна в случаях, когда ребенок не возвращается в абсолютно нормальное состояние вскоре после эпизодов припадков. Аналогично, люмбальная пункция проводится и детям до одного года при наличии малейших сомнений. Менингит у новорожденных может сопровождаться фебрилитетом или гипотермией и проявляться в виде затруднений при кормлении и дыхании. Ригидность мышц шеи и изменения родничка нетипичны. Люмбальная пункция обычно выполняется при любых септических проявлениях у нездоровых новорожденных.
Наличие пятнисто-папуллезной сыпи может служить ранним симптомом менингококкового сепсиса или проявлением вирусного заболевания. Петехии и пурпура говорят в пользу менингококковой инфекции, хотя также периодически встречаются при наличии вторичного сепсиса при гемофильной (тип В), пневмококковой инфекции или при некоторых вирусных заболеваниях (например, ECHO 9). Очаговая неврологическая симптоматика, такая как паралич черепных нервов или гемипарез обычно развивается поздно в ходе течения бактериального менингита, или раньше в качестве осложнения повышенного ВЧД (особенно параличи VI пары черепных нервов). Отек сосочка зрительного нерва редко заметен на ранних этапах; в сущности, наличие отека сосочка зрительного нерва должно вызывать подозрение о наличии очагового внутричерепного процесса, такого как абсцесс мозга или массивное повреждение, и является показанием к нейровизуализации до проведения люмбальной пункции.
При всех возможных рисках люмбальной пункции при менингитах на фоне повышенного ВЧД (Klein et al., 1986), отказ от выполнения пункции на раннем этапе заболевания значительно осложнит уход за больным ребенком. Диагноз на основе СМЖ, как было показано, изменил тактику ведения в 72% случаев с отсрочкой люмбальной пункции до тех пор, пока назначение антибиотиков повышало уровень стерильной СМЖ с 3% до 44%. Вероятность отека мозговой ткани, с предполагаемым риском смерти оценивается на уровне 4,3% (Rennick et al., 1993) и 6% (Wright et al., 1993; Lambert,1994). Люмбальная пункция, как предполагается, вызывает опущение мозгового конуса спинного мозга, хотя данных для определения явления как причины или следствия нет, а отеки мозговой ткани могут возникать и спонтанно.
Применение КТ для обнаружения отека или повышенного ВЧД чрезвычайно ограничено (Pike et al., 1990, Heyderman et al., 1992), и не способно предсказать риск опущения конуса. Данные полученные при компьютерной томографии заставили изменить тактику ведения пациентов в 5% случаев, при этом спинальная пункция откладывалась в среднем на 2,5 часа (Gopal et al., 1999). Кроме того, нормальные данные КТ не означают безопасное выполнение пункции, и в 36% случаев опущения, КТ было в пределах нормального. Используя строгий отбор пациентов, количество проведенных КТ можно значительно уменьшить (Hasbun et al., 2001). Mellor (1992) советовал откладывать спинномозговую пункцию по крайней мере на 30 минут после припадков, так как известно, что они вызывают транзиторное повышение ВЧД, и назначение маннитола перед проведением люмбальной пункции показано в сомнительных случаях, что обеспечивало эффективное снижение уровня ВЧД и повышение ЦПД и скорости кровотока (Goh и Minns, 1993). Другим противопоказанием к проведению спинальной пункции является необходимость срочного лечения шока (Lambert, 1994).
Это касаетс, прежде всего, менингококковой инфекции, диагностируемой по культуре крови. Таким образом, целесообразно отложить спинномозговую пункцию в случаях тяжелого угнетения сознания, когда ребенок находится в состоянии шока и когда имеется расширение зрачков, офтальмопарез или отек диска зрительного нерва.

е) Лабораторная диагностика:
Количество клеток в СМЖ при бактериальном менингите обычно колеблется между 1000 и 10000/мм 3 , и первоначально преобладают полиморфноядерные лейкоциты, но уровень более пяти одноядерных клеток считается ненормальным, а в 10% случаев отмечается преобладание лимфоцитов на ранних этапах. В норме нейтрофилы отсутствуют, но в цитоцентрифугированных образцах может быть обнаружен случайный единичный нейтрофил. После пункции возможно соотношение нейтрофилов и эритроцитов равное 1:700, если в периферической крови количество клеток красной крови и белых кровяных телец в пределах нормы.
Микроорганизмы можно обнаружить в мазках как внутриклеточно, так и внеклеточно. Окраска по Граму положительная в 25% случаев, в зависимости от концентрации патогенов в СМЖ (Onorato et al., 1980). Использование акридинового оранжевого, флюорохрома, окрашивающего нуклеиновые кислоты некоторых является исключение других возможно поддающихся лечению причин. Тщательные клинические, неврологические и лабораторные методы обследования определяются для каждого конкретного случая.

2. Другие лабораторные процедуры. Культура крови положительна в 80-90% случаев нелеченного менингита. Иногда культура крови может быть положительна, в то время как культура СМЖ отрицательная и, таким образом, информативна для терапии. Посевы из носа и зева не являются специфичными и чувствительными. Культура мочи и мазки из поражений кожи, окрашенные по Граму, дают возможность непосредственной идентификации патогенов.
Бактериологическое исследование жидкости из среднего уха, полученной при аспирации, в случаях сопутствующего среднего отита может выявить тот же микроорганизм, что и в ликворе, но это явление непостоянно, и даже при выявлении бактерии в обеих жидкостях нередко возможны разные штаммы.
Проводится подсчет форменных элементов крови с анализом воспалительного ответа. Обычно имеет место подъем лейкоцитов и повышенный уровень С-реактивного белка (Hansson et al., 1993).
3. Нейровизуализация. Визуализация на ранних этапах может быть нормальной, или показывать менингеальное повышение с контрастом, но его главным образом применяют для исключения другой патологии ЦНС и для диагностики осложнений (Klein et al., 1986) (см. ниже). Riordan et al., (1993) перечисляют следующие показания к КТ: длительное угнетение сознания, длительные частичные или поздние припадки, очаговые неврологические отклонения, увеличение окружности головы, подтверждение продолжающейся инфекции, и рецидивирующие симптомы и признаки. МРТ имеет дополнительные преимущества повышенной чувствительности, но не всегда доступно.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Внутричерепное кровоизлияние в ткань мозга или в окружающие ткани может возникать у любых новорожденных, однако особенно часто развиваются у недоношенных; около 20 % недоношенных новорожденных с массой тела при рождении менее 1500 г имеют внутричерепное кровоизлияние.
Гипоксическая ишемия, колебания артериального давления и давление, оказываемое на головку во время родов, являются основными причинами. Наличие зародышевого слоя хвостатого ядра (эмбриональные клетки, располагающиеся над хвостатым ядром на латеральной стенке боковых желудочков, которые обнаруживают только у плода) делает кровоизлияние более вероятным. Риск также повышается при наличии гематологических нарушений (например, недостаток витамина К, гемофилия, синдром диссеминированного внутрисосудистого свертывания - ДВС).
Такая родовая травма, как внутричерепное кровоизлияние у новорожденных может происходить в несколько пространств ЦНС. Небольшие кровоизлияния в субарахноидальное пространство, серп и намет мозжечка часто являются случайными находками на аутопсии новорожденных, умерших от причин, не связанных с ЦНС. Большие по размеру кровоизлияния в субарахноидальное или в субдуральное пространство, паренхиму мозга или желудочки встречаются реже, однако являются более тяжелыми.
Субарахноидальное кровоизлияние достоверно является наиболее частым видом внутричерепного кровоизлияния. Может проявляться апноэ, судорогами, нарушением сознания или неврологическими нарушениями у новорожденных. При больших кровоизлияниях сопутствующее воспаление мягкой мозговой оболочки может привести к развитию сообщающейся гидроцефалии по мере роста младенца.
Субдуральное кровоизлияние, которое сейчас встречается реже благодаря совершенствованию акушерской помощи, развивается в результате разрыва серпа твердой мозговой оболочки, наметов мозжечка или вен, впадающих в поперечный и верхний сагиттальный синусы. Такие разрывы имеют тенденцию возникать у новорожденных при первых родах, у больших новорожденных или после тяжелых родов это состояния, при которых отмечается повышенное давление на внутричерепные сосуды. Первым проявлением могут быть судороги; быстро увеличивающиеся размеры головы или неврологические нарушения - гипотония, слабый рефлекс Моро или распространенное кровоизлияние в сетчатку глаза.
Внутрижелудочковое и/или кровоизлияние в ткань мозга обычно возникает в течение первых 3 дней жизни и является наиболее тяжелым видом внутричерепного кровоизлияния. Кровоизлияния наиболее часто возникают у недоношенных новорожденных, часто являются двусторонними и обычно происходят в зародышевый слой хвостатого ядра. Большинство кровоизлияний субэпендимальные или внутрижелудочковые и небольшие по объему. При больших кровоизлияниях может отмечать кровоизлияние в паренхиму или желудочки мозга с большим количеством крови в большой и базальных цистернах. Гипоксия-ишемия часто предшествует внутрижелудочковому и субарахноидальному кровоизлиянию. Гипоксическая ишемия приводит к повреждению эндотелия капилляров, нарушает сосудистую мозговую ауторегуляцию и может увеличивать мозговой кровоток и венозное давление, каждый из которых может делать кровоизлияние более вероятным. Большинство внутрижелудочковых кровоизлияний являются бессимптомными, однако большие кровоизлияния могут вызывать апноэ, цианоз или внезапный коллапс.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Диагностика внутричерепного кровоизлияния у новорожденных
Внутричерепное кровоизлияние нужно подозревать у любого новорожденного с апноэ, судорогами, нарушением сознания или неврологическими нарушениями.
Необходимо назначить КТ головы. Несмотря на то что УЗИ головного мозга безопасно, не требует седации и может легко обнаружить кровь в желудочках или ткани мозга, КТ более чувствительно для обнаружения небольшого количества крови в субарахноидальном или субдуральном пространстве. Если диагноз сомнителен, можно исследовать ликвор для обнаружения эритроцитов: обычно ликвор содержит кровь. В то же время в ликворе у доношенных новорожденных часто присутствует небольшое количество эритроцитов. При субдуральном кровоизлиянии диафаноскопия черепа может выявить диагноз после того, как кровь лизировалась.
В дополнение следует провести коагулограмму, развернутый общий анализ крови и биохимический анализ крови для выявления других причин неврологической дисфункции (например, гипогликемия, гипокальциемия, электролитные расстройства). ЭЭГ может помочь установить прогноз, если новорожденный ребенок переживет острый период кровоизлияния.

[11], [12], [13], [14], [15], [16], [17], [18]
Лечение внутричерепного кровоизлияния у новорожденных
В большинстве случаев лечение поддерживающее, кроме гематологических причин кровоизлияния. Все дети должны получить витамин К, если его не вводили до этого. По результатам исследования свертывающей системы крови назначают тромбомассу или факторы свертывания крови. Субдуральные гематомы должны лечиться нейрохирургом; может потребоваться удаление крови.
Какой прогноз имеет внутричерепное кровоизлияние у новорожденных?
При субарахноидальном кровоизлиянии прогноз, как правило, хороший. Субдуральное внутричерепное кровоизлияние у новорожденных имеет осторожный прогноз, однако некоторые младенцы поправляются. Большинство младенцев с небольшими внутрижелудочковыми кровоизлияниями переживают острый период и затем поправляются. Для младенцев с большими внутрижелудочковыми кровоизлияниями прогноз неблагоприятный, особенно если кровоизлияние распространяется на паренхиму. У многих остается неврологическая резидуальная симптоматика.
Инфекции, повреждения головного мозга у недоношенных новорожденных. Особенности
У недоношенных младенцев имеется более высокий риск инфекционных осложнений, поскольку IgG в основном переносится через плаценту в последнем триместре, a IgA и IgM вообще не переносятся. Кроме того, инфекция внутри или вокруг шейки матки часто является причиной преждевременных родов и может вызвать инфицирование сразу после рождения.
Большинство инфекционных осложнений у недоношенных младенцев развиваются через несколько дней после рождения и являются нозокомиальными (внутрибольничными); они часто связаны с установленными катетерами или ИВЛ.
Инфекции у недоношенных младенцев являются основной причиной смерти и способствуют развитию бронхопульмональной (бронхолёгочной) дисплазии (БПД) — хронического заболевания лёгких, повреждению белого вещества головного мозга и последующей инвалидности.

Повреждения головного мозга у недоношенных
Кровоизлияния в головной мозг происходят в 25% случаев у младенцев с ОНВР и легко распознаются при ультразвуковом сканировании черепа. В типичных случаях они происходят в зародышевом матриксе выше хвостатого ядра, которое содержит тонкую сеть кровеносных сосудов. Большинство кровоизлияний происходит в первые 72 ч жизни.
Они наиболее типичны вследствие перинатальной асфиксии и у младенцев с тяжёлым РДС. Пневмоторакс является значительным фактором риска. Небольшие кровоизлияния, ограниченные зародышевым матриксом, не увеличивают риск церебрального паралича. Кровоизлияние может происходить в желудочках; обширные внутрижелудочковые кровоизлияния обусловливают 25-30% риск церебрального паралича.
Наиболее тяжёлым кровоизлиянием является односторонний геморрагический инфаркт с вовлечением паренхимы мозга; это часто приводит к гемиплегии.
Обширное внутрижелудочковое кровоизлияние может привести к нарушению оттока и реабсорбции спинномозговой жидкости (СМЖ), приводя к тому, что СМЖ накапливается под давлением. Эта дилатация может разрешаться спонтанно или прогрессировать до гидроцефалии, которая может вызывать расхождение швов, быстрое увеличение окружности головы и напряжённость переднего родничка.
Иногда требуется вентрикулоперитонеальное шунтирование, однако первоначальное облегчение симптомов можно обеспечить удалением СМЖ с помощью люмбарной или желудочковой пункции. Около половины младенцев с прогрессирующей постгеморрагической дилатацией желудочков страдают церебральным параличом, также имеется более высокий процент паренхиматозных инфарктов.
При наличии двусторонних множественных кист, так называемой ПВЛ, существует 80-90% риск спастической диплегии при заднем расположении. Внутрижелудочковое кровоизлияние и ПВЛ могут происходить при отсутствии патологических клинических проявлений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Энцефалит у детей — это воспаление ткани головного мозга, вызванное инфекционными, аутоиммунными или паранеопластическими факторами. Заболевание проявляется очаговыми нарушениями, судорожным синдромом, менингеальными знаками. Неспецифические симптомы включают лихорадку, недомогание, респираторные и диспепсические расстройства. Диагностика представлена современными методами нейровизуализации (МРТ, КТ), вирусологическим и серологическим исследованием спинномозговой жидкости (СМЖ), биопсией мозговой ткани. Этиотропное лечение ацикловиром назначается при герпетическом энцефалите, в остальных случаях применяют поддерживающую терапию.
МКБ-10
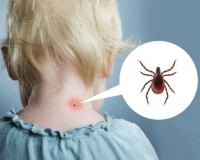
Общие сведения
Среди всех инфекционных болезней у детей нейроинфекции, которые обычно проявляются энцефалитом, составляют 3-5%. Заболевание возникает у пациентов любого возраста, в современной неонатологии нередки случаи внутриутробного церебрального воспаления. Половых различий среди заболевших нет. Ситуация осложняется тем, что типичные детские инфекции, такие как ветрянка и корь, при неблагоприятных условиях дают осложнения в виде энцефалита.

Причины
Основной этиологический фактор болезни — заражение детей нейротропными вирусами (арбовирусами, энтеровирусами, герпесвирусами). У школьников среди причин энцефалита повышается удельный вес экзантематозных инфекций (краснухи, кори, ветряной оспы), что обусловлено тесным взаимодействием в коллективе и высокой контагиозностью этих возбудителей. Симптомы энцефалита могут возникать под влиянием таких факторов, как:
- Бактериальная инфекция. Мозговые поражения встречаются при сифилисе (чаще врожденном), генерализованной стрептококковой или стафилококковой инфекции, что характернее для детей с отягощенной наследственностью или сниженным иммунитетом. Энцефалиты бывают при протозойных инфекциях: малярии, токсоплазмозе.
- Вакцинация. Существует риск воспаления нервной ткани после проведения АКДС, введения антирабической вакцины. Состояние типично для детей в возрасте 3-7 лет. Оно появляется спустя 1-2 недели после прививки. В 70% случаев наблюдаются легкие формы с быстрым самостоятельным восстановлением неврологических функций.
- Опухоли. Энцефалит иногда возникает при нарушениях работы иммунной системы и образовании аутоантител на фоне злокачественных новообразований. Состояние носит название паранеопластического процесса. Помимо повреждения мозга, у больных детей отмечаются полиорганные нарушения.
Патогенез
В пораженном отделе головного мозга у детей развивается острое или подострое воспаление, которое сопровождается отечностью тканей. Под токсическим влиянием продуктов распада вирусов и биологически активных веществ повышается проницаемость капилляров, в результате чего происходят петехиальные кровоизлияния. Такие патологические изменения вызывают общемозговые симптомы энцефалита.
Вирусы обладают прямым патогенным влиянием на нейроны, они провоцируют гибель клеток или появление в цитоплазме включений, которые нарушают образование нейромедиаторов и передачу импульсов. При этом определяются очаговые симптомы повреждения, которые зависят от локализации дефекта. В редких случаях болезнь заканчивается церебральным геморрагическим некрозом.
Классификация
С учетом распространенности поражения бывают полиоэнцефалиты (воспаление серого мозгового вещество), лейкоэнцефалиты (воспаление белого вещества) и панэнцефалиты (диффузный процесс). По локализации очага выделяют полушарные, стволовые, мозжечковые и другие виды. В клинической практике чаще всего используют классификацию по этиологическому фактору, согласно которой различают 2 формы:
- Первичный. Вызван попаданием в организм ребенка нейротропных вирусов, бактерий и простейших. В таком случае болезнь начинается с воспалительного процесса в головном или спинном мозге. Сюда относят клещевой энцефалит, японский комариный энцефалит, эпидемический летаргический энцефалит.
- Вторичный. Возникает как осложнение инфекций другой локализации либо развивается в асептических условиях под действием аутоиммунных процессов. Самые распространенные варианты: коревой, гриппозный, поствакцинальный.
Симптомы энцефалита у детей
Для энцефалита типична полиморфность клинических признаков, а его начальные этапы могут протекать в стертой форме, что затрудняет диагностику церебрального воспаления в практике современной педиатрии и детской неврологии. Патология в основном манифестирует общеинфекционными проявлениями: у детей повышается температура тела, беспокоят интенсивная головная боль, ломота в мышцах и суставах.
В зависимости от происхождения болезни, в продромальном периоде энцефалитов зачастую бывают симптомы со стороны желудочно-кишечного тракта, дыхательных органов. Возможна заложенность носа и слизистые выделения, гнусавость голоса, покашливание. Среди пищеварительных признаков выделяют рвоту и диарею, что более характерно для поражения энтеровирусами.
На вовлечение в процесс мозговой ткани указывает очаговая неврологическая симптоматика: расстройства чувствительности отдельных частей тела, парезы и параличи, нарушения зрения и обоняния. При тяжелом течении патологии у детей возможен судорожный синдром. Менингеальные знаки выражены незначительно, они присоединяются в случаях вовлечения в процесс мозговых оболочек с развитием менингоэнцефалита.
Осложнения
При обширных церебральных поражениях у ребенка есть риск возникновения эпилептического статуса, который сопровождается непрекращающимися судорожными припадками и потерей сознания. Тяжелые энцефалиты иногда вызывают угнетение сознания вплоть до глубокой комы. Среди отдаленных последствий заболевания называют стойкий неврологический дефицит (до 32% от всех случаев патологии), обусловленный необратимым повреждением участка нервной ткани.
Диагностика
При первичном обследовании детский невролог обращает внимание на общее состояние ребенка, наличие общемозговых и очаговых проявлений. При физикальном осмотре оценивают деятельность сердечно-сосудистой и дыхательной системы, проверяют рефлексы, мышечный тонус и когнитивные функций. Симптомы не позволяют поставить окончательный диагноз, поэтому проводятся инструментальные и лабораторные методики:
- МРТ головного мозга. Самый чувствительный метод для выявления воспаления на ранней стадии. О наличии патологии свидетельствует отечность отдельных областей мозговой коры, небольшие участки демиелинизации, изменения в зоне базальных ядер и таламуса.
- КТ головного мозга. Менее информативный способ нейровизуализации, который рекомендуется при отсутствии оборудования для МРТ. Компьютерную томографию полезно делать детям перед люмбальной пункцией, чтобы исключить противопоказания к ней (мозговой отек, гидроцефалию, опухоли).
- Биопсия головного мозга. Инвазивный метод диагностики применяется у детей в осложненных случаях, когда врачи не могут установить этиологию энцефалита либо при неэффективности стандартной интенсивной терапии. Биопсия производится целенаправленно после определения очага поражения на МРТ или КТ.
- Исследование СМЖ. Микроскопический, бактериологический и вирусологический анализы выполняются, чтобы найти причину развития энцефалита. Для точной диагностики герпесвирусов и энтеровирусов показано ПЦР-исследование ликвора. Серологические реакции СМЖ используются для оценки динамики болезни.
Лечение энцефалита у детей
Консервативная терапия
При любой форме энцефалита назначается патогенетическое лечение, которое направлено на стабилизацию витальных функций и активизацию собственных защитных сил организма ребенка. На первом месте стоит коррекция обезвоживания и электролитных нарушений, борьба с отеком мозга, десенсибилизирующая терапия. В случае высокой лихорадки используются антипиретики и физические методы охлаждения.
Важно место в лечении занимает устранение гипоксии, для чего ребенку проводят оксигенотерапию с повышенным содержанием кислорода в смеси, по показаниям выполняют интубацию и ИВЛ. Внутривенно вводят антиоксиданты, которые нейтрализуют свободные радикалы и продукты анаэробного распада молекул. В целях коррекции иммунитета рекомендованы рекомбинантные интерфероны, другие иммуностимуляторы.
Этиотропная терапия энцефалита возможна только при инфицировании герпесвирусами. Поскольку симптомы этого вида заболевания неспецифичны, введение препаратов группы ацикловира практикуют всем детям до установления этиологического фактора. Если подтверждено заражение вирусами герпеса лечение продолжают минимум 14 дней в возрастных дозировках.
Реабилитация
После ликвидации острых инфекционных проявлений ребенку необходимо длительное поддерживающее лечение, чтобы устранить остаточные симптомы. Из медикаментов назначают нейрометаболические препараты, миорелаксанты, лекарства на основе леводопы. Восстановить двигательную активность помогает лечебная физкультура, массаж, механотерапия. Для коррекции когнитивных нарушений требуется помощь логопеда, психолога.
Прогноз и профилактика
Восстановление после перенесенного энцефалита занимает длительное время, но при правильном подборе лечения и реабилитации у большинства детей симптомы полностью исчезают. Стойкие нарушения двигательной функции или органов чувств бывают после тяжелых форм заболевания. С целью профилактики энцефалитов необходимо своевременно выявлять и лечить детские инфекционные заболевания, проводить иммунизацию против клещевого энцефалита в эпидемически неблагоприятных регионах.
2. Клещевой энцефалит у детей: диагностика, лечение профилактика/ Н.В. Скрипченко// Инфекционные болезни. — 2010.
3. Вирусные энцефалиты у детей: прогнозирование исходов/ Н.В. Скрипченко, М.В. Савина, В.Н. Команцев, Г.П. Иванова // Детские инфекции. — 2009.
Читайте также:

