Инфекция у новорожденного пятнами
Обновлено: 24.04.2024
Врожденные заболевания являются одной из распространенных причин младенческой и детской смертности, развития хронических болезней у детей и инвалидизации.
Быстрый переход
Врожденные заболевания могут быть обусловлены генетическими мутациями (передающимися по наследству или спонтанными), инфекциями матери во время беременности (цитомегаловирус, ветряная оспа, краснуха), воздействием лекарств и химических веществ, загрязняющих воздух, воду или пищу. Причины множества врожденных дефектов до сих пор неизвестны.
Генетическими или наследственными факторами обусловлены около 20 % врожденных заболеваний. К ним относятся нарушения, при которых мутация затрагивает один ген (серповидно-клеточная анемия); хромосомные нарушения, при которых хромосомы (или их части) отсутствуют (синдром Тернера) или имеют структурные изменения (увеличение количества хромосом или трисомия при синдроме Дауна); многофакторные нарушения, вызванные мутациями двух и более генов. Врожденные дефекты и нарушения развития могут вызывать делеции или дупликации отдельных генов (изменения митохондриальной ДНК). Примером такого заболевания является муковисцидоз, характеризующееся поражением экзокринных желез и жизненно-важных органов (легких и желудочно-кишечного тракта). Врожденные заболевания также ассоциированы со случайными (новыми) повреждениями генов, спонтанными (не наследующимися от родителей) мутациями (большинство случаев ахондроплазии).
По статистике, врожденные заболевания имеют 2–3 % младенцев. К возрасту 1 года их число увеличивается до 5 %, поскольку не все эти патологии диагностируются сразу после рождения.
Врожденные (наследственные) заболевания также классифицируют по типу наследования. При аутосомно-доминантном наследовании заболевание может передаваться от родителя к ребенку в 50 % случаев (мышечная дистрофия Дюшенна, хорея Гентингтона). При аутосомно-рецессивном наследовании генетическая аномалия передается ребенку только в том случае, если оба родителя наделены одним и тем же дефектным геном (муковисцидоз, серповидно-клеточная анемия). Здесь частота наследования составит 25 %, то есть в среднем у 1 ребенка из 4 детей этих родителей будет аутосомно-рецессивное заболевание.
Патологические состояния могут передаваться и при наследовании, сцепленном с полом (наследование гена, находящегося в половых хромосомах). Х-сцепленные рецессивные заболевания почти всегда ограничены мужским полом (гемофилия, дальтонизм, мышечная дистрофия Дюшенна). Х-сцепленные доминантные заболевания встречаются как у мальчиков, так и у девочек, однако у детей мужского пола имеют более тяжелое течение (Х-сцепленный гипофосфатемический рахит). Y-сцепленные заболевания встречаются довольно редко, поскольку Y-хромосома содержит всего несколько генов (ихтиоз).
Некоторые врожденные заболевания формально не относятся к генетическим, но имеют ту или иную выраженность наследования: наследуются факторы риска либо сам ген, но с низкой пенетрантностью (частотой проявления гена в признаках).
Гемофилия
Гемофилия — группа редких наследственных нарушений свертываемости крови, вызванных дефицитом необходимого белка (фактора свертывания крови).
Гемофилия A (классическая) встречается чаще (>80 % случаев) и связана с дефицитом VIII фактора свертывания крови, гемофилия B (болезнь Кристмаса) — реже (>10 % случаев), она обусловлена недостаточностью IX фактора свертывания крови. Гемофилия C встречается очень редко, обусловлена дефицитом XI фактора свертывания крови, чаще всего в классификации группы ее не упоминают.
Заболевание относится к X-сцепленным с полом, наследуется по рецессивному признаку по женской линии. Классическую гемофилию вызывают мутации гена F8, расположенного на X-хромосоме. Примерно в 70 % случаев заболевание наследуется по Х-сцепленному образцу, в остальных случаях оно возникает спонтанно (новая мутация), в дальнейшем спонтанное заболевание становится наследственным. Гемофилией A болеют практически исключительно мужчины, редкие случаи заболевания у женщин, носительниц дефектного гена, почти всегда характеризуются легким течением. Гемофилию B вызывают мутации гена F9, так же расположенного на X-хромосоме, она характерна для мужчин, женщины болеют очень редко. В некоторых случаях заболевание возникает спонтанно (приобретенная гемофилия A или B) и тоже связано с недостаточностью VIII или IX факторов свертывания крови. Приобретенная гемофилия является аутоиммунным заболеванием, при котором организм вырабатывает антитела, атакующие факторы свертывания крови (чаще всего VIII фактор). Примерно в половине случаев приобретенной гемофилии у пациента имеется связанное с ней основное состояние или заболевание (беременность, аутоиммунные заболевания, миелопролиферативные заболевания, воспалительные заболевания кишечника и др.), в остальных эпизодах причина остается невыясненной.
Гемофилия A затрагивает примерно 1 из 5 000 новорожденных мальчиков, гемофилия B — примерно 1 из 25 000. Около 60 % пациентов имеют тяжелую форму гемофилии, обычно им ставят диагноз при рождении или в течение первых 2 лет жизни.
Возраст манифестации гемофилии и тяжесть течения заболевания зависят от уровня активности факторов свертывания крови. Легкая форма характеризуется уровнем фактора свертывания крови (VIII или IX), превышающим 5 % от нормы, средняя — 1–5 %, тяжелая — ниже 1 %. У большинства пациентов, независимо от тяжести течения заболевания, эпизоды кровотечения чаще встречаются в раннем детском, детском и подростковом возрасте, чем в дальнейшей взрослой жизни.
При легкой и умеренной формах гемофилии длительные кровотечения могут возникнуть только в результате травмы, хирургического вмешательства или стоматологической процедуры. Нередко диагноз гемофилии ребенку устанавливают к 5–6 годам, обратив внимание на длительное посттравматическое кровотечение, длительное кровотечение во время стоматологического лечения или операции. К другим заметным симптомам легкого и умеренного течения гемофилии относятся непроходящие гематомы (синяки), частые носовые кровотечения, кровоточивость десен.
Для тяжелой формы гемофилии характерны эпизоды спонтанного кровотечения, которые приводят к кровоизлияниям различной локализации — в мягкие ткани, мышцы, суставы. При гемартрозах (кровоизлияние в полость сустава) возникает ограничение подвижности суставов, сопровождающееся острой болью и воспалением. У пациентов с тяжелой формой гемофилии спонтанные кровотечения чаще всего происходят в мышцы и суставы, однако могут затрагивать любой внутренний орган, включая почки, органы ЖКТ, головной мозг (гематурия, мелена, гематохезия, желудочно-кишечные кровотечения, внутричерепные кровотечения). Тяжелая форма гемофилии A обычно проявляется в раннем детском возрасте, диагноз чаще всего устанавливается к 2 годам ребенка. Обычными симптомами (при отсутствии лечения заболевания) здесь являются кровотечения из-за незначительных травм ротовой полости (прикусывание губ, языка, щек), подкожные гематомы, большие шишки после удара головой, спонтанные кровотечения (2–5 эпизодов в месяц).
Диагноз гемофилии A или B устанавливается на основании симптомов, истории личного и семейного анамнеза пациента, лабораторных исследований (общего анализа крови, коагулограммы, оценивающей состояние системы свертывания крови и активности ее белков, молекулярно-генетического исследования). Парам из группы риска по рождению ребенка с гемофилией необходимо получить генетическую консультацию на этапе планирования беременности. Определение конкретной мутации гена F8 (или F9) помогает не только выявить женщин-носительниц дефектного гена в конкретной семье, но и полезно для пренатальной диагностики гемофилии (амниоцентез, биопсия хориона).
Некоторым пациентам с легкой формой гемофилии назначается синтетический аналог вазопрессина — десмопрессин, повышающий VIII фактор свертывания крови (вводится внутривенно или интраназально), а также антифибринолитические средства, замедляющие распад факторов свертывания крови.
Примерно в 30 % случаев лечения тяжелых случаев гемофилии длительная заместитетельная терапия может приводить к изоиммунизации — образованию антител к вводимым факторам свертывания крови (иммунная система распознает вводимый фактор VIII как чужеродный). Этот процесс может сопровождаться аллергическими реакциями (разной степени тяжести), возрастает риск жизнеугрожающих кровотечений. В этом случае пациенту назначается альтернативное лечение — плазмаферез, иммунодепрессанты.
Гемохроматозы
Гемохроматоз — наследственное заболевание, характеризующееся нарушением обмена железа и его накоплением в тканях и органах.
Заболевание сопровождается повышенным всасыванием железа в желудочно-кишечном тракте и накоплением в печени, сердце, поджелудочной железе, суставах, гипофизе, что приводит к полиорганной недостаточности и развитию таких болезней, как цирроз печени, рак печени, диабет, болезни сердца и суставов.
Наследственный гемохроматоз вызывают мутации генов HFE, HFE2, HAMP, SLC40A1 и TfR2, он классифицируется в зависимости от возраста начала, генетической причины и способа наследования: гемохроматоз 1 типа, гемохроматоз 2 типа, гемохроматоз 3 типа, гемохроматоз 4 типа. Вторичный гемохроматоз ассоциирован с другими заболеваниями (не является наследственным) — анемией, хронической болезнью печени, инфекциями.
Гемохроматоз, редко возникающий в младенческом возрасте и не имеющий явной причины, называют неонатальным гемохроматозом. При этой форме заболевания избыточное накопление железа в тканях и органах начинается еще до рождения ребенка. Неонатальный гемохроматоз быстро прогрессирует и характеризуется поражениями печени, которые выявляют при рождении или в первые дни жизни. Дети с этим заболеванием часто рождаются недоношенными или имеют нарушения внутриутробного развития. Точная причина неонатального гемохроматоза неизвестна, есть версия, что он развивается в том случае, если иммунная система матери распознает клетки печени ребенка как чужеродные. Симптомы обычно включают гипогликемию, нарушения свертываемости крови, пожелтение кожных покровов и склер глаз, отеки. Диагноз устанавливается на основании признаков и симптомов, лабораторных и инструментальных исследований, биопсии печени. Лечение включает переливание крови, внутривенное введение иммуноглобулинов, трансплантацию печени.
Гемохроматоз 1 типа ассоциирован с мутациями в гене HFE, расположенном на коротком плече 6–й хромосомы, наследуется по аутосомно-рецессивному типу, является наиболее распространенным типом наследственного гемохроматоза и поражает в основном мужчин. Вероятность того, что ребенок унаследует мутацию в гене HFE от родителя составляет 25 %, вероятность того, что он станет носителем дефектного гена — 50 %.
Начальные симптомы заболевания обычно отмечаются в возрасте 40–60 лет и включают боль в животе, снижение полового влечения, усталость, слабость, боли в суставах, сухость кожи. В дальнейшем проявляются такие симптомы и осложнения, как изменение пигментации кожи (бронзовая кожа), выпадение волос на голове и туловище, аритмия, кардиомиопатия, хроническая сердечная недостаточность, сахарный диабет, гепатомегалия, цирроз печени, спленомегалия, атрофия яичек, аменорея (у женщин) и другие.
Диагноз устанавливается на основании симптомов заболевания, лабораторных исследований (уровень железа, ферритина, трансферрина, железосвязывающей способности сыворотки крови, маркеры функции печени, уровень глюкозы крови и др.), инструментальных исследований (рентгенография суставов, электрокардиография и эхокардиография сердца, УЗИ органов брюшной полости, МРТ печени и др.), биопсии печени, молекулярно-генетического исследования (в том числе для выявления родственников — имеющих гемохроматоз или носителей).
Лечение гемохроматоза направлено на удаление избытка железа из организма (флеботомия, хелатирование) с помощью забора крови (как при взятии анализов или донорстве крови, только в большем объеме) и специальных препаратов, образующих комплексное соединение с железом и способствующих его удалению из железосодержащих белков (дефероксамин).
Терапевтическая флеботомия сначала проводится 1–2 раза в неделю, поддерживающая — каждые 2–4 месяца. Вместе с этим проводится симптоматическое лечение сахарного диабета, патологий сердца, цирроза печени и других заболеваний, вызванных гемохроматозом. Пациентам запрещен прием препаратов железа и любых медикаментозных средств или комплексов, которые могут содержать железо и витамин C, запрещен алкоголь во избежание дальнейшего повреждения печени (если оно имеется), рекомендуется придерживаться диеты, исключающей продукты с высоким содержанием железа (красное мясо, яблоки, печень, шпинат).
Гемохроматоз 2 типа вызывают мутации в генах HFE2 или HAMP, он наследуется по аутосомно-рецессивному типу и проявляется чаще всего в детском возрасте. Для этого типа заболевания характерны следующие симптомы: высокие уровни ферритина и трансферрина, врожденный фиброз печени, артропатия, кардиомиопатия, генерализованная гиперпигментация кожи, мышечная слабость, гипогонадизм, задержка полового созревания, сахарный диабет, цирроз печени, остеопороз, спленомегалия, гепатомегалия и другие. Диагностика и лечение гемохроматоза 2 типа проводятся аналогично диагностике и лечению гемохроматоза 1 типа.
Гемохроматоз 3 типа вызывают мутации в гене TFR2, он наследуется по аутосомно-рецессивному типу. Симптомы обычно проявляются до 30 лет и, помимо вышеперечисленных, могут включать снижение уровня лимфоцитов и нейтрофилов в крови, красные или пурпурные пятна на коже. Диагностика и лечение гемохроматоза 3 типа проводятся аналогично диагностике и лечению гемохроматоза 1 и 2 типов.
Симптомы гемохроматоза 4 типа могут проявиться как в детском, так и во взрослом возрасте. Этот тип заболевания вызывают мутации гена SLC40A1, наследуется оно по аутосомно-доминатному типу. Вероятность того, что ребенок унаследует мутацию в гене SLC40A1 от родителя составляет 50 %, соответственно, вероятность того, что он станет носителем дефектного гена — тоже 50 %. Симптомы гемохроматоза 4 типа могут проявляться в виде повышенной утомляемости, слабости, болей в суставах, изменения пигментации кожи, затруднения дыхания, сердечной недостаточности, сахарного диабета, анемии, врожденного фиброза печени, цирроза печени, остеоартроза, катаракты. Диагностика и лечение гемохроматоза 4 типа проводятся аналогично диагностике и лечению гемохроматоза 1, 2 и 3 типов.
Наследственный гемохроматоз — заболевание с пониженной пенетрантностью (вероятностью того, что ген будет иметь любые фенотипические проявления) дефектного гена, т. е. у некоторых людей с мутациями гена HFE никогда не проявятся симптомы, при этом у их детей или других членов семьи с мутацией гена произойдет манифестация заболевания.
Мышечная дистрофия Дюшенна
Мышечная дистрофия Дюшенна — редкое наследственное заболевание, характеризующееся нарастающей мышечной слабостью с последующей атрофией мышц. Ассоциировано с мутацией гена DMD, расположенного на половой X-хромосоме (X-сцепленный рецессивный тип наследования).
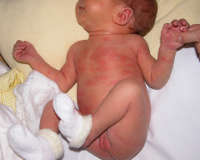
Эритема новорожденных – это транзиторное покраснение кожи, связанное с адаптацией ребенка к внеутробной жизни и сопровождающееся полиморфными высыпаниями. Основным симптомом является розово-красный цвет кожных покровов, отмечающийся в первые часы или на 2-3 сутки жизни ребенка. На фоне покраснения кожи в ряде случаев обнаруживается мелкая серо-желтая сыпь. Общее состояние, как правило, не страдает. Диагностика эритемы новорожденных основана на характерных симптомах, появляющихся в определенном возрасте (первые дни жизни), при этом клинические и лабораторные признаки воспаления и инфекций отсутствуют. Лечение обычно не требуется, по показаниям назначаются десенсибилизирующие препараты.
МКБ-10
Общие сведения
Эритема новорожденных относится к типичным адаптационным реакциям ребенка в первые дни жизни, поэтому фактически считается нормой в педиатрии. Встречается более чем у половины детей, чаще у малышей, находящихся на грудном вскармливании. Развитие эритемы в некоторой степени зависит от соматического состояния матери, поэтому можно говорить об увеличении частоты встречаемости в последние 10-20 лет в связи с ростом заболеваемости матерей сахарным диабетом, ожирением и другими социально значимыми нозологиями. Врачам следует сохранять настороженность в отношении эритемы новорожденных, особенно ее токсической формы, поскольку не исключено влияние данного состояния на дальнейшее формирование аллергического статуса ребенка.

Причины
Ведущая причина возникновения эритемы новорожденных – послеродовая адаптация организма к внешней среде, то есть к жизни вне материнской утробы. Первичные проявления во многом обусловлены разницей температур матки и окружающего воздуха, вследствие чего периферические сосуды ребенка расширяются для большего притока крови и, соответственно, согревания. Поэтому кожные покровы выглядят покрасневшими. Дальнейшее развитие эритемы новорожденных имеет аллергический генез. По большей части речь идет об алиментарном пути проникновения аллергенов, но также имеет место и контактный механизм. Определенную роль всегда играют патологии беременности – гипоксия плода, фетоплацентарная недостаточность и др.
Патогенез
После рождения ребенок впервые получает пищу через желудочно-кишечный тракт, незнакомый до настоящего момента с грудным молоком. Важно понимать, что само по себе грудное вскармливание не вызывает аллергию, но ее проявления практически неизбежны из-за огромного количества компонентов пищи, абсолютно новых для малыша. Воздушная среда тоже может оказывать раздражающее действие на кожу, но механизмы адаптации выстраиваются уже ко 2-3 дню жизни, поэтому проявления эритемы новорожденных постепенно нивелируются.
Классификация
Эритема новорожденных бывает физиологической и токсической. Классификация условна, поскольку токсическая эритема новорожденных многими специалистами не связывается с процессами адаптации ребенка в первые дни жизни, а считается отдельной нозологией. Кроме того, обе формы данного состояния требуют разной врачебной тактики.
- Физиологическая эритема. Клиническая картина обусловлена в большей степени температурным фактором.
- Токсическая эритема. Кожные проявления связаны с аллергической сенсибилизацией. Эритема может быть ограниченной, распространенной и генерализованной в зависимости от степени выраженности кожных проявлений и ухудшения общего состояния.
Симптомы эритемы новорожденных
Физиологическая эритема проявляется в первые часы жизни ребенка общим покраснением кожных покровов, больше в области ладоней и стоп. Как правило, в течение первых суток симптомы исчезают. Токсическая эритема новорожденных дебютирует обычно на 2-3 сутки (по мере формирования аллергического ответа). В отличие от физиологической эритемы, характерным признаком является сыпь. Высыпания представлены мелкими серо-желтыми бугорками с ярко-красным венчиком вокруг них. Образования всегда локализуются на ограниченном участке кожи и могут быть как единичными, так и множественными.
Общее состояние ребенка не страдает, температура может быть незначительно повышена. Генерализованная токсическая эритема новорожденных встречается относительно редко, в подобных случаях имеет место не только обильная сыпь по всему телу, но и ухудшение общего состояния – слабость, повышение температуры.
Диагностика
При постановке диагноза врач-педиатр учитывает возраст ребенка и частое сочетание с другими транзиторными состояниями: маститом новорожденных, гормональным кризом, олигурией, мочекислым инфарктом и т. д. Дифференциальная диагностика кожных элементов обычно не вызывает затруднений, поскольку характерные проявления вирусных заболеваний выглядят иначе и всегда сопровождаются другими общими симптомами. Физиологическая и токсическая эритема новорожденных различаются по времени появления и типу изменений кожи. При выраженной сенсибилизации проводится анализ крови малыша и матери на различные аллергены. Полностью исключить инфекции позволяет результат общего анализа крови ребенка.
Лечение эритемы новорожденных
В большинстве случаев состояние не требует врачебного вмешательства. Симптомы купируются в течение одного или нескольких дней. Ускорению восстановления нормального цвета кожных покровов способствуют воздушные ванны и соблюдение гипоаллергенной диеты кормящей матерью. Токсическая эритема новорожденных может потребовать назначения десенсибилизирующих препаратов (обычно в каплях) при обильных высыпаниях и беспокойстве ребенка, обычно связанном с зудом.
С целью снижения местного раздражения рекомендуется свободное пеленание. По показаниям проводится коррекция дисбиоза, поскольку большинство аллергенов попадают в организм ребенка именно алиментарным путем. Прогноз состояния благоприятный.
Молочница (или оральный кандидоз) у грудничков встречается очень часто, однако, не является нормой. Заболевание нужно лечить, стараться профилактировать. Без своевременной терапии грибковая инвазия переходит в хроническую форму, провоцирует осложнения.

Причины появления молочницы
Возбудителем болезни является грибок рода Candida. В небольшом количестве этот паразит присутствует на слизистой оболочке полости рта, коже совершенно здоровых людей, не доставляет неприятностей.
В момент ослабления иммунитета, системного заболевания колония грибка начинает активно разрастаться. Возбудитель повреждает ткани рта, проявляется негативная симптоматика заболевания. В группу риска по оральному кандидозу в первую очередь входят новорожденные из-за несформированных полностью защитных барьеров организма. Тяжелое течение, частые вспышки молочницы бывают маркером опасных патологий, поскольку развиваются только на фоне значительного ослабления иммунитета.
Внимание: Согласно рекомендации ВОЗ, рецидивирующий оральный кандидоз — повод для обследования на ВИЧ.
Другими причинами появления молочницы выступают:
- прохождение младенца через инфицированные родовые пути матери во время появления на свет;
- несоблюдение гигиены при уходе за ребенком;
- поедание сладостей в большом количестве, кормление сладкими молочными смесями;
- поражение вирусными, бактериальными инфекциями;
- стоматологические проблемы, сопряженные со снижением защитных функций слюны;
- склонность малыша к срыгиваниям;
- недоношенность;
- наличие системных, хронических патологий;
- лечение антибиотиками;
- использование грязных игрушек, пустышек, сосок.
Младенцы, питающиеся грудным молоком, менее подвержены кандидозу, но при условии, что мама соблюдает гигиенические правила.
Главный признак заболевания — локальный воспалительный процесс в очаге грибковой инвазии с формированием характерного налета.
Клиническая картина зависит от степени развития болезни. Врачи выделяют три стадии:
- I — на слизистой оболочке появляются чуть красноватые отметинки, налет белый, творожистой консистенции. Родители часто принимают его за остатки еды. Чтобы убедиться, что это не так, надо провести влажной салфеткой по пораженному участку. Пища легко сотрется, а результат жизнедеятельности грибков — останется;
- II — пятнышки сливаются друг с другом, захватывают большую площадь поверхности ротовой полости, под налетом формируются кровоточащие язвочки;
- III — запущенная стадия. Болевой синдром сильный. У ребенка наблюдается лихорадка, нарушение стула. Иногда малышу требуется госпитализация.
По течению заболевания молочницу разделяют на острую и хроническую. Для первой характерно распространение зоны поражения на всю слизистую оболочку рта, уголки губ, белесый налет, высокая температура тела.
Без лечения острая форма переходит в хроническую, трудно поддающуюся лечению. Налет в этом случае становится плотным, желтовато-коричневым. Пальпация причиняет сильную боль. Проблемная область отекает, увеличиваются лимфоузлы (обычно подчелюстные).
Дополнительными признаками патологии являются:
- раздражительность;
- беспокойный сон;
- повышенная жажда;
- сиплый, низкий голос (при инфицировании гортани);
- неприятный запах изо рта;
- снижение аппетита (иногда полный отказ от еды);
- постоянный плач.
В тяжелых случаях грибок распространяется в просвет кишечника, желудок. Симптоматика дополняется болями в животе, тошнотой, поносом, срыгиваниями. Без адекватной терапии кандидоз провоцирует осложнения со стороны дыхательной системы, поражает наружные половые органы.
Дифференциация молочницы с другими заболеваниями, как правило, не вызывает у врача затруднений. Педиатр ставит предварительный диагноз после сбора анамнеза, осмотра пациента.
Для его подтверждения делают соскоб со слизистой оболочке, проводят микроскопический анализ, который достоверно устанавливает возбудителя болезни. Чтобы определить степень развития патологии, уровень ее воздействия на организм, придется сдать общий, биохимический анализы крови, исследование мочи.
Когда грибковая инвазия присоединилась на фоне ослабления иммунитета из-за другого заболевания внутренних органов (например, гастрита или холецистита), больного направят на консультацию к узкому специалисту соответствующего профиля. После получения результатов полного обследования ребенку назначат оптимальную лечебную схему.
Основная задача терапии орального кандидоза — уничтожение колонии грибов. Для этого применяют местные обработки антисептическими растворами. Противогрибковые средства системного или локального действия для лечения младенцев используют редко, детям старше полугода назначают в тяжелых случаях, при неэффективности неспецифических лекарств.
Внимание: большинство антигрибковых препаратов противопоказаны маленьким пациентам. Использовать их надо, строго соблюдая назначенную дозировку. Запрещено заменять детские лекарства средствами для взрослых.
Для купирования негативной симптоматики назначают препараты разных фармакологических групп, исходя из основных проявлений болезни. Это могут быть:
- пробиотики;
- обезболивающие;
- жаропонижающие;
- антигистаминные;
- витаминные комплексы.
Самостоятельно дополнять лечение народными средствами не стоит. Например, распространенный отвар ромашки пересушивает слизистую оболочку, что усугубляет течение болезни.
Ребенка с молочницей не надо кормить:
- сладостями;
- картофелем;
- сладкими фруктами;
- бобовыми;
- мучными изделиями;
- отварной свеклой, морковью;
- сухофруктами.
Основу рациона должны составлять свежие овощи, мясо нежирных сортов, яйца, кисломолочные продукты. Такая пища нормализует работу кишечника, иммунной системы. Хорошо предложить малышу морсы, десерты из кислых ягод. Содержащиеся в них вещества замедляют распространение возбудителя.
В комнате, где находится больной ребенок, нужно создать достаточный уровень влажности, каждый день делать уборку.
Если соблюдать все врачебные рекомендации, полностью избавиться от молочницы получится за 7-10 дней. Прерывать курс лечения нельзя, даже когда внешние проявления болезни исчезли. Это может привести к тому, что инфекция вспыхнет с новой силой, перейдет на другие области организма либо в хроническую, рецидивирующую форму.
Чтобы снизить риск появления орального кандидоза у детей, нужно следовать простым правилам:
- как можно дольше поддерживать грудное вскармливание;
- тщательно мыть руки перед контактом с малышом;
- ограничить употребление сладостей, молочных смесей с высоким содержанием сахара;
- соблюдать личную гигиену при кормлении грудничка;
- правильно ухаживать за ротовой полостью ребенка;
- следить за чистотой пустышек, игрушек. Не облизывать упавшую соску. Слюна родителей может стать источником инфекции;
- беременным позаботиться о лечении вагинального грибка до родов.
Для предотвращения срыгивания нужно после кормления 3-5 минут подержать младенца в вертикальном положении, не начинать сразу играть с ним или переодевать.
Молочница во рту у младенцев — распространенное явление. Ее не стоит пугаться, но и оставлять без внимания нельзя. Без терапии заболевание приводит к осложнениям, нарушает сон, пищеварение малыша, замедляет его рост, развитие. Важно не заниматься самолечением, сразу обратиться к врачу, соблюдать назначения.
Сыпь при вирусной инфекции у ребенка
Ряд вирусных инфекций проявляется высыпаниями на коже, которые дают ключ к диагнозу. В некоторых случаях кожная сыпь является основным признаком. Раннее распознание характерных экзантем также помогает отличить вирусные инфекции от лекарственных реакций, бактериальных и риккетсиозных высыпаний, а также других реактивных эритем.
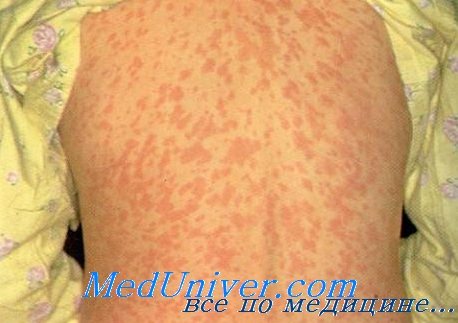
Сыпь у ребенка при кори
Многие другие вирусы вызывают характерную реакцию в коже. Инфекции герпесвирусов и поксвирусов диагностируются по характерным для них везикуло-буллезным высыпаниям, в то время как инфекции пикорнавирусов (к которым относятся энтеровирусы) идентифицируются по кореподобным экзантемам.
Вирусы вызывают появление экзантем посредством различных механизмов. Прямое инфицирование кожи происходит при ветряной оспе, энтеровирусах и герпетической инфекции. Другие высыпания, например, при кори и краснухе, вероятно, следствие сочетанных процессов распространения вируса на кожу и иммунологического ответа организма.
Некоторые взаимодействия между организмом и вирусом активируются воздействием определенных лекарств, примером служит генерализованная экзантема, которая развивается более чем у 95% пациентов с инфекцией вируса Эпштейна-Барр, которые получают ампициллин.
Экзантемы, вызванные энтеровирусами, очень вариабельны и обычно развиваются после более короткого по сравнению с классическими вирусными экзантемами инкубационного периода. Хотя они наблюдаются круглый год, пик заболеваемости приходится на конец лета и начало осени. Кореподобные, везикулезные, петехиальные и уртикарные высыпания проявляются вариабельно, обычно в сопровождении лихорадки.
Другие симптомы могут включать менингит, конъюнктивит, кашель, острый ринит, фарингит и пневмонию. Вирусная пузырчатка полости рта, кистей и стоп является специфическим заболеванием с характерными папулезно-везикулезными очагами на ладонях, подошвах, твердом нёбе и (нередко) на туловище, особенно на ягодицах. У пациентов с этим синдромом идентифицированы вирусы Коксаки А5, А10 и А16 и энтеровирус 71.
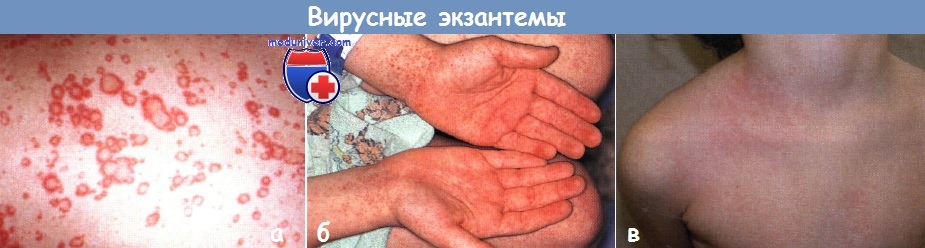
а - уртикарная вирусная экзантема распространилась с туловища на лицо и конечности у грудного ребенка. Очаги исчезли через несколько дней
б - у 6-летнего мальчика появились красные пятна и петехии диаметром 1-2 мм на дистальных участках конечностей с поражением ладоней и подошв
в - у этого здорового 4-летнего мальчика на левой стороне груди развились односторонние дискретные и сливающиеся папулезные высыпания, через несколько дней произошла генерализация высыпаний.
Односторонняя латероторакальная экзантема (асимметричная перифлексоральная экзантема детского возраста) - еще одно состояние с характерной клинической картиной, причиной которого могут быть различные возбудители, в том числе энтеровирусы. Бессимптомная или с минимальным зудом кореподобная или скарлатиноподобная сыпь обычно начинается около одной подмышечной впадины, часто остается на стороне первоначального поражения, распространяется по туловищу у детей грудного и дошкольного возраста.
Средний возраст начала заболевания 2 года. Девочки болеют в два раза чаще мальчиков. Очаги обычно заживают без рубцевания в течение 5 нед. Диагностические тесты отсутствуют, но в биопсиях кожи обнаруживают присущий только этой экзантеме эккринный лимфоцитарный инфильтрат.
Папулезно-везикулезные высыпания дифференцируют с вирусом varicella-zoster и инфекцией ВПГ с помощью теста Тцанка. Клиническое течение и, при необходимости, культуральный анализ и серологические исследования помогают установить специфический диагноз. Хотя пик менингококковой инфекции приходится на зиму и весну, отдельные случаи могут регистрироваться летом и осенью, в сезон энтеровирусов. Следовательно, ребенка с петехиальной экзантемой и предполагаемым энтеровирусным менингитом необходимо внимательно обследовать, чтобы исключить бактериальную инфекцию.
Инфекции цитомегаловируса, вируса Эпштейна-Барр и респираторных вирусов могут сопровождаться пятнистыми, кореподобными или уртикарными экзантемами, которые трудно отличить от лекарственных высыпаний. Дети, получающие лекарства и периодически болеющие вирусными инфекциями, должны продолжать курс лечения под внимательным наблюдением врача. Такие минимальные вирусные экзантемы обычно проходят за несколько дней, в то время как лекарственные реакции имеют тенденцию персистировать или усиливаться.
Однако прием лекарства необходимо прекратить у любого пациента, если развиваются крапивница, ангиоотек, ССД/ТЭН или другие признаки прогрессирующих аллергических реакций.
1. Принципы обследования кожи новорожденных детей

а) Осмотр кожи
б) Инструментальные методы исследования кожи
2. Особенности кожи новорожденного ребенка
3. Последствия врачебных манипуляций у новорожденного
4. Временные поражения кожи у новорожденных детей
5. Врожденные изменения кожи новорожденных детей
6. Пеленочный дерматит и его дифференциация
7. Инфекционные и паразитарные поражения кожи у ребенка
8. Буллезные болезни кожи у ребенка
9. Родимые пятна у новорожденного
а) Сосудистые мальформации
б) Невусы
- Дополнительно рекомендуем раздел статей по невусам - родинкам
В разделе собраны ссылки на статьи по невусам всех видов. Невусы в народе также называются родинками.
- Дополнительно рекомендуем посетить раздел статей по пигментным пятнам кожи - меланозам
В разделе собраны ссылки на статьи по невусам всех видов. Невусы в народе также называются родинками.
в) Опухоли
- Дополнительно рекомендуем раздел сайта по дерматоонкологии (опухолям кожи)
В разделе собраны статьи по эпидемиологии, этиологии, диагностике, лечению рака кожи.
Перейти в раздел опухоли кожи
Перейти в раздел лимфомы кожи
10. Эритемы у новорожденного
11. Болезни кожи ребенка и уход за ней - детская дерматология
В разделе собраны ссылки на статьи по болезням кожи ребенка, их диагностике, лечению. Отдельно собраны статьи по уходу за детской кожей.
12. Книги, презентации, лекции по дерматологии и венерологии
В разделе представлены книги, диссертации, презентации по дерматологии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

