Инфекция в плаценте отзывы
Обновлено: 19.04.2024
Цель исследования: определить частоту и локализацию воспалительных изменений в последах у женщин со своевременными и преждевременными родами. Проведен анализ заключений гистологического исследования последов у 327 родивших женщин, взятых методом сплошной выборки. При преждевременных родах воспалительные изменения были обнаружены в 77,8 % случаев, что достоверно чаще, чем при своевременных родах – 36,7% (р 2 и точный тест Фишера.
Результаты
Таблица 1
Частота и локализация воспалительных изменений в последе при своевременных и преждевременных родах по данным патоморфологического исследования
р
1. Поражение плаценты:
Базальная пластинка (базальный децидуит)
Базальная пластинка, ворсинчатый хорион (базальный децидуит, виллузит)
2. Поражение плодных оболочек:
Париетальная пластинка, гладкий хорион
Париетальная пластинка, гладкий хорион, амнион (мембранит)
3. Сочетанные поражения плаценты, оболочек, пуповины:
Сочетанное поражение базальной и париетальной пластинок
(базальный и париетальный децидуит)
Сочетанное поражение плодных оболочек и пуповины
Сочетанное поражение плодных оболочек, плаценты и пуповины (плацентит)
Также были получены достоверные отличия по степени распространения внутриматочного воспаления между подгруппами с разными сроками родов (табл. 2). При очень ранних преждевременных родах (22 недели – 27 недель 6 дней), которые произошли в 1 случае, было выявлено сочетанное поражение плаценты, плодных оболочек и пуповины (плацентит).
При ранних преждевременных родах (28 недель – 33 недели 6 дней) воспалительные изменения в последе были установлены в 85,7 % случаев. При этом, в отличие от своевременных родов, достоверно чаще они были представлены мембранитом (в том числе сочетанием его с фуникулитом) – в 21,4 %, виллузитом – в 14,3 % случаев и плацентитом – в 7,1 %. Вместе с тем в превалирующем числе наблюдений, так же, как и при своевременных родах, присутствовали такие формы, как хориодецидуит (28,6 %) и сочетанное поражение базальной и париетальной пластинок (14,3 %).
Таблица 2
Частота и локализация воспалительных изменений в последе при своевременных и преждевременных родах по данным патоморфологического исследования
Плацентарная недостаточность (ПН), несмотря на успехи современного акушерства, занимает ведущее место в структуре перинатальной заболеваемости и смертности. Плацентарная дисфункция служит основной причиной внутриутробной гипоксии, синдрома задержки роста плода (СЗРП). Частота ПН варьирует по данным различных авторов от 13 до 42% [10, 15].
В то же время отсутствует единство взглядов на ведение беременных с ПН, дискутируется вопрос о длительности лечения, сроках и методах родоразрешения беременных. Актуальным остается изучение адаптационных и компенсаторных изменений в плаценте на ультраструктурном уровне с последующей разработкой подходов к коррекции этих процессов.
Плацентарная недостаточность — это симптомокомплекс, при котором возникают морфофункциональные нарушения плаценты и плода вследствие различных экстрагенитальных, гинекологических заболеваний и акушерских осложнений. При этом нарушается кровообращение плаценты и плода, что сопровождается в ряде случаев задержкой роста плода [9, 10, 14].
Выделяют следующие факторы риска, приводящие к развитию плацентарной недостаточности: возраст младше 17 лет и старше 30 лет; неблагоприятные социально-бытовые условия; вредные пристрастия; экстрагенитальная патология; инфекционные и гинекологические заболевания; отягощенный акушерско-гинекологический анамнез [10, 17].
Несмотря на полиэтиологичную природу ПН, в развитии осложнения на фоне инфекции имеются определенные особенности. К первичным звеньям в патогенезе недостаточности плаценты относят нарушение созревания плаценты, отставание формирования котиледонов, снижение маточно-плацентарного и плодово-плацентарного кровообращения [21].
Под влиянием одного или нескольких патологических факторов возникает активация функции плаценты и компенсаторно-приспособительных процессов, при угнетении которых развивается стадия дезорганизации и угнетения функции плаценты, с возможным развитием в ней необратимых деструктивных процессов [1].
Воздействие инфекционного фактора, при истощении компенсаторно-приспособительных реакций всех звеньев в функциональной системе мать – плацента – плод, способствует инфекционному поражению плаценты с последующим заражением плода [1]. Развивается токсинемия, расстройства метаболизма, циркуляторные нарушения в данной системе.
Плацентарная недостаточность, обусловленная неспецифическим воздействием микробных токсинов и метаболитов, поступающих в материнский кровоток из очага инфекции, создает предпосылки для развития хронической гипоксии и гипотрофии плода. Не оспорим тот факт, что в развитии инфекционного поражения плаценты и плода, степени тяжести их нарушений, локализации патологического процесса, имеют значение сроки беременности, вид возбудителя и его вирулентность, тропизм возбудителя к плаценте, органам и тканям плода, пути проникновения микроорганизмов от матери к плоду, защитные резервы матери и плода [17].
При наличии инфекции в амниотической жидкости повышается уровень липополисахаридов с последующей активацией деятельности клеток фетального трофобласта, что приводит к усиленному синтезу ими цитокинов: IL 1, 6, 8, 10, TNF. Они, в свою очередь, создавая условия для повышения метаболизма цАМФ, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать – плацента – плод [16]. При участии цитокинов, под воздействием эндотоксинов и фосфолипаз микроорганизмов происходит высвобождение арахидоновой кислоты из тканевых фосфолипидов, вызывая синтез простагландинов. Простагландины Е2 и F2α являются медиаторами деградации интерстициального коллагена I типа, дилатации шейки матки и развития родовой деятельности [15]. Однако по данным зарубежной литературы, концентрации регуляторных цитокинов IL 4 и IL 10 оказываются меньше значений, чем у здоровых женщин [20].
Циркуляция вирусов в крови или наличие гнойно-воспалительного очага в организме матери способствует гематогенному или трансплацентарному пути передачи инфекции к плоду [3, 5]. Отмечены случаи трансдецидуального пути проникновения инфекции (из гнойных очагов между стенкой матки и плодными оболочками) и нисходящего пути (через маточные трубы из возможных очагов в брюшной полости). В тоже время, наличие массивной инфекции у женщин вирусной или бактериальной этиологии может не вызывать инфицированности у плода [3, 9, 14, 15].
Таким образом, степень выраженности патологического влияния инфекции на плод и новорожденного зависит от характера изменений иммунного статуса беременной. Повышенный рост титра активных антител, может выступать в качестве прямых патогенных факторов по отношению к плоду. В свою очередь тяжесть общего клинического состояния и частота нарушений физиологического течения раннего неонатального периода зависит от выраженности изменений содержания данных антител.
Во время физиологически протекающей беременности меняются функции Т-системы иммунитета у матери за счет выработки цитотрофобластом иммунодепрессантов, возникает состояние физиологической иммуносупрессии и развитие вторичного иммунодефицита, создавая хорошие условия для реактивации хронической инфекции [19]. У беременных с персистирующей бактериальной инфекцией снижается интерфероносинтезирующая функция лейкоцитов, развивается ферментативный дисбаланс иммунокомпетентных клеток [14]. При вирусных заболеваниях снижается количество лимфоцитов, угнетается их бластная трансформация, с последующим подавлением ими синтеза α и γ-интерферона [8].
При выявлении плацентарной недостаточности инфекционного генеза необходимо определение причины, которая ее вызвала [1]. Методы диагностики плацентарной недостаточности включают в себя: 1) стандартные, свидетельствующие о степени и характере изменений происходящих в плаценте, 2) специфические обследования на вид возбудителя у беременных с высоким риском развития ПН.
К стандартным методам относятся исследования гормональной (плацентарного лактогена, трофобластического бета-1-гликопротеина (ТБГ), хорионического гонадотропина, эстриола и кортизола в сыворотке крови беременных) [10] и метаболической функции плаценты, ультразвуковое исследование, допплерометрия кровотока в сосудах фетоплацентарного комплекса, морфологическая диагностика плаценты [2, 11]. Причем оценка нарушений метаболизма (изменение уровня плацентарной щелочной фосфатазы), образование продуктов свободно-радикальных реакций, сдвиги кислотно-основного состояния позволяют диагностировать хроническую ПН на доклиническом этапе.
При развитии инфекционного процесса определение белков острой фазы (БОФ), например, лактоферрина (ЛФ) [4], позволяет определить напряженность организма, связанную с бактериальной агрессией, при этом концентрация ЛФ в плазме крови не зависит от степени ее насыщения железом [7]. ЛФ синтезируются клетками сыворотки крови нейтрофилами [7], стимулируют фагоцитарные и цитотоксические свойства макрофагов, повышая их бактерицидную активность, а так же угнетают реакцию СЗ и С5 компонентов комплемента с иммунными комплексами по классическому пути, оказывая супрессивное действие на выработку IL 1 [6].
При ПН инфекционного генеза и ВУИ важную роль играет исследование амниотической жидкости на противовоспалительные цитокины (IL 6). Так повышение содержания IL 6 в слизи цервикального канала у беременных с вирусной инфекцией служит маркером ВУИ у плода [10].
При инфекционном процессе в репродуктивном тракте беременных происходит активация клеток иммунной системы, приводящее к индукции клеточного иммунного ответа и продукции провоспалительных цитокинов [13]. Выявление в сыворотке крови повышенной концентрации цитокинов говорит о нарушении принципа локальности функционирования цитокиновой системы, развивающееся при воспалительных процессах, и в дальнейшем сопровождающееся генерализованной активацией клеток иммунной системы [12]. Развитие воспалительного процесса в урогенитальном тракте беременных сопровождается антигенной стимуляцией макрофагов, нейтрофилов, лимфоцитов, усиленной продукцией цитокинов (IL 1, IL 6, IL 8, TNF и т.д.) с развитием синдрома системного воспалительного ответа [12,17]. В результате этого, по мере развития инфекционного процесса, возникает гипоксия плода. В зависимости от компенсаторных возможностей организма имеющиеся метаболические расстройства у плода, могут приводить к нарушению функционального состояния матери и плода [2]. Развитие явлений плацентита при ПН инфекционного генеза приводит к системным нарушениям гормонального баланса, иммунного и цитокинового статусов [11, 18].
Учитывая короткий период полужизни цитокинов, тесный биологический эффект одного цитокина, с действием других нацеливает клиницистов на поиск новых маркеров активации иммунной системы.
Таким образом, диагностика плацентарной недостаточности инфекционного генеза, особенно на ранних этапах ее развития, требует детального исследования беременных на инфекции, передаваемые половым путем и выделение пациенток в группу риска по развитию ВУИ. Необходимо своевременное проведение ультразвуковой диагностики ПН и ВУИ, с назначением адекватной терапии с учетом сложившейся клинической ситуации.
Список использованных источников:
1. Бубнова Н.И., Зайдиева З.С., Тютюнник В.Л. Морфология последа при генитальной герпетической инфекции// Акушерство и гинекология. – 2001. – № 6. – С. 24-29.
2. Введение в клиническую морфологию плаценты человека/ Под ред. А.Ф.Яковцевой.- Саратов: Изд-во Саратовского ун-та, 1991.- 168 с.
3. Веденеева Г.Н., Фоменко Б.А., Евсюкова И.И., Сельков С.А. Состояние и последующее развитие новорожденных детей от матерей с ЦМВИ// Российский вестник перинатологии и педиатрии. – 1997. – № 3. – С. 25-29.
4. Гнипова В.В. Оптимизация патогенетической терапии у женщин с привычным невынашиванием беременности I триместра на основании исследования состояния эндометрия: Автореф. дис. … канд. мед. наук. - М., 2003. - 20 с.
5. Димитрова В.И. Оздоровление женщин после неразвивающейся беременности: Автореф. дис. … канд. мед. наук. - М., 2006.-22 с.
7. Ефремов С.Н., Цхай В.Б., Пуликов А.С., Макаренко Т.А. Морфофункциональные особенности плаценты при хламидиозе// Вестник перинатологии, акушерства и гинекологии. – Красноярск, 2000. – Вып. 7. – С. 46-49.
8. Запертова Е.Ю. Роль ряда цитокинов и интегринов в генезе привычного невынашивания беременности: Автореф. дис. … канд. мед. наук. -М., 2005.- 24 с.
10. Макаров И.О. Функциональное состояние системы мать-плацента-плод при гестозе: Дис. . докт. мед. наук. – М. – 1998.
12. Назаров П.Г. Реактанты острой фазы воспаления. – СПб.: Наука, 2001. – 423с.
13. Останин А.А., Макагон А.В., Леплина О.Ю. Показатели иммунитета плода в ранней диагностике внутриутробной инфекции// Медицинская иммунология. – 2001. – Т. 3, № 4. – С. 515-524.
14. Савичева А.М., Башмакова М.А., Аржанова О.Н. и др. Инфекции у беременных// Журналъ акушерства и женскихъ болезней.-2002.-Вып.2-Т.LI.- С.71-77.
15. Серов В.Н., Тютюнник В.Л., Зубков В.В., Зайдиева З.С. Перинатальные исходы у беременных с инфекционными заболеваниями и плацентарной недостаточностью// Акушерство и гинекология. – 2002. – № 3. – С. 16-21.
16. Тареева Т.Г. Перинатальные аспекты смешанной урогенитальной инфекции (патогенез, прогнозирование, профилактика): Дис. . докт. мед. наук. – М. – 2000.
17. Тютюнник В.Л. Хроническая плацентарная недостаточность при бактериальной и вирусной инфекции (патогенез, диагностика, профилактика, лечение): Дис. . докт. мед. наук. – М. – 2002.
18. Шуршалина А.В. Хронический эндометрит у женщин с патологией репродуктивной функции: Автореф. дис. . докт. мед. наук. -М., 2007.- 38 с.
19. Hallman M. Intrauterine infections and the fetus// Duodecim. – 1999. – Vol. 115, № 14. – P. 1437-1438.
20. Yamada H., Kato E.H., Tsuruga R. et al. Insulin response patterns contribute to different perinatal risks in gestational diabetes// Gynecol.Obstet.Invest.-2001.-Vol.51.-P.103-109.
21. Kingdom R., Gupta N., Nair D. et al. Screening for TORCH-infections in pregnant women: a report from Delhi// Southeast. Asian. J. Trop. Med. Public. Health. – 1999. – Vol. 30, № 2. – P. 284-286.
Подписано в печать: 12.01.2012
Гиперплазия плаценты — увеличение толщины и объема плацентарной ткани, связанное с действием компенсаторных и патологических факторов. Специфические клинические симптомы отсутствуют. На поздних этапах при наличии плацентарной недостаточности патология проявляется изменением активности плода — усилением или замедлением его шевелений. Для постановки диагноза используют УЗИ матки, КТГ, допплерографию плацентарного кровотока, инвазивные пренатальные методы исследований, лабораторные анализы. Лечение направлено на улучшение кровотока в маточно-плацентарной системе, устранение причины расстройства и коррекцию сопутствующих нарушений.
Общие сведения
В современном акушерстве утолщение плаценты рассматривается не как отдельная нозологическая единица, а как важный диагностический признак, свидетельствующий о наличии другой патологии. В норме по мере развития беременности плацентарная ткань постепенно утолщается, достигая максимальных размеров к 34-36 неделе. После этого ее рост останавливается, а объем остается таким же или даже несколько уменьшается. При гиперплазии плаценты ее масса достигает 750 г и более вместо средних 400-600 г, а плодово-плацентарный коэффициент, отражающий соотношение веса ребенка и плацентарной ткани, к концу беременности составляет не более 2-3 вместо нормальных 6-7.

Причины гиперплазии плаценты
Утолщение плацентарной ткани обычно является следствием компенсаторных реакций и защитных механизмов, призванных обеспечить оптимальные условия развития и безопасность плода. В ряде случаев увеличение массы плаценты вызвано патологическими изменениями в ее тканях. По мнению специалистов в сфере акушерства и гинекологии, основными причинами гиперплазии органа являются:
- Гемолитическая болезнь плода. Увеличенная плацента — один из признаков, по которым можно заподозрить изосерологическую несовместимость крови ребенка и матери. При иммунном конфликте по Rh-фактору и группе крови истинная гиперплазия плацентарной ткани с ангиоматозом ее ворсин способствует достаточной оксигенации плода.
- Выраженная анемия матери. При снижении уровня гемоглобина до 70-80 и менее г/л включаются компенсаторные механизмы, направленные на улучшение кровоснабжения тканей плода. Объем плацентарной ткани увеличивается преимущественно за счет разрастания сосудов в хорионических ворсинах, что позволяет усилить кровоток и улучшить поступление кислорода к ребенку.
- Тяжелый диабет матери. Особенностью сахарного диабета I типа и гестационного диабета является ухудшение микроциркуляции в различных органах и тканях, в том числе плаценте. Компенсаторный ангиоматоз хориональных ворсин, приводящий к гиперплазии детского места, дает возможность улучшить кровоснабжение в фетоплацентарной системе, обеспечить плод кислородом и питательными веществами.
- Гестозы. Патологический спазм сосудов, составляющий основу таких осложнений беременности, нарушает микроциркуляцию, способствует повышению сосудистой проницаемости и накоплению жидкости в интерстициальной ткани. Аналогичные процессы происходят в плаценте – хорионические ворсины отекают, что приводит к ложной гиперплазии органа.
- Врожденные пороки развития. Гиперплазированная плацента обеспечивает нормальную оксигенацию тканей ребенка с застойными пороками сердца, кистозно-аденоматозным пороком легких, врожденной тератомой, нейробластомой, лейкемией. Такие дефекты возникают при генетических аномалиях, внутриутробном заражении краснухой, цитомегаловирусом, парвовирусом B19, токсоплазмозом.
- Хронические эндометриты. Воспалительные процессы в эндометрии, вызванные возбудителями гонореи, сифилиса, хламидиоза, микоплазмоза и других ЗППП, могут нарушить нормальное формирование плаценты. Увеличение количества сосудов в ворсинах, сопровождающееся истинной гиперплазией тканей, является компенсацией первичной плацентарной недостаточности.
- Острые инфекционные заболевания матери. Разрастание плаценты у беременных, перенесших грипп, ОРВИ, другие инфекционные болезни, носит преимущественно защитный характер. В таких случаях увеличение плаценты направлено на усиление иммунного эффекта. Кроме того, компенсаторный ангиоматоз предотвращает возможные нарушения микроциркуляции.
- Многоплодная беременность. Для адекватного развития в матке двух и более плодов требуется большее количество плацентарной ткани. Истинная компенсаторная гиперплазия детского места в случае вынашивания близнецов позволяет поставлять развивающимся плодам достаточное количество кислорода и питательных веществ. При недоразвитии плаценты возможна гибель одного из детей.
- Заболевания плаценты. Масса плаценты возрастает при наличии в ее структуре объемных образований — первичных опухолей (хориоангиом, хорионтератом) и гнойных абсцессов. Хотя неоплазии плаценты обычно имеют небольшие размеры, их диаметр иногда достигает 5 см и более. Детское место также утолщается при воспалении плодных оболочек (хориоамнионите).
Патогенез
Механизм гиперплазии плаценты напрямую зависит от причин, спровоцировавших утолщение детского места. При истинном разрастании плацентарной ткани в основе патогенеза лежит компенсаторный ангиоматоз, возникший в ответ на кислородное голодание плода. Для улучшения фетоплацентарного кровоснабжения количество сосудов в ворсине хориона увеличивается с 4-6 до 25-50 и более, из-за чего плацента становится толще. При ложной гиперплазии размер и толщина детского места изменяются вследствие патофизиологических процессов, характерных для основного заболевания. Обычно в этих случаях объем органа увеличивается за счет отека интерстиция, реже — фиброзных и деструктивных изменений. При некоторых состояниях включаются оба механизма — компенсаторный и патологический.
Симптомы гиперплазии плаценты
На ранних этапах заболевания какие-либо клинические проявления отсутствуют, утолщение органа часто становится случайной находкой при проведении планового УЗИ после 20-й недели беременности. По мере прогрессирования гиперплазии могут возникнуть признаки, характерные для плацентарной недостаточности, — плод становится более активным, что проявляется усилением и учащением его шевелений. Прогностически неблагоприятным симптомом, при появлении которого требуется срочная консультация акушера-гинеколога, является затихание движений ребенка. Значительное увеличение живота отмечается только при сочетании гиперплазии с многоводием.
Осложнения
Последствия для плода и матери, возникающие при наличии гиперплазии плаценты, связаны с возможным нарушением ее основных функций — питательной, гормональной и защитной. При наличии патологических процессов и деструкции плацентарной ткани развивается фетоплацентарная недостаточность, влекущая за собой задержку внутриутробного развития, гипотрофию, гипоксию и в крайних случаях гибель ребенка. У беременных с увеличенной плацентой повышается риск преждевременных родов и необходимости кесарева сечения. Нарушение секреции гормонов (эстрогенов, прогестерона, хорионического гонадотропина, плацентарного лактогенного гормона, релаксина) чревато слабостью родовой деятельности, повышенным родовым травматизмом, гипотоническими кровотечениями в послеродовом периоде, гипогалактией.
Диагностика
Задачами диагностического этапа являются оценка степени гиперплазии плаценты, выявление структурных изменений и признаков функциональной недостаточности, уточнение причин, приведших к увеличению органа. Комплексное обследование включает инструментальные и лабораторные методы, позволяющие получить точные данные о состоянии плацентарной ткани, плода и беременной женщины. Для целей диагностики наиболее ценными являются:
Для оценки функционального состояния организма женщины и выявления экстрагенитальной патологии назначают общие анализы крови и мочи, биохимическое исследование крови, определяют уровень глюкозы. В качестве вспомогательных методов обследования плода рекомендованы его фетометрия и эхокардиография. Дифференциальная диагностика проводится между заболеваниями и патологическими состояниями, провоцирующими утолщение плаценты. При необходимости пациентку консультируют эндокринолог, дерматовенеролог, инфекционист, уролог, врач-генетик.
Лечение гиперплазии плаценты
Основными целями терапии являются устранение заболевания, вызвавшего гиперпластические нарушения в плаценте, и нормализация маточно-плацентарного кровоснабжения. Кроме применения медикаментов женщине рекомендуют изменить образ жизни: увеличить время отдыха и ночного сна, полноценно питаться, избегать переохлаждений, значительных физических и эмоциональных нагрузок, дозированно выполнять специальные упражнения для беременных. При утолщенной плаценте пациентке назначают:
- Этиологическое лечение. Выбор конкретного метода или схемы зависит от основной патологии. При выраженном резус-конфликте используют интраперитонеальную гемотрансфузию, при анемии — препараты железа с аскорбиновой кислотой, при инфекционных процессах — антибиотики, при сахарном диабете — сахароснижающие средства и т. п.
- Препараты, нормализующие плацентарный кровоток. Чтобы улучшить перфузию, применяют актовегин , периферические вазодилататоры, антикоагулянты и антитромботические препараты, которые нормализуют микроциркуляцию крови в плаценте, ускоряют процессы утилизации глюкозы и кислорода, повышая устойчивость к гипоксии.
Дополнительно в схему лечения гиперплазии включают витаминно-минеральные комплексы, иммунокорректоры и эссенциальные фосфолипиды. Прерывание беременности выполняется только в тяжелых случаях конфликта по резус- или AB0-факторам либо при обнаружении другой патологии, представляющей непосредственную угрозу здоровью и жизни беременной или плода.
Прогноз и профилактика
Прогноз зависит от причины, вызвавшей гиперплазию плаценты, и в большинстве случаев при адекватном комплексном лечении является благоприятным. Профилактика направлена на раннюю диагностику генитальной и экстрагенитальной патологии, возможных пороков развития ребенка. Рекомендованы планирование беременности, своевременная постановка на учет в женской консультации, регулярное прохождение УЗИ-скрининга, санация очагов хронической инфекции, ограничение пребывания в местах скопления людей при эпидемиологически неблагоприятной ситуации, прием препаратов железа для предупреждения анемии.
Внутриутробная инфекция (ВУИ) представляет собой серьезную проблему современной перинатальной медицины, так как данное осложнение может быть причиной перинатальной патологии и смертности матери и ребенка [1-3, 6, 9].
ВУИ играет важную роль в генезе различных патологических процессов при беременности, оказывает вредное влияние на исход беременности и состояние новорожденного. В подавляющем большинстве случаев ВУИ является причиной антенатальной патологии: 32% самопроизвольного выкидыша, 24% внутриутробной задержки развития плода и преждевременных родов. Наиболее распространенным представителем нативных вирусов является герпесвирусная инфекция, частота обнаружения вируса простого герпеса (ВПГ) составляет 98,9% среди взрослого населения земного шара [1, 2, 4, 7].
В последние годы отмечается тенденция к увеличению инфицирования беременных ВПГ. Генитальной герпетической инфекции уделяется большое внимание, так как ее способность активно размножаться в плаценте и эмбриональных тканях, проникать через плацентарный барьер и вызывать внутриутробное поражение плода приводит к формированию плацентарной недостаточности и развитию пороков развития плода [1-3, 6].
Возрастающая роль внутриутробных инфекций среди причин неблагоприятных перинатальных исходов определяет актуальность всестороннего изучения этой проблемы.
Цель исследования: изучение роли ВПГ в генезе плацентарной недостаточности и определение специфических изменений в плаценте женщин с генитальной герпетической инфекцией.
Материалы и методы исследования. Под нашим наблюдением находилось 204 женщины с диагностированной вирусной инфекцией, Возраст больных составлял от 18 до 37 лет. У всех пациенток в анамнезе (1,2±0,4 года назад) были перинатальные потери, хронические воспалительные заболевания репродуктивной системы, что и послужило основанием для проведения детального клинико-лабораторного, в том числе серологического, обследования на наличие вирусной инфекции. Также проводилось ультразвуковое исследование плода и плаценты в 16-17, 24-28 недель гестации и накануне родов с осуществлением допплерометрии и ультразвуковой фетометрии плода.
Макроскопическое, морфометрическое, гистологическое и иммуногистохимическое исследование плаценты, пуповины и околоплодных оболочек.
Результаты. Методом ПЦР в большинстве случаев обнаружен вирус генитального герпеса в виде моноинфекции у 19,2% (n=40) беременных. У 80,7% (n=164) беременных отмечалось сочетание герпетической инфекции с цитомегаловирусом, а также бактериально-кандидозной инфекций шейки матки. Детальное изучение акушерского анамнеза позволило выделить высокий процент 40,4% (n=82) самопроизвольных выкидышей в ранние сроки гестации, а у 13,5% (27 женщин) в поздние сроки гестации. В 23,0% (n=47) отмечена неразвивающаяся беременность. Преждевременные роды - выявлены в 22,1% (n=45) случаев. 13,5% (n=27) женщин перенесли операцию по поводу внематочной беременности, у 12,5% (n=25) пациенток роды закончились перинатальной смертью новорожденного на различные сутки жизни. У 10,5% (n=21) женщин беременность была прервана по мед. показаниям в различные сроки гестации по поводу аномалии развития и уродства плода, что может быть связано с патогенным действием вируса герпеса на яйцеклетку. В 9,6% (n=19) случаев отмечалось вторичное бесплодие, а в меньшинстве 5,7% (n=11) случаев отмечено антенатальная гибель плода. Наиболее часто встречающимся осложнением родового акта у беременных явилось несвоевременное излитие околоплодных вод 31,7%. При ультразвуковом исследовании выявлен кальциноз плаценты различной степени выраженности 42,4%, задержка внутриутробного развития плода с отставанием от гестационного срока на две недели 10,1%, многоводие 13,4%, маловодие 14,5%, преждевременное созревание плацент в 22,7%. Допплерометрическое исследование позволило в 49,7% случаев выявить нарушения со стороны фето- и маточно-плацентарного кровотока.
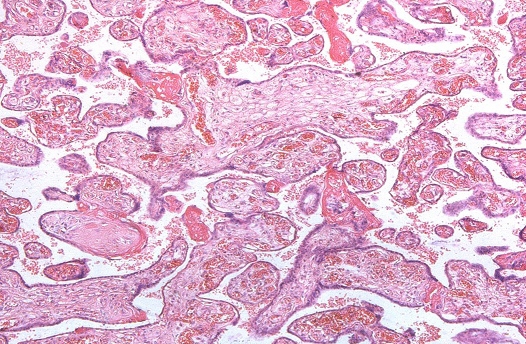
Рис. 1. Патологическая незрелость ворсин хориона при герпесвирусной инфекции у беременных
В ткани плаценты с помощью флюоресцирующих моноклональных антител выявлялись антигены вируса простого герпеса 1-го и 2-го типа. Причем 1-й тип у 15%, 2-й у 40%, сочетание 1-го и 2-го типов у 45%. Светооптически в плаценте пораженных только вирусом простого герпеса 1-го или 2-го типа, изменения идентичны. Характерным является наличие ограниченного продуктивного очагового воспаления с вовлечением в патологический процесс плодовой и материнской частей плаценты. При этом в эпителии амниона, синцитиотрофобласте, эндотелии сосудов, клетках базальной пластинки и септ выявляются гигантские одноядерные клетки с крупными гиперхромными ядрами, содержащими базофильное включение. Последние отделены от кариолеммы полоской просветления и содержат антиген вируса простого герпеса. Часть клеток эпителия амниона и трофобласта претерпевает некротические изменения. Во всех случаях наблюдаются распространенные поражения стенок сосудов ворсин в виде очагового эндоваскулита, иногда с некрозом части внутренней выстилки и формированием тромбов. Интервиллезит встречается нечасто и носит очаговый характер. Более типичными являются кровоизлияния или очаги тромбоза в межворсинчатом пространстве. Базальный децидуит различной степени выраженности имеется во всех наблюдениях. Некротические изменения встречаются как в отдельных клетках, так и в виде очагов. Постоянно выявляются участки склероза, диффузные отложения солей кальция, фибриноида в ворсинах и базальной пластинке.
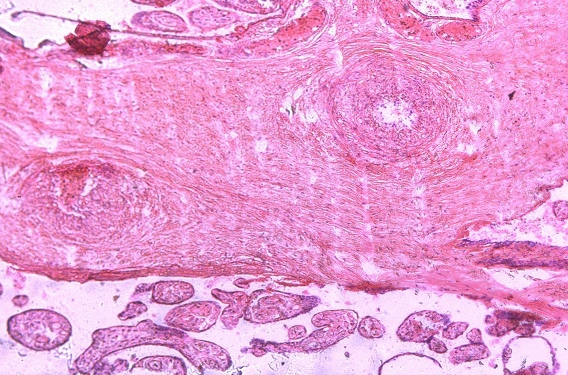
Рис. 2. Отложение фибриноида в прилежащем межворсинчатом пространстве
Изменения в плаценте во многом зависят от времени возникновения рецидивов и их количества. Степень деструкции более выражена у пациенток, имевших 4 рецидива и более.
Обострение заболевания в 1 и II триместрах беременности морфологически манифестируется фибропластическими изменениями. В сосудах стволовых, зрелых промежуточных и терминальных ворсин имеются проявления продуктивного васкулита, с фиброзом стенок, облитерацией и стенозом просвета отдельных из них. Хориальная пластинка выглядит утолщенной, интенсивно окрашивается фуксилином по Ван-Гизону. Плодные оболочки отечны, эпителий их местами утолщен, образует несколько рядов. Воспалительные изменения носят очаговый характер. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 15,3±0,62%; 46,0±3,24% содержат 1-2 капилляра, 24,8±0,96% - 3-5 капилляров, 9,4±0,86% - 10 капилляров, 4,5±0,11% - более 10 капилляров. При наличии низкого коэффициента плотности расположения ворсин (2,35±0.4) дети рождаются с нормальной массой тела, что свидетельствует о компенсированной трофической функции плаценты. Уменьшение объема материнской крови в межворсинчатом пространстве (коэффициент 4,7±0,24) сопровождается гипотрофией плода.
Возникновение рецидивов герпетической инфекции в III триместре беременности сочетается с альтеративными процессами в структурах последа. В базальной пластинке, септах, крупных и мелких ворсинах, амнионе, гладком хорионе обнаруживаются резко выраженные дистрофические изменения, некробиоз, очаги фибриноидного некроза. При этом имеется лимфоидно-плазмоцитарная и лимфоидно-макрофагальная воспалительная реакция, нередко с гигантоклеточным метаморфозом и очаговыми кровоизлияниями.
При этом микроскопически в амнионе и пуповине определяются банальная флора (кокки, палочки и др.), париетальный хориоамнионит и париетальный децидуит. Воспалительный инфильтрат содержит преимущественно полиморфноядерные лейкоциты. Фуникулит сопровождается воспалительной инфильтрацией стенок пупочной вены (лишь в одном наблюдении имелась нерезко выраженная воспалительная инфильтрация стенки одной из пупочных артерий). Значительные изменения имеются в сосудах ворсин различного калибра. Продуктивное или смешанное экссудативно-продуктивное воспаление в стенках сочетается со стенозированием их просвета, крайне редко с облитерацией. В межворсинчатом пространстве воспалительные изменения носят ограниченный очаговый характер и представлены скудной лимфоидно-плазмоцитарной инфильтрацией, наличием нитей фибрина. В ворсинах имеются отложения солей кальция, выявляется железо. В 10 наблюдениях констатированы очаговые кровоизлияния в межворсинчатом пространстве. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 13,8+0,3%; 37,2±1,22% содержат 1-2 капилляра, 24,0±1,1% - 3-5 капилляров, 7,6±0,31% - 6-10 капилляров.
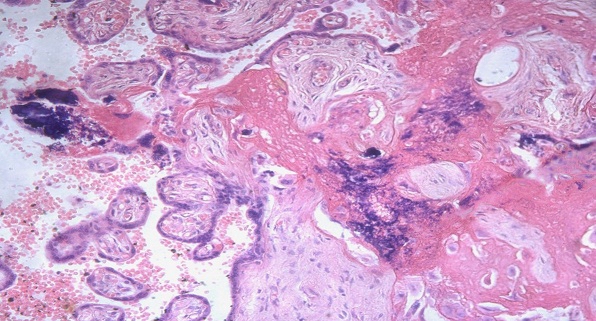
Рис. 3. Некроз и лимфоидная инфильтрация стромы базальной пластины у беременных с герпесвирусной инфекцией
Наряду с описанными изменениями, характеризирующими нарушение созревания плаценты, ее повреждение и воспаление, имеют место различной степени выраженности компенсаторно-приспособительные процессы. Последние определяются степенью васкуляризации ворсин, зависящей от времени возникновения рецидива, наличием функционирующих синцитиальных узелков и количеством циркулирующей материнской крови в межворсинчатом пространстве. Функционирующие синцитиальные узелки, отражающие пролиферативные возможности трофобласта, имеются во всех случаях. Они представляют собой скопление базофильных, тесно прилежащих друг к другу ядер. Нередко эти структуры образуют "мостики", связывающие между собой терминальные ворсины и поддерживающие их внутреннее взаиморасположение. При морфологическом исследовании плацент детей, родившихся в удовлетворительном состоянии и массой тела более 3000 г., выявлены, наряду с нарушением их созревания, повреждением и воспалением, хорошо развитые компенсаторно-приспособительные процессы, основная масса терминальных ворсин была хорошо васкуляризирована. Морфометрически установлено, что 0,95% терминальных ворсин были бессосудистыми, 1,4% ворсин содержали 1-2 капилляра, 2,4% - 3-5 капилляров, 1,1%- 6-10 капилляров и 0,94% - более 10 капилляров. Это свидетельствовало о значительной гиперваскуляризации терминальных ворсин, что обеспечило хорошее внутри-утробное развитие плода. Хорошо была представлена пролиферация синцитиотрофобласта с образованием синцитиальных почек и синцитиальных мостиков. Описанные изменения указывали на наличие компенсированной формы относительной плацентарной недостаточности.
При морфологическом исследовании последов детей, родившихся с явлениями гипотрофии, наряду с характерными изменениями и различной степени выраженности компенсаторно-приспособительными реакциями, имелось явная редукция сосудистого русла ворсинчатого хориона. Это сочеталось с повышением коэффициента плотности ворсин, который составил 4,09±0,06 и, как следствие этого, объем материнской крови в межворсинчатом пространстве был уменьшен. Эти изменения соответствовали относительно субкомпенсированной форме плацентарной недостаточности.
При морфологическом исследовании плаценты после самопроизвольного выкидыша наряду с выраженными альтернативными и воспалительными изменениями отмечалась резкая задержка развития ворсинчатого хориона, выраженный продуктивный васкулит, что сочеталось со слабовыраженными компенсаторно-приспособительными процессами и свидетельствовало о тяжелом герпетическом поражении плаценты с явлениями декомпенсированной формы хронической плацентарной недостаточности.
Заключение. Генитальная герпетическая инфекция приводит к развитию хронической плацентарной недостаточности, степень тяжести которой зависит от времени, частоты и длительности рецидивов заболевания. Изменения в плаценте характеризуются наличием как деструктивных, так и компенсаторных процессов, степень сохранности которых определяет дальнейшее развитие и состояние плода.
Беременных с данной патологией следует отнести к группе высокого риска по возможности развития плацентарной недостаточности. В план обследования пациенток с данной патологией должны быть включены современные методы диагностики состояния фетоплацентарного комплекса и морфологическое исследование последа. Выявленные морфологические изменения последа позволяют своевременно начать патогенетически обоснованную терапию новорожденных, что способствует снижению частоты тяжелых форм неонатального герпеса.
Список использованных источников:
1. Каримова Ф.Д., Раджабова З.А. Современные аспекты патогенеза, диагностики и лечения герпесвирусной инфекции. Метод. пособие. 2008 - С. 1-13.
2. Андриевская И.А. Состояние стероидогенеза в системе мать плацента плод при обострении герпесной инфекции// Бюл. физиол. и патол. дыхания. - 2004. - Вып. 17. - С. 65-68.
3. Довжикова И.В. Гистохимическая характеристика этапов синтеза холестерина в плаценте беременных, перенесших обострение герпесвирусной инфекции// Бюл. физиол. и патол. дыхания. - 2008. - Вып. 28. - С. 17-20.
4. Сухих Г.Л., Ванько Л.В. Иммунология беременности. - М: РАМН, 2003; 400 с.
5. Brown Z. Preventing herpes simplex virus transmission to the neonate// Herpes. - 2004; 11; 3: 175-186.
6. Gerber S., Hohlfeld P. Screening for infectious diseases// Childs Nerv Syst - 2003; 19: 7-8: 429-432.
7. Jonsson M.K., Wahren B. Sexually transmitted herpes simplex viruses// Scand J Infect Dis - 2004; 36: 2: 93-101.
8. Leung D.Т., Sacks S.L. Current treatment options to prevent perinatal transmission of herpes simplex virus// Expert opin Pharmacother 2003; 4: 10: 1809-1819.
9. Schleiss M.R. Vertically transmitted herpes virus infections// Herpes 2003; 10: 1:4-11.
10. Henderson J.L., Weiner C.P. Congenital infection// Curr. Opin. Obstet, Gynecol. 2005, vol. 7, № 2, p. 130–134.
Подписано в печать: 11.01.2012
Читайте также:

