Инфекция вызванная burkholderia pyrrocinia dsm10685 что вызывает
Обновлено: 24.04.2024
Инфекции вызванные Burkholderia cepacia, Burkholderia pseudomallei, Stenotrophomonas maltophilia, Acinetobacter
Burkholderia cepacia. Возбудитель хронических заболеваний лёгких у пациентов с муковисцидозом. Инфекция характеризуется нарушениями функции лёгких и молниеносной септицемией. В лечебных учреждениях происходит её передача от одного пациента с муковисцидозом к другому. Возбудитель обладает природной устойчивостью к большинству антибиотиков.
Антимикробную терапию назначают только после проведения тестов на чувствительность микроорганизма к антибактериальным препаратам (обычно применяют цефалоспорины широкого спектра действия, карбапенемы или уреидопенициллины).
Burkholderia pseudomallei. Сапрофит, обитающий в почве и водоёмах тропической зоны. Вызывает мелиоидоз (ложный сап), характеризующийся туберкулёзоподобными симптомами и развитием острой септицемии или множественных абсцессов. Септицемия часто приводит к летальному исходу. Диагностические мероприятия включают бактериологическое исследование крови и тканей больного. Для лечения используют цефтазидим.
Другой вид рода Burkholderia — Burkholderia mallei — вызывает похожую инфекцию у лошадей (сап), которая может перейти к человеку.
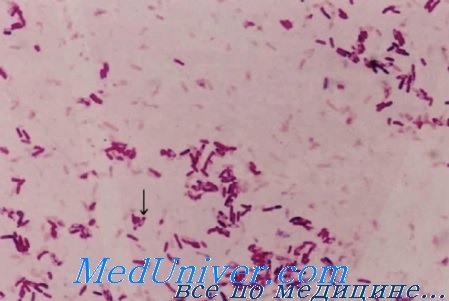
Возбудитель инфекции - бактерия Burkholderia cepacia
Stenotrophomonas maltophilia — грамотрицательная палочка, обитающая в почве и воде. Охотно колонизирует влажные поверхности и благодаря природной устойчивости к большинству антибиотиков представляет серьёзную угрозу для пациентов, помещённых в отделение интенсивной терапии, и для лиц со сниженным иммунитетом. Инфекция распространяется через предметы общего пользования и медицинские принадлежности (например, ингаляторы, катетеры идр.). Возбудитель вызывает септицемию и пневмонию.
Большинство штаммов устойчивы к действию аминогликозидов и карбапенемов, однако чувствительны к ко-тримоксазолу, тетрациклинам и иногда к цефалоспоринам широкого спектра действия.
Acinetobacter — мелкие грамотрицательные коккобациллы, обитающие в окружающей среде и обладающие природной устойчивостью к большинству антибиотиков. Обычно инфекция возникает у пациентов, находящихся на стационарном лечении (особенно в отделении интенсивной терапии). Возбудитель колонизирует различные предметы в местах с высокой влажностью (например, увлажнители воздуха) и вызывает вспышки мультирезистентных инфекций. При генерализированном течении развивается пневмония, септицемия, менингит и инфекции мочевыводящих путей.
В группу риска входят пациенты, принимающие антибиотики, с множеством установленных катетеров, после интубации трахеи. Антибактериальное лечение назначают после проведения тестов на чувствительность к антибиотикам.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции вызванные Pseudomonas aeruginosa: диагностика, лечение, профилактика
К роду Pseudomonas относят возбудителей, обитающих в окружающей среде и при определённых условиях вызывающих инфекционный процесс у человека (оппортунистические инфекции). Наиболее патогенной бактерией считают Pseudomonas aeruginosa.
Pseudomonas aeruginosa - аэробная грамотрицательная подвижная палочка, широко распространена в окружающей среде. В микрофлоре у здоровых людей её определяют достаточно редко. Вероятность носительства повышается у пациентов, находящихся на стационарном лечении. Источник P. aeruginosa —практически любые предметы (умывальные раковины, водопроводные краны, покрытые дезинфицирующими средствами поверхности) по истечении 24 ч после дезинфекции.
Патогенез инфекции вызванной Pseudomonas aeruginosa. Pseudomonas aeruginosa вырабатывает цитотоксины и протеазы (экзотоксины А и S, гемолизины и эластазу). Возбудитель, выделенный от пациентов с муковисцидозом, способен синтезировать полисахаридные альгинаты, что облегчает образование микроколоний, защищает их от опсонизации, фагоцитоза и воздействия антибиотиков. Факторы адгезии — альгинаты, пили и наружные мембранные белки.
Образование альгинатов сопровождается уменьшением подвижности возбудителя и снижением синтеза экзотоксинов, развитием реакций гиперчувствительности к антибиотикам, снижением синтеза липополисахарида.
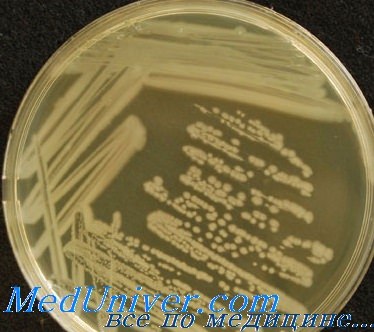
Pseudomonas aeruginosa
Клинические признаки инфекции вызванной Pseudomonas aeruginosa. Быстрее всего прогрессируют инфекционные поражения роговицы и наружный отит. Воротами инфекции могут быть ожоговые и раневые поверхности, при этом возможно развитие вторичной септицемии. Последняя — наиболее частая причина смерти пациентов с нейтропенией.
Некоторые штаммы вызывают деструкцию кожных покровов и гангренозную эктиму. В дальнейшем может развиться остеомиелит, септический артрит и менингит (особенно после нейрохирургических операций). Хронический муковисцидоз приводит к прогрессирующему ухудшению функции лёгких.
Лабораторная диагностика инфекции вызванной Pseudomonas aeruginosa:
• Культивирование на простых и селективных питательных средах (с цетавлоном, иргазином и налидиксовой кислотой) при 42 °С.
• Изучение биохимических свойств возбудителя.
• Серотипирование по полисахаридному (О) и жгутиковому (Н) антигену.
• Фаготипирование.
• Бактериоцинотипирование.
• Молекулярное типирование [гель-электрофорез в пульсирующем электрическом поле (PFGE)].
Лечение инфекции вызванной Pseudomonas aeruginosa. Для лечения применяют аминогликозиды, кар-бапенемы, уреидопенициллины, цефалоспорины широкого спектра действия или фторхинолоны. Некоторым штаммам возбудителя свойственна мультирезистентность.
Профилактика и контроль инфекции вызванной Pseudomonas aeruginosa. В настоящее время вакцинацию не считают эффективным методом профилактики синегнойных инфекций. Для предотвращения распространения мультирезистентных штаммов необходима изоляция инфицированных пациентов и уменьшение количества влажных предметов (тампоны, бельё и др.), способных быть источниками инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции вызванные бактериями рода Borrelia: клиника, диагностика, лечение
Микроорганизмы рода Borrelia — спиральные бактерии с небольшим числом завитков. Переносчики заболеваний, вызываемых боррелиями, — членистоногие (вши и клещи). Единичные случаи инфекции регистрируют во всём мире, при этом чётко отмечены географические границы и специфичность хозяев. Так, только человек заражается возвратным эпидемическим тифом (возбудитель — В. recurrentis). Эпидемии возникают во время войн и массовых миграций, когда люди попадают на территорию обитания переносчиков инфекции (клещи и грызуны).
Возвратный тиф - инфекция вызванная бактериями Borrelia recurrentis
Попадая в кровоток, Borrelia вызывает лихорадку. В ответ на проникновение возбудителя в крови появляются антитела, но различные антигенные варианты микроорганизма обусловливают возможность возникновения рецидива. При отсутствии лечения заболевание заканчивается только при образовании антител ко всем возможным вариантам антигена.
Пациенты предъявляют жалобы на головные и мышечные боли, тахикардию и озноб. При осмотре обнаруживают гепатоспленомегалию и петехиальную сыпь. Длительность приступов 3—6 дней; рецидив возникает примерно через неделю. Эпидемический возвратный тиф характеризуется очень высокой смертностью (до 40%). При клещевом возвратном тифе последняя редко превышает 5%.
Наиболее частые причины смерти — нарушения сердечного ритма, вторично возникающие при миокардите, мозговые кровоизлияния, печёночная недостаточность. Для профилактики заболевания после укуса насекомых применяют доксициклин.
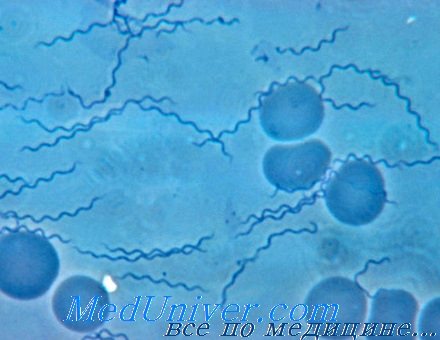
Возбудитель возвратного тифа - Borrelia recurrentis
Болезнь Лайма - инфекция вызванная бактериями Borrelia burgdorferi, afzelii, garinii
Сначала обнаруживают увеличивающееся в размерах красное пятно или папулу (хроническая мигрирующая эритема), затем возникают головные боли, конъюнктивит, лихорадка и региональная лимфаденопатия. Течение заболевания осложняется возникновением новых очагов на коже, миокардитом, артритом, асептическим менингитом, параличом черепных нервов и радикулитом. Иногда отмечают развитие хронического атрофического акродерматита. Диагностические мероприятия включают иммуноферментный анализ и вестернблоттинг.
Язвенно-плёнчатая ангина (Симановского-Плаута-Венсана) - инфекция вызванная бактериями Borrelia vincenti
Возбудители инфекции — Borrelia vincenti и фузобактерии (или другие анаэробные микроорганизмы ротовой полости).
Диагноз устанавливают на основании клинических данных и подтверждают выделением чистой культуры и микроскопией мазков, окрашенных по Граму. Для лечения применяют пенициллин и метронидазол.
Диагностика и лечение инфекции вызванной бактериями рода Borrelia
Диагноз ставят на основании определения боррелий при микроскопическом исследовании мазков крови. Кроме того, для диагностики болезни Лайма применяют ИФА.
На ранних стадиях болезни Лайма назначают доксициклин или амоксициллин. Цефтриаксон используют в терапии на поздних стадиях или рецидиве болезни Лайма. Кроме того, доксициклин считают препаратом выбора для лечения возвратного тифа. Хорошие результаты продемонстрировали клинические испытания вакцины против болезни Лайма, содержащей белок внешней мембраны возбудителя.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сепации опасны только для конкретной группы людей – это пациенты с онкологическими и онкогематологическими заболеваниями, а также с вирусом иммунодефицита человека, то есть для пациентов с измененным иммунным статусом. А теперь давайте вспомним, что происходит последние два года, когда иммунный статус больных изменяется медикаментозно, а также какое оборудование и методы используются для лечения. Сложим два плюс два и начнем нервно посматривать в сторону причины нашего сегодняшнего разговора.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
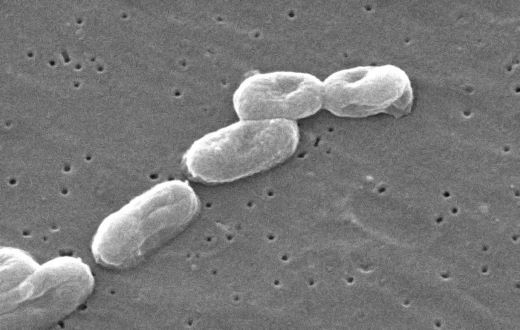
Сегодня мы будем разговаривать про неочевидного для нашей Азбуки возбудителя, а именно о Burkholderia cepacia.
Микробиологические аспекты
Все они относятся к аэробным грамотрицательным неферментерам (как и синегнойная палочка, за чью родственницу долго принимали сепацию).
Микробы комплекса легко растут на стандартных питательных средах, поэтому проблем с детекцией не будет даже в слабо оснащенной микробиологической лаборатории, но будут проблемы с определением антибиотикочувствительности.
Сепации обитают повсеместно (такое свойство мы обсуждали ранее для клостридий).
Они в состоянии выживать:
- в воде, в том числе морской
- почве, особенно заболоченной
- растениях (микроб в свое время был открыт как возбудитель луковой гнили)
Но нам больше интересны вопросы выживания в больничной среде, и здесь начинаются очень большие проблемы, рядом с которыми синегнойная палочка начинает выглядеть мягкой и пушистой (она всего-то только фурацилин на завтрак-обед-ужин употребляет). Итак, в больничных условиях Bcc может расти:
- в антисептиках
- в дезрастворах
- циркулирует в воздухе в виде аэрозоля (а значит, передается по вентиляции)
- в дистиллированной воде
- в распылителях
- сохраняет жизнеспособность на поверхностях более 24 часов
- живет в системах водоснабжения и трубках, предназначенных для орошения
То есть живет вообще везде и способна вызывать внутрибольничные вспышки в техотделениях, где находятся самые незащищенные от заражения иммунокомпрометированные пациенты, в том числе онкологического и онкогематологического профиля, а также пациенты с муковисцидозом, для которых сепация – самый настоящий бич.
В вопросах взаимоотношения с антибиотиками все очень и очень плохо с самого начала. Сепации природно устойчивы практически ко всему антибактериальному арсеналу и, наверное, проще сказать, к чему они могут быть природно чувствительны, но все же не будем нарушать общую структуру статей, да и в выдаче результата из лаборатории надо правильно ориентироваться.
Итак, B. cepacia изначально устойчива:
- к макролидам
- к линезолиду
- к природным пенициллинам (ими микробы натурально питаются, как синегнойка фурацилином)
- к тетрациклинам
- к нитрофуранам
- к аминогликозидам
- к полимиксину
- часто – к имипенему
Кроме того, обязательно необходимо определять чувствительность к следующим препаратам, так как она может варьироваться, то есть может быть изначальная как устойчивость, так и чувствительность, а потому определяем MIC к:
- к группе монобактамов,
- к ципрофлоксацину,
- к доксициклину,
- к ко-тримоксазолу,
- к хлорамфениколу.
К слову, стоит отметить, что B. cepacia – это не совсем уж абсолютное зло и человечество научилось использовать ее в мирных целях. Существуют запатентованные штаммы для сельского хозяйства, которые умеют разлагать токсические группы пестицидов и гербицидов и таким образом участвуют в рекультивации земель сельхозназначения. Но отсюда же возникает риск, который мы уже обсуждали в статьях о представителях семейства Enterobacteriaceae, когда одни штаммы обмениваются генами антибактериальной устойчивости с другими, дикими, то есть природными, и гены антибиотикорезистентности уходят из под контроля.
Клинические аспекты
B. cepacia может инфицировать любые локусы организма и вызывает:
- пневмонии,
- инфекции мочевыводящих путей (ассоциированные с установкой катетеров),
- перитониты,
- ожоговую инфекцию,
- раневую и послеоперационную инфекции,
- менингиты,
- эндокардиты,
- сепсис.
Конечно, до текущего времени о сепациях говорилось в основном в применении к пациентам с муковисцидозом, которые могут инфицировать друг друга как в больнице, так и вне ее. И для этой группы больных разработаны специальные рекомендации, чтобы те, кто носит сепацию, не пересекались с теми, кто еще не инфицирован (что вызывало и вызывает большие человеческие трагедии). И в этих случаях принципиально важно помнить, что Всс, полученная от больных, очень сильно отличается от штаммов, что живут в окружающей среде, и они опасны только для очень конкретной группы людей – это пациенты с онкологическими и онкогематологическими заболеваниями, а также с вирусом иммунодефицита человека, то есть для пациентов с измененным иммунным статусом. А теперь давайте вспомним, что происходит последние два года, когда иммунный статус больных изменяется медикаментозно, а также какое оборудование и методы используются для лечения. Сложим два плюс два и начнем нервно посматривать в сторону причины нашего сегодняшнего разговора.
В подтверждение логических размышлений автор хотел бы предложить для ознакомления следующие описания клинических случаев, которые пока, и это хорошо, не носят масштабного характера, но все же заставляют серьезно задуматься о, не побоимся этих слов, ближайшем будущем. Статьи англоязычные, но уровень современных нейросетей вполне позволяет читать почти нормальный машинный перевод. Итак,
На что еще необходимо обратить пристальное внимание, если вдруг (при наличии постоянного микробиологического мониторинга) у вас в отделении выскочила сепация? Во-первых, вспомним, что основной путь передачи – контактный, когда разлетается слюна (а мы помним, что, в отличие от коронавируса, эта маленькая дрянь висит аэрозолем в воздухе), либо опосредованно, где эти самые жидкости могли остаться – это санузлы (раковины и унитазы), полотенца, ручки на дверях. Во-вторых, главную опасность в плане вторичного инфицирования сепациями в условиях ковидариев несет, конечно же, медицинская аппаратура – маски, трубки, распылители, воздуховоды и т. п. Вот с этим и будем работать.
Терапевтические аспекты
Как видим, автор в своем репертуаре – пришел, нагнал ужасов, рассказав об очередной, не сказать, что часто встречающейся зверюге. А как лечить?
Не стану изменять себе и про очередного возбудителя скажу – и этим тоже лучше не заражать, так как существует четкая корреляция между появлением B. cepacia, ухудшением состояния пациента, развитием сепсиса и последующей смертью. Чтобы такого не происходило, надо понимать, в каких условиях мы работаем, особенно когда имеем дело с тяжелой категорией пациентов, находящейся на вентиляции любого типа. То есть снова возвращаемся к вопросам наличия микробиологической лаборатории. Она же ответит нам на вопрос – чем лечить, так как природная сепация, по факту, чувствительна только к нежно любимому мной цефтазидиму (вот тут ему написана буквально ода) и меропенему. Для препаратов, демонстрирующих переменную чувствительность (ципрофлоксацин, доксициклин, ко-тримоксазол и хлорамфеникол) нужно обязательно исследовать чувствительность с применением MIC, а не диско-диффузионных методов.
Для больных муковисцидозом давно и тщательно разработаны схемы назначения антибактериальных препаратов даже не с профилактической, а с санирующей целью. Данные схемы не являются целью нашей статьи, но необходимо отметить, что в этом случае антибактериальная терапия серьезно отличается от наших стандартных подходов, и уже одна только колонизация сепацией является показанием к назначению антибиотиков, так как совершенно достоверно доказано, что развившаяся инфекция ведет к достоверному увеличению летальности.
В заключение хотелось бы сказать, что меньше всего автору хочется быть правой и увидеть вторичные постковидные пневмонии, вызванные или ассоциированные с B. cepacia в соматических отделениях. Это тот случай, когда очень хочется ошибиться. Но все-таки хотелось бы обратиться к коллегам, несущим тяжелейшую вахту в ковидариях, тем более когда уже пришел омикрон и все началось сначала – если все-таки возможно, помойте-обработайте лишний раз руки, это действительно спасет как минимум еще одну жизнь.

Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Героями сегодняшнего разговора станут энтеробактеры, серрации, морганеллы. Конечно, есть и другие представители и, возможно, в постковид они начнут встречаться намного чаще, но пока нам в рамках Азбуки достаточно вышеперечисленных плюс кишечные палки и клебсиеллы, о которых мы говорили ранее.
Enterobacter spp.
Микробиологические аспекты
Род энтеробактера включает несколько видов, но наиболее клинически значимыми из них являются:
Очень важно помнить, что энтеробактеры проявляют природную устойчивость к большому спектру антибиотиков, таким как бета-лактамы, к которым они продуцируют хромосомные AmpC бета-лактамазы, плазмидные бета-лактамазы расширенного спектра, а также карбапенемазы. Так как клинически значимые представители Enterobacter spp. обитают в желудочно-кишечном тракте человека, то основным источником инфицирования для пациента становится медицинский персонал, который просто по факту своей ежедневной работы в больнице с антибиотиками является резервуаром всевозможных антибиотикорезистентностей.
Клинически значимые аспекты
Enterobacter spp. является причиной:
- Инфекций мочевыводящих путей: катетер – или инструментально-ассоциированных (как результат эндоскопических манипуляций контаминированным инструментарием).
- Внутрибольничных пневмоний, в том числе вентилятор-ассоциированных.
- Инфекций кожи и мягких тканей, таких как раневые инфекции, инфицирование пролежней, ожоговые инфекции и послеоперационные инфекции. Кроме того в случае полимикробного характера инфицирования пролежней возможно развитие сепсиса как исхода раневой инфекции.
- Инфекций кровотока – катетер – и инструмент-ассоциированные.
- Инфекций центральной нервной системы — менингиты, чаще всего внутрибольничные, как следствие нейрохирургических вмешательств.
- Неонатальных инфекций, таких как некротический энтероколит, сепсис и менингит.
Чем лечить?
Ответ будет традиционным – лучше вообще не инфицировать, тогда не придется ломать голову, чем все это лечить. В основе терапии лежит обязательное микробиологическое исследование с определением антибиотикочувствительности.
В случае выявления представителей Enterobacter spp. при лечении тяжелых инфекций предпочтение следует отдавать комбинированной терапии, и самыми подходящими будут пиперациллин-тазобактам в комбинации с аминогликозидами или фторхинолонами. А для преодоления резистентности, вызванной бета-лактамазами расширенного спектра, можно использовать карбопенемы.
Для лечения инфекций мочевыводящих путей самым первым и наиважнейшим является удаление мочевого катетера до момента прекращения пиурии. Далее лечим либо исходя из профиля антибиотикограммы, либо ципрофлоксацином в правильно подобранной дозе, либо, как было указано выше, рассматриваем назначение нитрофуранов и фосфомицина.
Serratia spp.
Клинические аспекты
Что вызывает?
- Катетер-ассоциированные инфекции и как их исход – сепсис.
- Инфекции мочевыводящих путей как следствие медицинских манипуляций необработанным инструментом.
- Раневые инфекции в послеоперационном периоде.
- Нозокомиальные пневмонии как следствие интубации.
- Септические артриты.
- Конъюнктивиты и кератиты.
- И редко вызывали остеомиелиты и эндокардиты
Терапевтические аспекты
В первую очередь про серрацию надо узнать, а значит, необходимо микробиологическое исследование. Во-вторую, вспомнить о природной устойчивости. В-третью, держать в уме то, что очень часто цефалоспорины третьего и четвертого поколения тоже не будут работать, так как посредством плазмид получают устойчивость от родственников по семейству Enterobacteriaceae, например, от родной сестры – клебсиеллы. Точно таким же образом серрация может оказаться устойчивой и к карбопенемам. К фторхинолонам резистентность так же уже давно описана.
Так чем лечить?
Лучше вообще не заражать – потому что если бак. лаборатория дает серрацию, то ниоткуда кроме как с наших рук она появиться не может, так как ни ходить, ни летать сия зверюшка до сих пор не научилась.
В случае развития тяжелых инфекций – сепсиса, вентилятор-ассоциированной пневмонии и т. п., и только при документированной чувствительности, препаратами выбора могут быть цефепим или меропенем, или ципрофлоксацин в вену в стандартных дозировках. Если чувствительность утеряна, то зовем клинического фармаколога, а если такового нет, то смотрим в сторону амикацина, пиперациллина-тазобактама и азтреонама, только помним об их побочных эффектах. Курс лечения соблюдать жизненно необходимо, чтобы зверюшка еще куда-нибудь не мутировала и новыми механизмами защиты не обзавелась. Обычно речь идет о 10-14 днях (но так как польза превышает вред, то нефротоксичность аминогликозидов со временем отступит, а ототоксичность – тут уж как повезет).
Инфекции мочеполового тракта лечим так же с учетом чувствительности, и если таковая располагает, то препаратом выбора становятся фторхинолоны, либо комбинация двух антибиотиков, например фторхинолон с карбапенемом или бета-лактам с аминогликозидом.
Эндокардиты с остеомиелитами бывают хоть и редко, но крайне метко, а потому снова сначала исследуем чувствительность, потом индивидуально в каждом случае подбираем антибиотики (а лучше зовем клинического фармаколога, пусть он мучается). И снова крайне важно соблюдение сроков лечения, для эндокардита это порядка четырех, а то и шести недель внутривенной антибактериальной терапии, а для остеомиелита не менее двух недель. Почему нельзя меньше? Потому что последует мутация и новый рецидив, а антибиотиков просто может не хватить, ибо, как и сестра-клебсиелла, серрация тоже умеет в панрезистентность.
В заключении хочется повторить, что и в этом случае проще помыть руки, чем разгребать последствия инфицирования серрацией. Мытье рук и проще, и дешевле, и, что самое главное, спокойнее.
Morganella spp.
Морганеллы будут последними представителями семейства Enterobacteriaceae, которых мы обсуждаем в рамках нашей Азбуки. Если кому-то станет интересно покопаться дальше, то к их услугам всегда будет четырехтомник по медицинской микробиологии под редакцией Лабинской, конкретно второй и третий том, в которых все очень подробно расписано, правда, чтение это для неподготовленного человека будет довольно сложным. Но вернемся к нашей морганелле.
Микробиологические аспекты
Морганелла существует только одна – M.morganii, но имеет два подвида – M.morganii и M.sibonii, которые отличаются только по ферментации треалозы, и никакого клинического значения данное отличие не имеет.
Конечно, и морганелла умеет в природную устойчивость к антибиотикам, а именно к пенициллинам, цефалоспоринам первого и второго поколения, макролидам и ко-тримоксазолу. При этом сохраняет высочайшую чувствительность к аминогликозидам, пиперациллину, цефалоспоринам третьего и четвертого поколения, фторхинолонам и карбопенемам. То есть данную зверюшку есть чем победить.
Клинические аспекты
Морганелла является представителем нормальной микрофлоры человека и самостоятельно крайне редко что-то вызывает. Этим крайне редким являются инфекции мочевыводящих путей, чему способствуют крайне пожилой возраст, длительная госпитализация, мочевой катетер и иммунодефицит любой этиологии.
В плане приобретенной антибиотикорезистентности морганелла обзавелась факторами устойчивости к фторхинолонам, что и понятно, учитывая какие именно заболевания она вызывает и чем их чаще всего лечат.
Что еще может вызывать?
- Крайне редко – сепсис, как исход инфекции мочевыводящих путей.
- Раневую хирургическую инфекцию.
- Септический артрит.
- Неонатальный сепсис и хореоамнионит.
- Менингит.
- Перикардит.
Но стоит иметь в виду, что данные ситуации крайне редки, и стоит изначально подумать не об этом возбудителе, а о том, какой за ним может прятаться в виду контаминации материала, и лучше бы все еще раз пересеять и перепроверить.
Терапевтические аспекты
Если результат микробиологического исследования сомнений не вызывает и вы убеждены, что имеете дело с морганеллами, то препаратами выбора становятся карбопенемы, и только в случае их недоступности и документированной бактериологом чувствительности, можно посмотреть в сторону цефалоспоринов, например, цефтазидима (для которого нужна отдельная цефалоспориназа, чтобы он был инактивирован), а лучше цефтазидим-авибактама. Хотя если недоступны карбопенемы, то и Завицефте, скорее всего, взяться будет неоткуда.
Какие препараты могут быть использованы в качестве резервных? Решать этот вопрос также необходимо только после получения результата микробиологии и чувствительности в идеале по МПК, и только после этого рассматривать назначение цефепима или ципрофлоксацина, или аминогликозидов (они, к слову, в случае морганеллы могут обоснованно выступать в качестве монотерапии инфекций мочевыводящих путей).
Читайте также:

