Ингибиторы протеазы вич что это
Обновлено: 25.04.2024
Ингибиторы репликации ВИЧ. Нуклеозидные ингибиторы обратной транскриптазы
Пандемия, вызванная ВИЧ-1, стимулировала интенсивный поиск новых антивирусных препаратов для лечения этого заболевания. Терапевтически эффективными оказались лекарственные вещества нескольких различных классов:
• нуклеозидные ингибиторы обратной транскриптазы (NRTI);
• ненуклеозидные ингибиторы обратной транскриптазы (NNRTI);
• ингибиторы протеаз (PI);
• антиретровирусный ингибитор слияния.
Лечение антивирусными препаратами замедляет возникновение СПИДа, улучшает состояние и выживаемость пациентов, если оценивать их по суррогатным маркерам, т.е. числу CD4+ Т-лимфоцитов и содержанию вируса в плазме. Применение 1 или 2 лекарственных препаратов ассоциируется с высокой скоростью прогрессирования болезни и возникновением резистентности вируса, поэтому в настоящее время для лечения ВИЧ-инфекции одновременно используют 3 антивирусных препарата или более. Попытки индуцировать супрессию вируса с помощью трех антивирусных препаратов, а затем поддерживать достигнутый эффект только двумя лекарствами привели к неприемлемо высокой частоте возврата заболевания. Как правило, одновременно используют комбинацию лекарств, относящихся к нескольким классам.
Нуклеозидные ингибиторы обратной транскриптазы
Зидовудин, аналог тимидина, является прототипным нуклеозидным ингибитором обратной транскриптазы. Он был первым антивирусным агентом, допущенным для лечения ВИЧ-инфекции. Зидовудин ингибирует ВИЧ-1, ВИЧ-2, вирус 1 Т-клеточного лейкоза/лимфомы человека и другие ретровирусы.
NRTI обладают следующими общими характеристиками:
• после активации в клетках под действием клеточных ферментов превращаются в соответствующие трифосфаты;
• утрачивают антиретровирусную активность в результате мутаций вирусной обратной транскриптазы, которые снижают аффинность фермента к NRTI. Частота возникновения резистентности и ее степень варьируют в зависимости от типа препарата;
• избирательность действия обусловлена более высокой аффинностью NRTI-трифосфатов к обратной транскриптазе по сравнению с ДНК-полимеразой клеток организма-хозяина.
Первоначально ретровирус ВИЧ должен синтезировать провирусную ДНК-копию своего РНК-генома, чтобы начать репликацию. Специфичный для ВИЧ фермент — обратная транскриптаза, или ревертаза (RT) — синтезирует комплементарную ДНК-цепь, используя пул дезоксинуклеотидов инфицированной клетки (тимидин, гуанозин, аденозин, цитидин). Поскольку NRTI являются дидезоксинуклеотидными аналогами и не имеют второй гидроксильной группы, существенной для последовательного присоединения оснований к растущей ДНК-цепи, их включение под действием RT терминирует элонгацию ДНК-цепей. Они оказывают также конкурентный ингибирующий эффект на саму RT.
NRTI быстро элиминируются из плазмы; Т1/2 из сыворотки варьирует от 1 час для ставудина до 3-4 час для ламивудина. Однако удаление внутриклеточных NRTI-нуклеотидов происходит медленнее, в связи с этим возможен нечастый прием препарата. Все NRTI, за исключением абакавира, выводятся с мочой. Экскреция зидовудина происходит после его глюкуронизации в печени. Другие NRTI выводятся в неизмененном виде. При почечной недостаточности дозу NRTI снижают от 50% для зидовудина, ставудина и зальцитабина до 80-90% для ламивудина и диданозина. Метаболизм NRTI не зависит от цитохрома Р-450. NRTI слабо связываются с белками и проникают в ЦНС в значительных концентрациях.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первые антиретровирусные препараты — нуклеозидные ингибиторы обратной транскриптазы — были лишь частично эффективны в отношении вируса иммунодефицита человека. Только с появлением следующего класса, ингибиторов протеазы, удалось достичь контроля над заболеванием и резко снизить смертность. Им, а также ингибиторам ещё одного жизненно важного для лечения ВИЧ фермента — интегразы, и посвящена наша следующая статья из цикла об антиретровирусных препаратах.
Ингибиторы протеазы: механизм действия
Внедрение в клиническую практику ингибиторов протеазы стало краеугольным камнем лечения ВИЧ. Их добавление в схему терапии к двум нуклеозидным ингибиторам обратной транскриптазы (НИОТ) позволило уменьшить количество пациентов с прогрессирующим течением заболевания (до развития СПИДа или смерти) в два раза. У 90 % пациентов, получавших комбинацию из трёх препаратов, число частиц РНК ВИЧ в крови снизилось с более чем 20 000 на миллилитр до менее чем 500 на миллилитр за 24 недели терапии [1].
Механизм действия ингибиторов протеазы основан на их способности блокировать один из ферментов, служащих важным элементом созревания вируса в жизненном цикле ВИЧ. Геном ВИЧ кодирует длинный полипептид. После удаления оболочки вируса и обратной транскрипции генома РНК образуется полипептид, содержащий все продукты вирусных генов, включая структурные белки и ферменты. Затем протеаза ВИЧ расщепляет его на составляющие вирусные белки. При подавлении активности протеазы этот процесс блокируется, что приводит к нарушению созревания вирусной мРНК, в результате чего образуются вирусные частицы, не способные заражать новые клетки [1].
Первыми ингибиторами протеазы стали пептидомиметические молекулы, схожие с пептидом-предшественником и конкурирующие с ним. Однако, как и большинство пептидомиметических белков, ранние ингибиторы протеазы имели существенный фармакокинетический недостаток: они плохо всасывались и быстро выводились при пероральном приёме. Проблема была решена заменой участка пиридина в структуре ингибиторов протеазы на тиазол, менее богатый электронами. Благодаря этому удалось повысить метаболическую стабильность молекулы и улучшить растворимость вещества в воде, а также увеличить его эффективность в отношении вируса [1, 2].
Общие свойства ингибиторов протеазы
Препараты этой группы снижают концентрацию вирусной РНК, увеличивают количество белых кровяных клеток, отвечающих за реакцию иммунной системы на инфекцию (CD-4 клеток) и, в итоге, улучшают выживаемость при включении в терапию наряду с антиретровирусными препаратами других классов.
В целом ингибиторы протеазы имеют сходные терапевтические эффекты. Их активность в отношении ВИЧ-1 и ВИЧ-2 расценивается как высокая, а устойчивость к ним развивается медленно.
Фармакокинетика
Ингибиторы протеазы интенсивно метаболизируются изоферментами системы цитохрома Р450, в частности, CYP3A4, что открывает возможности для целого ряда межлекарственных взаимодействий. Средства, индуцирующие активность ферментов Р450, например, рифампицин или экстракт зверобоя, ускоряют метаболизм ингибиторов протеазы, уменьшая их концентрацию в плазме и терапевтическую эффективность. И наоборот: препараты-ингибиторы ферментов Р450, такие как кетоконазол или циметидин, повышают уровень ингибиторов протеазы в плазме, что связано с увеличением токсичности последних [2].
На сегодня наиболее мощным ингибитором CYP3A4 является ритонавир. Он специально комбинируется с другими ингибиторами протеазы, являющимися субстратами CYP3A4 для продления их периода полувыведения [4].
Ингибиторы протеазы лучше всасываются при приёме во время или после еды [2, 3].
Показания
Препараты этого класса применяются для лечения ВИЧ-инфекции, профилактики передачи инфекции от матери к ребёнку и постконтактной профилактики заболевания.
Противопоказания
Противопоказано одновременное применение ритонавира с препаратами, выведение которых зависит от активности CYP3A4, во избежание токсичности антиретровирусной терапии.
Побочные эффекты
Неблагоприятные реакции при применении ингибиторов протеазы включают [2, 3, 4]:
- желудочно-кишечные расстройства, в частности, диарею с неустановленным механизмом, которая осложняется тем, что она нередко становится одним из осложнений ВИЧ;
- гиперлипидемию — общий побочный эффект для всех ингибиторов протеазы, реже возникает при приёме атазанавира; по всей видимости, нарушение липидного обмена связано с перераспределением жировой ткани, характерным для ВИЧ, которое обостряется при приёме ингибиторов протеазы;
- гипергликемию, инсулинорезистентность, которые развиваются, вероятно, в результате подавления ингибиторами протеаз переносчика глюкозы, что приводит к подавлению активности поглощения глюкозы клетками; с меньшей вероятностью этот побочный эффект проявляет атазанавир по сравнению с другими ингибиторами протеазы;
- сыпь, чаще всего возникает при приёме ампренавира.
Известен и ряд уникальных побочных эффектов: так, при приёме атазанавира может фиксироваться гипербилирубинемия, которая не считается признаком гепатотоксичности препарата, а на фоне применения индинавира возникает кристаллурия и нефролитиаз, что связано с плохой растворимостью препарата в воде. Поэтому пациентам, получающим индинавир, рекомендуют увеличить потребление жидкости во время лечения.
Особые указания
Использование ритонавира в качестве единственного ингибитора протеазы ограничено из‑за его выраженных пищеварительных побочных эффектов в терапевтических дозировках. Сегодня препарат применяют в низких дозах для повышения активности других ингибиторов протеаз. Одним из самых частых комбинированных препаратов, используемых для лечения ВИЧ, сегодня является лопинавир + ритонавир. Следует обратить внимание на то, что капсулы и растворы ритонавира содержат этиловый спирт, поэтому пациентам, получающим препарат, необходимо избегать приёма препаратов, вызывающих дисульфирамовую реакцию, в частности, дисульфирама и метронидазола [4].
Ингибиторы интегразы: механизм действия
Интеграза наряду с обратной транскриптазой и протеазой — один из ключевых участников репликации ВИЧ-1. Она катализирует процессы, приводящие к перемещению ДНК или её фрагментов внутри генома или между геномами. Будучи частью прединтеграционного комплекса, интеграза распознаёт длинные терминальные повторы на концах двойной цепи вновь синтезированной вирусной ДНК, отщепляет по два или по три основания с каждого конца, а также участвует в транспортировке вирусной ДНК в ядро клетки-мишени, где определяет предпочтительный сайт внедрения вирусной ДНК в хромосому и осуществляет её интеграцию в клеточный геном [5].
Ингибиторы интегразы, связываясь с её активным участком и блокируя этап переноса цепей во время интеграции ретровирусной ДНК, предотвращают образование ковалентных связей с ДНК хозяина и включение ВИЧ в геном хозяина [4].
В отличие от обратной транскриптазы и протеазы, интеграза не имеет близких аналогов в эукариотической клетке, поэтому у препаратов, избирательно действующих на неё, побочные эффекты должны быть минимальны [5].
Первым ингибитором протеазы стал ралтегравир, одобренный Администрацией по продуктам питания и лекарственным препаратам США в 2007 году [6]. Сегодня наряду с ралтегравиром используются ещё 4 препарата этого класса: элвитегравир, долутегравир, биктегравир и каботегравир. В разработке находится ещё две молекулы, одна из которых, по всей вероятности, имеет длительность действия до 4 раз больше по сравнению с ралтегравиром и, возможно, будет отнесена к ингибиторам интегразы второго поколения.
Общие свойства ингибиторов протеаз
Механизмы устойчивости к ингибиторам интегразы отличаются от таковых к другим классам антиретровирусных препаратов. Если в основе резистентности большинства ненуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы лежит изменение конфигурации активного центра фермента и следующее за ним блокирование присоединения молекулы лекарства, то в случае с ингибиторами интегразы, по всей вероятности, имеют место другие феномены, причём для разных мутаций они могут отличаться [7]. Считается, что ралтегравир имеет низкий генетический барьер для развития устойчивости, поскольку единичная точечная мутация ВИЧ может приводить к изменению способности интегразы к ингибированию. Возможно, имеет место перекрёстная резистентность между ингибиторами интегразы [4].
Фармакокинетика
Основной путь выведения ралтегравира — через печень, тем не менее коррекция дозы препарата у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести не требуется. Почечное выведение играет незначительную роль в метаболизме ингибиторов протеазы, поэтому при почечной недостаточности дозу не пересматривают.
Ралтегравир не является субстратом для ферментов цитохрома CYP450, не ингибирует и не индуцирует их, с чем связана низкая частота лекарственных взаимодействий.
Показания
Ингибиторы протеазы показаны при ВИЧ-1 инфекции у пациентов, у которых выработалась устойчивость к другим классам антиретровирусных препаратов.
Противопоказания
Не имеют терапевтического значения ввиду высокого профиля безопасности препаратов.
Побочные эффекты
Поскольку антиретровирусные препараты обычно назначаются в комбинированных схемах, возникают сложности с определением неблагоприятных реакций, связанных с конкретным классом или лекарственным средством. В целом ингибиторы протеазы хорошо переносятся. В контролируемых исследованиях побочные эффекты при приёме ралтегравира были сопоставимы с таковыми при приёме плацебо. Ралтегравир считается одним из самых безопасных препаратов для лечения ВИЧ-инфекции благодаря минимальному риску развития нежелательных явлений, причём как у пациентов, ранее не получавших антиретровирусную терапию, так и уже имевших опыт лечения препаратами других классов [4, 8].
Особые указания
В настоящее время существуют ограниченные данные об активности ингибиторов протеазы в отношении ВИЧ-2.
Во время клинических исследований наблюдалось небольшое, статистически незначимое увеличение заболеваемости раком у пациентов, получавших ралтегравир, по сравнению с пациентами, получавшими плацебо.
Как и в случае с большинством других антиретровирусных препаратов, безопасность ингибиторов интегразы при применении во время беременности не установлена.
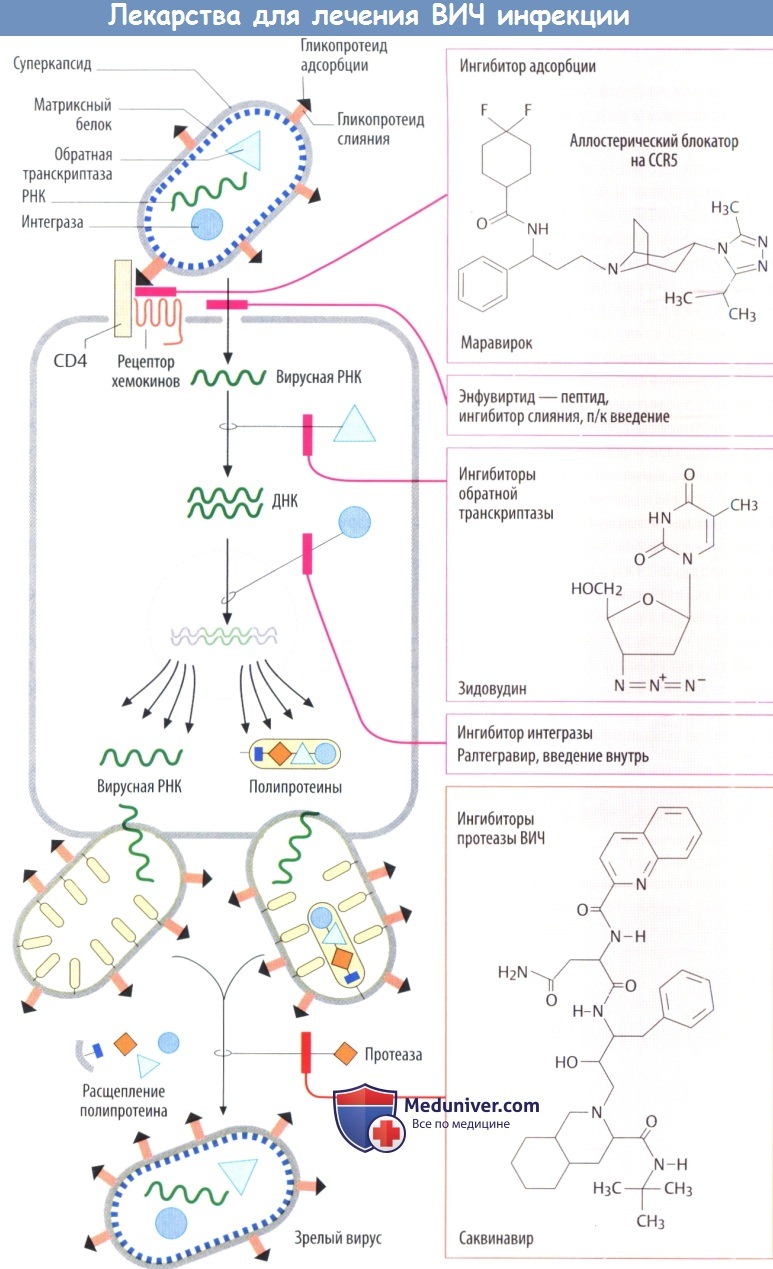
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.

На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Лекарства для лечения ВИЧ и СПИДа
Репликация ВИЧ включает в себя ряд специфических необходимых для вируса этапов в метаболизме, поэтому теоретически она может быть чувствительна к направленным на эти особенности медикаментозным вмешательствам. Во-первых, вирус связывается с моноцитами или лимфоцитами Т-хелперами посредством гликопротеида вирусной оболочки.
Оба типа этих клеток несут комплекс CD4, но отличаются по участку связывания второго рецептора хемокина (CCR5 или CXCR4). После связывания белок слияния покидает вирусную оболочку, которая инициирует слияние оболочки и клеточной мембраны. Затем вирусная РНК транскрибируется в ДНК — этап, катализируемый вирусной обратной транскриптазой. Двунитевая ДНК встраивается в геном хозяина с помощью вирусной интегразы.
Под контролем вирусной ДНК начинается репликация вируса с синтезом вирусной РНК и белков, в т. ч. ферментов (обратная транскриптаза и интеграза) и структурных белков (слой матричного белка внутри вирусной оболочки). Эти белки собираются не отдельно, а в виде полипротеинов. N терминальный остаток жирной кислоты (мирси-тоил) стимулирует присоединение к внутренней поверхности плазмолеммы. При покидании вирусной частицы клетки хозяина капсула забирает с собой пораженную область мембраны.
Во время этого процесса протеаза, содержащаяся в полипротеине, расщепляет последний на отдельные функционально активные белки.
I. Ингибиторы обратной транскриптазы ВИЧ:
а) Нуклеозидные ингибиторы. К представителям данной группы относятся зидовудин, ставудин, залцитабин, диданозин и ламивудин. Они являются нуклеозидами, содержащими измененную углеводную половину, и требуют биоактивации путем фосфорилирования. Будучи трифосфатами, они ингибируют обратную транскриптазу и вызывают разрыв нити после встраивания в вирусную ДНК. Препараты применяются внутрь. Они несколько отличаются по спектру побочных эффектов (лейкопения у зидовудина; периферическая нейропатия и панкреатит у других) и по своим механизмам резистентности.
При лечении СПИДа в основном используются сочетания из двух членов данной группы + ненуклеозидный ингибитор (см. ниже) либо один или два ингибитора протеаз.
б) Ненуклеозидные ингибиторы. Невирапин и эфавиренз являются активными ингибиторами обратной транскриптазы, т. е. они не требуют фосфорилирования. К побочным эффектам относятся сыпь и взаимодействия с изоферментами (CYP) цитохрома Р450.
II. Ингибиторы протеазы ВИЧ. Ингибиторы вирусной протеазы предупреждают расщепление неактивных белков-предшественников и, следовательно, созревание вируса. Они вводятся внутрь. Саквинавир считается анормальным пептидом. У него низкая биодоступность. Другими ингибиторами протеазы, которые к тому же обладают значительно большей биодоступностью, являются ритонавир, индинавир, нелфинавир и ампренавир. В биотрансформации этих препаратов участвуют изоферменты CYP, и поэтому не исключено взаимодействие с другим препаратами, которые метаболизируются данным путем.
Длительное применение препаратов может быть связано со специфическим перераспределением в жировой ткани и метаболическими нарушениями (гиперлипидемия, резистентность к инсулину, гипергликемия).
III. Резервные препараты:
а) Маравирок блокирует рецепторы хемокина CCR5. Его вводят внутрь, т. к. показано, что ВИЧ связывается именно с этим, а не с другим участком.
б) Энфувиртид — пептид, который связывает вирусный белок слияния, предупреждая образование необходимых конформационных изменений. Он является резервным препаратом.
в) Ралтегравир ингибирует вирусную интегразу, что приводит к блокаде интеграции кодированной вирусом ДНК в геном клетки хозяина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

