Инсульт при инфекционном эндокардите
Обновлено: 25.04.2024
В настоящее время ведущей причиной лакунарного инфаркта (ЛИ) головного мозга считается церебральная микроангиопатия на фоне артериальной гипертензии. Однако появляются данные, что эмболия в церебральные перфорантные артерии также может приводить к ЛИ. Целью настоящего исследования было определить может ли лакунарный инфаркт головного мозга развиться вследствие кардиогенной или артерио-артериальной эмболии в перфорантные артерии, а также уточнить критерии диагностики различных этиопатогенетических вариантов ЛИ. Нами было обследовано 211 больных ЛИ (97 мужчин и 114 женщин в возрасте от 38 до 84 лет). Пациенты были разделены на 2 группы: I группа — больные ЛИ без потенциальных источников церебральной эмболии — 179 пациентов (84,8%); II группа — больные ЛИ с верифицированным потенциальным источником церебральной эмболии — 32 пациента (15,2%). Проведенное исследование показало, что особенности клинической картины не позволяют судить о причине лакунарного инфаркта. Изолированная оценка факторов риска инсульта без оценки результатов лабораторно-инструментальных исследований, также не позволяет определить механизм развития ЛИ. Для больных с эмболическим генезом ЛИ характерно: наличие потенциальных источников кардиальной и артерио-артериальной эмболии; микроэмболические сигналы по данным допплеровского мониторинга церебральных артерий; выраженный неврологический дефицит; множественные лакунарные очаги в нескольких сосудистых бассейнах или несколько крупных очагов (более 15 мм) в одном сосудистом бассейне, либо сочетание лакунарных и территориальных очагов по данным МРТ в диффузионном режиме. Выполненное нами исследование подтвердило возможность эмболического генеза ЛИ. Верификация истинной причины, приведшей к фокальному церебральному повреждению, необходима для выбора адекватного метода вторичной профилактики ЛИ. Ключевые слова: лакунарный инфаркт, эмболия
Материал и методы:
Нами было обследовано 211 больных лакунарным ишемическим инсультом, находившихся на обследовании и лечении в Пироговском Центре в период с 2003 по 2008 гг. Среди обследованных больных было 97 мужчин и 114 женщин в возрасте от 38 до 84 лет, средний возраст составил 61,2±12,2 года. Пациенты были разделены на 2 группы: I группа — больные ЛИ, у которых в результате обследования не были выявлены потенциальные источники церебральной эмболии — 179 пациентов (84,8%); II группа — больные ЛИ, у которых в результате обследования были выявлены потенциальные источники церебральной эмболии — 32 пациента (15,2%). Пациенты I группы были разделены на две подгруппы: Iа — больные ЛИ с длительным анамнезом гипертонической болезни — 99 пациентов; Iб — больные ЛИ с грубым атеросклеротическим поражением церебральных артерий или дислипидемией — 80 пациентов. Iа группа была условно названа как группа пациентов ЛИ вследствие гипертонической микроангиопатии, Iб группа — вследствие атеросклеротической микроангиопатии, II группа — пациенты с эмболическим генезом ЛИ. Группы были равнозначны по возрасту, процентному соотношению мужчин и женщин. У всех больных клиническая картина была представлена одним из лакунарных синдромов. Всем пациентам выполнялось:
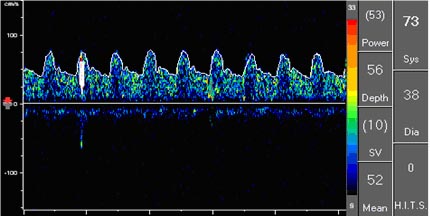
Рис 1. Пациент П, 52 лет.
Микроэмболический сигнал в правой средней мозговой артерии у пациента с ЛИ на фоне стеноза правой внутренней сонной артерии 80%.
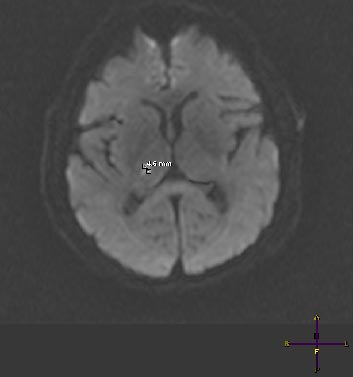
Рис 2. Пациент А., 54 лет. Лакунарный очаг в области правого таламуса по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне артериальной гипертензии.
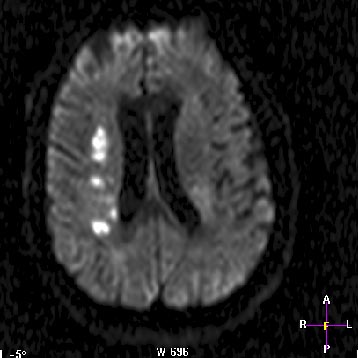
Рис 3. Пациент П, 52 лет. Множественные лакунарные очаги в бассейне правой средней мозговой артерии по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне стеноза правой внутренней сонной артерии 80%.
Таблица 1.
Частота встречаемости АГ, СД и дислипидемии в группах больных ЛИ
| Фактор риска | Гипертоническая микроангиопатия n=99 | Атеросклеротическая микроангиопатия n=80 | Эмболический генез n=32 | |||
|---|---|---|---|---|---|---|
| Кол-во | % | Кол-во | % | Кол-во | % | |
| ГБ | 99 | 100,0 | 64 | 80,0% | 26 | 81,3% |
| СД | 13 | 13,1% | 24 | 30,0% | 12 | 37,5% |
| Дислипидемия | 43 | 49,5% | 75 | 93,8% | 28 | 87,5% |
Таблица 2.
Данные МРТ головного мозга в диффузионном режиме в группах больных ЛИ
| МРТ в диффузионном режиме | Гипертоническая микроангиопатия n=99 | Атеросклеротическая микроангиопатия n=80 | Эмболический генез n=32 | |||
|---|---|---|---|---|---|---|
| Кол-во | % | Кол-во | % | Кол-во | % | |
| Единичный маленький (до 15 мм) очаг, либо отсутствие изменений | 84 | 84,9% | 53 | 66,3% | 0 | 0,0% |
| Большой (более 15 мм) или несколько мелких очагов в одном сосудистом бассейне | 13 | 13,1% | 18 | 22,5% | 8 | 25,0% |
| Множественные очаги в нескольких сосудистых бассейнах или несколько крупных очагов (более 15 мм) в одном бассейне | 2 | 2,1% | 9 | 11,2% | 24 | 75,0% |
Назначение адекватной антимикробной терапии пациентам с инфекционным эндокардитом приводит к снижению смертности и излечению с минимальными анатомическими изменениями клапанного аппарата сердца. При этом следует отметить, что существующая практика назначения антимикробных препаратов при инфекционном эндокардите в Российской Федерации не всегда соответствует современным рекомендациям.
Несмотря на достигнутый прогресс в ранней диагностике и лечении, инфек ционный эндокардит (ИЭ) продолжает ассоциироваться с развитием тяжелых осложнений и высокой смертностью [1]. В течение последних десятилетий увеличилось количество и изменилось соотношение основных факторов риска ИЭ. Наиболее важную роль стали играть инъекционная наркомания, кардиохирургические операции и инвазивные медицинские манипуляции, что привело к смене ведущего возбудителя, которым в настоящее время, согласно большинству исследований, является Staphy lo coccus aureus [2,3].
В последние годы отмечается рост резистентности большинства возбудителей к антимикробным препаратам, применяемым в клинической практике. В случае ИЭ основную проблему представляют метициллинорезистентные штаммы S. aureus (MRSA) и штаммы Enterococcus spp. с высоким уровнем резистентности к аминогликозидам [1,4]. Долгое время единственным антибиотиком, высоко активным в отношении MRSA, был ванкомицин. Однако в последние годы все чаще регистрируются случаи сниженной чувствительности S. aureus к данному препарату. В настоящее время разработаны и внедрены в клиническую практику несколько новых антистафилококковых препаратов. Одним из них является даптомицин, обладающий высокой активностью как в отношении метициллиночувствительных штаммов S. aureus (MSSA), так и MRSA, а также в отношении штаммов со сниженной чувствительностью к гликопептидам [5]. Следует отметить, что преобладание S. aureus в структуре возбудителей ИЭ обусловливает острое течение инфекционного процесса и высокую частоту тромбоэмболических ос лож нений [6,7].
Принципы антимикробной терапии инфекционного эндокардита
Основополагающими принципами лечения пациентов с ИЭ являются своевременное назначение и длительное проведение антимикробной терапии. При этом предпоч тительно применение препаратов с бак терицидной активностью в высоких дозах [5,8]. При ведении пациентов с ИЭ чаще всего используются рекомендации Европей ского общества кардиологов 2015 г., в соответствии с которыми антимикробная терапия данного заболевания должна по возможности носить этиотропный характер [8].
В этиологической структуре ИЭ ведущую роль играют грамположительные микроорганизмы, среди которых чаще всего выделяют стафилококки, стрептококки и энтерококки [1]. В случае выделения стрептококков препаратами выбора являются бензилпенициллин, амоксициллин и цефтриаксон. При аллергии на бета-лактамные антибиотики допустимо применение ванкомицина. С целью сокращения сроков антимикробной терапии до 2 недель рекомендуется добавление аминогликозидов II поколения (табл. 1 и 2) [8].
| Препараты | Доза, путь ведения | Длительность | Комментарий |
|---|---|---|---|
| Четырехнедельная терапия | |||
| Бензилпенициллин или | 12-18 млн ЕД/сут в/в в 4-6 введени | 4 недели | Предпочтительно у пациентов старше 65 лет, с |
| амоксициллин или | 100-200 мг/кг/сут в/в в 4-6 введений | 4 недели | нефропатией и поражением VIII пары черепномозговых |
| цефтриаксон | 2 г/сут в/в или в/м в 1 введение | 4 недели | нервов. При ИЭ протезированных клапанов – 6 нед |
| Двухнедельная терапия | |||
| Бензилпенициллин или | 12-18 млн ЕД/сут в/в в 4-6 введений | 2 недели | Допустимо в случае неосложненного ИЭ |
| амоксициллин или | 100-200 мг/кг/сут в/в в 4-6 введени | 2 недели | нативных клапанов |
| цефтриаксон + | 2 г/сут, в/в или в/м в 1 введение | 2 недели | |
| гентамицин или | 3 мг/кг/сут в/в или в/м в 1 введение | 2 недели | |
| нетилмицин | 4-5 мг/кг/сут в/в в 1 введение | 2 недели | |
| При аллергии на бета-лактамы | |||
| Ванкомицин | 30 мг/кг/сут в/в в 2 введения | 4 недели | При ИЭ протезированных клапанов – 6 нед |
| Препараты | Доза, путь ведения | Длительность | Комментарий |
|---|---|---|---|
| Стандартная схема | |||
| Бензилпенициллин или | 12-18 млн ЕД/сут в/в в 4-6 введени | 4 недели | При ИЭ протезированных клапанов – 6 нед |
| амоксициллин или | 100-200 мг/кг/сут в/в в 4-6 введений | 4 недели | |
| цефтриаксон | 2 г/сут в/в или в/м в 1 введение | 4 недели | |
| гентамицин | 3 мг/кг/сут в/в или в/м в 1 введение | 2 недели | |
| При аллергии на бета-лактамы | |||
| Ванкомицин + | 30 мг/кг/сут, в/в в 2 введения | 4 недели | При ИЭ протезированных клапанов – 6 нед |
| гентамицин | 3 мг/кг/сут в/в или в/м в 1 введение | 2 недели | |
В случае бактериемии, вызванной MSSA, при поражении как нативных, так и протезированных клапанов препаратом выбора считают оксациллин (табл. 3). У пациентов с аллергией на бета-лактамы или имеющих бактериемию, вызванную MRSA, предпочтение следует отдавать ванкомицину (табл. 4) [8].
| Препараты | Доза, путь ведения | Длительность | Комментарий |
|---|---|---|---|
| Нативные клапаны | |||
| Оксациллин | 12 г/сут в/в в 4-6 введений | 4-6 недель | Сопутствующее назначение гентамицина |
| Ко-тримоксазол + | 4,8/0,96 г/сут в/в в 4-6 введений | 1 нед в/в и 5 нед внутр | не показано в виду высокого риска |
| клиндамицин | 1,8 г/сут в 3 ведения | 1 неделя | нефротоксичности |
| Протезированные клапаныы | |||
| Оксациллин + | 12 г/сут, в/в в 4-6 введений | ≥6 недель | Предпочтительно введение аминогли |
| рифампицин + | 0,9-1,2 г/сут в/в или внутрь в 2-3 введения | ≥6 недель | козида 1 раз в сутки с целью уменьшения |
| гентамицин | 3 мг/кг/сут, в/в или в/м в 1-2 введения | 2 недели | риска нефротоксичности |
| Препараты | Доза, путь ведения | Длительность | Комментарий |
|---|---|---|---|
| Нативные клапаны | |||
| Ванкомицин | 30-60 мг/кг/сут в/в в 2-3 введения | 4-6 недель | Даптомицин более эффективен, чем |
| Даптомицин | 10 мг/кг/сут в/в в 1 введение | 4-6 недель | ванкомицин в отношении MSSA и |
| Ко-тримаксозол + | 4,8/0,96 г/сут в/в 4-6 введений | 1 нед в/в и 5 нед внутрь | MRSA (минимальная подавляющая |
| клиндамицин | 1,8 г/сут в 3 введения | 1 неделя | концентрация >1 мг/л) |
| Протезированные клапаныы | |||
| Ванкомицин + | 30-60 мг/кг/сут, в/в в 2-3 введения | ≥6 недель | Предпочтительно введение аминогликозида |
| рифампицин + | 0,9-1,2 г/сут в/в или внутрь в 2-3 введения | ≥6 недель | козида 1 раз в сутки с целью уменьшения |
| гентамицин | 3 мг/кг/сут в/в или в/м в 1-2 введения | 2 недели | ния риска нефротоксичности |
В условиях ведущей роли S. aureus в этиологической структуре ИЭ и увеличения частоты бактериемии, вызванной MRSA, проведено достаточно большое количество исследований, в которых сравнивали эффективность и безопасность стандартной схемы (ванкомицин + гентамицин) и даптомицина. В большинстве из них даптомицин не уступал стандартной схеме по эффективности, что обосновывает его назначение при бактериемии, вызванной MRSA. Преимуществами даптомицина являются отсутствие нефротоксичности, а также гораздо более низкий уровень резистентности микроорганизмов по сравнению с ванкомицином. Вместе с тем, высокая стоимость даптомицина и отсутствие дженериков существенно ограничивают частоту назначения этого препарата [8].
Учитывая возможность образования биопленок при стафилококковом ИЭ протезированных клапанов, с целью повышения эффективности терапии через 3-5 дней после ее назначения рекомендуется добавление рифампицина [3,8].
При энтерококковой этиологии ИЭ препаратами выбора являются аминопенициллины или гликопептиды в сочетании с аминогликозидами II поколения (табл. 5) [8].
| Препараты | Доза, путь ведения | Длительность | Комментарий |
|---|---|---|---|
| Амоксициллин + | 200 мг/кг/сут в/в в 4-6 введений | 4-6 недель | 6 недель в случае сохранения симптомов более 3 |
| гентамицин | 3 мг/кг/сут в/в или в/м в 1 введение | 2-6 недель | мес или при поражении протезированных клапанов |
| Ампициллин + | 200 мг/кг/сут в/в в 4-6 введений | 6 недель | Активность в отношении Enterococcus faecalis |
| цефтриаксон | 4 г в/в или в/м в 2 введения | 6 недель | |
| Ванкомицин + | 30 мг/кг/сут, в/в в 2 введения | 6 недель | |
| гентамицин | 3 мг/кг/сут, в/в или в/м в 1 введение | 6 недель |
Следует отметить, что несмотря на многообразие факторов риска, грамотрицательные микроорганизмы, за исключением бактерий группы HACEK, являются нетипичными возбудителями ИЭ. В случае же выделения последних препарат выбора – цефтриаксон, длительность назначения которого при поражении нативных клапанов составляет 4 недели, а при поражении протезированных клапанов – 6 недель [8].
В Российской Федерации регистрируется крайне низкая частота выделения этиологически значимых возбудителей при проведении бактериологического исследования крови. Так, согласно результатам многоцентрового фармакоэпидемиологического исследования МАЭСТРО, включавшего 406 пациентов с ИЭ из 11 многопрофильных стационаров 9 городов Россий ской Федерации, этиология заболевания была установлена только в 35,5% случаев [1]. При выборе стартовой антимикробной терапии у пациентов с отрицательным результатом бактериологического исследования крови необходимо принимать во внимание наличие соответствующих факторов риска [8,9].
Несмотря на отсутствие на сегодняшний день четких доказательств преимущества комбинированной антимикробной терапии ИЭ перед монотерапией, в ряде случаев комбинированное назначение антибиотиков имеет принципиально важное значение. Имеющиеся данные свидетельствуют о том, что комбинированная антимикробная терапия способствует профилактике рецидивов и снижению длительности лечения, особенно при энтерококковой этиологии заболевания [8,10]. Вместе с тем, в соответствии с результатами исследования МАЭСТРО назначение комбинированной стартовой антимикробной терапии отмечено лишь в 41% случаев ИЭ [2].
Наиболее частыми комбинациями антимикробных препаратов при терапии пациентов с ИЭ являются сочетания бета-лактамных антибиотиков или гликопептидов с аминогликозидами, хотя указанные схемы вызывают опасения ввиду возможной нефротоксичности. В последнее время в медицинской литературе появляется все больше работ, в которых доказываются эффективность и снижение риска возникновения нежелательных лекарственных реакций при применении потенциально более безопасных комбинаций, прежде всего ампициллина с цефтриаксоном при ИЭ, вызванном Enterococcus faecalis [11,12]. Еще одним способом снижения риска развития нефротоксичности, закрепленным в рекомендациях Европейского общества кардиологов 2015 г., является однократное введение суточной дозы аминогликозидов [8].
Длительность антимикробной терапии пациентов с ИЭ составляет 4-6 недель, в ряде случаев достигает 8 недель. Однако не всегда имеется возможность госпитализации пациента на столь длительный срок, в связи с чем обсуждается амбулаторное применение парентеральных антимикробных препаратов, которое допустимо лишь в тех случаях, когда у госпитализированного в стационар пациента отмечается положительная клиническая динамика, отсутствует высокий риск развития осложнений и имеются необходимые условия для ухода в амбулаторных условиях [8]. Возможность амбулаторного применения антимикробных препаратов при ИЭ подтверждается данными C. Monteiro и С. Cobbs, которые проанализировали опыт амбулаторного лечения 277 пациентов с ИЭ в 14 исследованиях. У 223 из них была подтверждена клиническая эффективность такой терапии [13].
При ИЭ считают предпочтительным парентеральный путь введения антимикробных препаратов. Однако в ряде случаев, например, у инъекционных наркоманов, он может быть затруднен из-за поражения вен. В связи с этим в течение последних лет изучается возможность перорального применения антимикробных препаратов у пациентов с ИЭ. Чаще всего в таких случаях назначают аминопенициллины (амоксициллин), фторхинолоны (ципрофлоксацин), оксазолидиноны (линезолид) и рифампицин [14,15]. При этом следует отметить, что в случае стафилококковой природы инфекционного процесса пероральный путь ведения антимикробных препаратов возможен исключительно при наличии ответа на двухнедельную парентеральной терапию [8]. Вместе с тем, необходимо подчеркнуть, что возможность применения пероральной антимикробной терапии при ИЭ требует дальнейшего изучения.
Основными показаниями к раннему хирургическомувмешательству при ИЭ являются быстро прогрессирующая сердечная недостаточность, неконтролируемая инфекция (отсутствие положительной динамики при адекватно назначенной антимикробной терапии) и профилактика тромбоэмболических осложнений при высоком риске их развития (подвижные вегетации размером более 10 мм с потенциальным сочетанием инфицирования стафилококковой и грибковой этиологии и поражением митрального клапана) [8].
Заключение
Своевременная диагностика ИЭ и назначение антимикробной терапии приводят к значительному снижению риска развития анатомических изменений клапанов сердца. Вместе с тем, в Российской Федерации в большинстве случаев адекватное назначение антимикробных препаратов при ИЭ отмечается только в условиях крупных многопрофильных стационаров [2]. С целью повышения эффективности лечения к ведению пациентов с ИЭ рекомендуется привлекать специалистов различного профиля, включая кардиолога, врача функциональной диагностики, клинического фармаколога и кардиохирурга [16]. Несмотря на установленные алгоритмы антимикробной терапии в отношении подавляющего большинства случаев ИЭ, продолжаются дискуссии специалистов, касающиеся вопросов терапии ИЭ стафилококковой этиологии и эмпирической антибиотикотерапии данной нозологии. В современных международных рекомендациях отмечено, что если инфекционный процесс не поддается контролю при назначении антимикробной терапии, необходимо хирургическое лечение [8]. Вместе с тем, многие отечественные специалисты призывают подходить к решению данного вопроса очень осмотрительно, учитывая, что качество жизни консервативно пролеченных пациентов значительно выше по сравнению с теми, кто перенес оперативное вмешательство на клапанном аппарате сердца и вынуждены впоследствии постоянно принимать непрямые антикоагулянты.
Неврологические осложнения развиваются у15-40% пациентов с инфекционным эндокардитом и в большинстве случаев обусловлены тромбоэмболией церебральных сосудов. Риск эмболий зависит от размеров и подвижности вегетаций. Среди возбудителей эндокардита сразвитием данных осложнений чаще других ассоциирован Staphylococcus aureus. При возникновении неврологических осложнений инфекционного эндокардита принципиально важным является привлечение специалистов различного профиля с целью более точной диагностики, определения тактики лечения и улучшения прогноза пациентов.
Неврологические осложнения развиваются у 15-40% пациентов с инфекционным эндокардитом (ИЭ). Чаще всего они возникают до начала антимикробной терапии (АМТ) и в первые дни после ее назначения, когда отмечается гемодинамическая нестабильность вегетаций [1,2]. Спектр неврологических осложнений ИЭ включает в себя ишемический и геморрагический инсульт, транзиторные ишемические атаки, бессимптомную церебральную эмболию, микотические аневризмы, абсцесс мозга, менингит, токсическую энцефалопатию и эпилепсию [3,4]. Среди возбудителей ИЭ с развитием неврологических осложнений чаще других ассоциирован Staphylococcus aureus. Это связано с тем, что при стафилококковой этиологии заболевания наблюдаются острое течение инфекционного процесса и изменения в свертывающей системе крови, способствующие возникновению тромбоэмболий [5,6]. Ишемическое или геморрагическое повреждение центральной нервной системы приводит к более чем двукратному повышению внутрибольничной летальности пациентов с ИЭ [7,8].
| Локализация | Частота, % |
|---|---|
| Селезенка | 40,8 |
| Головной мозг | 35,2 |
| Конечности | 25,3 |
| Почки | 22,5 |
| Коронарные артерии | 15,5 |
| Легкие | 8,5 |
| Центральная артерия сетчатки | 2,8 |
Структура и характеристика неврологических осложнений ИЭ
Тромбоэмболические проявления – одни из самых частых системных осложнений ИЭ. Например, в многоцентровом исследовании МАЭСТРО частота их составила 38,2% и превышала таковую иммунопатологических проявлений заболевания (11,1%) (рис. 1) [2]. При стафилококковой этиологии ИЭ тромбоэмболические осложнения возникают чаще, чем при стрептококковой или энтерококковой (рис. 2) [9]. Результаты ряда современных исследований свидетельствуют о том, что при ИЭ чаще всего развиваются тромбоэмболии сосудов селезенки и головного мозга (табл. 1) [3,9].
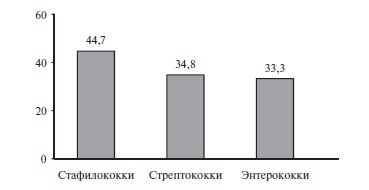
Рис. 1. Частота основных клинических проявлений ИЭ в%(исследование МАЭСТРО).
Ряд экспертов констатировали достоверно более высокую летальность в группе пациентов с тромбоэмболиями (39%, p<0,001) по сравнению с таковой у пациентов, у которых данные осложнения не отмечались (9%) [9].
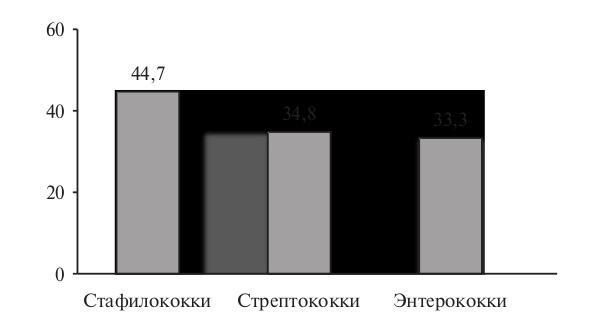
Рис. 2. Частота тромбоэмболических осложнений при ИЭ в зависимости от возбудителя (%).
ИЭ может осложниться внутримозговым или субарахноидальным кровоизлияниями, сопровождающимися высокой летальностью [3,11]. Первичное внутримозговое кровоизлияние у больных с ИЭ наблюдается в 2,4% случаев [9]. Основной причиной вторичных геморрагических осложнений ИЭ является геморрагическая трансформация ишемического инсульта как следствие септической эмболии церебральных сосудов. К более редким причинам внутримозговых кровоизлияний относятся гнойный артериит, некроз сосудистой стенки, не приводящий к образованию аневризмы, а также сопутствующее назначение антиагрегантов и антикоагулянтов [8].
Микотические аневризмы встречаются у 2-5% пациентов с ИЭ (рис. 3) и могут быть обусловлены как прямым воздействием инфекционного агента на стенку сосуда, так и септической эмболией vasa vasorum [8]. Mикотические аневризмы чаще развиваются в бифуркациях дистальных отделов средней мозговой артерии. Окклюзия сосудов септическими эмболами, сопровождающаяся вторичным артериитом и деструкцией стенки сосуда, как правило, наблюдается при ИЭ, вызванным S. aureus, в то время как поражение сосудистой стенки vasa vasorum ассоциировано с выделением Streptococcus viridans [12]. Микотические аневризмы могут быть бессимптомными, а клинические проявления их варьируются от легкой головной боли до менингеального синдрома, расстройств чувствительности, поражения черепно-мозговых нервов, эпилептических приступов, внезапно развившегося гемипареза и гемианопсии [13].
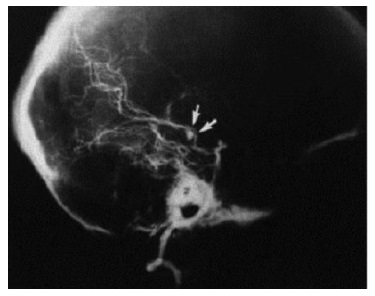
Рис. 3. Визуализация микотической аневризмы при ангиографии церебральных сосудов.
Менингит и менингоэнцефалит в последние десятилетия осложняют течение ИЭ примерно в 3% случаев. Они вызывают существенное ухудшение состояния больных и прогноза. Развитие воспаления мозговых оболочек связывают с воздействием высоко вирулентных возбудителей, присутствующих в составе тромботических масс, прежде всего S. aureus [9].
Абсцессы головного мозга при ИЭ встречаются редко. Они формируются в результате септических эмболий на фоне ограниченного инфекционного воспаления нервных волокон, которое может трансформиро ваться в микро- и/или макроабсцессы. Чаще развиваются микроабсцессы, которые могут проявляться головной болью, эпилептическими приступами и энцефалопатией [8].
Энцефалопатия является неспецифическим проявлением ИЭ и может быть объяснена наличием лихорадки, развитием острого нарушения мозгового кровообращения в лобных долях головного мозга, а также усугублением дисциркуляторной энцефалопатии у пожилых пациентов на фоне интоксикации. Развитие данного осложнения характеризуется изменением личности, возникновением галлюцинаций и параноидальных идей [9,10].
Ведение пациентов с неврологическими осложнениями инфекционного эндокардита
В рекомендациях Европейского общества кардиологов 2015 года подчеркивается важность лечения пациентов с ИЭ в специализированных центрах и привлечения мультидисциплинарной команды специалистов, которая способна определить тактику ведения пациентов (выбор комбинаций антимикробных препаратов и длительности АМТ, установление показаний для оперативного лечения), своевременно выявить осложнения заболевания и провести их коррекцию (табл. 2) [3,14].
| Показания | Время | Класс рекомендаций | Уровень доказательств |
|---|---|---|---|
| Примечание: *эхстренное хирургическое вмешательство – в течение 24 часов; **неотложное хирургическое вмешательство – в течение нескольких дней; ***отложить – через 1-2 недели АМТ | |||
| Сердечная недостаточность | |||
| Поражение аортального или митрального клапана с тяжелой острой регургитацией, обструкцией или фистулой, ведущее к рефрактерному отеку легких или кардиогенному шоку | Экстренно | I | B |
| Поражение аортального или митрального клапана с тяжелой острой регургитацией, обструкцией, вызывающее симптомы сердечной недостаточности или эхокардиографические признаки нарушенной гемодинамики | Неотложно | I | B |
| Неконтролируемая инфекция | |||
| Локально неконтролируемая инфекция (абсцесс, псевдоаневризма, фистула, растущая вегетация) | Неотложно | I | B |
| Инфекция, вызванная грибами или множественно-резистентными микроорганизмами | Неотложно/ отложить | I | C |
| Персистирующие положительные результаты бактериологического исследования крови несмотря на назначение адекватной АМТ | Неотложно | IIа | B |
| Поражение протезированных клапанов, вызванное стафилококками и не-HACEK грамотрицательными микроорганизмами | Неотложно/ отложить | IIа | C |
| Предотвращение тромбоэмболических осложнений | |||
| Поражение аортального или митрального клапана с персистирующими вегетациями размером более 10 мм после хотя бы одного эпизода эмболии несмотря на назначение адекватной АМТ | Неотложно | I | B |
| Поражение аортального или митрального клапана с вегетациями более 10 мм, ассоциированное с тяжелым стенозом или регургитацией и низким операционным риском | Неотложно | IIа | B |
| Поражение аортального или митрального клапана с изолированными очень большими вегетациями (более 30 мм) | Неотложно | IIа | B |
| Поражение аортального или митрального клапана с изолированными большими вегетациями (более 15 мм) и отсутствием других показаний для хирургического вмешательства | Неотложно | IIb | C |
Ключевую роль в прогнозировании тромбоэмболических осложнений играет эхокардиография, которая позволяет точно установить локализацию поражения, размеры микробных вегетаций, степень и динамику компенсации поврежденного клапана, что, в свою очередь, определяет дальнейшую тактику ведения пациентов с ИЭ. Факторы риска эмболий включают в себя размер и подвижность вегетаций, их локализацию на митральном клапане [15]. По данным современных исследований, высокий риск тромбоэмболических осложнений отмечается при наличии вегетаций диаметром более 10 мм, а самый высокий – при размере вегетаций 30 мм и более [16,17].
В многоцентровом исследовании МАЭСТРО чреспищеводная эхокардиография, позволяющей диагностировать ИЭ на начальных стадиях заболевания, использовалась в 15,8% случаев. Инфекционное поражение чаще всего локализовалось на митральном (43,6%) и аортальном (37,9%) клапанов. У 15,9% больных отмечалось сочетанное поражение клапанов, которое обусловливало повышенный риск развития тромбоэмболических осложнений [18].
В последние годы увеличилось количество публикаций, свидетельствующих о потенциальной роли в диагностике инфекционного поражения эндокарда компьютерной и магнитно-резонансной томографии. Однако на сегодняшний день эти методы исследования не вошли в рутинную практику, а их применение при ИЭ в основном ограничено диагностикой поражения головного мозга (табл. 3). Кроме того, использование контрастных веществ в ходе проведения данных визуализирующих методов исследования должно быть ограничено у пациентов с нефропатией и нестабильной гемодинамикой [3].
| Рекомендации | Класс рекомендаций | Уровень доказательств |
|---|---|---|
| Если после бессимптомной эмболии или транзиторной ишемической атаки кардиохирургическое вмешательство показано, оно должно быть выполнено без задержки | I | B |
| Нейрохирургическое вмешательство рекомендуется при очень больших, увеличивающихся или разрывающихся микотических аневризмах | I | C |
| После внутричерепного кровоизлияния хирургическое лечение должно быть отложено по крайней мере на 1 месяц | IIа | B |
| После развития ишемического инсульта вопрос о хирургическом лечении с целью коррекции сердечной недостаточности, устранения абсцесса или неконтролируемой инфекции должен быть немедленно рассмотрен при сохраняющихся показаниях к его проведению при отсутствии комы и исключении внутричерепного кровоизлияния с помощью КТ или МРТ | IIа | B |
| При сохранении подозрения на развитие микотических аневризм и отрицательных результатах неинвазивных визуализирующих методов рекомендуется проведение ангиографии | IIа | B |
В соответствии с рекомендациями Европейского общества кардиологов наибольшее значение для снижения риска тромбоэмболических осложнений имеет раннее назначение адекватной АМТ [3]. Вместе с тем, согласно результатам исследования МАЭСТРО, стартовая АМТ при ИЭ была эффективной лишь в 51,3% случаев [1]. Следует отметить, что с учетом низкой частоты выделения этиологически значимых возбудителей при ИЭ в Российской Федерации (по данным исследования МАЭСТРО – 35,5%) важное значение для обеспечения эффективности АМТ имеет выявление потенциальных факторов риска, таких как инъекционная наркомания, кардиохирургические вмешательства и инвазивные медицинские манипуляции, которые обусловливают ведущую роль S. aureus в этиологической структуре за бо левания [1,2].
Важно подчеркнуть, что применение антитромботических лекарственных средств в активную фазу инфекционного процесса в настоящее время не подкреплено данными крупных клинических исследований и оправдано лишь при поражении протезированных клапанов, частота вовлечения которых на сегодняшний день не превышает 15%. Кроме того, в случае поражения протезированных клапанов увеличивается вероятность выделения коагулазонегативных стафилококков, что также может способствовать нарушению реологических свойств крови [3].
Целесообразность выполнения раннего хирургического вмешательства для предотвращения тромбоэмболических осложнений у пациентов с ИЭ широко обсуждается в экспертном сообществе. В настоящее время рекомендуется индивидуально подходить к решению этого вопроса, принимая во внимание степень поражения клапанного аппарата сердца и динамику ответа на АМТ (табл. 2) [3,19].
Хирургическое лечение микотических аневризм, включающее клипирование или эндоваскулярную эмболизацию, представляет собой одну из наиболее сложных процедур даже в современных условиях. При отсутствии возможности хирургического вмешательства терапия должна включать в себя длительный курс назначения антимикробных препаратов, что в подавляющем большинстве случаев позволяет уменьшить размер микотических аневризм [18].
Заключение
Проблема неврологических осложнений ИЭ остается одной из наиболее серьезных в кардионеврологии. Для ее успешного решения необходимы усилия широкого круга специалистов – кардиологов, кардиохирургов, неврологов, нейрохирургов, врачей функциональной диагностики и других. Современная диагностика ИЭ основывается на предложенных в 1994 г. и впоследствии дополненных Duke критериев, согласно которым ключевая роль отводится бактериологическому исследованию крови и визуализирующим методам диагностики. Вместе с тем, в Российской Федерации отмечается чрезвычайно низкая частота выделения этиологически значимых возбудителей из крови, а также недостаточно широкое использование чреспищеводной эхокардиографии, позволяющей диагностировать поражение клапанов сердца на начальных стадиях заболевания. Ранняя диагностика ИЭ и назначение адекватной АМТ способствуют максимальному сокращению риска неврологических осложнений. В случае развития таких осложнений показания к хирургическому лечению сохраняются, но потенциальная польза его должна быть сопоставлена с операционным риском и послеоперационным прогнозом.
Среди неврологических осложнений ИЭ чаще всего встречается ишемическое поражение головного мозга вследствие тромбоэмболии церебральных сосудов. Наиболее высокий риск тромбоэмболических осложнений наблюдается в первые 2 недели заболевания и ассоциирован с размерами и подвижностью вегетаций, наличием в анамнезе эпизода тромбоэмболии, а также видом этиологически значимого микроорганизма. Знание вариантов поражения нервной системы при ИЭ, которое может маскировать основное заболевание, позволит в более ранние сроки поставить правильный диагноз и своевременно назначить лечение, способствующее снижению смертности и улучшению прогноза у данной категории пациентов.
Повышение эффективности ведения пациентов с ИЭ невозможно без знания особенностей диагностики и подходов к терапии, четких представлений об этиологической структуре, учета глобальных и локальных данных об антимикробной резистентности наиболее часто встречающихся возбудителей. В этой связи чрезвычайно важной представляется совместная работа клиникомикробиологических лабораторий, направленная на получение достоверных данных о возбудителях и их чувствительности к антимикробным препаратам, и врачей, осуществляющих лечение пациентов с ИЭ. Одним из методов получения подобной информации является участие научных работников и практикующих врачей в многоцентровых клинических исследованиях, проводимых по единому протоколу.
Ни одно заболевание сердца не может сравниться с инфекционным эндокардитом по частоте, разнообразию и тяжести неврологических осложнений. Не случайно, что более ста лет назад Ослер описал инфекционный эндокардит как триаду, состоящую из лихорадки, сердечного шума и гемиплегии [1]. Инфекционный эндокардит является чрезвычайно тяжелым заболеванием с летальностью, достигающей при консервативном лечении 80% (общая летальность составляет [2, 3]. В настоящее время инфекционный эндокардит вышел на четвертое место по уровню смертности среди инфекционных синдромов после уросепсиса, пневмонии и перитонита и занял нишу социально обусловленных заболеваний [4]. Несмотря на успехи в диагностике и лечении инфекционного эндокардита частота неврологических осложнений заболевания остается в последние три десятилетия на уровне (по нашим данным — около 25%) [5, 6, 7, 8, 9, 10, 11]. Присоединение неврологических осложнений значительно увеличивает летальность. При мозговой эмболии на фоне инфекционного эндокардита она колеблется между 20% и 80% (по нашим данным — около 60%), а в доантибиотическую эру она составляла 100% [5, 11, 12, 13, 14]. Основными этиопатогенетическими факторами при инфекционном эндокардите являются: травма эндокарда, бактериемия и ослабление резистентности организма. Спектр наиболее частых возбудителей и предрасполагающих кардиальных повреждений к настоящему времени претерпел некоторые изменения. Ревматическое заболевание сердца было одним из наиболее распространенных заболеваний сердца, предрасполагающих к эндокардиту (вторичный инфекционный эндокардит), но сейчас чаще развивается первичный инфекционный эндокардит, то есть поражение условно неизмененных клапанов сердца. Вместе с изменениями предрасполагающих условий изменились и возбудители эндокардита. Наиболее частыми остаются стрептококки и стафилококки, однако, частота стрептококковой этиологии снижается, а стафилококковой — растет, кроме того, в последние годы продолжает расти доля энтерококка, а также грамотрицательной флоры, микоплазм, вирусов, грибов, риккетсий, вероятно, вследствие иммуносупрессии, изменения клапанного субстрата и использования антимикробных средств. Неврологические осложнения у больных инфекционным эндокардитом чаще развиваются при поражении золотистым стафилококком [3, 11, 12, 15, 16]. Характерный патологический признак инфекционного эндокардита — это наличие вегетаций на створках клапанов. Вегетации состоят из аморфного фибрина и тромбоцитов вместе с возбудителями и лейкоцитами, являясь, таким образом, инфицированными белыми фибрин-тромбоцитарными тромбами. Возбудители, как правило, локализуются глубоко внутри вегетации и, таким образом, надежно защищены от антибактериальных факторов крови. Для обнаружения вегетаций используют эхокардиографию. Трансэзофагеальная эхокардиография значительно превосходит трансторакальное исследование — чувствительность достигает специфичность — [3]. У обследованных нами пациентов вегетации имели существенные различия: по размеру — от очень мелких до массивных (24 мм); по форме — шаровидные, булавовидные, лентовидные, дольчатые; по характеру прикрепления к клапану — на узком основании, на широком основании; по подвижности — флотирующие, фиксированные; по структуре — рыхлые, организованные. Очень важной является последняя характеристика, поскольку она отражает активность инфекционного процесса в сердце и эмбологенный потенциал вегетаций. Шестидесятиминутный транскраниальный допплеровский мониторинг кровотока по средней мозговой артерии позволяет детектировать микроэмболические сигналы (МЭС) у больных инфекционным эндокардитом. В нашем исследовании все пациенты с МЭС имели свежий инфекционный эндокардит (давность не более 2 месяцев) и рыхлые вегетации по данным эхокардиографии. При давности эндокардита более 2 месяцев МЭС не обнаруживались. Появление МЭС связано с пассажем мелких фрагментов рыхлых клапанный вегетаций, а также агрегатов тромбоцитов, образующихся в турбулентном потоке вблизи пораженного клапана. Неврологические осложнения наиболее часто возникают до начала антибактериальной терапии и в первую неделю ее проведения. В подавляющем большинстве случаев церебральная эмболия развивается в течение первого месяца от момента появления симптомов эндокардита. В этот период вегетации являются рыхлыми и могут легко фрагментироваться, вызывая эмболизацию. Затем в процессе адекватной антибактериальной терапии происходит уплотнение вегетаций. По данным эхокардиографии, выполненной в динамике, вегетации становятся плотными и прочными, они организуются, покрываются эндотелием и уже реже вызывают эмболии. Неврологические осложнения инфекционного эндокардита связаны с количеством, размером, локализацией и инфицированностью эмболов. Пациенты с инфекционным эндокардитом могут переносить инфаркт головного мозга, интрацеребральную и субарахноидальную геморрагию, микотическую аневризму, энцефалопатию, внутримозговой абсцесс, менингит и менингоэнцефалит. Ишемический инсульт является наиболее частой неврологической манифестацией инфекционного эндокардита (по данным литературы — у пациентов с инфекционным эндокардитом, по нашим данным — у 20%). Методы нейровизуализации демонстрируют в большинстве случаев множественные ишемические очаги, из которых примерно половина — корковые, локализующиеся в бассейнах концевых ветвей мозговых артерий, а другая половина представляет собой лакунарные очаги, располагающиеся в глубине полушарий мозга на границе серого и белого вещества. При небольших размерах очагов течение инсульта является достаточно доброкачественным. МРТ является более информативным методом исследования, чем КТ, в выявлении очагового поражения головного мозга у больных инфекционным эндокардитом. Наиболее часто поражается бассейн левой средней мозговой артерии. Церебральная геморрагия имеет место приблизительно у пациентов с инфекционным эндокардитом (по нашим данным — у 5%), чаще при поражении Staphylococcus aureus, и происходит вследствие трех отдельных патофизиологических механизмов. Церебральная септическая эмболия с последующим эрозивным артериитом является причиной и ранней геморрагии, и образования микотических аневризм с их последующим разрывом. Геморрагическая трансформация ишемического инфаркта дополняет данную триаду. Экспериментальные исследования церебральной септической эмболии документируют появление септического артериита в течение 1 дня после эмболии. Считается, что сосудистая деструкция возникает вследствие проникновения микроорганизмов из просвета сосуда в пространства Вирхова-Робена через vasa vasorum окклюзированного сосудистого сегмента. Микроорганизмы затем проникают в адвентицию сосуда, разрушая более медиальные слои до тех пор, пока не достигнут внутренней эластической пластинки. Микотические аневризмы по данным литературы имеют место у 5%-12% пациентов с эндокардитом (по нашим данным — около 1%). Примерно половина микотических аневризм разрывается с развитием интрацеребральной геморрагии или субарахноидального кровоизлияния. Иногда разрыв аневризм происходит спустя месяцы после излечения эндокардита. Летальность при разрыве достигает 80%. У 30% больных при антибиотикотерапии аневризмы подвергаются обратному развитию, а также менее вероятен разрыв аневризмы. Острая энцефалопатия — второе по частоте неврологическое осложнение эндокардита (по данным литературы и нашим данным ее переносят около 20% пациентов с инфекционным эндокардитом). Патофизиологическими механизмами являются мультифокальная септическая микроэмболия с последующим образованием микроинфарктов и микроабсцессов, изменения интракраниальных артерий (периваскулярная пролиферация), мозговая дисциркуляция и интоксикация. Аутопсические исследования пациентов с неврологическими осложнениями эндокардита показывают множественные микроинфаркты у 23%, микроабсцессы — у 26%. Большие абсцессы головного мозга редки. Они имеют место менее чем в 1% случаев при эндокардите. Менингит и менингоэнцефалит развиваются примерно у 4% пациентов с инфекционным эндокардитом, являются, как правило, дебютом заболевания, и поражение клапанов сердца выявляется уже после постановки неврологического диагноза. Таким образом, неврологические осложнения при инфекционном эндокардите представляют собой довольно пеструю картину. Инфекционный эндокардит до сегодняшнего дня остается одним из наиболее трудно диагностируемых заболеваний, несмотря на хорошо известные клинические и лабораторные признаки. Особенно затруднена постановка правильного диагноза в случае дебюта заболевания неврологическими осложнениями. По нашим данным примерно у 10% больных инфекционный эндокардит дебютировал развитием неврологических осложнений в виде ишемического, геморрагического инсультов или субарахноидального кровоизлияния. В этом случае имеются некоторые отличительные особенности течения неврологической патологии, которые позволяют заподозрить инфекционный эндокардит в качестве причинного фактора.
- Начало развития неврологической симптоматики является острым, с захватом нескольких бассейнов кровоснабжения головного мозга. Очаговые симптомы поражения нервной системы часто не достигают выраженной степени. Более часто, чем при инсультах иного генеза, встречается общемозговая симптоматика (головная боль, оглушение и др.).
- При нейровизуализации выявляются множественные инфаркты мозга.
- Часто наблюдается повышение температуры тела еще до развития симптомов поражения нервной системы.
- При лабораторных исследованиях выявляется: снижение уровня гемоглобина, снижение количества эритроцитов, лейкоцитоз, увеличение СОЭ.
- При УЗИ часто обнаруживается увеличение селезенки.
- При эхокардиографии выявляются клапанные вегетации.
СПИСОК ЛИТЕРАТУРЫ
- Osler W. Gulstonian lectures on malignant endocarditis // Lancet.- 1885.- Vol. 1.- P.
- Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита.- СПб.: Наука, 1995.- 230 с.
- Mylonakis E., Calderwood S.B. Infective endocarditis in adults // N. Engl. J. Med.- 2001.- Vol. 345.- P.
- Bayer A.S., Bolger A.F., Taubert K.A., et al. Diagnosis and management of infective endocarditis and its complications // Circulation.- 1998.- Vol. 98.- P.
- Arauz-Gongora A.A., Souta-Meirino C.A., Cotter-Lemus L.E., et al. The neurological complications of infectious endocarditis // Arch. Inst. Cardiol. Mex.- 1998.- Vol. 68.- P.
- Jones H.R., Siekert R.G., Ceraci J.E. Neurologic manifestations of bacterial endocarditis // Ann. Int. Med.- 1969.- Vol. 71.- P.
- Millaire A., Leroy O., Gaday V., et al. Incidence and prognosis of embolic events and metastatic infections in infective endocarditis // Europ. Heart J.- 1997.- Vol. 18.- P.
- Pruitt A.A., Rubin R.H., Karchmer A.W., Duncan G.W. Neurologic complications of bacterial endocarditis // Medicine.- 1978.- Vol. 57.- P.
- Salgado A.V., Furlan A.J., Keys T.F., et al. Neurologic complications of endocarditis: A experience // Neurology.- 1989.- Vol. 39.- P.
- Кузнецов А.Н. Кардиогенная и артерио-артериальная церебральная эмболия: Этиология, патогенез, клиника, диагностика, лечение и профилактика: Автореф. дис. : д-ра мед. наук.- СПб., 2001.- 32 с.
- Климов И.А. Автореф. Дис.
- Heiro M., Nikoskelainen J., Engblom E., et al. Neurologic manifestations of infective endocarditis: A experience in a teaching hospital in Finland // Arch. Intern. Med.- 2000.- Vol. 160.- P.
- Herrschaft H. Herzkrankheiten als Ursache zerebraler Symptome und Syndrome // Fortschr. Neurol. Psychiatr.- 1990.- Jg.58.- S.
- Rabinovich S., Evans J., Smith J.M., January L.E. A long term view of bacterial endocarditis: 337 cases // Ann. Int. Med.- 1965.- Vol. 63.- P. 185.
- Hanna J.P., Furlan A.J. Cardiac disease and embolic sources // Brain ischemia: Basic concepts and clinical relevance / Ed. by Caplan L.R.- London, etc.: Springer-Verlag, 1995.- P.
-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

