Интоксикация организма после перитонита
Обновлено: 19.04.2024
В работе на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определена роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита. Исследования показали, что при остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в ее тканях при сохранении их значительного уровня в тканях брюшины и кишечника. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.

1. Брискин Б.С., Яровая Г.А., Савченко З.И. Иммунные и ферментные нарушения у больных с острым панкреатитом // Хирургия. Журнал им. Н.И. Пирогова. – 2001. – № 7. – С. 21–24.
2. Глушко В.А. Неотложные хирургические вмешательства при нагноившихся постнекротических кистах поджелудочной железы // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 126–127.
3. Кифус Ф.В., Пахомова Г.В., Береснева Э.А., Дубров Э.Я. Выбор лечебной тактики при забрюшинных флегмонах на основании клинико-экспериментальных исследований // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 42–43.
4. Купцова М.Ф., Васильков В.Г., Бегунов В.А., Чернова Т.В. Интенсивная терапия гнойно-септических заболеваний // Материалы четвертого Всероссийского съезда анестезиологов и реаниматологов. – М., 1994. – С. 203–204.
5. Малярчук В.И., Корольков А.Ю., Иванов В.А. Малоинвазивные вмешательства при осложненном панкреонекрозе // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 85–86.
6. Batalik B., Mydlo J. Peroperative peritoneal lavage and intra-abdominal instillation of antibiotics in an experiment // Rozhl. Chir. – 1991, mar. – Vol. 70. – № 5. – P. 300–303.
7. Cuesta M.A., Doblas M., Castaneda L. Sequential abdominal Reexplorations with Zipper Technique // World. J. Surg. – 1991. – Vol. 15. – P. 74–80.
8. Wahl W., Minkus A., Junginger T. Prognostisch relevante Faktoren bei der intraabdominalen Infektion // Langenbecks. Arch. Chir. – 1992. – Bd. 377 (4). – Р. 237–243.
Эндогенная интоксикация является ведущим синдромом у 85 % больных гнойно-септическими заболеваниями [4]. Одной из основных причин развития эндогенной интоксикации является перитонит. Актуальность гнойного воспаления брюшины перед современной хирургией обусловливает то, что оно является главенствующим осложнением многих заболеваний и встречается достаточно часто [1, 2, 5]. Кроме того, при остром перитоните сохраняется достаточно высокая летальность ‒ 20–30 %, которая в терминальной стадии заболевания достигает 50–70 %, а при генерализации инфекции и развитии полиорганной недостаточности 75,8–100,0 % [3, 6–8]. Поэтому особую значимость приобретает изучение факторов прогрессирования эндогенной интоксикации при остром перитоните с целью своевременного патогенетического влияния на них.
Цель работы. В эксперименте на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определить роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита.
Материалы и методы исследования
В основу работы положены экспериментальные исследования на взрослых беспородных собаках обоего пола, разделенных для решения поставленных задач на 2 группы. Первая группа (n = 16) – животным моделировали острый перитонит по способу А.П. Власова (1991) путем введения каловой взвеси в брюшную полость, через сутки проводили лапаротомию, оценивали выраженность воспалительного процесса в брюшной полости, количество экссудата, макроскопическое состояние кишечника и печени, забирали образцы ткани печени и кишечника. Брюшную полость санировали. Вторая группа (n = 12) – животным моделировали острый перитонит по той же методике, однако брюшную полость не санировали.
В контрольные сроки проводили забор крови и лимфы, биопсию тканей печени и кишечника, исследовали выраженность эндогенной интоксикации по содержанию ее маркеров в плазме крови и лимфе, активность перекисного окисления липидов (ПОЛ), фосфолипазы А2 и супероксиддисмутазы в плазме крови, лимфе, тканях печени и кишечника.
В послеоперационном периоде животным проводилась антибактериальная (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела) и инфузионная (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы животного) терапия.
Активность фосфолипазы А2 оценивали по каталитической деятельности фермента потенциометрическим методом. Диеновые и триеновые конъюгаты в липидах определяли спектрофотометрическим методом при длине волны 232 и 275 нм. Содержание малонового диальдегида выявляли в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы изучали в реакции с нитросиним тетразолием.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента, корреляционная зависимость оценена с помощью критерия r. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение
Экспериментальные исследования показали, что через сутки (первая группа) после введения в брюшную полость каловой взвеси у животных развивался острый перитонит. Животные были вялые, адинамичные, жадно пили воду, у некоторых животных отмечено возникновение рвоты или рвотных движений. Температура тела была субфебрильной. При лапаротомии в брюшной полости имелся мутный с хлопьями фибрина и неприятным запахом выпот, количество которого достигало 114,40 ± 4,15 мл. Петли кишок были увеличены в диаметре за счет содержания в них кишечного содержимого и газа, стенка тонкой кишки была инфильтрирована, с налетом фибрина. Париетальная брюшина гиперемирована, инфильтрирована, с мелкоточечными кровоизлияниями.
В динамике развития патологического процесса отмечалось существенное увеличение в плазме крови содержания токсических продуктов как гидрофильной, так и гидрофобной природы (рис. 1).
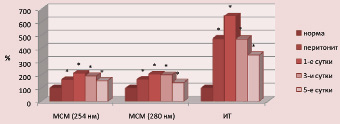
Рис. 1. Показатели эндогенной интоксикации плазмы крови общего кровотока при остром перитоните (значения нормы приняты за 100 %). Примечание: здесь и далее: * – достоверность отличия от нормы при p < 0,001
В лимфе содержание токсических продуктов также возрастало. Однако в отличие от данных плазмы крови, где после санации брюшной полости отмечается снижение выраженности эндогенной интоксикации, в лимфе в течение всего эксперимента их уровень сохранялся на высоких цифрах (рис. 2).
При исследовании скорости лимфотока было выявлено снижение значения данного показателя на всех этапах динамического наблюдения. Так, на первые сутки эксперимента он был ниже нормы на 27,3 % (р < 0,05), на третьи – уже на 48,2 % (р < 0,05), а на пятые – на 45,3 % (р < 0,05).
В ходе проведения экспериментальных исследований при остром перитоните нами установлен факт интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в динамике патологического процесса в плазме крови и лимфе.
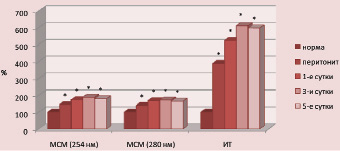
Рис. 2. Показатели эндогенной интоксикации лимфы при остром перитоните (значения нормы приняты за 100 %)
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали до третьих суток заболевания, к концу наблюдения данные показатели стабилизировались. Так, уровень первичных продуктов ПОЛ превышал норму на 68,1–124,5 % (р < 0,05), активность фосфолипазы А2 возрастала на 215,2–714,3 % (р < 0,05), активность супероксиддисмутазы снижалась на 24,5–49,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 51,36–149,24 % (p < 0,001) выше нормы (рис. 3), а активность супероксиддисмутазы была на 28,12–64,23 % (p < 0,001) ниже нормальных значений.
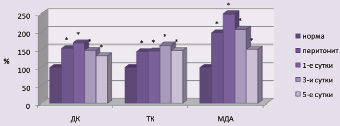
Рис. 3. Динамика молекулярных продуктов липопереокисления в ткани тонкой кишки при остром перитоните на фоне стандартной терапии (ДК – диеновые, ТК – триеновые коньюгаты; МДА – малоновый диальдегид)
В ткани печени также существенно возрастала интенсивность ПОЛ, о чём свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы более чем в 2 раза. В тканевых структурах органа отмечалась интенсификация фосфолипазы А2. Отметим, что в ткани печени положительная динамика изученных показателей регистрировалась уже с первых суток после проведения хирургического лечения перитонита.
Корреляционный анализ выявил сопряженность эндогенной интоксикации с выраженностью мембранодестабилизирующих явлений в тканевых структурах кишечника и печени. Отметим, что наиболее высокие значения коэффициента корреляции были зафиксированы при анализе взаимосвязи мембранодеструктивных процессов в кишечнике и содержания маркеров эндогенной интоксикации в лимфе, а также мембранодеструктивных процессов в печени и содержания маркеров эндогенной интоксикации в плазме крови.
Следует выделить, что восстановление гомеостатических констант в плазме крови при остром перитоните происходит быстрее, чем в лимфе, что обусловлено быстрым регрессом мембранодестабилизирующих явлений в тканях печени при сохранении их значительного уровня в тканях брюшины и кишечника.
В заключении данной серии экспериментов отметим, что в прогрессировании эндогенной интоксикации при остром перитоните важное значение имеют мембранодестабилизирующие явления не только в тканях брюшины и кишечника, но и печени. При остром перитоните после санации брюшной полости и уменьшения воспалительного процесса в ней происходит быстрое восстановление функциональной активности печени, что приводит к уменьшению уровня токсических продуктов в плазме крови при сохранении относительно высокого их уровня в лимфе.
Во второй группе, как указано выше, санация брюшной полости животным не проводилась, что способствовало прогрессивному течению заболевания с утяжелением клинической, макроскопической и биохимической симптоматики у подопытных животных.
Явления эндотоксикоза в данной группе исследования нарастали в течение всего периода наблюдения. Так, содержание молекул средней массы в плазме крови превышало норму на 125,3–412 % (p < 0,05). Индекс токсичности возрастал относительно нормы от 658,7 % (p < 0,05) на вторые сутки эксперимента до 974,3 % (p < 0,05) – на конечном этапе наблюдения.
В лимфе содержание токсических продуктов также возрастало на всех сроках эксперимента, но прирост (темп) был ниже такового в плазме крови. При исследовании скорости лимфотока было выявлено прогрессивное снижение значения данного показателя на всех этапах динамического наблюдения на 34,4–59,2 % (p < 0,05).
При прогрессировании перитонита регистрировалось динамическое увеличение интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в плазме крови и лимфе.
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали в течение всего эксперимента. Так, уровень первичных продуктов ПОЛ превышал норму на 148,3–226,4 % (р < 0,05), активность фосфолипазы А2 возрастала на 812,5–1121,5 % (р < 0,05), активность супероксиддисмутазы снижалась на 52,4–76,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 154,3–235,7 % (p < 0,05) выше нормы, а активность супероксиддисмутазы была ниже нормы на 56,3–78,4 % (p < 0,05).
В ткани печени также прогрессивно возрастала интенсивность ПОЛ, о чем свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы; отмечалось повышение фосфолипазной активности.
Отметим, что при прогрессировании острого перитонита при отсутствии хирургического лечения динамика содержания токсических продуктов в плазме крови и лимфе, а также в ткани кишечника и печени одинакова.
Таким образом, исследования показали, что при нарастании воспалительного процесса в брюшной полости отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
1. При остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что во многом обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в тканях органа при сохранении их значительного уровня в тканях брюшины и кишечника.
2. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
Рецензенты:
Несмотря на схожесть патогенеза, синдрома эндогенной интоксикации при каждой нозологической форме имеет определенные специфические признаки (Ю. С. Гольд-фарб, 1988; Б. И. Шулутко, 1993; Э. А. Туликова, 1994). Перитонит условно можно назвать классической моделью СЭИ, поэтому его целесообразно рассмотреть в качестве базовой модели данного состояния.
Патогенез. Выделяют три компонента, участвующих в формировании СЭИ при перитоните:
1. Микробиологический.
2. Биохимический.
3. Иммунологический.
В течении СЭИ выделяют три (разы (В. К. Гостищев и соавт., 1992):
I фаза — фаза интоксикации. В формировании СЭИ участвуют болезнетворные микробы и их токсины, биоактивные вещества, синтезируемые в организме в норме, но в данном случае их синтез выходит из-под контроля и вещества начинают накапливаться.
II фаза — диспротеинемия. Для нее характерны активные деструктивные процессы в тканях; усиливается распад белков, снижается их синтез, нарушаются процессы дезаминирования. С момента начала деструкции в крови повышается уровень некротических тел, СМ, которые и вызывают токсический эффект. В начале II фазы присоединяются аутоаллергические процессы.
III фаза — накопление промежуточных метаболитов. В крови и лимфе накапливаются этанол, аммиак, ацетон и др. Микробный фактор может ускорить переход одной фазы в другую. Тяжесть, время развития и обратимость СЭИ прямо связаны с тем, какие микробы вызвали заболевание: ранее имевшаяся микрофлора или новые.
Клинически в течении синдрома эндогенной интоксикации различают три степени тяжести (В. К. Гостищев и соавт., 1992). Основные критерии клинических данных степеней тяжести эндогенной интоксикации представлены в табл. 28.
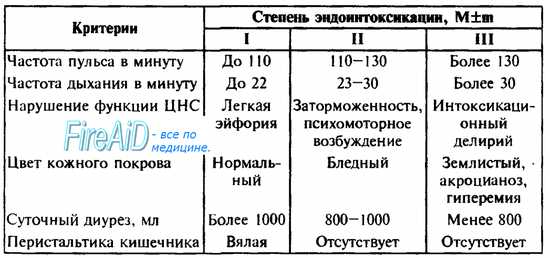
Таблица 28. Степени эндогенной интоксикации при перитоните (В. К. Гостищев и соавт., 1992).
Наиболее характерным признаком появления синдрома эндогенной интоксикации при перитоните является нарушение сознания в виде энцефалопатии (см. тему НЕОТЛОЖНЫЕ СОСТОЯНИЯ В ПСИХИАТРИИ). Больной становится заторможенным и безразличным к окружающему. Вначале данное состояние чередуется с периодами легкой эйфории, в это время больные говорливы, не могут сосредоточиться на одной мысли. При нарастании интоксикации заторможенность также нарастает, иногда наоборот, возникает психомоторное возбуждение, переходящее в интоксикационный делирий, после чего возможно наступление комы (см. тему ОБМОРОК, КОЛЛАПС, КОМА). Для определения снижения (угнетения) уровня сознания можно использовать шкалу Глазго.
Другим характерным признаком синдрома эндогенной интоксикации является сокращение почасового диуреза, обусловленное поражением почечных канальцев по типу острого нефроза и потери жидкости (рвота, понос, выход жидкости во внеклеточное пространство). Вследствие этого происходит дополнительное отравление организма невыведенными продуктами белкового обмена. Каждой степени СЭИ соответствует определенный суточный диурез (см. табл. 28). Критическим является почасовой диурез в объеме 40 мл/час и менее. При тяжелой степени интоксикации с переходом олигурии в анурию возможно формирование ОПН (см. тему ОСТРАЯ ПОЧЕЧНАЯ И ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТИ).
Появление желтушности кожных покровов и склер является прогностически неблагоприятным признаком, так как это свидетельствует о развитии острой печеночной недостаточности и снижении детоксикационных возможностей организма (см. тему ОСТРАЯ ПОЧЕЧНАЯ И ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТИ).
Гемодинамические изменения при СЭИ, как впрочем и все другие, не являются специфическими. Причиной учащения пульса, снижения АД могут быть шок, реакция на боль, кровопотерю, предшествующая сердечная недостаточность. Следует помнить, что снижение давления ниже 90 мм рт. ст. характерно для шока II степени (см. тему ШОКОВЫЕ СОСТОЯНИЯ).
Основные биохимические показатели синдрома эндогенной интоксикации на фоне перитонита представлены в табл. 29.
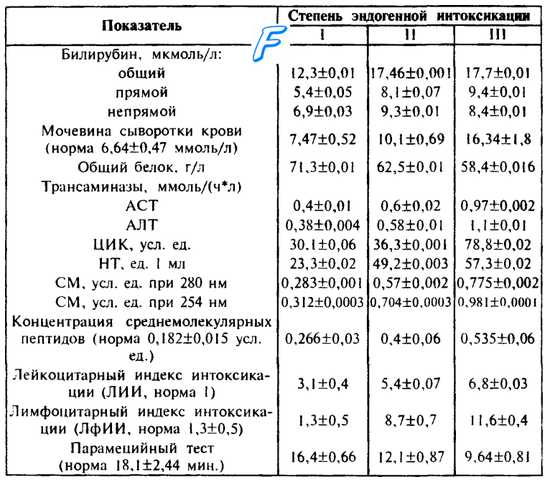
Таблица 29. Биохимические показатели крови при эндогенной интоксикации различной степени, М±т (В. К. Гостищев и соавт., 1992).
Примечание. 1. ЦИК — циркулирующие имунные комплексы; НТ некротические тела; СМ — средние молекулы.
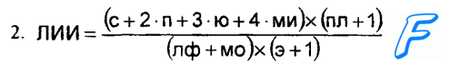
ми миелоциты;
с сегментоядерные лейкоциты;
ю метамиелоциты;
п палочкоядерные лейкоциты;
пл плазменные клетки;
лф лимфоциты;
МО моноциты;
э эозинофилы.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Хирургическое лечение. При активном вмешательстве на ранних стадиях ЭИ достаточно ликвидировать причину, чтобы прервать дальнейшее развитие эндотоксикоза. При запущенных формах продукты промежуточного обмена накапливаются в сосудистом русле и паренхиматозных органах, вызывая полиорганную недостаточность, поэтому хирургическое устранение очага воспаления и его санация способствуют ликвидации лишь отдельных компонентов ЭИ.
Консервативное лечение больных с ЭИ должно строиться с учетом степени эндотоксикоза (В. К. Гостищев и соавт., 1994). К общим методам воздействия на ЭИ относятся инфузионная терапия, различные способы экстракорпоральной детоксикации (см. выше), гипербарическая оксигенация.
Больному необходимо обеспечить полноценное парентеральное питание. Суточный каллораж должен быть не менее 3000 ккал/ сутки, 2/3 этой потребности рекомендуется обеспечивать за счет концентрированных растворов глюкозы, а 1/3 — за счет жировых эмульсий (20% раствор интралипида, липофундина).
Общий объем вводимой жидкости в период острой интоксикации — 4—5 л/сутки. Из этого количества 2,5—3 литра должно приходиться на кристаллоидные растворы, остальное — коллоиды и белковые препараты крови (плазма, альбумин, протеин). Выбор инфузионно-трансфузионных сред, их комбинация определяются характером волемических нарушений, дефицитом белкового и электролитного состава крови. Коррекцию водно-электролитного состава осуществляют с помощью солевых растворов типа Рингер-Локка. Коррекцию диспротеинемий проводят с помощью белковых гидролизатов, плазмы и протеинов.
Простым и широко используемым методом лечения эндогенной интоксикаци является форсированный диурез, основанный на использовании естественного процесса удаления токсических веществ из организма. Предварительно проводят умеренную гемодилюцию, для чего используют растворы кристаллоидов, низкомолекулярных декстранов, а при гиповолемии — белковые кровезаменители. Один из вариантов водной нагрузки: в/в вводится 1000 мл физиологического раствора, 200 мл 4% раствора бикарбоната натрия и 400 мл реополиг-люкина, затем маннитол из расчета 1 — 1,5 г/кг или 40—80 мг лазик-са; мосле этого продолжают вливание 5% раствора глюкозы, белковых препаратов (плазма крови, раствор альбумина, белковый гид-ролизат) в объеме 1000—1500 мл. Кроме того, в состав трансфузи-онных сред включают растворы хлорида калия (40—60 мл 10% раствора или 100—120 мл 4% раствора дробно), хлорида натрия (50 мл 10% раствора), хлорида кальция (30 мл 10% раствора) для коррекции неизбежной при проведении методики форсированного диуреза потери электролитов. Лечение осуществляется под контролем за почасовым диурезом и ЦВД, электролитным и белковым балансом организма, КЩС, остаточным азотом.

Антибактериальная терапия проводится препаратами широкого спектра действия в сочетании трех препаратов разных групп. При этом учитывается вид микроорганизма и его чувствительность к препарату.
В качестве иммунокоррегируюшей терапии используют иммуномодуляторы: Тактивин (синоним: Т-активин) по 1 мл 0,01% раствора п/к (ежедневно, курс 10—12 инъекций), тималин, взрослым по 5—20 мг ежедневно (30—100 мг на курс), левамизол (обычно 50 мг 3 раза в день в течение 4—5 дней, через 7 дней курс повторяют; или по 150 мг 1 раз/день, курс 5—7 дней), диуцифон по 0,1 г 3—4 раза в день или вводят в/м по 4 мл 5% р-ра (0,2 г) 1 раз в сутки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение перитонита. Прогноз перитонита
В связи со сложностью патогенеза и разнообразием нарушений в организме у больных с тяжелыми формами перитонита лечение этого тяжелого заболевания должно быть комплексным и включать предоперационную подготовку, своевременно проведенную операцию, тщательную санацию брюшной полости и правильное послеоперационное ведение.
Предоперационная подготовка особенно необходима у больных с тяжелой формой разлитого перитонита; она должна быть кратковременной (не более 2—3 ч), но достаточно полной. Задачами предоперационной подготовки являются нормализация кровообращения и дыхания, снижение интоксикации, коррекции нарушенных обменных процессов. Для уменьшения интоксикации и борьбы с гиловолемией большое значение имеет капельное внутривенное вливание солевых растворов. При выраженной сосудистой недостаточности внутривенно капелыю вводят 30—50 мг преднизалона. Большинство современных хирургов, оперируя больных с разлитым перитонитом, отлают предпочтение общему обезболиванию с применением миорелаксантов.
Операционный доступ должен быть достаточно широким, чтобы можно было произвести тщательную ревизию брюшной полости и выполнить операцию на больном органе, являющемся источником перитонита. Доступом, отвечающим такому требованию, является срединный разрез, который начинают немного выше пупка н по мерс надобности расширяют вверх или вниз. Если источник перитонита установлен до операции, можно пользоваться и другими доступами. В частности, при перитонитах аппендикулярного происхождения применяют разрез Волковича — Дьяконова, при острых холециститах — косой разрез в правом подреберье н т. д. Однако при всех формах распространенных перитонитов, какого бы происхождения они пн были, надо заканчивать операцию (если даже вначале применялся другой доступ) широкой срединной лапаротомней, которая позволяет более тщательно осушить брюшную полость.
После вскрытия брюшной полости при наличии в ней большого количества гнойного экссудата его удаляют электроотсосом. Затем должен быть найден и ликвидирован источник перитонита. Если патологический очаг удалить невозможно, к нему подводят отграничивающие тампоны. После ликвидации источника перитонита приступают к последовательному тщательному туалету брюшной полости, удалению оставшегося гноя. При этом используют электроотсос, марлевые тампоны и тупферы. Все манипуляции должны производиться нежно, осторожно, так как малейшая погрешность в обращении с воспаленным кишечником вызывает травму серозного покрова.

Метод промывания брюшной полости для удаления гноя различными жидкостями (изотоническим раствором хлорида натрия, содержащим антисептики, щелочной эмульсией, мыльной пеной по Симоняну), не нашел широкого применения из-за опасности генерализации инфекции. Кроме того, промывание брюшной полости весьма травматично и не обеспечивает достаточного освобождения ее от гноя.
После осушения брюшной полости от гноя в нее вводят раствор антибиотиков широкого спектра действия в дозе, достаточной для того, чтобы обеспечить нужную концентрацию их в экссудате. Вопрос о том. зашивать ли брюшную полость наглухо или дренировать, решается индивидуально. Известно, что брюшина лучше справляется с инфекцией, еслп брюшная полость после удаления источника перитонита зашита наглухо. Введение в брюшную полость дренажей показано, как правило, лишь больным с гнойным разлитым перитонитом. Микроирригаторы для введения антибиотиков мы применяем н при местном перитоните, когда вблизи очага процесса имеется выпот с неприятным гнилостным запахом. Тампонирование брюшной полости при перитоните показано после вскрытия гнойников с плотной пиогенной оболочкой, при гнилостной или анаэробной инфекции, при наличии очагов гиойно-некротического процесса, которые не могут быть удалены (некротический панкреатит, некроз брюшины и клетчатки), при невозможности удаления первичного источника перитонита.
Успех операции во многом зависит от правильного послеоперационного лечения больного. Комплекс лечебных мероприятий строится на основе современных представлений о патогенезе перитонита и должен быть направлен на компенсацию патофизиологических нарушений, борьбу с инфекцией и интоксикацией. Интенсивность и полнота лечебных мероприятий зависят от распространенности перитонита. При разлитом гнойном перитоните основное внимание должно быть направлено на пополнение объемного дефицита жидкости. Для этой цели наиболее подходит низкомолекулярные растворы, плазма, плазмозаменяющие средства, аминокислоты и кровь. Устранение дефицита жидкости достигается также путем введения 5% раствора глюкозы и солевых растворов. Количество переливаемых растворов должно соответствовать количеству потерянной жидкости. Количество необходимой жидкости определяют, исходя из клинической картины и таких показателей, как гематокрит, центральное венозное давление, количество циркулирующей крови, количество выделяемой мочи.
Клиническими признаками гиповолемии являются: возбуждение, учащение дыхания, холодная влажная кожа, частый нитевидный пульс, значительное снижение диуреза (менее 25 мл/ч), низкое пульсовое давление, метаболический ацидоз.
Для возмещения электролитов необходимо применять изотонический раствор хлорида натрия, раствор Рингера и др. Смеси, содержащие калий, вливают при наличии достаточного диуреза. При этом придерживаются правила: при диурезе 40—50 мл/ч раствор не должен содержать калия более 30—40 ммоль/л. При необходимости поддержания диуреза применяют манпнтол. При аиурии, когда содержание калия в плазме выше 7 ммоль/л (7 мэкв/л), рН крови снижается ниже 7.3, а мочевина превышает 50 ммоль/л (300 мг%), показан экстракорпоральный гемодиализ. Важное значение имеет парентеральное питание, которое должно проводиться систематически и быть высококалорийным (не менее 2500—3000 ккал в сутки). Наиболее питательными и легко усвояемыми веществами являются жировые эмульсии и смеси аминокислот. Больным необходимо вводить анаболические гормоны (неробол, ретаболил) или пиримидиновые производные (пентоксил н др.), обладающие анаболическим действием. Для устранения нарушения микроциркуляции уместно применять трасилол (100 000—200 000 ЕД в день) и другие аналогичные препараты, угнетающие кининовую систему крови (антикоагулянты, стероидные гормоны). Необходимо давать больным витамины, особенно витамины группы В и С, которые лучше вводить инфузионно, через систему. Для борьбы с инфекцией применяют антибиотики. При лечении антибиотиками важно знать вид микроба, вызвавшего перитонит, и его чувствительность к тем или иным препаратам. Для этого во время операции должен быть взят гной для посева и определения чувствительности флоры к антибиотикам.
В настоящее время при разлитом перитоните многие хирурги применяют пернтонсальный диализ. Этот метод обеспечивает благоприятные условия для достижения эффективной концентрации антибиотиков в крови н экссудате, но требует строгого динамического лабораторного контроля и коррекции. Пернтонсальный диализ способствует удалению экссудата, токсинов, бактерий, продуктов тканевого аутолиза. При местном перитоните, отграничении источника инфекции тампонами, сомнении в надежности швов, наложенных на дефект в стенке желудка или кишки, он противопоказан.
Серьезное внимание должно быть уделено борьбе с парезом желудочно-кишечного тракта и дыхательной недостаточностью. Отмечены положительные результаты местной и обшей гипотермии и применения гипербарической оксигенации.
До недавнего времени прогноз при разлитом гнойном перитоните был плохим, летальность колебалась в пределах 60—70%. В настоящее время, благодаря правильной организации скорой медицинской помощи в нашей стране, ранней госпитализации, раннему комплексному лечению и применению современных антибиотиков летальность значительно снизилась. По данным современных авторов, она колеблется в пределах от 6 до 19,5%.
Перитонит – локальное или диффузное воспаление серозного покрова брюшной полости – брюшины. Клиническими признаками перитонита служат боль в животе, напряжение мышц брюшной стенки, тошнота и рвота, задержка стула и газов, гипертермия, тяжелое общее состояние. Диагностика перитонита основывается на сведениях анамнеза, выявлении положительных перитонеальных симптомов, данных УЗИ, рентгенографии, вагинального и ректального исследований, лабораторных тестов. Лечение перитонита всегда хирургическое (лапаротомия, санация брюшной полости) с адекватной предоперационной и послеоперационной антибактериальной и дезинтоксикационной терапией.
МКБ-10
Общие сведения
Перитонит – тяжелое осложнение воспалительно-деструктивных заболеваний органов брюшной полости, сопровождающееся выраженными местными и общими симптомами, развитием полиорганной недостаточности. Летальность от перитонита в гастроэнтерологии составляет 20-30%, а при наиболее тяжелых формах достигает 40-50%.
Брюшина (peritoneum) образована двумя переходящими друг в друга серозными листками - висцеральным и париетальным, покрывающими внутренние органы и стенки брюшной полости. Брюшина является полупроницаемой, активно функционирующей мембраной, выполняющей множество важных функций: резорбтивную (всасывание экссудата, продуктов лизиса, бактерий, некротических тканей); экссудативную (выделение серозной жидкости), барьерную (механическая и противомикробная защита органов брюшной полости) и др. Важнейшим защитным свойством брюшины является ее способность к отграничению воспаления в брюшной полости благодаря фиброзным спайкам и рубцам, а также клеточным и гуморальным механизмам.

Причины перитонита
Этиологическим звеном при перитоните выступает бактериальная инфекция, в большинстве случаев представленная неспецифической микрофлорой желудочно-кишечного тракта. Это могут быть грамотрицательные (энтеробактер, кишечная палочка, протей, синегнойная палочка) и грамположительные (стафилококки, стрептококки) аэробы; грамотрицательные (фузобактерии, бактероиды) и грамположительные (эубактерии, клостридии, пептококки) анаэробы. В 60-80% наблюдений перитонит вызывается ассоциацией микробов – чаще кишечной палочкой и стафилококком. Реже развитие перитонита бывает обусловлено специфической микрофлорой – гонококками, гемолитическим стрептококком, пневмококками, микобактериями туберкулеза. Поэтому для выбора рационального лечения перитонита первостепенное значение имеет бактериологический посев содержимого брюшной полости с определением чувствительности выделенной микрофлоры к антибактериальным препаратам.
В соответствии с этиологией различают первичные (идиопатические) и вторичные перитониты. Для первичных перитонитов характерно проникновение микрофлоры в брюшную полость лимфогенным, гематогенным путем или по фаллопиевым трубам. Непосредственное воспаление брюшины может быть связано с сальпингитами, энтероколитами, туберкулезом почек или гениталий. Первичные перитониты встречаются нечасто – в 1-1,5% случаев.
В клинической практике гораздо чаще приходится сталкиваться с вторичными перитонитами, развивающимися вследствие детсруктивно-воспалительных заболеваний или травм брюшной полости. Наиболее часто перитонит осложняет течение аппендицита (перфоративного, флегмонозного, гангренозного), прободной язвы желудка или 12-перстной кишки, пиосальпинкса, разрыва кисты яичника, кишечной непроходимости, ущемления грыжи, острой окклюзии мезентериальных сосудов, болезни Крона, дивертикулита, флегмонозно-гангренозного холецистита, панкреатита, панкреонекроза и др. заболеваний.
Посттравматический перитонит развивается вследствие закрытых и открытых повреждений органов брюшной полости. Причинами послеоперационных перитонитов могут служить несостоятельность анастомозов, дефекты наложения лигатур, механическое повреждение брюшины, интраоперационное инфицирование брюшной полости, гемоперитонеум при неадекватном гемостазе. Отдельно выделяют канцероматозные, паразитарные, гранулематозные, ревматоидные перитониты.
Классификация
По этиологии различают бактериальные и абактериальные (асептические, токсико-химические) перитониты. Последние развиваются в результате раздражения брюшины агрессивными неинфекционными агентами (желчью, кровью, желудочным соком, панкреатическим соком, мочой, хилезной жидкостью). Абактериальный перитонит довольно быстро принимает характер микробного вследствие присоединения инфекционных возбудителей из просвета ЖКТ.
В зависимости от характера перитонеального выпота различают серозный, фибринозный, геморрагический, желчный, гнойный, каловый, гнилостный перитонит.
По клиническому течению перитониты делятся на острые и хронические. С учетом распространенности поражения по поверхности брюшины различают отграниченный (местный) и диффузный перитонит. К вариантам местного перитонита относят поддиафрагмальный, аппендикулярный, подпеченочный, межкишечный, тазовый абсцессы. О диффузном перитоните говорят, когда воспаление брюшины не имеет тенденции к ограничению и четких границ. По степени поражения брюшины диффузные перитониты подразделяются на местные (развивающиеся в одной анатомической области, вблизи от источника инфекции), распространенные (охватывают несколько анатомических областей) и общие (при тотальном поражении брюшины).
В развитии перитонита принято выделять раннюю фазу (до 12 часов), позднюю (до 3-5 суток) и конечную (от 6 до 21 дня от начала заболевания). В соответствии с патогенетическими изменениями различают реактивную, токсическую и терминальную стадии перитонита. В реактивную стадию перитонита (24 часа от момента поражения брюшины) отмечается гиперергическая реакция на раздражение брюшины; в эту фазу максимально выражены местные проявления и менее выражены общие симптомы. Токсическая стадия перитонита (от 4 до 72 часов) характеризуется нарастанием интоксикации (эндотоксическим шоком), усилением и преобладанием общих реакций. В терминальной стадии перитонита (позднее 72 часов) происходит истощение защитно-компенсаторных механизмов, развиваются глубокие нарушения жизненно важных функций организма.
Симптомы перитонита
В реактивном периоде перитонита отмечаются абдоминальные боли, локализация и интенсивность которых определяются причиной воспаления брюшины. Первоначально боль имеет четкую локализацию в области источника воспаления; может иррадиировать в плечо или надключичную область вследствие раздражения нервных окончаний диафрагмы гнойно-воспалительным экссудатом. Постепенно боли распространяются по всему животу, становятся незатихающими, теряют четкую локализацию. В терминальном периоде в связи с параличом нервных окончаний брюшины болевой синдром становится менее интенсивным.
Характерными симптомами перитонита служат тошнота и рвота желудочным содержимым, которые в начальной стадии возникают рефлекторно. В более поздние сроки перитонита рвотная реакция обусловлена парезом кишечника; в рвотных массах появляется примесь желчи, затем - содержимое кишечника (фекальная рвота). Вследствие выраженного эндотоксикоза развивается паралитическая кишечная непроходимость, клинически проявляющаяся задержкой стула и неотхождением газов.
При перитоните, даже в самой ранней стадии, обращает на себя внимание внешний вид больного: страдальческое выражение лица, адинамия, бледность кожных покровов, холодный пот, акроцианоз. Пациент принимает вынужденное положение, облегчающее боль – чаще на боку или спине с поджатыми к животу ногами. Дыхание становится поверхностным, температура повышенная, отмечается гипотония, тахикардия 120-140 уд. в мин., не соответствующая субфебрилитету.
Диагностика
Изменения в общем анализе крови при перитоните (лейкоцитоз, нейтрофилез, увеличение СОЭ) свидетельствуют о гнойной интоксикации. Лапароцентез (пункция брюшной полости) и диагностическая лапароскопия показаны в неясных для диагностики случаях и позволяют судить о причине и характере перитонита.
Лечение перитонита
Выявление перитонита служит основанием для экстренного хирургического вмешательства. Лечебная тактика при перитоните зависит от его причины, однако во всех случаях в ходе операции придерживаются одинакового алгоритма: показано выполнение лапаротомии, проведение изоляции или удаления источника перитонита, осуществление интра- и послеоперационной санации брюшной полости, обеспечение декомпрессии тонкой кишки.
Послеоперационное ведение пациентов с перитонитом включает инфузионную и антибактериальную терапию, назначение иммунокорректоров, переливание лейкоцитарной массы, внутривенное введение озонированных растворов и др. Для противомикробной терапии перитонита чаще используется комбинация цефалоспоринов, аминогликозидов и метронидазола, обеспечивающая воздействие на весь спектр возможных возбудителей.
С целью стимуляции перистальтики и восстановления функций ЖКТ показано назначение антихолинэстеразных препаратов (неостигмина), ганглиоблокаторов (димеколония йодид, бензогексония), антихолинэргических средств (атропина), препаратов калия, физиопроцедур (электростимуляции кишечника, диадинамотерапии).
Прогноз и профилактика
Успех лечения перитонита во многом зависит от срока выполнения операции и полноты объема послеоперационной терапии. Летальность при разлитом перитоните достигает 40% и более; гибель пациентов наступает от гнойной интоксикации и полиорганной недостаточности.
Поскольку большинство перитонитов являются вторичными, их профилактика требует своевременного выявления и лечения основной патологии - аппендицита, язвы желудка, панкреатита, холецистита и др. Предупреждение послеоперационного перитонита включает адекватный гемостаз, санацию брюшной полости, проверку состоятельности анастомозов при абдоминальных операциях.
Читайте также:

