Интоксикация от печени в головной мозг
Обновлено: 22.04.2024
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
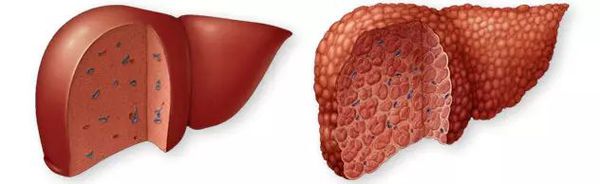
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
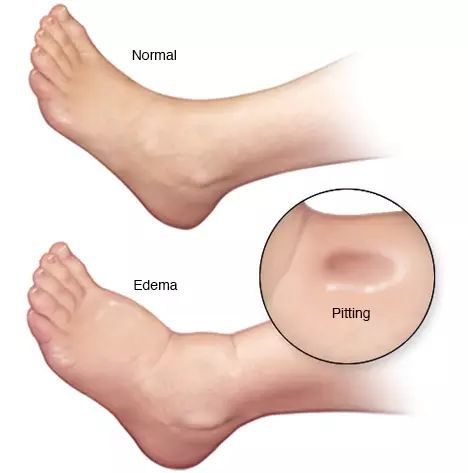
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
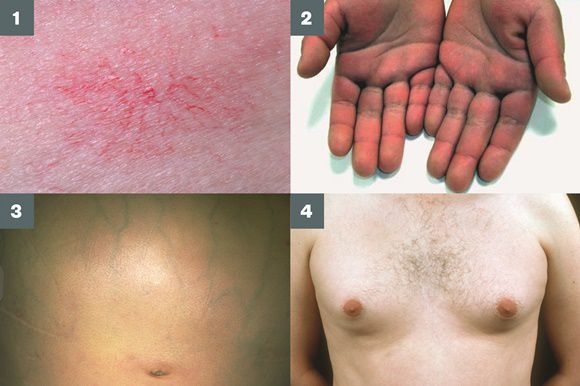
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Токсический гепатит – поражение печени промышленными, сельскохозяйственными и бытовыми химическими веществами, гепатотропными ядами, приводящее к воспалительной реакции и некрозу гепатоцитов, изменению реактивности печени. Клинически проявляется гепатомегалией и болью в правом подреберье, желтухой, диспепсическими явлениями, энцефалопатией, асцитом, анорексией. Диагностика включает клинический и биохимический анализы крови, УЗИ, КТ либо МРТ печени и допплерометрию ее сосудов, биопсию, радиоизотопное исследование. Лечение направлено на прерывание контакта с токсическим веществом, выведение его из организма, проведение симптоматической терапии, трансплантации печени.
Общие сведения
Токсический гепатит – поражение печени острого, подострого либо хронического характера, развивающееся в результате попадания в организм токсических веществ, которые губительно воздействуют на клетки печени, вызывая их некроз. Токсическое поражение печени встречается не так уж часто – не более 1-2 случаев на 100 тысяч населения в год. Среди всех госпитализированных в отделения гастроэнтерологии в РФ токсические гепатозы, вызванные приемом гепатотропных ядов, выявляются примерно у 3% пациентов. Среди причин формирования печеночной недостаточности данная патология занимает второе место после алкогольного гепатита. Изучением гепатотоксичности различных химических веществ занимаются ведущие гепатологи, гастроэнтерологи и токсикологи всего мира.

Причины токсического гепатита
В зависимости от строения все гепатотоксичные химические вещества подразделяются на несколько групп. К первой группе относят хлорированные углеводороды – хлороформ, дихлорэтан, четыреххлористый углерод, хлористый метил, этилхлорид и другие. Эти вещества применяются в производстве автомобилей, самолетов, огнетушителей, в машиностроении, при пошиве обуви, в химчистках, для дезинфекции, дезинсекции и дегельминтизации, в качестве растворителей жиров. В организм проникают через кожу, при дыхании и употреблении внутрь. Выделяются легкими, почками, кишечником. Четыреххлористые углеводороды воздействуют на эндоплазматический ретикулум, разрушая ферментативные системы гепатоцита; усиливают переокисление ненасыщенных жирных кислот в клеточных мембранах.
Вторая группа веществ включает дифенилы и хлорированные нафталины – они используются в оболочках электропроводов, в электроконденсаторах, могут применяться в качестве аналогов воска, смолы, каучука. Третья группа состоит из бензола и его производных: анилина, толуола, тринитротолуола и др. Эти соединения в последние годы активно эксплуатируются в промышленности при производстве взрывчатых веществ, органических красок. В кровоток попадают после контакта с кожей, слизистыми оболочками, при приеме внутрь.
В четвертой группе находятся металлоиды и металлы – золото, фосфор, мышьяк, олово, ртуть, свинец. В настоящее время данные химические элементы в промышленности используются редко, производители стараются найти им более безопасную замену. Тяжелые металлы связываются с сульфгидрильными группами, блокируя активность печеночных ферментов. В отдельную группу выносят природные гепатотропные яды (ядовитые грибы, семена гелиотропа опушенного), сельскохозяйственные и бытовые инсектициды.
Все химические вещества, попадающие в организм, подвергаются разрушению либо связыванию. Основную роль в этих процессах играет печень. Некоторые вещества и их производные, образующиеся при биотрансформации, могут оказывать токсическое действие на гепатоциты. При этом гепатотоксичность может быть истинной (возникает у всех людей при введении определенной дозы вещества в организм) либо проявляться идиосинкразией (индивидуальная гиперчувствительность организма к данному соединению). Механизм действия гепатотропного яда зависит от его химического строения и дозы, однако результатом в любом случае будет разрушение клеток печени и сбой обменных процессов в ней.
Разрушающее влияние перечисленных токсических веществ значительно усиливается, если в прошлом гепатоциты подвергались воздействию больших доз алкоголя, гепатотоксичных лекарственных препаратов, вирусов и бактерий. Также токсический гепатит быстрее развивается у людей, страдающих истощением и дефицитом белка в организме.
Симптомы токсического гепатита
Для всех токсических гепатитов характерно наличие двух групп симптомов: признаков поражения непосредственно печени (желтуха, гепатомегалия, боли в правом подреберье) и признаков токсического воздействия на другие органы (зависят от химического строения отравляющего вещества).
Острое поражение четыреххлористыми углеводородами манифестирует симптомами повреждения головного мозга: угнетение сознания вплоть до комы в пределах одних-двух суток, головная боль, выраженная слабость. Затем присоединяются желтуха, тошнота, рвота, понос, повышение температуры до субфебрильных цифр, затрудненное дыхание, синюшный цвет кожи, желудочно-кишечные кровотечения. Смерть от острой печеночной недостаточности может наступить в течение нескольких дней – двух недель (в зависимости от дозы токсина). Хроническое отравление данными химическими веществами проявляется головной болью, болью в области печени, диспепсическими явлениями, слабостью. Постоянный контакт с четыреххлористыми углеводородами может привести к развитию цирроза печени на протяжении нескольких месяцев.
Для отравления производными бензола характерен токсический гепатит, которому сопутствуют апластическая анемия, поражение головного мозга, катаракта. Постоянный контакт с бензолом приводит к развитию хронического токсического гепатита, сопровождающегося геморрагическим синдромом, асцитом, циррозом печени.
Отравление мышьяком клинически проявляется желтухой, увеличением размеров печени, нарушением функции почек и периферических нервов. Для поражения фосфором, кроме симптомов токсического гепатита, характерны повышенная кровоточивость, гипогликемия. Токсический гепатит при воздействии меди развивается только в случае попадания в организм более одного грамма этого химического элемента, смерть – при превышении дозы в 10 грамм. Симптомы отравления медью – острая боль в области желудка, тошнота, рвота, профузный понос, кровотечения, уменьшение объема мочи. Смерть наступает от фульминантной почечной и печеночной недостаточности. Токсическое поражение печени железом напоминает отравление медью.
При употреблении ядовитых грибов клиническая картина токсического гепатита развивается в течение ближайших двадцати часов. Также поражаются почки, центральная нервная система. Пациенты предъявляют жалобы на желтушность кожных покровов, тошноту, рвоту, сильные боли в животе, диарею. Выраженная дегидратация и дисэлектролитемия приводят к сбоям в работе сердечно-сосудистой системы (нарушения ритма вплоть до остановки сердца) и головного мозга (судорожный синдром, угнетение сознания). Острый некроз печени приводит к прекращению ее белково-синтезирующей функции, что проявляется массивным геморрагическим синдромом. Каждый второй больной погибает от печеночной энцефалопатии, уремии, сердечно-сосудистых нарушений; у остальных формируется цирроз печени.
Употребление злаков, зараженных семенами гелиотропа, чаще всего приводит к хронической интоксикации, проявляющейся симптомами токсического поражения печени и вено-окклюзионной болезни (желтуха, гепатомегалия, боли в правом подреберье, асцит, ожирение).
При отравлении инсектицидами данные химические соединения накапливаются в жировых клетках печени и других органов, что ведет к формированию полиорганной недостаточности: токсического гепатита, миокардита, нефрита, поражения центральной нервной системы, развития агранулоцитоза. При хроническом поражении инсектицидами, помимо клинической картины токсического поражения печени, пациент отмечает появление полирадикулопатий, болей в сердце, нарушения функций почек; в анализах выявляют анемию и лейкопению. После прекращения воздействия инсектицида на организм данные патологические изменения быстро регрессируют.
Диагностика
Лабораторная диагностика токсического гепатита не позволяет выявить специфичные признаки данной патологии. Следует помнить, что у 3% здоровых людей печеночные пробы могут быть изменены, еще примерно у 5% их изменение никак не связано с поражением печени. И наоборот, примерно в 10% случаев токсического гепатита лабораторные показатели будут находиться в границах нормы. Оценка тяжести поражения печени проводится на основании исследования уровней общего билирубина и его фракций, трансаминаз, ферментов (ЩФ, ГГТП, ЛДГ), альбумина и протромбина. Для выявления некоторых гепатотоксичных веществ возможно проведение специальных лабораторных тестов. Обязательно проводят исследования на вирусные гепатиты, ВИЧ.
Из инструментальных методов в диагностике токсического гепатита используют УЗИ, КТ и МРТ печени, допплерометрию печеночных сосудов, эластографию, радиоизотопное исследование гепатобилиарной системы. Перечисленные методики не дают возможности определить этиологию гепатита, но позволят подтвердить поражение печени. Наиболее точным способом оценки морфологических изменений при токсическом гепатите является биопсия печени с последующим гистологическим исследованием биоптатов.
Токсический гепатит следует дифференцировать с поражением печени алкоголем, медикаментами, бактериями, вирусами и паразитами; с желчнокаменной болезнью, раком печени и другими опухолями данной локализации, аутоиммунным гепатитом, пороками развития печени и ЖВП, болезнями обмена веществ, острым панкреатитом, реактивным гепатитом.
Лечение токсического гепатита
Основное направление лечения токсического гепатита любой этиологии – прекращение контакта с химическим агентом, обезвреживание и быстрое выведение его из организма. При отравлении тяжелыми металлами антидотами являются унитиол, тиосульфат натрия (для ртути, мышьяка, свинца); дефероксамин (для железа); бензиламин, глюкокортикостероиды (для меди). Всем пациентам обязательно назначают витамины группы В, фолиевую, никотиновую и аскорбиновую кислоты. Если на фоне токсического гепатита развилась тяжелая печеночная и/или почечная недостаточность, проводят гемодиализ. При формировании фульминантной печеночной недостаточности может потребоваться трансплантация печени.
Прогноз и профилактика
В большинстве случаев проявления токсического гепатита регрессируют после прекращения контакта с ядовитым веществом, наступает полное выздоровление. После тяжелого токсического поражения печени с массивным некрозом гепатоцитов развивается цирроз печени, в редких случаях – рак печени.
Профилактика токсического гепатита заключается в строгом соблюдении техники безопасности при контакте с токсичными веществами, проведении регулярных медицинских осмотров всего контингента контактирующих с токсинами рабочих (для своевременного выявления лиц с патологией печени и недопущения их к работе с токсическими химическими соединениями), налаживании здорового питания с достаточным количеством белка, борьбе с алкоголизмом.
Печеночная кома – нейрофизиологический синдром, развивающийся у пациентов с печеночной недостаточностью, который сопровождается тяжелым угнетением центральной нервной системы. Основными признаками являются отсутствие сознания, наличие патологических рефлексов, децеребрационная ригидность конечностей, в терминальной стадии – отсутствие зрачкового и роговичного рефлексов. Диагноз устанавливается на основании клиники, данных ЭЭГ, биохимических проб, КТ, МРТ. Приоритетные направления лечения – коррекция отека мозга, внутричерепной гипертензии, детоксикация, гепатопротекторная терапия. Наиболее эффективный метод – трансплантация печени.
Общие сведения
Печеночная кома является терминальной стадией печеночной энцефалопатии. Это тяжелое осложнение различных заболеваний в гастроэнтерологии, характеризующееся высокой летальностью даже на фоне проводимой интенсивной терапии. Точные статистические данные о распространенности печеночной комы отсутствуют; тяжелая мозговая дисфункция регистрируется примерно у 30% пациентов с печеночной недостаточностью. Поражение головного мозга при печеночной коме обусловлено метаболическими расстройствами, которые развиваются на фоне печеночно-клеточной недостаточности, а также портосистемного шунтирования крови. Важную роль в патогенезе печеночной комы играет отек головного мозга, который вследствие вклинения ствола мозга является основной причиной смерти у 82% пациентов.
Причины печеночной комы
Чаще всего причиной печеночной комы является декомпенсация уже имеющегося у пациента хронического заболевания печени (цирроза, гепатита, злокачественной опухоли и др.). К срыву компенсации могут привести желудочно-кишечное кровотечение, длительное злоупотребление алкоголем, разлитой перитонит, сепсис, анестезия с использованием фторотана, прием некоторых лекарственных препаратов (седативных, противотуберкулезных средств, анальгетиков, диуретиков), хроническая толстокишечная непроходимость, а также длительное хирургическое вмешательство.
Реже печеночная кома развивается вследствие фульминантной гепатоклеточной недостаточности, при этом тяжелая энцефалопатия и кома наблюдаются спустя пять-шесть недель после появления первых клинических признаков, без предшествующей патологи печени. Наиболее часто такая форма возникает при воздействии гепатотоксических ядов (отравлении грибами, алкоголем, промышленными ядами), вирусных гепатитах, тяжелых инфекционных заболеваниях, хирургическом шоке. В 17% случаев причина печеночной комы остается невыясненной.
В развитии печеночной комы как терминальной стадии энцефалопатии важным механизмом является повреждение головного мозга эндогенными токсинами: аммиаком, жирными кислотами, фенолами. Аммиак, образованный в толстом кишечнике, поступает по системе воротной вены к гепатоцитам, однако не включается в орнитиновый цикл, как должно быть в норме. Скорость его метаболизма снижается, и токсические продукты поступают в общий кровоток. Воздействие циркулирующих в крови эндогенных токсинов приводит к повышению проницаемости гематоэнцефалического барьера и нарушению осморегуляции мозговых клеток, что сопровождается накоплением в последних избыточного количества жидкости — отеком головного мозга. Кроме того, в центральной нервной системе токсические метаболиты нарушают энергетические процессы в нейронах, происходит снижение скорости окисления глюкозы и развитие кислородного голодания клеток. Это усугубляет отек мозга.
Симптомы печеночной комы
Клиническая картина печеночной комы определяется ее стадией. На стадии начальной, или неглубокой, комы сознание отсутствует, однако есть реакция на интенсивные болевые раздражители. Сохранены глоточный и роговичный рефлексы, зрачки расширены, возможно непроизвольное мочеиспускание и дефекация, имеют место патологические рефлексы (Жуковского, Бабинского и другие), судороги, децеребрационная ригидность конечностей. У некоторых пациентов возникают стереотипные движения: хватание, жевание. На стадии глубокой печеночной комы отсутствует реакция на любые раздражители, характерна арефлексия (в том числе отсутствие реакции зрачков на свет и роговичного рефлекса), паралич сфинктеров. Возможны генерализованные клонические судороги, остановка дыхания.
Помимо психоневрологической симптоматики, печеночная кома сопровождается признаками гепатоклеточной недостаточности. Характерна желтушность кожных покровов, типичный печеночный запах, тахикардия, гипертермия, геморрагический синдром. Массивные некротические процессы в печени приводят к уменьшению ее размеров, присоединению инфекционных осложнений, сепсиса, почечной недостаточности. Причинами летального исхода, помимо отека мозга, могут быть гиповолемический или инфекционно-токсический шок, почечная недостаточность, отек легких.
Диагностика
Верификация диагноза печеночной комы основана на данных клинической картины заболевания, лабораторных и инструментальных методов исследования. Консультация гастроэнтеролога и реаниматолога по возможности должна проводиться с участием родственников пациента, поскольку важно оценить анамнестические данные: когда появились первые симптомы, скорость их прогрессирования, возможные этиологические факторы. При осмотре пациента обращает на себя внимание желтушность кожных покровов, печеночный запах. Сознание отсутствует. В зависимости от стадии комы рефлексы на сильные раздражители и зрачковые рефлексы сохранены или отсутствуют.
Характерными изменениями результатов лабораторных исследований при печеночной коме являются признаки гепатоклеточной недостаточности: гипербилирубинемия, значительное повышение активности сывороточных трансаминаз, снижение протромбинового индекса и количества тромбоцитов в крови, анемия, гипоальбуминемия. При анализе ликвора определяется повышение уровня белка. Обязательно проводится токсикологическое исследование и анализ крови на маркеры вирусных гепатитов.
Электроэнцефалограмма при печеночной коме характеризуется замедлением либо полным отсутствием альфа-ритма, доминированием тета- и дельта-волн. Дополнительными методами диагностики являются компьютерная томография, МРТ головного мозга, магнитно-резонансная спектроскопия. Дифференциальная диагностика печеночной комы проводится с острыми нарушениями мозгового кровообращения, коматозным состоянием при метаболических нарушениях (гипокалиемии, уремии), терминальной стадией токсической энцефалопатии.
Лечение печеночной комы
Пациенты в состоянии печеночной комы госпитализируются в отделение интенсивной терапии. Лечение начинается с максимально быстрого определения причины патологии (инфекционное заболевание, кровотечение из органов желудочно-кишечного тракта, отравление грибами и др.) и устранения этиологического фактора. Обязательно осуществляется постоянный ЭКГ-мониторинг, пульсоксиметрия, контроль внутричерепного давления. Для печеночной комы характерна прогрессирующая дыхательная недостаточность, поэтому проводится интубация трахеи и искусственная вентиляция легких. Препаратами выбора для проведения глубокой седации являются фентанил и пропофол. С целью коррекции глюкозной недостаточности и кислородного голодания клеток головного мозга внутривенно вводят раствор глюкозы. Если имеет место кровотечение и коагулопатия, применяется свежезамороженная плазма. Снижение уровня гемоглобина ниже 70 г/л является показанием к гемотрансфузии. Коррекция гипопротеинемии проводится с использованием альбумина.
Быстрое (в течение нескольких часов) ухудшение неврологической симптоматики свидетельствует о внутричерепной гипертезии, терапия которой показана даже при отсутствии инвазивных методов контроля внутричерепного давления. Более чем у 85% пациентов развивается отек мозга. Базисное лечение внутричерепной гипертензии и отека головного мозга включает ИВЛ и седацию, нормализацию температуры тела, электролитного и газового состава крови. При неэффективности данных методов применяют гиперосмолярную терапию (внутривенное капельное введение маннитола, гипертонического раствора натрия хлорида), гипервентиляцию (ИВЛ в режиме гипервентиляции дает возможность на 1-2 часа снизить ВЧД и выиграть время для проведения других мероприятий), введение тиопентала натрия, умеренную гипотермию, в крайних случаях – декомпрессивную краниотомию.
Для профилактики инфекционных осложнений, в том числе при ИВЛ, проводится антибиотикотерапия (цефалоспорины, ванкомицин). Для печеночной комы, как и любого критического состояния, характерно стрессовое повреждение слизистой оболочки ЖКТ; для предупреждения желудочно-кишечного кровотечения назначаются ингибиторы протонной помпы, викасол. С целью снижения абсорбции аммиака в кишечнике и токсического повреждения клеток головного мозга используют препараты лактулозы. Эффективно подавляют аммониегенную флору ципрофлоксацин и метронидазол. Также назначаются препараты L-орнитин-L-аспартата, которые стимулируют ферментную активность в гепатоцитах, клетках мышц и головного мозга. Для ускорения опорожнения кишечника ставятся клизмы с раствором сульфата магния.
Питание пациента с печеночной комой парентеральное, с сохранением калорийности и ограничением количества белка. Назначается гепатопротекторная терапия для повышения устойчивости гепатоцитов к повреждающим факторам, ускорения процессов регенерации (аргинина глутамат, препараты расторопши, тиотриазолин и другие препараты). Обязательно проводятся методы экстракорпоральной детоксикации (гемодиализ, гемосорбция и другие).
Единственным методом, обладающим высокой эффективностью при терминальной печеночной недостаточности и коме, является трансплантация печени. Данный метод лечения показан при нехолестатическом циррозе (при инфекционном, аутоиммунном, алкогольном повреждении, передозировке лекарственных препаратов), а также первичном билиарном циррозе.
Прогноз и профилактика
Печеночная кома является прогностически крайне неблагоприятным состоянием. Выживаемость пациентов составляет не более 20%, лишь малая часть больных может дождаться выполнения трансплантации печени. Наибольший показатель летальности при возрасте пациентов до 10 и после 40 лет, продолжительности желтухи менее семи дней до развития тяжелой энцефалопатии, уровне билирубина более 300 мкмоль/л, быстропрогрессирующем уменьшении размеров печени, тяжелой дыхательной недостаточности.
Профилактика печеночной комы заключается в своевременном адекватном лечении заболеваний печени, грамотном назначении лекарственных препаратов, исключении самолечения пациентами, недопущении отравления токсическими веществами, грибами, предупреждении вирусных гепатитов, отказе от алкоголя.
Раковая интоксикация – патологическое состояние, обусловленное распространенным онкологическим процессом и распадом злокачественной опухоли. Возникает на поздних стадиях онкологического заболевания. Может провоцироваться активной противораковой терапией. Проявляется слабостью, утомляемостью, бледностью кожи, сухостью слизистых, тошнотой, рвотой, потерей веса и аппетита, потливостью, гипертермией, костно-суставными болями, нарушениями сна, психическими расстройствами, анемией и снижением иммунитета. Диагноз выставляется на основании анамнеза, клинической симптоматики, результатов анализов и инструментальных исследований. Лечение симптоматическое.
Общие сведения
Раковая интоксикация – комплекс расстройств, возникающих у онкологических больных при отравлении организма продуктами распада злокачественной опухоли. Выявляется преимущественно на терминальных стадиях заболевания, рассматривается как одна из основных причин гибели пациентов. Кроме того, раковая интоксикация часто наблюдается при проведении химиотерапии, является закономерным следствием активного противоракового лечения, вызывающего разрушение опухоли.
Раковая интоксикация может провоцировать нарушения деятельности различных органов и систем, в том числе – почечную и печеночную недостаточность, сепсис и другие тяжелые инфекционные осложнения, что обуславливает важность продуманного подбора дозировок и видов лекарственных препаратов с учетом общего состояния больного, а также наличия тех или иных хронических заболеваний. Лечение осуществляют специалисты в области онкологии.

Причины раковой интоксикации
Одной из отличительных особенностей злокачественной опухоли является ее способность к быстрому неконтролируемому росту. Как правило, темпы роста сосудов, обеспечивающих кровоснабжение новообразования, отстают от скорости роста опухолевой ткани. Злокачественные клетки достаточно устойчивы к гипоксии и могут некоторое время существовать в условиях недостаточного кровоснабжения, однако рано или поздно умирают. Обычно этот процесс наблюдается при опухолях достаточно большого размера. Массовая гибель клеток становится причиной распада новообразования и вызывает раковую интоксикацию.
В организм попадает большое количество продуктов распада, которые провоцируют расстройства всех видов обмена веществ и нарушения деятельности различных органов и систем. Раковая интоксикация становится причиной повышения уровня мочевины. Кристаллы мочевины оседают в почечных канальцах, вызывая развитие почечной недостаточности, которая еще больше усугубляет обменные нарушения. Из-за увеличения количества фосфатов возникает дефицит ионов кальция, следствием которого становятся нарушения работы нервной системы. Повышение уровня кальция негативно влияет на работу сердца. У пациентов с раковой интоксикацией возникают аритмии, в тяжелых случаях возможно прекращение сердечной деятельности. Увеличение количества свободных радикалов стимулирует распад эритроцитов и развитие анемии.
Проявления раковой интоксикации весьма вариабельны. Формирование клинической картины определяется тяжестью состояния пациента, скоростью разрушения новообразования, количеством токсических веществ, попадающих в основной кровоток, особенностями локализации и течения онкологического процесса, масштабом хирургического вмешательства, наличием и объемом кровопотери (как возникшей в ходе операции и послеоперационном периоде, так и связанной с распадом опухоли), присоединением воспалительных осложнений, дозой химиопрепарата и другими факторами.
Симптомы раковой интоксикации
Наиболее постоянными признаками раковой интоксикации являются прогрессирующая слабость и беспричинная утомляемость. Наблюдаются характерные изменения внешнего вида: дефицит массы тела (в тяжелых случаях – вплоть до кахексии), бледный, землистый или желтоватый оттенок кожи, сухость кожи и слизистых оболочек. Возможен цианоз дистальных отделов конечностей. У больных с нарушениями функции печени выявляется иктеричность склер. Пациенты с раковой интоксикацией предъявляют жалобы на усиленное потоотделение. Как правило, потливость более выражена в ночное время.
В ходе опроса врач устанавливает, что резкое снижение веса произошло в течение короткого промежутка времени и сопровождалось нарушениями аппетита: отвращением к еде (особенно – к мясным продуктам), извращением вкуса и т. д. Кроме того, при раковой интоксикации наблюдаются диспепсические расстройства: тошнота, рвота и нарушения стула. Возможны запоры, поносы или чередование запоров и поносов. Отмечается длительное повышение температуры до субфебрильных (при некоторых заболеваниях – до фебрильных) цифр. Возникают боли в костях и суставах.
Больные с раковой интоксикацией могут сообщать о периодических мигренях и приступах головокружения. Расспрос пациентов и их родственников позволяет выявить изменения психического и эмоционального статуса. Могут наблюдаться апатия, раздражительность и эмоциональная лабильность. Раковая интоксикация нередко сопровождается депрессивными расстройствами. Возможны нарушения сна: бессонница, поверхностный сон, трудности при засыпании, ночные и ранние пробуждения. Часто обнаруживаются нарушения сердечного ритма. При раковой интоксикации существует высокая вероятность развития тромбозов и склонность к возникновению инфекционных осложнений. В анализе крови обнаруживаются признаки анемии (обычно – умеренной нормохромной).
Диагностика раковой интоксикации
Диагноз выставляется с учетом анамнеза, жалоб, данных объективного осмотра и результатов дополнительных исследований. Решающую роль в определении причины раковой интоксикации играет выявление основной патологии. При характерной клинической картине и отсутствии установленного диагноза онкологического заболевания пациентам с подозрением на раковую интоксикацию назначают комплексное обследование, которое включает в себя общие анализы крови и мочи, биохимический анализ крови, анализ крови на онкомаркеры, рентгенографию грудной клетки, сцинтиграфию костей скелета, УЗИ брюшной полости, УЗИ малого таза, гинекологический осмотр и другие исследования. План обследования определяется индивидуально.
При уже диагностированном онкологическом заболевании требуется оценка выраженности раковой интоксикации для определения тактики лечения (составления плана химиотерапии, принятия решения об оперативном вмешательстве, подбора симптоматических препаратов и т. д.). Для оценки тяжести раковой интоксикации используются стандартные показатели крови: уровень мочевины, креатинина и С-реактивного белка, реактивный ответ нейтрофилов, лейкоцитарный индекс интоксикации и т. д. Наряду с перечисленными показателями могут потребоваться данные о состоянии различных органов и систем больного с раковой интоксикацией, полученные при проведении ЭКГ, анализов мочи, анализов крови на гормоны и других исследований.
Лечение раковой интоксикации
Лечение симптоматическое, включает в себя мероприятия по детоксикации, устранению или смягчению клинических проявлений и коррекции нарушений деятельности различных органов и систем. Осуществляют энтеросорбцию, гемосорбцию и аппликационную сорбцию. Пациентам выписывают сорбенты для приема внутрь. При тяжелой раковой интоксикации применяют гемодиализ или плазмаферез. При наличии открытых ран в области распада опухоли проводят перевязки с сорбентами местного действия.
При рвоте больным с раковой интоксикацией назначают противорвотные средства (домперидон, метоклопрамид), при запорах – слабительные для перорального приема и ректальные свечи (макрогол, препараты сены, бисакодил, касторовое масло и пр.). При анемии используют препараты железа внутрь и парентерально, применяют эритропоэтин. Выбор медикаментов при раковой интоксикации, сопровождающейся психическими расстройствами, зависит от вида и тяжести расстройств. При эмоциональной лабильности назначают мягкие седативные средства, при нарушениях сна – снотворные, при депрессии – транквилизаторы и антидепрессанты.
Прогноз определяется причинами раковой интоксикации, тяжестью основного процесса, возрастом и общим состоянием больного, наличием и тяжестью сопутствующей соматической патологии. Состояния, возникающие при распаде крупных распространенных опухолей в запущенных стадиях заболевания, являются прогностически неблагоприятными. Больные с раковой интоксикацией погибают от кровотечений, нарушений деятельности органов, пораженных первичной опухолью или гематогенными метастазами, а также от истощения, инфекционных осложнений, почечной недостаточности, тромбозов, нарушений сердечной деятельности или полиорганной недостаточности, обусловленной обменными расстройствами и ослаблением организма. При раковой интоксикации, возникшей в процессе химиотерапии, прогноз может быть благоприятным. При приеме химиопрепаратов это – временное состояние, являющееся частью лечебного процесса.

Энцефалопатия это поражение головного мозга. Человеку, не имеющему медицинского образования и ранее не сталкивающемуся с проблемами печени, может показаться странным: если болит в районе живота – при чем тут мозг?
Об этом и других важных моментах расскажет наш эксперт, к.м.н., врач-гастроэнтеролог, гепатолог, преподаватель СПбГУ Мария Прашнова.
Что такое печеночная энцефалопатия
Да, оказывается, прогрессирующие заболевания печени могут влиять на состояние сознания и деятельность головного мозга вообще. Более того, печеночная энцефалопатия – довольно частое осложнение.
Причины печеночной энцефалопатии
Как правило, по словам нашего эксперта, осложнение развивается по двум причинам.
Вторая причина – формирование функциональных или органических шунтов (аномальных сосудов) между системами портального и общего кровотока. Иными словами, когда кровь от внутренних органов (в первую очередь от кишечника), минуя печень, попадает прямо в общий кровоток.
То есть токсические продукты кишечного происхождения проникают в головной мозг. Сами можете представить, насколько это неприятно.
— В 90% развития эпизодов печеночной энцефалопатии участвуют провоцирующие (триггерные) факторы, такие как инфекция, желудочно-кишечное кровотечение, электролитные нарушения и неверный прием мочегонных средств, а также запоры, — отмечает Мария Прашнова.
Симптомы печеночной энцефалопатии
И вот – сбой в работе организма, в результате токсины добрались до мозга. Как реагирует на это главный орган центральной нервной системы?
— Проявления печеночной энцефалопатии представлены широким спектром неврологических или психических нарушений с различной степенью выраженности – от субклинических, то есть неявных, до комы, — рассказывает доктор Прашнова. — При легких формах изменения выявляются только в ходе психометрических тестов, ориентированных на оценку внимания, кратковременной памяти, психомоторных способностей и возможностей, а также электрофизиологических и других методах исследования функционирования мозга.
Но если процесс уже запущен, осложнение начинает прогрессировать, и тогда уже близкие больного могут заметить некоторые признаки. Появляются апатия, раздражительность и расторможенность, возникают очевидные нарушения сознания.
Например, по словам нашего эксперта, часто наблюдаются нарушения цикла сна и бодрствования – днем все время клонит в сон (особенно в машине или под звуки телевизора), а ночью включается активность. Также может отмечаться дезориентация во времени и пространстве, неадекватное поведение, резкое возбуждение или, напротив, ступор. А в тяжелом случае – кома.
— При осмотре некоматозных пациентов врач может выявить моторные (гипертонус, гиперрефлексия и положительный рефлекс Бабинского) и экстрапирамидальные расстройства (гипомимия – ослабление мимики, мышечная ригидность, брадикинезия – когда замедляются движения рук и ног, монотонность и замедленность речи, дрожание конечностей), — говорит Мария Прашнова. — Однако, печеночная энцефалопатия это клинический диагноз, то есть врач ориентируется на наличие комплекса симптомов, выявление триггера и исключение других расстройств, приводящих к нарушению сознания.

То есть, похожие симптомы могут проявляться при заболеваниях и расстройствах, вообще не относящихся к печени. Например, это могут быть гипогликемия и кетоацидоз при сахарном диабете, алкогольное или лекарственное отравление (бензодиазепины, нейролептики, опиоиды), деменция и различные психические расстройства, нейроинфекции, электролитные нарушения (гипонатриемия и гиперкальциемия), внутричерепное кровоизлияние и инсульт, полиорганная недостаточность.
Лечение печеночной энцефалопатии
Самое важное, что нужно знать – чем раньше выявить осложнение и начать лечиться, тем лучше. Печеночная энцефалопатия не приговор.
— Повреждение нервной ткани при печеночной энцефалопатии в большинстве нетяжелых случаев является обратимым при условии своевременного выявления и лечения, — подчеркивает Мария Прашнова. — Но у пациентов с циррозом печени явная ПЭ, равно как и кровотечение из варикозно-расширенных вен или асцит, является индикатором декомпенсации заболевания печени. А это само по себе сопряжено с высоким риском смерти.
Также нужно знать, что у выживших пациентов в большинстве случаев осложнение приходит вновь. По словам врача-гастроэнтеролога, рецидивы возникают в 40% в течение первого года после эпизода явной печеночной энцефалопатии.
Диагностика
Почему это осложнение чаще всего протекает тяжело? Дело в том, что на самой ранней стадии симптомы вообще не заметны, но и позже сам больной не замечает у себя подозрительных признаков. И соответственно, к врачу не обращается. Поэтому близкие человека с больной печенью должны быть особенно внимательны к нему.
Близкие могут заметить первые проявления этой болезни на латентной (скрытой) стадии, но чаще печеночная энцефалопатия выявляется на более поздних стадиях, когда человек уже попал в стационар или реанимацию.

Мария Прашнова К.м.н., врач-гастроэнтеролог, гепатолог
— Диагностировать это осложнение может врач-терапевт, инфекционист и гастроэнтеролог, но при наличии хронического заболевания печени (особенно в стадии цирроза) идеальным вариантом является быстрая связь с лечащим гепатологом, который знает особенности течения болезни конкретного человека.
Для диагностики необходимо определить степень тяжести заболевания – насколько пациент самостоятелен или за ним требуется уход.
— Оценку тяжести ПЭ проводят комплексно. Применяемые стратегии исследований варьируются от простой оценки с использованием клинических шкал (например, West-Haven с выделением 4х стадий и шкала комы Глазго для пациентов с тяжелыми нарушениями) до анализа с привлечением сложных психометрических и нейрофизиологических инструментов, — поясняет врач-гастроэнтеролог. — Тем не менее, ни одна из методик не является стандартной для оценки патологического процесса в целом. Выбор подходящих исследований и диагностических инструментов зависит от выраженности заболевания и нарушения физиологических функций.
Современные методы лечения
Для лечения явной печеночной энцефалопатии требуется в первую очередь выявить и устранить провоцирующий фактор, а также доктора назначают лактулозу (пребиотик) и рифаксимин (кишечный антибиотик).
— Полезными в лечении могут оказаться пероральный прием аминокислот с разветвленной цепью (BCAA), внутривенное введение препаратов, влияющих на метаболизм аммиака (L- орнитин-L-аспартат), прием пробиотиков или других антибактериальных препаратов в зависимости от тяжести и клинической ситуации, — отмечает доктор Прашнова. — Коррекция азотистого метаболизма имеет решающее значение в лечении всех стадий ПЭ у пациентов с циррозом, поэтому немаловажную роль играет питание. Между тем, этот фактор часто недооценивается, и у 75% пациентов с ПЭ имеет место белково-энергетическая недостаточность, сопровождающаяся потерей мышечной массы и истощением энергетических депо.

— Диетотерапия заключается в частом дробном питании с повышенным потреблением килокалорий. Рекомендуется прием небольших объемов пищи в течение дня и легкий перекус перед сном. Следует избегать появления чувства голода, — рассказывает Мария Прашнова. — Из всех питательных веществ глюкоза является наиболее легкоусвояемой, однако, она не должна использоваться в качестве единственного источника калорий. Также важно получать достаточно белка с пищей. Определенное ограничение белка может быть необходимо в первые несколько дней лечения явной ПЭ, но в дальнейшем нужно нормализовать поступление белка (1,2–1,5 г/кг массы тела в день). При плохой переносимости возможен дополнительный прием BCAA.
Но бывает, что ни медикаменты, ни диеты уже не помогают. Поэтому при тяжелой печеночной энцефалопатии, когда лечение не дает должного эффекта, проводится трансплантация печени.
Профилактика печеночной энцефалопатии в домашних условиях
Чтобы избежать лишних проблем и необходимости серьезного вмешательства, в том числе хирургического, достаточно соблюдать некоторые профилактические меры. Вот несколько пунктов, которые нельзя оставлять без внимания при хроническом заболевании печени (особенно в стадии цирроза):
- Регулярное контрольное обследование под наблюдением гепатолога.
- Своевременное выявление и устранение инфекций и кровотечений (например, терапия варикозно-расширенных вен пищевода) как одних из главных триггеров ПЭ.
- Следить за регулярностью стула и отсутствием запоров.
- Коррекция питания и уменьшение имеющейся саркопении (потери мышечной массы).
— Профилактическое назначение медикаментозного лечения требуется в случае уже перенесенного эпизода явной печеночной энцефалопатии, а также пациентам с циррозом печени и высоким риском возникновения ПЭ, — отмечает Мария Прашнова.
Популярные вопросы и ответы
Может ли МРТ показать наличие заболевания?
Компьютерная томография и магнитно-резонансная томография не представляют ценности для диагностики или определения степени тяжести заболевания. Однако риск внутримозгового кровоизлияния в этой группе пациентов повышен. При этом симптоматика такого состояния может совпадать с клинической картиной печеночной энцефалопатии, поэтому сканирование мозга обычно является частью комплекса диагностики.
В моей практике был случай госпитализации пациентки с циррозом печени и подозрением на тяжелую ПЭ. Однако, при обследовании была выявлена внутричерепная гематома, которая и явилась причиной спутанности сознания женщины. Уже позже родственники рассказали, что несколько дней назад женщина упала и, вероятно, ударилась головой. Вот почему так важно наличие опекунства людей с циррозом печени.
Помогают ли витамины при лечении печеночной энцефалопатии?
Как правило, пациентам рекомендуют прием мультивитаминов, однако достоверные данные о пользе витаминов и минеральных добавок отсутствуют.
Читайте также:

