Интоксикация печени у крысы
Обновлено: 24.04.2024
Печень – один из важнейших органов в организме, она участвует во всех метаболических процессах, происходящих в организме. К ее основным функциям относят:
- Обмен белков
- Обмен углеводов
- Обмен липидов
- Обмен витаминов
- Обмен гормонов
- Обмен пигментов
- Обезвреживание токсических веществ
- Иммунная защита
- Кровообращение
- Пищеварительная функция
Поражения печени и желчевыводящих путей составляют значительный процент болезней животных, в том числе грызунов и зайцеобразных, диагностируемых в условиях ветеринарной клиники.
Болезни печени и желчевыводящих путей, встречающиеся у грызунов и кроликов:
- Невоспалительные заболевания — гепатозы (жировой, амилоидный)
- Воспалительные заболевания — гепатиты (острый и хронический, первичный и вторичный)
- Цирроз печени
- Новообразования печени
- Абсцессы печени
- Нарушения кровообращения в печени
Болезни желчевыводящих путей:
- Холецистит — воспаление желчного пузыря
- Холангит — воспаление желчных протоков
- Холелитиаз — образование камней в желчном пузыре
Нередко заболевания могут протекать сочетано.
Наиболее частые причины болезней печени и желчевыводящих путей у грызунов и кроликов:
- Действие токсинов, поступающих с пищей (недоброкачественные корма)
- Действие токсинов, образующихся при неполном переваривании пищи при заболеваниях кишечника
- Паразитарные заболевания (кокцидиоз, лямблиоз, амебиаз, некоторые глистные инвазии)
- Отравление гепатотоксическими веществами, в т.ч. лекарственными препаратами
- Голодание (например, при патологии прикуса)
- Инфекции
- Нарушения белкового, углеводного, жирового обменов веществ, сахарный диабет
- Действие токсинов, возникающих при почечной недостаточности
- Токсические продукты распада белков при больших злокачественных опухолях
Клинические симптомы болезней печени и желчевыводящих путей у грызунов и зайцеобразных:
Диагностику болезней печени проводят комплексно в условиях ветеринарной клиники, включая анамнез, клинические признаки, пальпаторное и перкуторное обследование животного, лабораторные анализы, позволяющие оценить функциональное состояние печени, и дополнительные методы исследования – рентген, УЗИ.
Анамнез жизни — проводится с целью сбора данных о предшествовавшем заболеванию периоде жизни животного.
Владельцам необходимо дать ответы на следующие вопросы:
- возраст животного
- условия содержания
- проведённые вакцинации (для кроликов)
- контакты с другими домашними животными или дикими грызунами
- подробный состав рациона
- имела ли место быть смена рациона и условий содержания
- время и характер проявления болезни
- течение заболевания (резкое или постепенное ухудшение состояния, течение со спонтанными ремиссиями)
- изменение аппетита
- изменение жажды
- изменение каловых масс и мочи
- динамика кондиции животного
- увеличение объёма живота
- изменение поведения животного
- изменение качества шерсти и состояния кожного покрова
При клиническом исследовании обращают внимание на внешний вид животного:
- положение тела животного в пространстве
- конституция
- упитанность
При исследовании слизистых оболочек и кожных покровов особое внимание обращают на:
- наличие иктеричности, анемичности
- склонность к геморрагиям
При пальпации брюшной стенки животного отмечают:
- болезненность
- увеличение размеров печени
- отёки и асциты
- пневматоз ЖКТ
Биохимическое исследование крови (основные показатели, которые оцениваются у грызунов и зайцеобразных при болезнях печени и желчевыводящих путей):
- Общий белок
- Альбумин
- АСТ
- АЛТ
- ГГТ
- ЛДГ
- Билирубин
- Щелочная фосфатаза
Стандартный набор показателей у грызунов включает первые 5 показателей, остальные по усмотрению, если есть возможность взять достаточный объем биоматериала.
Гематологические исследования позволяют выявлять только неспецифические изменения, возникающие при болезнях печени. Выявляют:
- увеличение скорости оседания эритроцитов (СОЭ)
- лейкопению
- лейкоцитоз (нейтрофилию)
- тромбоцитопению
- анемию микроцитарную, макроцитарную или гемолитическую
- изменение величины гематокрита
Исследование мочи проводят на наличие уробилина и специфических кристаллов.
- Уробилин представляет собой желчный пигмент, который является конечным продуктом превращения гемоглобина. Уробилин получается из уробилиногена, который есть в свежей моче.
- В норме уробилин попадает в мочу в ничтожно малых количествах. Но если при лабораторных исследованиях уробилина оказывается больше нормы, такая положительная реакция (от слабоположительной + до резкоположительной +++) говорит о возможном наличии заболеваний печени и желчевыводящих путей:
- циррозы, гепатиты,
- закупорка камнем желчевыводящих путей,
- опухоли,
- отек тканей печени в результате застойных явлений.
- Наличие специфических кристаллов:
- Лейцин и тирозин: выраженное расстройство обмена веществ; отравление фосфором; деструктивные заболевания печени.
- Цистин: врожденное нарушение цистинового обмена – цистиноз; цирроз печени; вирусный гепатит; состояние печеночной комы.
Рентгенографическое исследование используется для оценки размеров печени и обнаружения асцита.
- Опухоли, гипертрофический цирроз, избыточная нагрузка сопровождаются увеличением объёма печени.
- Атрофический цирроз приводит к уменьшению границ печени.
- Показателем патологии печени может служить повышение рентгеновской контрастности органа.
Ультразвуковое исследование используется для:
- определения размера и объёма печени,
- очагов эхогенности,
- визуализации желчных путей,
- определения наличия взвеси или камней в желчном пузыре,
- обнаружения асцита, в т.ч. при небольшом скоплении жидкости
- контроля проведения биопсии печени, но у грызунов и кроликов используется редко.
Тактика лечения болезней печени
1.Устранение или снижение активности этиологического фактора (причина)
2.Детоксикация организма (энтеросгель, энтеродез)
3.Коррекция водного и электролитного баланса (натрия хлорид, рингер, рингер-локка, регидрон, гидровит)
5.Лактулоза (связывание аммиака, слабительный эффект): Дюфалак, Лактусан, Лактофильтрум
6.Гепатопротекторы (Карсил, Гептрал, Эссенциале, Лив52, Хофитол, Гепатовет)
7.Витамины и аминокислоты (Дюфалайт, Гемобаланс)
Тактика лечения болезней желчевыводящих путей
1.Устранение этиологического фактора или снижение его активности
3.Снятие спазмов желчевыводящих путей (но-шпа, папаверин, атропин, бускопан)
4.Желчегонные препараты (Урсофальк, Хофитол, Холензим, Холосас, Тыквеол, кукурузные рыльца)
5.Желчегонные продукты в рационе (листья одуванчика, укроп, шпинат, сельдерей; капуста, помидоры, морковь, топинамбур, свекла, грейпфрут, апельсин, кислые яблоки, овсяные отруби, плоды шиповника)
Профилактика болезней печени и желчевыводящих путей
- Сбалансированное кормление
- Отсутствие в рационе потенциально опасных продуктов, способных вызвать отравление — экзотические фрукты и овощи, сочные корма неизвестного происхождения, особенно в зимне-весенний период
- Профилактические мероприятия (антигельминтики, кокцидиостатики)
- Оптимальные условия содержания, просторная клетка – профилактика ожирения
Высокий процент патологий печени, выявленных в зимнее время, связан с изменением рациона кормления. В данный период в рационе грызунов увеличивается доля концентрированных кормов, а также покупной зелени, овощей и фруктов, которые выращены не в нашей полосе, и в большинстве случаев проходят обработку, чтобы сохранить их свежесть, или выращены с помощью удобрений. Чувствительный пищеварительный тракт грызунов реагирует на подобные изменения. Особенно это видно по обращениям с животными в январе, в период новогодних праздников, когда травоядные животные — морские свинки, кролики, шиншиллы часто становятся жертвами салатов с новогоднего стола – хозяева угощают их шкурками от огурцов, помидорами, зеленью, экзотическими фруктами.
В минимальном количестве патологии печени и желчевыводящих путей выявляются в летнее время, когда преобладает натуральный рацион – свежевысушенное сено, трава, овощи-фрукты с собственного огорода.
У морских свинок патологии, связанные с поражением печени и желчевыводящих путей составляют примерно 20% от общего количества заболеваний, у кроликов около 10%, у крыс и шиншилл около 5% (по данным обращений за 2014 год). У остальных грызунов болезни печени не всегда представляется возможным диагностировать в связи с маленьким размером животного, сложностью взятия анализов крови и проведения УЗИ.
Булекбаева Л.Э. 1 Ерлан А.Е. 1 Рыспекова Ш.О. 2 Джусипбекова Б.А. 2 Алпысбаева К.К. 2 Артыкбаева У.С. 2
Статья посвящена исследованию морфологических свойств крови и лимфы, реогепатографии и уровень кровоснабжении сосудов у крыс. При экспериментальном токсическом гепатите у крыс лимфатическая система вовлекается в патологический процесс. Возрастает уровень тромбогенных процессов не только в крови, но и в лимфе. Изменение реогепатографии обуславливаются нарушением оттока в паренхиме, изменением эластичности сосудов печени и развитием артериовенозных шунтов.

2. Забродский П.Ф., Германчук В.Т. Влияние тетрахлорметана на показатели иммунной системы // Бюлл. экспер. биол. и мед. – 2004. – № 1. – С. 56–57.
3. Камалов Ю.Р., Северов М.В., Олейникова Е.Б. Значение ультразвукового исследования вен портальной системы для выявления синдрома портальной гипертензии у больных циррозом печени.// Тез.1-го съезда Ассоциации специалистов ультразвуковой диагностики в медицине. – М., 1991. – С. 96.
4. Клишина И.М. Влияние гомогената трутеновых личинок на уровень белка и нуклеиновых кислот в условиях токсической гепатопатии // Матер. 55-ой регион. конф. по фармации, фармакологии и подготовка кадров. – Пятигорск, 2000. – С. 195–196.
5. Копылова Л.Е., Саркова Е.В., Асташов В.В. Лимфатический регион печени матери и потомства при беременности, осложненной действием экотоксикантов.// Бюлл. СО РАМН. – 2008. – № 5. – С. 38–43.
6. Кунцевич Г.И., Скуба Н.Д., Белолапотко Е.А. Роль комплексного ультразвукового исследования в дифференциальной диагностике очаговых образований печени. Методические рекомендации. – М., 1997. – C. 45.
7. Юрова Е.Г., Асташов В.В., Казаков О.В. Структура брыжеечных лимфатических узлов у крыс с хроническим токсическим гепатитом и в условиях его коррекции лазерным излучением и фитосорбционными комплексами // В кн.: Проблемы экспериментальной клинической и профилактической лимфологии. – Новосибирск, 2002. – С. 389–391.
8. Raom R., Kuman K.V et. al. Влияние фруктозы на активность синтезы оксид азота под действием CCl4 // Indian J. Exp. Biol. – 2001. – V. 39, № 1. – P. 68–69.
9. Zhang J., Zong Ch., Li D., Zhan R. Взаимосвязь между локальной ренин-ангиотензин-альдестероновой системой и фиброзом печени крыс // Word. Chin. J. Dig. – 2002. – V. 10, № 4. – P. 397–400.
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
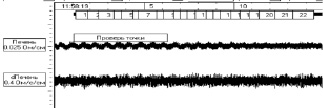
а) реогепатограмма контрольной группыу крыс
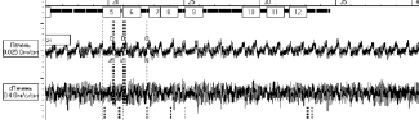
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).

В результате интоксикации организма экспериментальных животных солями нитритов и нитратов в печени крыс обнаружены ряд морфологических изменения, характеризующихся нарушением балочной структуры, изменениями количества двух и многоядерных гепатоцитов, выраженностью сосудистых изменений. Отмеченные морфологические изменения, несомненно, связаны с усилением образования оксидов азота из нитритов и нитратов.
Ключевые слова: эксперимент, печень, интоксикация, нитраты и нитриты
Актуальность проблемы. Влияние экологической обстановки на организм человека имеет важное прикладное и теоретическое значение. В районах Приаралья отмечается высокая инсоляция воды и почвы. В зоне экологической катастрофы, к которым относятся районы вокруг Аральского моря, отмечаются солевые бури, высокое содержание солей в питьевой воде, что оказывают неблагоприятное влияние на организм человека [2]. Экспериментальные исследования по изучению влияния солей нитритов и нитратов на организм животного, в частности на морфологические параметры печени, позволит выявить новые прогностические критерии по оказанию профилактической помощи, жителям проживающим в зоне экологической катастрофы [1, 5].
Клинические исследования показали важность исследований в данном направлении, так как в результате длительного поступления в организ нитритов и и нитратов образуются высокореакционные соединения азота — его оксиды [3, 6]. Они токсически влияют на все органы и ткани организма. При этом наибольшие функциональные и морфологические нарушения отмечаются в желудочно-кишечном тракте (язвы, эрозии, кровоизлияния), легких (отек, пневмония) и поджелудочной железе (преходящие гипергликемии) и печени. Многими авторами неоднократно подчёркивалось, что в патогенезе раннего периода интоксикации солями существенную роль играют нарушения функций печени [4].
Цель — изучить морфологические особенности состояния печени при интоксикации нитритами и нитратами в эксперименте.
Материалы и методы исследования.
В эксперименте воспроизводилась модель хронического отравления нитрами и нитритами на крысах Концентрация нитритов и нитратов, вводимых внутрижелудочно, соответствовала значениям в 2–3 раза превышавшим предельно допустимые дозы (ПДД).
Все процедуры эксперимента соответствовали требованиям Международных правил гуманного отношения к животным, отраженным в Санитарных правилах по оборудованию и содержанию экспериментально-биологических клиник (вивариев).
Единичные редко расположенные мелкоточечные воспалительные инфильтраты выходят из портальной стромы в периферические отделы дольки без развития некроза гепатоцитов, располагаясь между печёночными клетками — так называемый дискретный инфильтрат, изредка развиваются единичные перипортальные некрозы.
Нередко на ранних сроках экспериментальной интоксикации нитритами и нитратами у крыс обнаруживались очаговые пролиферативные изменения внутри долек: чётко отграниченные инфильтраты из клеток — производных системы мононуклеарных фагоцитов.
Интенсивность гематотканевого обмена в значительной степени зависит от скорости кровотока в синусоидах, что в свою очередь завистило от особенностей их строения. Так, нами отменено, что в норме и первые сутки интоксикации в перипортальных отделах дольки печени встречались главным образом прямые и ветвящиеся синусоиды. В последующем, к седьмым суткам перипортальные тракты до зон примыкания к центральным венам характеризовались преимущественно ветвящимися синусоидами с наблюдением чёткой тенденции к анастомозированию, причём характерной немаловажной особенностью является выявленная нами прямопропорциональная взаимосвязь появления унулиподий от сроков интоксикации солями.
В общей характеристике морфологические проявления после интоксикации проявляются нарушением балочного строения печени, внутридольковыми альтернативными проявлениями с проявлением некрозов единичных гепатоцитов со скоплением в этих участках небольшого количества макрофагов, лимфоцитов, нейтрофилов, очагами жировой дистрофии гепатоцитов, пролиферацией и гипертрофией звёздчатых ретикулоэндотелиоцитов, отёком и расширением портальных трактов с инфильтрацией их лимфогистиоцитарными элементами и нейтрофилами, иногда пролиферацией перипортальных и интралобулярных желчных протоков и формированием лимфоидных фолликулов. Микроскопически обнаруживается полиморфизм гепатоцитов (клетки различных размеров, среди них большое количество двух- и многоядерных, ядра различных размеров), их набухание, вследствие чего нарушается чёткость балочного строения. Белковая (гидропическая, балонная) и жировая дистрофия имеют мелкоочаговый характер, причём выраженность данных изменений трудно определить как характерные, или специфичные в конкретном случае.
В различных отделах печёночных долек встречались мелкие очаги некроза паренхимы с разрушением аргирофильной стромы и очаговые инфильтраты из макрофагов, лимфоцитов, нейтрофилов. Выражены пролиферация и гипертрофии звёздчатых ретикулоэндотелиоцитов (макрофагов печени). Портальные тракты расширены, отёчны, умеренно или слабо инфильтрированы лимфогистиоцитарными элементами с примесью нейтрофилов.
В результате наших исследований подтверждено, что интоксикация солями нитритов и нитратов нарушают морфологический пейзаж печёночных структур, что приводит в последующем к функциональным сдвигам, приводящим к снижению детоксикационной функции печени и развитию эндогенной интоксикации.
В результате интоксикации организма экспериментальных животных солями нитритов и нитратов в печени крыс обнаружены ряд морфологических изменения, характеризующихся нарушением балочной структуры, изменениями количества двух и многоядерных гепатоцитов, выраженностью сосудистых изменений. Отмеченные морфологические изменения, несомненно, связаны с усилением образования оксидов азота из нитритов и нитратов.
- Абзалова Ш. Р. Морфофункциональные изменения печени при экспериментальном ишемическом поражении головного мозга //Молодой ученый. — 2015. — №. 90. — С. 375–379.
- Ибрагимов У. К. Биоантиоксиданты в клинической медицине.// VIII Международная конференция Биоантиоксидант. Тезисы докладов.-Москва.-4–6 октября 2010.-с.176–177.
- Ибрагимов У. К., Хайбуллина З. Р. Биологические мембраны (монография).-Ташкент, 2009, 134 С.
- Hammerman C., Kaplan M. Ischemia and reperfusion injury. The ultimate pathophysiologic paradox // Clin. Perinatol. 1998. V. 25. № 3. Р. 757–777.
- Smrcka M., Otevrel F., Kuchtickova S., Horky M., Juran V., Duba M., Graterol I.Experimental model of reversible focal ischemia in the rat // Scripta medica (BRNO). 2001. № 74. P. 391–398
- Ying I, Saposnik G, Vermeulen MJ, Leung A, Ray JG. Nonalcoholic fatty liver disease and acute ischemic stroke. Epidemiology. — 2011, Jan;22(1):129–130.
Основные термины (генерируются автоматически): изменение, нитрат, балочная структура, главный образ, жировая дистрофия, организм человека, очаговая гиперемия, печень крыс, хроническое отравление, экологическая катастрофа.

В данной серии опытов нами исследовано состояние ПОЛ и активность ферментов АОС в печени, тимусе, селезенке экспериментальных крыс, получавших ксенобиотики.
Важным фактором в патогенезе поражений органов являются изменения, возникающие в структуре и функции органов, усиление интенсивности ПОЛ непредельных жирных кислот ФЛ с образованием токсических метаболитов, которые приводят к повреждению биологических мембран [1, 2,3].
Гидроперекиси, диеновые кетоны, диеновые коньюгаты, малоновый диальдегид являются метаболитами, обладающими цитотоксичностью [4, 62, 5, 6].
В связи с этим представляет интерес изучение состояния окисления липидов в печени и в органах иммунной системы, где происходит метаболизм ксенобиотиков и выработка иммунных тел.
Результаты проведенных исследований показали, что в процессе интоксикации гепатотропными ксенобиотиками происходит усиление интенсивности ПОЛ (рис.1.) не только в печени, но и в органах иммунной системы. Так, в тимусе крыс, получавших гелиотрин на 50-ый день опыта, содержание МДА по сравнению с контролем повышалось в 5 раз, в селезенке- 4,5 раза, в сыворотке крови — в 6 раз, а в печени в 9,5раз. На 70-й день исследования происходило постепенное снижение содержания МДА в исследуемых объектах, кроме сыворотки крови. У крыс, получавших ССl4, также наблюдалось увеличение количества МДА во всех исследуемых органах и в сыворотке крови. Но в данном случае эти показатели были гораздо больше и составляли: на 50-й день количество МДА в тимусе увеличилось в 8,4, в селезенке в 5,2 раза, в сыворотке крови в 6,3раза, а в печени в 14,6 раза. На 70-й день эти показатели продолжали нарастать и составили в тимусе в 13, а в селезенке в 6,3 раза, в сыворотке крови в 7,5 раза, а в печени в 17,4раза.

Рис. 1. Изменение содержания МДА у крыс при интоксикации гелиотрином
Наибольшее содержание МДА выявлено в печени, что, вероятно, объясняется метаболизмом в ней гелиотрина и CCl4 (табл.1.).
Содержание МДА (нмоль/мг белка) в органах крыс при введении ССl4n=8–10

Ганглиозиды, занимая 2,8 % клеточной мембраны, выполняют жизненно важные функции: рецепция, взаимодействие между клетками, перенос ионов, восприятие химических и физических сигналов, поддержание мембранного потенциала [2, 3, 7, 8, 11]. Церамидная часть ганглиозидов погружена в жидкую липидную фазу мембраны, а разветвленная олигосахаридная — ориентирована в межклеточное пространство, где она тянется к соседней клетке [3, 11]. Ганглиозиды, взаимодействуя с ФЛ и белками, влияют на функции мембраносвязанных ферментов [4, 5, 7, 8, 10].
Поэтому любые воздействия на мембрану клетки (ксенобиотики, канцерогены, токсины и т. д.) и функциональные изменения в активности оксидантных и антиоксидантных ферментных систем, приводят к изменению содержания и состава ганглиозидов.
Поэтому в настоящей работе нами исследованы показатели общих и индивидуальных ганглиозидов в гомогенатах печени и иммунокомпетентных органов крыс при интоксикации ССl4 и гелиотрином.
В динамике интоксикации крыс ССl4 в исследуемых органах происходят существенные сдвиги в количественном составе ганглиозидов. В таблице 1. представлены результаты исследования содержания ганглиозидов печени и тимуса экспериментальных крыс, получавших CCl4.
Содержание общих и индивидуальных ганглиозидов в органах крыс (мкг ск/г ткани) при интоксикации CCl4n= 8–10
Ганглиозиды
Интактные (контроль) M±m
Дни исследования
50-й M±m
70-й M±m
Как видно из данных таблицы, содержание общих ганглиозидов в печени и в тимусе во все сроки исследования снижено в различной степени. Они наиболее выражены на 70-й день исследования, где разница в показателях тимуса составляет 4,25 раза, а в печени 2,7 раза относительно контроля. Меньшее снижение содержания ганглиозидов в печени видимо, связано с наличием запаса в ней витамина А, кофактора ферментов участвующих в синтезе ганглиозидов и гликопротеидов.
В составе индивидуальных ганглиозидов печени выявлено значительное снижение GQ фракции в 5,4; GT в 6,0; GD1а в 4,0; GD1b — 3,5; GD3–6,3 раза сравнительно с контрольными показателями.
В остальных фракциях разница в исследуемых показателях составила от 1,7 до 2,0 раз.
В тимусе снижение исследуемых показателей составили: GQ — 9,0; GT — 6,9; GD1a — 7,0; GD1b — 7,3 раза по сравнению с контрольными величинами, остальные фракции колебались от 2,8 до 4,5 раза.
Таким образом, под влиянием CCl4 происходят изменения в составе как сложных, так и простых ганглиозидов. Эти изменения могут привести к нарушению в этих органах ионной проницаемости, рецепции гормонов и нарушению других обменных процессов, происходящих в мембранах исследуемых органов.
Интоксикация крыс CCl4 вызвала изменения и в ганглиозидном спектре селезенки. Выявлено, что наиболее высокое содержание в селезенке из фракции ганглиозидов оказались GQ, GT, GD1a,. Снижение содержания общих и индивидуальных ганглиозидов в исследуемых органах при интоксикации CCl4 наблюдалась во все сроки исследования. На 50-й день исследования разница в этих показателях составила от 1,2 до 2,1 раза, на 70-й день от — 3,2 до 10,0 раз, т. е. эти изменения нарастали на 70-й день исследования (табл.2.).
Содержание общих и индивидуальных ганглиозидов в селезенке крыс (1мкг ск/г ткани) при интоксикации CCl4n=8–10
Ганглиозиды
Интактные (контроль) M±m
Дни исследования
50-й M±m
70-й M±m
В печени экспериментальных крыс отмечается тенденция снижения всех фракций ганглиозидов. Так, на 50-й день опыта в печени GQ снижалось на 47,5 %, на 70-й — 84,7 %. Содержание GD1b снизилось на 38,8 %; 76,5 %, соответственно. Выраженные отличия выявлены также в показателях GD3, его содержание по сравнению с контролем снизилось в печени на 23,4 % и 35 %, соответственно. Определенные изменения претерпевало общее содержание ганглиозидов, при этом его показатели в печени составили 28,4 % и 47,7 %.
В селезенке содержание GQ на 50-й день исследования снизилось на 37,4 %, на 70-й день 85,4 %. В эти же сроки исследования в тимусе содержание GQ снизилось на 60,7 % и 83,8 %. Содержание GD1b в селезенке снизилось на 50-й день на 38 %, на 70-й день на 84,4 % относительно контроля, в тимусе на 50-й день на 46,2 %, на 70-й день на 77,2 %, а содержание GM3 снизилось в селезенке на 50-й день на 41,7 %, на 70-й день на 65 %, в тимусе на 50-й день 67,5 %, на 70-й день на 84,9 % относительно контроля соответственно.
Таким образом, при введении экспериментальным крысам гепатотропных ксенобиотиков (CCl4 и гелиотрина) содержание ганглиозидов в печени, селезенке и тимусе снизилось от 19 до 85 % по сравнению с контрольными величинами.
Анализ динамики изменения содержания ганглиозидов у экспериментальных групп животных выявил определенные закономерности, имеющие значение в разработке патогенеза действия гепатотропных ксенобиотиков.
У крыс получавших CCl4, достоверные изменения в содержании ганглиозидов в сторону снижения наблюдаются во все сроки исследования, но они наиболее выражены на 70-й день исследования. Если эти изменения у крыс получавших CCl4 снизились на 50-й день исследования в 1,8–2,6 раза, а на 70-й день от 1,9 до 6,6 раза, то у крыс получавших гелиотрин эти показатели колебались от 1,8–6,2 на 50-й день; 3,2–8,5 на 70-й день исследования.
Выраженные изменения отмечались в содержании следующих индивидуальных фракции ганглиозидов: GQ, GT, GD1b, GD1a (в печени), GQ, GT, GD1b, GD1a, GM3, (в тимусе), а в гомогенатах селезенки отмечено отсутствие GD3 и значительное снижение GD1b и GD1a.
Таким образом, анализ полученных результатов показал, что в процессе интоксикации гепатотропными ксенобиотиками происходит снижение всех фракций ганглиозидов в исследуемых органах. Это, видимо, связано превалированием процесса катаболизма над процессами анаболизма ганглиозидов, превалированием активности сиалидазгидролаз над активностью сиалилтрансфераз — синтетаз ганглиозидов [15].
При введении ксенобиотиков происходят нарушения в активности ферментов мембран цитозоля, митохондрий и других органелл, что приводит к усилению ПОЛ, увеличивает окислительное фосфорилирование, нарушает цикл Кребса. Все это создает дефицит субстратов синтеза ганглиозидов (глюкозы, АТФ, нуклеиновых кислот, сиаловых кислот). Повреждение печеночных клеток приводит также к нарушению глюконеогенетической функции клеток печени, усиливается расход, замедляется синтез гликогена [1, 9]. Все это сопровождается нарушением рецепции инсулина в мембране клеток и приводит к гиперинсулинемии, нарушению биосинтеза глюкоконьюгатов из углеводов и его субстратов, снижается транспорт углеводов через мембраны клеток, их фосфорилирование и затормаживается биосинтез олигосахаридной части гликолипидов [6, 12, 15].
Таким образом, дефицит субстратов для биосинтеза ганглиозидов на фоне усиления активности сиалидаз-гидролаз и снижения активности сиалилтрансфераз — синтетаз приводит к изменению состава ганглиозидов и нарушению поверхностных функций мембран органов [13, 14].
Сопоставление результатов исследования содержания ганглиозидов с результатами исследования фосфолипидов выявило, что наряду с изменением количественного состава индивидуальных фосфолипидов также изменяется содержание индивидуальных ганглиозидов. Следует при этом отметить, что если в составе индивидуальных фосфолипидов наблюдается тенденция снижения и повышения содержания определенных фракций, то в составе индивидуальных ганглиозидов такого явления не происходит. В этом случае наблюдается одностороннее изменение — снижение содержания всех фракции ганглиозидов. Причем, содержание ди- и олигосиалганглиозидов уменьшается в большей мере, чем содержание моносиалганглиозидов. Вследствие уменьшения содержания индивидуальных ганглиозидов уменьшается содержание общих ганглиозидов в печени на 47,7 %, в селезенке на 70 % и в тимусе на 65 %. Аналогичные отклонения происходили в органах иммунной системы. Отмечалась картина пропорциональности между ЛФХ, ФХ и индивидуальными ганглиозидами. Прогрессивное нарастание содержания ЛФХ приводило к интенсивному снижению ФХ и количества всех фракций ганглиозидов. Эта тенденция сохранялась во всех изученных органах экспериментальных крыс, максимум, которого приходился на 70-й день исследования.
Следовательно, результаты исследования свидетельствуют о том, что введение крысам ксенобиотиков гелиотрина и CCl4 сопровождается существенными сдвигами в составе индивидуальных ганглиозидов не только в печени, но и в органах и клетках иммунной системы, выраженность которых прямо пропорциональна течению патологического процесса. Резкие изменения в содержании индивидуальных ганглиозидов и ФЛ во всех изученных органах, очевидно, и обуславливают нарушения структуры и функциональной активности клетки и способствуют развитию патологического процесса.
Таким образом, интоксикация экспериментальных крыс гепатотропными ксенобиотиками сопровождается изменениями в составе общих и индивидуальных ФЛ и ганглиозидов во всех изученных органах. Выраженность наблюдаемых отклонений в содержании ФЛ и ганглиозидов корректировали при прогрессировании патологического процесса. Независимо от этиологического фактора, природы ксенобиотика, формы патологического процесса, дозы ксенобиотика в печени и в органах иммунной системы происходят структурно-функциональные нарушения, ведущие к нарушениям внутриклеточного метаболизма и усугубляющие патологический процесс.
Основные термины (генерируются автоматически): день, содержание, патологический процесс, печень, изменение, орган, иммунная система, крыса, показатель, раз.
Читайте также:

