Интоксикация почек у детей симптомы
Обновлено: 11.05.2024
Пиелонефрит – воспаление почек бактериальной природы. Этому недугу подвержен практически каждый второй новорожденный, потому что почки к моменту рождения еще должным образом не сформированы. В группе риска также находятся дети, прошедшие реанимацию сразу после рождения.
При этой болезни поражается чашечно-лоханочная система и паренхима почек (внутренние ткани). Выявляется в основном у детей до семи лет.
Основной возбудитель пиелонефрита у ребенка – это кишечная палочка, оседающая в мочевыделительной системе. Также недуг часто провоцируется кокковой инфекцией. Источник:
А.А. Козловский
Пиелонефриты у детей (обзор литературы)
// Проблемы здоровья и экологии, 2009, с.60-66
Важно! Родители должны знать и вовремя выявить признаки пиелонефрита у ребенка. Болезнь опасна передом в хроническую форму и даже летальным исходом.
Причины заболевания
Простейшие микроорганизмы, вирусы, грибы, бактерии – возбудители воспалительных болезней почек. При хронических формах в ряде случаев диагностируется одновременное сочетание разных возбудителей.
Микроорганизмы могут попадать в почки:
Предрасполагающие факторы:
- высокая агрессивность микроорганизма, его стойкость к защитным механизмам организма;
- аномалии строения почек, вызывающие неправильный отток мочи;
- пузырно-мочеточниковый рефлюкс (когда моча из мочевого пузыря поступает обратно в почки);
- застои мочи;
- нарушение личной гигиены;
- воспаления половых органов;
- цистит;
- сахарный диабет;
- недуги, снижающие иммунитет;
- глисты;
- хронические инфекции;
- переохлаждение;
- перевод ребенка до года на искусственное кормление;
- прорезывание зубов.
Симптоматика недуга
Симптомы и особенности острого пиелонефрита у детей
Признаки заболевания могут различаться и зависят от тяжести процесса, имеющихся заболеваний, возраста и других факторов. Общая симптоматика такова:
Признаки хронического воспалительного процесса в почках
Для хронической формы заболевания характерно чередование ремиссий и обострений. Во время обострения симптомы повторяют острую разновидность пиелонефрита. Если ребенок долго подвержен этому хроническому недугу, он становится раздражительным, невнимательным, быстро устает. Иногда отмечаются задержки развития.
Почему трудно диагностировать пиелонефрит у грудных детей?
Младенец не может рассказать родителям и врачу о неприятных ощущениях. Поэтому родители должны быть очень внимательными. Для новорожденных характерные такие симптомы, как:
- частая рвота и срыгивания;
- вялое сосание или полный отказ от груди (бутылочки);
- синюшность кожных покровов над верхней губой;
- отсутствие прибавки массы тела или ее снижение;
- сухость кожи;
- беспричинный плач и беспокойство (сигнализируют о боли);
- затрудненное мочеиспускание (ребенок беспокоится, плачет, краснеет перед этим процессом);
- диарея;
- повышенная температура тела;
- нарушение сна. Источник:
Е.М. Плешкова
Особенности пиелонефрита детей грудного возраста
// Вестник Смоленской государственной медицинской академии, 2006, с.51-53
Классификация заболевания
| Вид | Особенности |
|---|---|
| Первичный | При отсутствии предрасполагающих внешних факторов. |
| Вторичный | Возникает при различных расстройствах и аномалиях строения мочевыводящей системы. |
| Острый | Такой пиелонефрит возникает под действием предрасполагающих факторов и возбудителей (после простуды, при переохлаждении и др.), ремиссия у ребенка наступает через 1-2 месяца терапии. |
| Хронический | Бывает латентным (без явных признаков) и рецидивирующим (с обострениями не менее 4 раз в год). |
Диагностика пилонефрита
Заболевание диагностируется лабораторными и инструментальными методами:
- накопительные пробы;
- общий анализ мочи;
- посев мочи;
- биохимический и клинический анализы крови;
- биохимия мочи;
- контроль АД;
- УЗИ;
- рентгенография;
- МРТ;
- КТ;
- и другие по назначению врача. Источник:
А.И. Сафина
Пиелонефрит детей раннего возраста: современные подходы к диагностике и лечению
// Практическая медицина, 2012, №7(62), с.50-56
Способы лечения
Важно! Нельзя применять народные методики и бесконтрольно принимать препараты. Терапия должна назначаться и контролироваться только врачом.
Острая форма болезни
При пиелонефрите этой формы у детей важна диета, постельный режим. Корректировка рациона направлена на снижение нагрузки на почки. Также проводится медикаментозное лечение антибактериальными препаратами, уросептиками, спазмолитиками, жаропонижающими и др. Лечение занимает около месяца или двух, может рекомендоваться госпитализация. Источник:
С.В. Мальцев, А.И. Сафина
Лечение пиелонефрита у детей
// Практическая медицина, 2007, №5(24), с.20-24
В период ремиссии ребенок должен наблюдаться у педиатра, нефролога, сдавать анализы с заданной регулярностью.
Хроническая форма болезни
Терапия схожа с той, которая применяется при остром пиелонефрите. Она включает применение диеты, медикаментов, а также при ряде аномалий показана операция. В период ремиссии назначаются противорецидивные меры (уросептики, антибиотики, фитотерапия и др.).
Профилактические меры
Залог здоровья ребенка – правильный образ жизни матери во время беременности: диета, своевременное лечение цистита. Ребенку же, особенно находящемуся в зоне риска, важно поддерживать иммунитет, заниматься ЛФК, по рекомендации врача – принимать витаминные комплексы или травяные отвары.
Записаться на прием к детскому нефрологу вы можете по телефону.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
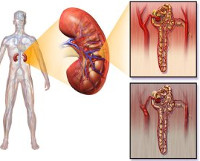
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
Общие сведения
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
Почечная недостаточность у детей — это острое или хроническое нарушение функций почек, которое сопровождается электролитными и метаболическими расстройствами. Провоцируется ренальными, преренальными и постренальными причинами. Симптомы почечной недостаточности включают неспецифические проявления (слабость, ухудшение аппетита, похудение), изменение диуреза и состава мочи, уремические осложнения со стороны внутренних органов. Для диагностики проводят исследование крови и мочи, УЗИ органов мочевыделения, биопсию почек. Лечение состоит из коррекции гомеостаза, этиопатогенетической терапии, перитонеального или гемодиализа.
МКБ-10

Общие сведения

Причины
Этиологическая структура зависит от варианта почечной недостаточности и возраста ребенка. Среди младенческого и раннего детского возраста преобладают врожденные факторы, тогда как у школьников возрастает удельный вес приобретенных болезней почек и токсических влияний на клубочковый аппарат. Причины почечной недостаточности у детей подразделяются на несколько категорий:
- Врожденные заболевания почек. Чаще всего причиной патологии становятся наследственные обструктивные уропатии и тубулопатии, которые осложняются бактериальным воспалительным процессом и дисплазией почечной паренхимы. Среди пороков развития преобладают агенезия или гипоплазия, поликистоз, мегауретер.
- Приобретенные почечные болезни. Симптомы ренальной недостаточности наблюдаются при поражении клубочков (гломерулонефрите, волчаночном нефрите), канальцевом некрозе вследствие ишемии органа, воздействии нефротоксических ядов и лекарств. Реже патология вызвана поражением интерстиция и почечных сосудов.
- Расстройства гемодинамики. Острые формы заболевания возникают при уменьшении ОЦК, что сопровождается гипоперфузией клубочков. Это бывает при кровотечении, полиурии, многократной диарее и рвоте. Ишемия органа провоцируется снижением сердечного выброса и дилатацией периферических сосудов.
- Нарушения оттока мочи. Обструкция может происходить в любом отделе мочевыделительного тракта: мочеточниках, шейке мочевого пузыря, уретре. Патологические изменения обусловлены механическим сдавлением почечных лоханок большим количеством жидкости. Обструкция возможна при МКБ, опухоли, травме.
Патогенез
В зависимости от причин развития патологические процессы при ОПН вызваны разными механизмами: ишемией ренальной паренхимы, активацией шунтов в юкстамедуллярной зоне, токсическим поражением клубочков и эпителия канальцев, острой обструкцией мочевыводящего тракта. Возникающие изменения вначале носят обратимый характер и при устранении провоцирующих факторов функции нефронов полностью восстанавливаются.
При ХПН механизм повреждения не зависит от первопричины синдрома. При утрате большого количества функционирующих нефронов в оставшихся клубочках начинаются компенсаторные процессы: изменение диаметра афферентных и эфферентных артериол, нарушение целостности базальной мембраны, повышение гидростатического давления. В результате усугубляется внутриклубочковая гипертензия, а клетки начинают синтезировать провоспалительные цитокины.
Классификация
Почечная недостаточность делится на 2 большие группы: острая, для которой характерны условно обратимые процессы без первичной гибели нефронов, и хроническая, характеризующаяся постепенным снижением процента функционирующих клубочков. С учетом причины ОПН бывает преренальной, ренальной и постренальной. В детской нефрологии для оценки степени поражения используют педиатрическую классификацию RIFLE, которая включает 5 стадий:
- Риск. Скорость клубочковой фильтрации (СКФ) снижается на 25-50%, а объем мочи составляет менее 0,5 мл/кг/час в течение минимум 8 часов.
- Повреждение. СКФ уменьшается на 50-75% от возрастной нормы, а сниженный уровень мочевыделения сохраняется не менее 16 часов.
- Недостаточность. Характеризуется падением СКФ более, чем на 75%, или абсолютным значением менее 35 мл/мин/1,73 м 2 . Диурез снижается до 0,3 мл/кг за час на протяжении суток и дольше.
- Потеря. Диагностируется, если у ребенка сохраняются симптомы ОПН более 3 недель.
- Терминальная стадия. Соответствует хронической болезни почек (ХБП), когда клинические проявления патологии длятся дольше 3 месяцев.
Симптомы
ОПН у детей
В клинической картине острой формы почечной недостаточности выделяют 4 фазы. На начальном этапе специфические симптомы отсутствуют, но есть признаки основного заболевания или кратковременного провоцирующего фактора (кровотечение, обезвоживание). Беспокоят тошнота, повышенная утомляемость, снижение аппетита, но дети, особенно младшего возраста, редко предъявляют жалобы.
Затем наступает олигоанурическая стадия, когда количество выделяемой за сутки мочи намного меньше возрастной нормы. Вследствие метаболических изменений у детей возникает диарея и рвота, наблюдается патологическая сонливость и угнетение сознания. Отмечаются повышенная сухость кожи, беловатый налет на слизистых, изо рта ребенка пахнет аммиаком. Состояние длится в среднем 10-14 суток.
На диуретической стадии количество мочи компенсаторно увеличивается и может достигать 2-3 л в сутки. Постепенно нормализуется водно-электролитный баланс, исчезают симптомы ОПН, к ребенку возвращаются аппетит, интерес к подвижным играм. Полиурия сохраняется около 2 недель. Далее болезнь переходит в восстановительную фазу, продолжающуюся 6 месяцев и более.
ХПН у детей
Симптомы ХПН возникают постепенно, прогрессируют несколько месяцев или даже лет. Вначале появляется слабость, сухость кожи и слизистых, снижение успеваемости в школе. Ребенок постоянно хочет пить, но аппетит снижен. На поздних стадиях кожа становится бледной с желтоватым оттенком, заметны дрожание пальцев рук и мелкие судороги, нарастает апатия. Зачастую формируется анемия, вызванная нехваткой эритропоэтина.
Осложнения
ОПН значительно ухудшает состояние ребенка, а летальность колеблется от 3-5% при гемолитико-уремическом синдроме до 30-70% при сепсисе и полиорганной недостаточности. Даже при успешном лечении и восстановлении мочевыделительной функции возможны отдаленные последствия — у 10-25% детей формируется хроническая болезнь почек. ОПН опасна электролитными расстройствами (гиперкалиемия, гипокальциемия, гиперфосфатемия).
В терминальной стадии ХПН возникают желудочно-кишечные кровотечения, отек легких, перикардит и плеврит. Длительное течение заболевания сопровождается артериальной гипертензией, которая при отсутствии лечения развивается у детей любого возраста. Неврологические осложнения проявляются спутанностью сознания, периферической полинейропатией. Возможна остеодистрофия, из-за чего у ребенка наблюдается задержка роста и физического развития.
Диагностика
Лечение почечной недостаточности у детей
Для успешного купирования ОПН необходимо устранить ее причину. При преренальной форме мероприятия направлены на нормализацию ОЦК, при ренальной проводится этиопатогенетическая терапия почечной патологии, при постренальной нужно как можно быстрее ликвидировать обструкцию мочевыводящих путей. Для коррекции нарушений водно-электролитного обмена назначаются солевые растворы, диуретики. При ХПН лечение включает несколько групп препаратов:
- Гипотензивные средства. Наиболее часто применяют ингибиторы АПФ, которые не только предупреждают симптомы вторичной гипертонии, но и замедляют развитие почечной недостаточности. Как альтернативу используют блокаторы кальциевых каналов, бета-блокаторы.
- Препараты эритропоэтина. Эффективны при анемии, которая возникает у ребенка уже на ранних стадиях болезни. В основном принимаются медикаменты ЭПО второго поколения с пролонгированным эффектом.
- Железосодержащие лекарства. Для устранения абсолютного или функционального дефицита этого микроэлемента назначают детские пероральные формы (в виде сиропов), а старшим детям дают таблетированные варианты. По показаниям комбинируют препараты с фолиевой кислотой.
- ВитаминD. Холекальциферол предупреждает почечную остеодистрофию и применяется для ее лечения. Во время курса врачи регулярно контролируют уровни кальция и фосфора в крови.
У детей почечная недостаточность зачастую сопровождается белково-энергетическим голоданием, поэтому важно обеспечить адекватное по калорийности и сбалансированности питание. При ХПН четко регламентируют содержание белка и соли в диете. Если пациент находится в тяжелом состоянии, потребности в основных питательных веществах и энергии восполняются растворами глюкозы, специальными препаратами для парентерального питания.
В тяжелых случаях ОПН и терминальном периоде ХПН рекомендована заместительная почечная терапия. У новорожденных и младенцев чаще выполняется перитонеальный диализ, детям постарше преимущественно назначают классический гемодиализ. Показаниями к неотложному началу диализной терапии служат длительная олигоанурия, резкое повышение мочевины и креатинина, уремическая энцефалопатия.
Прогноз и профилактика
При ОПН вероятность полного выздоровления высока при раннем начале терапии. При ХПН прогноз менее благоприятный, поскольку гибель нефронов у детей необратима, но методы современной нефрологии замедляют прогрессирование болезни и улучшают качество жизни ребенка. Для профилактики почечной недостаточности необходимо выявлять и лечить заболевания мочевыделительной системы, проводить медико-генетическое консультирование и антенатальную охрану плода.
1. Эпидемиология острого почечного повреждения у детей/ А.Л. Музуров// Российский вестник детской хирургии, анестезиологии и реаниматологии. — 2017.
2. Особенности хронической почечной недостаточности у детей/ Т.И. Раздолькина // Трудный пациент. — 2013.
3. Причины и лечение острой почечной недостаточности у детей/ О.И. Андриянова, К.Ф. Манеров, Ю.А. Чурляев, И.Г. Хамин// Общая реаниматология. — 2007.
4. Выбор метода заместительной почечной терапии при острой почечной недостаточности у детей/ Д.В. Зверев, А.И. Макулова, В.И. Лифшиц, Х.М. Эмирова// Педиатрия. — 2007.
Для этого патологического состояния характерен комплекс симптомов, возникающих на фоне полной или частичной неспособности почек осуществлять выделительную функцию.

Родителям важно владеть информацией о признаках, указывающих на развитие синдрома у ребенка.
Организм не может функционировать в условиях постоянного накопления отходов обмена веществ и токсинов. Он также не в состоянии поддерживать кислотно-щелочной и водно-солевой баланс. Патология требует скорейшей медицинской помощи, в противном случае есть риск летального исхода.
Стать поводом для беспокойства и обращения к врачу должны следующие патологические проявления:
- уменьшение объема диуреза (мочи, которая выводится из организма);
- выраженные отеки на лице и в области конечностей;
- общие и функциональные расстройства, схожие с состоянием отравления: вялость, утомляемость, головная боль, диарея, рвота;
- высокая температура;
- появление желтушного оттенка кожи.
При обращении к врачу и проведении диагностики выявляются изменение в показателях анализов:
- протеинурия (наличие белков в моче);
- признаки мочекаменной болезни на различных стадиях (песок или конкременты в почках).
Развитие нефротического синдрома, характеризующегося отеками, значительным количеством протеина в моче и понижением его в крови сопровождает почечную недостаточность у детей, но практически не встречается у взрослых.
Почечная недостаточность в острой форме у детей
![почечна недостаточность]()
Сопровождается интоксикацией организма отходами метаболизма, которые не могут выводиться с мочой вследствие почечной дисфункции.
Симптоматика данной формы развивается быстро. На протяжении нескольких дней появляется симптомы, напоминающие отравление – ребенок становится вялым, возникает тошнота, иногда рвота.
Подобные проявления связаны с интоксикацией азотистыми метаболитами (уремией) и расстройством водно-электролитного баланса.
Однако, после этого может последовать рецидив – возвращение патологической симптоматики.
Признаки острой почечной недостаточности требуют немедленного обращения к врачу и госпитализации в стационар!
Почечная недостаточность в хронической форме у детей
Может развиваться как итог протекания острой формы, быть следствием хронических инфекций мочевыделительных органов. В ряде случае причиной становится отягощенный наследственный фактор.
Патологически изменения происходят в течение длительного промежутка времени и грозят полной утратой функции почек.
В клинической медицине выделяют четыре стали заболевания:
- латентную (не сопровождающуюся выраженными симптомами);
- азотемическая – стадия, характеризующая клиническими проявлениями как общими (интоксикация) так и касающимися отдельных систем организма (пищеварительная, нервная, сердечно-сосудистая);
- декомпенсационная – добавляются местные воспаления и отеки;
- терминальная – единственным вариантов для пациента в этом случае будет пересадка почки либо гемодиализ.
Если у ребенка появились незначительные отклонения в работе почек или процессе мочеиспускания, следует немедленно обратиться к педиатру для получения рекомендаций. При необходимости врач даст направление на осмотр узким специалистом.
Почечная недостаточность – терапевтические меры
Главными целями в лечении острой почечной недостаточности выступают мероприятия по очищению организма от накопившихся в нем токсических веществ и восстановление нормального кровотока в тканях органа. Для этого применяют препараты различных групп: диуретики, противошоковые лекарственные средства, а также сосудорасширяющие и уменьшающие вязкость крови медикаменты.
Для детей старшего возраста (начиная с 10 лет) возможно применения сеансов плазмофореза (процедуры очистки крови, происходящей вне тела пациента).
Для устранения имеющейся и снижения риска возникновения вторичной инфекции в терапию почечной недостаточности включают антибактериальные препараты. Введение калия, глюкозы и электролитных смесей может выступать в качестве поддерживающей меры.
Хроническая почечная недостаточность требует комплексного лечения, как поврежденной почки, так и исходного сопутствующей патологии.
Если имеет место вторая или более поздние стадии и наблюдается интоксикация, то будут назначены сеансы гемодиализа. Из медикаментозных средств следует выделить:
- антациды в качестве симптоматической терапии;
- витаминные и минеральные добавки (витамин D, кальций, витамины группы B);
- препараты железа – при развитии анемии;
- препараты, понижающие уровень фосфора;
- гипотензивные средства (если ХПН сопровождается гипертонией); – с целью нормализации вывода мочи.
На поздних стадиях и при тяжелом течении заболевания единственным выходом может стать пересадка донорской почки.
Рецепты народной медицины для здоровья почек

Здесь стоит привести несколько популярных методик приготовления натуральных лекарственных средств:
- общеукрепляющий напиток. Потребуется смешать в равных долях веточки малины, раздробленные ягоды шиповника и мелко порубленные листья черной смородины. Теперь 1 столовую ложку этой смеси залить кипятком (около 500 мл). Это средство ребенку надлежит принимать ежедневно небольшими порциями;
- свежий гранатовый сок. Этот напиток способствует стабилизации водно-солевого баланса. Ребенку сок предпочтительнее принимать в разбавленном водой виде. Регулярное употребление сока в течение двух месяцев станет и общеукрепляющей мерой;
- отвар из кожицы граната и плодов шиповника. Оба ингредиента следует измельчить и смешать в равных долях. Затем залить кипятком и варить в течение 5 минут. Дать отвару остыть и процедить. Можно ускорить процесс приготовления, заменив кипячение настаиванием в закрытом термосе. Пить полученное природное лекарство нужно небольшими порциями в течение дня.
Сбои в функционировании почек – это серьезное нарушение, способное привести к летальному исходу или необходимости трансплантации. Однако, намного более опасна тенденция игнорировать имеющиеся у ребенка симптомы. Следует помнить, что своевременное обращение к врачу может обеспечить диагностику, лечение и минимум последствий для организма малыша. Важным является и выполнение рекомендаций педиатра при лечении острых инфекции детской мочеполовой сферы, которые часто становятся причиной почечной недостаточности.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Нефрит – это группа заболеваний почек воспалительной природы. У детей бывает двух основных форм: наследственный и приобретенный.
Воспалительный процесс обычно возникает в обеих почках ребенка, распространяется на чашечно-лоханочную систему, почечные клубочки и канальца. Такой недуг может появляться даже у новорожденных, в медицине сейчас нет единого мнения о том, каков механизм зарождения и развития недуга. Острый тубулоинтерстициальный нефрит обычно провоцируется у детей наследственной предрасположенностью, сопровождается инфекцией и аллергией. Источник:
Н.И. Хлебовец
Тубулоинтерстициальный нефрит у детей
// Журнал Гродненского государственного университета, 2014, №1, с.94-97
Основные причины недуга в детском возрасте:
- различные болезни матери в период беременности;
- сахарный диабет;
- онкология;
- аутоиммунные процессы;
- миелома;
- васкулит;
- острые инфекции;
- тромбоз;
- поражение организма солями тяжелых металлов;
- самолечение лекарственными препаратами без контроля специалиста (особенно опасно применение антибиотиков без соответствующего назначения);
- реакции на вакцины;
- переохлаждение;
- туберкулез.
Симптоматика заболевания
Симптомы обычно одинаковы, вне зависимости от причины поражения почек, а также сходны для детей любого возраста – от новорожденных до подростков:
- отеки;
- сниженный аппетит;
- общая слабость;
- ощущение сухости во рту;
- озноб;
- покраснение кожи;
- сухость кожи, волос, ногтей;
- головная боль;
- болезненность в зоне поясницы;
- судороги;
- малый объем суточной мочи;
- вздутие живота;
- рвота и другие расстройства ЖКТ.
Если болезнь протекает длительно, то происходит гибель большого числа почечных клубочков. В результате этого формируется почечная недостаточность.
Для хронической формы недуга характерны:
- интенсивная потливость, увеличивающаяся ночью;
- сниженный аппетит;
- желтый оттенок кожи;
- частые позывы к мочеиспусканию;
- боль во время мочеиспускания;
- мутная моча.
Классификация нефритов
Воспалительный процесс в чашечно-лоханочной системе. Имеет бактериальную природу, провоцируется кишечной палочкой, стафилококком и рядом других возбудителей.
Негативному воздействию подвергаются почечные клубочки. Может быть трех форм: острым, подострым и хроническим. Характеризуется отечностью, кровью в моче, повышенным АД. Источник:
Lechon FC, Espi MT, Abal RP, Peiro JLE
Acute glomerulonephritis associated with pneumonia: review of three cases.
Ped. Nephrol. 2010; 25: 161-164
Поражение почечных тканей и канальцев. Причинами служат вирусы, бесконтрольный прием мочегонных лекарств и антибиотиков.
Поражение интерстициальной ткани почек и канальцев, асептическое воспаление тканей. В процесс вовлекается лимфоток, кровеносные сосуды.
Причиной служит красная волчанка, провоцирующая воспаление не только в почках. Источник:
Г.А. Маковецкая, Л.И. Мазур, В.Н. Баринов, Е.А. Баранникова, Е.М. Ромаданова, П.В. Моринец
Волчаночный нефрит у детей: манифестация, диагностика, лечение
// Российский вестник перинатологии и педиатрии, 2017, №62(4), с.185-186
Стрептококковая инфекция у новорожденного, поражение ткани почек.
Провоцируется ионизирующим излучением, в результате чего нарушается функция почечных канальцев. При хронической форме развивается почечная недостаточность либо артериальная гипертензия.
В начале развития симптоматика почти полностью отсутствует. По мере течения болезни может понижаться слух и зрение, проявляться необычная утомляемость, нередко бледнеют кожные покровы.
Диагностика недуга
Определение вида и степени тяжести нефрита заключается в сборе анамнеза, в том числе семейного, а также проведении следующих исследований:
- биохимический и клинический анализы крови;
- общий анализ мочи и исследование по Нечипоренко;
- УЗИ.
Методы лечения заболевания
Важно! Лечение должен проводить только врач, строго контролирующий ход терапии. Запрещено самостоятельно пытаться вылечить ребенка, применять народные средства и ориентироваться на опыт других родителей.
После установления диагноза врач назначает ребенку специальную диету. Ребенок обязательно должен соблюдать постельный режим, не подвергаться нагрузкам и стрессам.
Проводится медикаментозная терапия с применением витаминных комплексов, антибиотиков. Она может корректироваться при отсутствии ожидаемого эффекта. Длительность медикаментозного лечения обычно большая – до полутора месяцев.
Иногда (при наличии токсинов в плазме крови) проводят плазмоферез и гемосорбцию (очистку крови).
Любая терапия подразумевает участие специалиста, регулярные анализы для контроля хода лечения. Когда окончен основной курс, нередко детей направляют в санатории, рекомендуют физиотерапию.
Нужна ли операция?
В ряде случаев причина нефрита может быть устранена только хирургически. Это нужно при локальных опухолях, перекрутах мочеточников, неправильном строении органов мочевыводящей системы, мочекаменной болезни. Редко проводится радикальная операция по удалению почки – в случаях, когда воспаление провоцирует другие тяжелые болезни.
Методы профилактики детского нефрита
Родителям следует знать, что недопустимо самостоятельное назначение профилактических препаратов. Даже после обследования делать это должен только врач.
В рамках профилактики важно следить за образом жизни ребенка, своевременно выявлять тревожную симптоматику, проводить диспансеризацию по данному профилю. Детям, находящимся в группе риска, рекомендуется лечебная физкультура, закаливания, умеренная физическая нагрузка, соблюдение определенной диеты (получите консультацию врача для ее составления).
В нашем медицинском центре работают одни из лучших специалистов Северной столицы: детские нефрологи, урологи, педиатры.
- Н.И. Хлебовец. Тубулоинтерстициальный нефрит у детей // Журнал Гродненского государственного университета, 2014, №1, с.94-97.
- Lechon FC, Espi MT, Abal RP, Peiro JLE. Acute glomerulonephritis associated with pneumonia: review of three cases. Ped. Nephrol. 2010; 25: 161-164.
- Г.А. Маковецкая, Л.И. Мазур, В.Н. Баринов, Е.А. Баранникова, Е.М. Ромаданова, П.В. Моринец. Волчаночный нефрит у детей: манифестация, диагностика, лечение // Российский вестник перинатологии и педиатрии, 2017, №62(4), с.185-186.
Лаврищева Юлия Владимировна
Clinic
Лаврищева Юлия Владимировна
Врач первой квалификационной категории
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Читайте также:


