Интоксикация у ребенка отек
Обновлено: 25.04.2024
Отек мозга у ребенка: причины, клиника, лечение
а) Определение и клинические проявления. Отек мозга определяется как повышение объема головного мозга вследствие увеличения содержания в нем воды. Отек является важной причиной повышения ВЧД. Тем не менее, локализованный отек не обязательно вызывает внутричерепную гипертензию, однако может привести к очаговой дисфункции.
Диагностика отека мозга может быть сложна. Клинические проявления включают признаки повышенного ВЧД, а дифференциация отека мозга от застойного полнокровия мозга, т. е. увеличения объема крови в головном мозге, может быть трудной. Повышение объема крови может быть вызвано эпилептической активностью, параличом сосудов вследствие асфиксии, травмой головы, повышением содержания СO2 в крови вследствие заболеваний легких или сердца, венозной обструкцией и эффектами препаратов, таких как нитраты, хлорпромазин и галотан.
Отек мозга может быть выявлен при визуализации. КТ может демонстрировать диффузное или локализованное небольшое ослабление сигнала в результате высокого содержания воды. На МРТ отек часто проявляется интенсивным сигналом на Т2-взвешенных спин-эхо последовательностях (Barnes et al., 1987).
Диффузионно-взвешенная МРТ и диффузионно-тензорная МРТ, позволяющие точнее изучить содержание воды и подвижность, могут дать информацию о локализации отека относительно различных клеточных компартментов и могут быть полезны при определении тактики лечения (Lu et al., 2004; Sinha et al., 2004). Отек может быть изолированной находкой, например, у пациентов с диабетическим кетоацидозом (Rosenbloom et al., 1980) или после унилатерального или фокального эпилептического статуса. Отеком часто сопровождаются другие патологические процессы, такие как опухоли и абсцессы мозга.
Клинические проявления отека мозга часто трудно отделить от проявлений причинного заболевания. Основным последствием отека мозга является уменьшение микроперфузии мозга и ишемия. По этой причине наличие отека мозга, вместе с другими нарушениями или изолированно, играет важную роль в ведении пациентов и в понимании клинической картины.
б) Типы и причины отека мозга. Отек мозга можно разделить на несколько типов в зависимости от локализации и патогенеза, причем каждый тип отека преимущественно ассоциирован с определенными причинами.
Вазогенный отек возникает вследствие повышенной проницаемости эндотелия капилляров гематоэнцефалического барьера, что приводит к экссудации богатого белками фильтрата плазмы во внеклеточную жидкость. Это тип отека вовлекает в наибольшей степени белое вещество мозга, с локальным или диффузным распространением. Вазогенный отек вызывают воспалительные процессы, такие как менингит или абсцессы; опухоли мозга; очаговые поражения, вызывающие воспалительную реакцию с помощью различных механизмов, такие как внутричерепные кровоизлияния или инфаркты; и расстройства, при которых преимущественно поражаются сосуды, такие как свинцовая энцефалопатия или гипертензивная энцефалопатия.
Отек, появляющийся через несколько часов после травмы головы, вероятно, относится к этому типу, так же как и очаговый отек после сложного парциального эпилептического статуса, хотя, в обоих случаях, причин и механизмов может быть несколько. Лечение кортикостероидами эффективно только при этом типе отека.
Цитотоксический отек может сосуществовать с вазогенным отеком. При этом типе клеточные компоненты мозга, особенно астроциты, но также нейроны и эндотелиальные клетки, подвергаются быстрому отеку в результате дисфункции мембран и ионных насосов. Последний обычно возникает вследствие дефицита энергии и может привести к смерти клеток, при которой отек становится необратимым. Самой частой причиной является гипоксия вследствие остановки сердца или вследствие любой причины гипоксически-ишемической энцефалопатии, хотя возможными причинами являются различные токсины и тяжелые инфекционные процессы, а также повышение ВЧД со снижением мозгового кровотока.
Другие механизмы включают гибель нейронов после эпилептического статуса и артериального инфаркта.
Гипоосмолярный отек развивается из-за разницы осмотического давления между низкой осмолярностью плазмы и более высокой осмолярностью глиальных клеток. Внутри астроцитов накапливается вода. Этот тип отека возникает при гипонатриемии, либо ятрогенной, либо вследствие неадекватной секреции АДГ у пациентов с сахарным диабетом при лечении кетоацидоза, и при синдроме нарушенного равновесия у пациентов, находящихся на диализе по поводу почечной недостаточности или по другим причинам.
Интерстициальный отек вызывается трансэпендимальной резорбцией СМЖ из желудочков во внеклеточное пространство у пациентов с гидроцефалией. Этот тип отека хорошо виден при КТ или МРТ, которые демонстрируют снижение аттенуации в перивентрикулярных областях, особенно вокруг передних и задних рогов.
Гидростатический отек возникает, когда повышение внутрисосудистого давления передается на капиллярное ложе вследствие недостаточного повышения сосудистого сопротивления, что приводит к выходу жидкости во внеклеточное пространство. Это происходит при нарушении сложных механизмов ауторегуляции сосудов мозга.

в) Лечение повышенного внутричерепного давления. Повышение ВЧД является одной из основных проблем при опухолях мозга и других объемных образованиях, а также при некоторых острых патологиях, таких как травма, инфекции ЦНС и ишемия. Повышенное ВЧД вызывает многие осложнения, включая смещение структур мозга и грыжу, поэтому требует раннего распознавания и лечения. В таблице ниже перечислены симптомы и признаки угрожающих жизни осложнений.
Эти проявления обычно относятся к грыже, хотя они могут быть вызваны высоким ВЧД со сниженным мозговым кровотоком, поэтому при снижении давления часто достигается регрессия симптомов.
В хронических случаях, например, при опухолях мозга, достаточным обычно является лечение причины (удаление образования). В острых ситуациях, однако, лечение причины столь же необходимо, но может быть недостаточным. Наиболее частые причины острого повышения ВЧД перечислены в таблице ниже. В таких случаях часто необходимо быстрое снижение ВЧД, что может значительно улучшить исход (см. Minns, 1991).
Целью лечения является снижение ВЧД для поддержания мозгового перфузионного давления выше 50 мм рт. ст., что гарантирует нормальную оксигенацию мозга. Мозговое перфузионное давление равно разнице между средним системным давлением и ВЧД. Следовательно, жизненно важным является поддержание системной циркуляции. ВЧД можно определить различными способами, но одиночное измерение имеет малую ценность для правильного ведения пациента. По этой причине все большее применение находит постоянный мониторинг ВЧД. Тем не менее, следует подчеркнуть, что гораздо более важным является неотложное лечение причины, например, менингита, чем постановка монитора ВЧД (Kirkham, 1991).
Когда перфузия мозга приближается к нулю, при допплеровском исследовании обычно наблюдается обратный кровоток в течение диастолы, а на ЭЭГ выявляется замедление и низкая амплитуда коррелирующие с недостатком перфузии мозга.
Лечение повышенного ВЧД, независимо от причины, включает обязательное исключение всех факторов, таких как болезненные стимулы, которые могут транзиторно повысить ВЧД. Следует ограничить кристаллоидные растворы до 60-70% от возрастной нормы и избегать гипоосмотических жидкостей. Следует быстро восстановить адекватную циркуляцию, при необходимости с помощью объемозамещающих растворов и вазопрессорных препаратов, таких как допамин (10-20 мкг/кг/мин); затем следует поддерживать кровообращение с помощью более низких доз (2 мкг/кг/мин). Следует проводить интенсивное лечение судорог, которые приводят к вторичному ухудшению.
Вероятно, целесообразно назначение маннитола (0,25-2 мг/кг в 20% растворе) болюсно в течение 10-15 минут на раннем этапе лечения. Этот препарат имеет высокую эффективность в снижении ВЧД; максимальное действие наступает в течение 30 минут, эффект длится от двух до шести часов. Длительное применение может сопровождаться рикошетной внутричерепной гипертензией и усилением вазогенного отека (Kaufmann и Cardoso, 1992), поэтому вместо регулярных доз без мониторинга, предпочительнее нерегулярное использование небольших доз (0,25 мг/кг) в ответ на острые повышения ВЧД. Некоторые авторы рекомендуют более высокие дозы (Cruz et al., 2004).

Гипервентиляция вызывает церебральную вазоконстрикцию и уменьшает объем крови в мозге, по крайней мере, в начальной стадии. Влияние длительной гипервентиляции является спорным, так как вазоконстриктивный эффект может исчезать, а гемодинамика у бессознательного пациента часто нарушена так, что уменьшение СО2 может сопровождаться повышением мозгового кровотока (Kirkham, 1991). Гипервентиляция со снижением рСО2
Стероиды эффективны главным образом при лечении перифокального отека при опухолях или абсцессах. Широко применяется дексаметазон. Препарат обычно назначается внутривенно в дозе 0,1-0,25 мг/кг массы тела в начале лечения, а затем может быть продолжен парентерально или перорально в общей дозе 0,25-0,5 мг/кг/день, разделенной на четыре приема (Han и Sun, 2002). Пульс-терапия высокими дозами может быть более эффективной.
Барбитуратная кома не показана, возможно, за исключением случаев не поддающейся лечению внутричерепной гипертензии или повышения ВЧД в связи с эпилептическим статусом. Предполагаемое протективное влияние барбитуратов на мозг не было подтверждено. Часто применяется тиопентал в дозе 3-5 мг/кг в течение 10-20 минут, с последующими инфузиями 1-2 мг/кг с интервалами один или два часа. Препарат сильно влияет на мониторинг ЭЭГ.
Некоторые врачи до сих пор применяют гипотермию, хотя ее роль является спорной.
Дренирование СМЖ рекомендуется редко, за исключением случаев псевдотумора мозга, при которых оно может выполняться повторными люмбальными пункциями. Наружное отведение СМЖ может быть эффективно у некоторых нейрохирургических пациентов, однако высокий риск инфекции ограничивает использование этого метода специализированными отделениями.
Хирургическая декомпрессия является исключительной мерой по спасению жизни с весьма ограниченными показаниями для проведения.
Пищевое отравление у ребенка – острое инфекционно-токсическое поражение, возникающее вследствие употребления в пищу недоброкачественных продуктов, содержащих болезнетворные микроорганизмы и их токсины, растительных или иных ядов. Пищевое отравление у ребенка проявляется диареей, рвотой, лихорадкой, интоксикацией, обезвоживанием. Диагностика пищевого отравления у детей предполагает выяснение эпидемиологического анамнеза; идентификацию возбудителя или токсина в крови, испражнениях, рвотных массах, пробах продуктов. Лечение пищевого отравления у детей требует незамедлительного промывания желудка или постановки очистительной клизмы, приема энтеросорбентов, регидратации.

Общие сведения
Пищевое отравление у ребенка – пищевая токсикоинфекция или интоксикация, связанная с употреблением инфицированной пищи, воды либо ядовитых (растительных, химических, лекарственных) веществ. Пищевые отравления у детей занимают ведущее место в ряду инфекционной патологии и токсикологии детского возраста и представляют серьезную проблему практической педиатрии.
Пищевое отравление у ребенка протекает гораздо тяжелее, чем у взрослых, что объясняется особенностями детского организма: низкой кислотностью желудочного сока, незаконченным формированием микрофлоры кишечника, более быстрым всасыванием яда и его распространением по всему организму, относительно низкой дезинтоксикационной способностью печени и фильтрационной функцией почек и т. д. Нередко одни и те же продукты, не вызывающие у взрослого никаких признаков отравления, служат причиной пищевого отравления у ребенка.

Классификация
У ребенка могут встречаться следующие виды пищевых отравлений:
- Инфекционные пищевые отравления, вызванные микробами и их токсинами (пищевые токсикоинфекции и пищевые токсикозы - бактериотоксикозы, ботулизм).
- Неинфекционные пищевые отравления, вызванные ядовитыми продуктами растительного, животного происхождения, ядовитыми примесями.
В клиническом течении пищевого отравления у ребенка различают 3 стадии:
Причины
Инфекционные пищевые отравления у ребенка (пищевые токсикоинфекции) могут вызываться стафилококком, протеем, клебсиеллами, клостридиями, цитробактерами, энтеротоксигенными штаммами кишечной палочки и др. Данные возбудители проникают в организм исключительно с пищей, в которой предварительно размножаются и вырабатывают токсины. Контаминации пищи и накоплению токсинов благоприятствует несоблюдение санитарно-гигиенических норм в процессе хранения, приготовления и реализации пищи. При этом продукты могут выглядеть как недоброкачественные (неприятный запах, вкус, измененный цвет, консистенция) или иметь нормальные органолептические качества.
Микробными источниками, обсеменяющими пищу, могут выступать лица, страдающие кишечными инфекциями, гнойными заболеваниями (ангинами, фурункулезом, стрептодермией, панарициями, маститом и др.), а также животные, загрязняющие своими испражнениями воду, почву, растения и другие объекты внешней среды. Пищевое отравление у ребенка может быть вызвано употреблением некипяченой воды, инфицированного молока и молочных продуктов, яиц, кондитерских изделий с кремом, рыбы и морепродуктов, колбас, мяса (говядины, свинины, кур и др.), консервов домашнего приготовления и т. д.
Пищевые отравления у детей могут протекать в виде спорадических, семейных случаев или массовых вспышек. Для них характерен подъем заболеваемости в летне-осенний период, когда имеются благоприятные условия для размножения микробных возбудителей и накопления токсинов.
Неинфекционные пищевые отравления обычно связаны со случайным употреблением ребенком ядовитых ягод (паслена, волчьей ягоды, бузины черной, вороньего глаза и др.), растений (болиголова, белены, веха ядовитого, дурмана и др.), грибов (бледной поганки, мухоморов, ложных лисичек или опят). Пищевое отравление у ребенка может возникать при употреблении в пищу сельхозпродуктов, загрязненных ядовитыми химическими примесями (фунгицидами, инсектицидами, неорганическими соединениями).
Симптомы пищевого отравления у ребенка
Клиническая картина пищевого отравления у ребенка при различных токсикоинфекциях очень похожа. Обычно латентная стадия продолжается 2-6 часов; иногда укорачивается до 30 мин. или удлиняется до 24 ч. Пищевое отравление у ребенка проявляется признаками гастроэнтерита, общеинфекционными симптомами, интоксикацией, обезвоживанием.
Начинается заболевание остро, с тошноты, многократной рвоты съеденной пищей, болей в животе (главным образом, в области желудка), водянистой диареи с примесями зелени, слизи, прожилками крови. Частота стула достигает 5-10 раз в сутки.
Течение пищевого отравления короткое; в большинстве случаев симптомы регрессируют через 2–3 дня, хотя слабость, боли в животе могут сохраняться дольше. Тяжелые формы пищевого отравления может наблюдаться у детей раннего возраста, ослабленных лиц с сопутствующим фоном (недоношенность, гипотрофия, дисбактериоз и др.). В тяжелых случаях у ребенка может развиться некротический энтерит, инфекционно-токсический или гиповолемический шок, эндокардит, сепсис.
При пищевом отравлении ядовитыми растениями у ребенка нередко поражается ЦНС, что может проявляться заторможенностью, эйфорией, галлюцинациями, нарушениями зрения, расстройствами речи, судорогами, комой. При токсическом воздействии на сердечно-сосудистую систему возникает тахикардия или брадикардия, аритмия, артериальная гипотония. Большинство растений главным образом поражает ЖКТ, что делает пищевое отравление у ребенка менее опасным.
При отравлении мухоморами возникают повышенное слюноотделение, рвота, одышка, бронхоспазм, галлюцинации, судорожный синдром. Смертность при отравлении мухоморами составляет 1%. С клинической картиной, диагностикой и лечением ботулизма можно ознакомиться здесь.
Диагностика пищевого отравления у ребенка
Пищевое отравление у ребенка может обычно диагностируется педиатром или детским инфекционистом. Постановке диагноза пищевого отравления у ребенка способствует выяснение эпидемиологического анамнеза, типичная клиническая картина, указание на групповые случаи отравления лиц, употреблявших одну и ту же пищу.
Специфические диагностические тесты включают выделение возбудителя из бактериологического посева испражнений, рвотных масс, промывных вод желудка, остатков зараженного продукта. В случае подозрения на генерализованную форму инфекции проводится бакпосев крови. При массовых вспышках пищевых токсикоинфекций в детских коллективах обследованию подлежат кухонные работники, у которых берутся мазки с рук, из носоглотки, прямой кишки. Экспресс-методы выявления возбудителя (РИФ, ИФА, ПЦР) имею вспомогательное значение.
В отдельных случаях ребенку с пищевым отравлением может потребоваться консультация детского невролога, детского гастроэнтеролога, детского хирурга. Дифференциальную диагностику пищевого отравления осуществляют с острым гастритом, острым аппендицитом, холециститом, панкреатитом, лямблиозом, ОКИ, менингитом у ребенка.
Лечение пищевого отравления у ребенка
Неотложная помощь при установлении факта пищевого отравления у ребенка состоит в промывании желудка до чистых вод и постановке очистительной клизмы для удаления токсинов из ЖКТ. С этой же целью показано назначение энтеросорбентов (активированного угля, комбинированных препаратов).
Для ликвидации обезвоживания необходимо проведение пероральной регидратации (сладкий чай, солевые растворы) при среднетяжелых формах – парентеральной регидратационной терапии солевыми растворами. При пищевом отравлении ребенку назначается заместительная терапия полиферментными препаратами с панкреатином. Противомикробная терапия ребенку с пищевым отравлением проводится только при тяжелых токсикоинфекциях под контролем врача.
Целесообразно воздержание от приема пищи в течение 12–24 часов. После прекращения рвоты ребенку рекомендуется щадящая диета (жидкие каши, слизистые супы, сухари, компоты, кефир).
При отравлении бледной поганкой ребенку требуется проведение экстренной экстракорпоральной гемокоррекции (гемосорбции).
Прогноз и профилактика пищевого отравления у ребенка
Пищевое отравление у ребенка, протекающее в легкой или средней степени тяжести обычно заканчивается полным выздоровлением. Последствиями пищевого отравления у ребенка могут являться различные нарушения функции органов и систем. Так, исходом пищевой токсикоинфекции нередко служит дисбактериоз, а отравления грибами - почечная и печеночная недостаточность. При тяжелом пищевом отравлении у ребенка может развиваться тяжелая полиорганная недостаточность, требующая проведения интенсивной терапии. При токсикоинфекциях летальность невелика (около 1%), чего нельзя сказать об отравлениях грибами.
Профилактика пищевого отравления у ребенка диктует необходимость правильного хранения и проведения адекватной термической обработки пищевых продуктов, употребления только кипяченой воды, тщательного мытья рук и продуктов питания под проточной водой. Необходимо регулярное гигиеническое обследование лиц, работающих на детских кухнях и в общепите; недопущение на пищеблок работников с гнойничковыми заболеваниями кожи (пиодермией), инфекциями дыхательных путей, кишечными инфекциями.
Необходимо знакомить детей с ядовитыми растениями и грибами, строжайшим образом запрещать им употреблять в пищу неизвестные ягоды, плоды, семена т. д.
Токсический отек легких – это острое ингаляционное поражение легких, обусловленное вдыханием химических веществ, обладающих пульмонотоксичностью. Клиническая картина разворачивается постадийно; возникает удушье, кашель, пенистая мокрота, боль в груди, одышка, резкая слабость, коллапс. Может наступить остановка дыхания и сердечной деятельности. При благоприятном сценарии токсический отек легких претерпевает обратное развитие. Диагноз подтверждается данными анамнеза, рентгенографии легких, исследования крови. Первая помощь состоит в прекращении контакта с пульмонотоксикантом, проведении кислородотерапии, введении стероидных противовоспалительных, мочегонных, онкотически активных средств, кардиотоников.
МКБ-10
Общие сведения
Токсический отек легких - тяжелое состояние, вызванное ингаляционными пульмонотропными ядами, вдыхание которых вызывает структурно-функциональные нарушения со стороны органов дыхания. Возможны случаи как единичных, так и массовых поражений. Отек легких является самой тяжелой формой токсического поражения дыхательных путей: при интоксикации легкой степени развивается острый ларинготрахеит, средней степени – бронхит и трахеобронхит, тяжелой степени - токсическая пневмония и отек легких. Токсический отек легких сопровождается высоким процентом летальности от острой сердечно-сосудистой недостаточности и сопутствующих осложнений. Изучение проблемы токсического отека легких требует координации усилий со стороны клинической пульмонологии, токсикологии, реаниматологии и других специальностей.

Причины
Развитию токсического отека легких предшествует вдыхание пульмонотоксикантов - газов и паров раздражающего (аммиака, фтористого водорода, концентрированных кислот) или удушающего действия (фосгена, дифосгена, хлора, оксидов азота, дыма от горения). В мирное время такие отравления чаще всего происходят по причине несоблюдения техники безопасности при работе с данными веществами, нарушения технологии производственных процессов, а также при техногенных авариях и катастрофах на промышленных объектах. Возможно поражение боевыми отравляющими веществами в условиях военных действий.
Патогенез
Непосредственный механизм токсического отека легких обусловлен повреждением альвеолярно-капиллярного барьера веществами-токсикантами. Вслед за первичными биохимическими изменениями в легких происходит гибель эндотелиоцитов, альвеоцитов, бронхиального эпителия и др. Повышению проницаемости капиллярных мембран способствует освобождение и образование в тканях гистамина, норадреналина, ацетилхолина, серотонина, ангиотензина I и др., нервно-рефлекторные нарушения. Альвеолы заполняются отечной жидкостью, что вызывает нарушение газообмена в легких, способствует нарастанию гипоксемии и гиперкапнии. Характерно изменение реологических свойств крови (сгущение и увеличение вязкости крови), накопление кислых продуктов метаболизма в тканях, сдвиг рН в кислую сторону. Токсическому отеку легких сопутствуют системные нарушения функции почек, печени, ЦНС.
Симптомы
В течение ближайших минут и часов после ингаляции поражающих веществ возникают явления раздражения слизистых оболочек: першение в горле, кашель, слизистые выделения из носа, резь в глазах, слезотечение. В рефлекторную стадию токсического отека легких появляются и нарастают ощущения стеснения и боли в груди, затруднение дыхания, головокружение, слабость. При некоторых отравлениях (азотной кислотой, окисью азота) могут отмечаться диспепсические расстройства. Данные нарушения не оказывают значительного влияния на самочувствие пострадавшего и вскоре стихают. Это знаменует переход начального периода токсического отека легких в скрытый.
Вторая стадия характеризуется как период мнимого благополучия и продолжается от 2-х часов до одних суток. Субъективные ощущения минимальны, однако при физикальном обследовании выявляется тахипноэ, брадикардия, снижение пульсового давления. Чем короче скрытый период, тем неблагоприятнее исход токсического отека легких. В случае тяжелого отравления данная стадия может отсутствовать.
Через несколько часов на смену периоду мнимого благополучия приходит период нарастания отека и выраженных клинических проявлений. Вновь возникает приступообразный мучительный кашель, затрудненное дыхание, одышка, появляется цианоз. Состояние пострадавшего быстро ухудшается: усиливается слабость и головная боль, нарастает боль в грудной клетке. Дыхание становится частым и поверхностным, отмечается умеренная тахикардия, артериальная гипотония. В периоде нарастания токсического отека легких появляется обильная пенистая мокрота (до 1 л и больше), иногда с примесью крови; клокочущее, слышимое на расстоянии дыхание.
Осложнения
При тяжелых формах токсического отека легких смерть может наступить в течение 24-48 часов. При своевременном начале интенсивной терапии, а также в более легких случаях патологические изменения претерпевают обратное развитие. Постепенно стихает кашель, уменьшается одышка и количество мокроты, ослабевают и исчезают хрипы. В самых благоприятных ситуациях выздоровление наступает в течение нескольких недель. Однако период разрешения может осложняться вторичным отеком легких, бактериальной пневмонией, миокардиодистрофией, тромбозами. В отдаленном периоде после стихания токсического отека легких нередко формируется токсический пневмосклероз и эмфизема легких, возможно обострение туберкулеза легких. Сравнительно часто развиваются осложнения со стороны ЦНС (астеноневротические расстройства), печени (токсический гепатит), почек (почечная недостаточность).
Диагностика
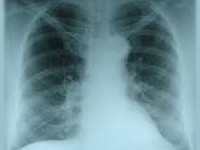
Физикальные, лабораторные и рентгеноморфологические данные меняются в зависимости от периода токсического отека легких. Объективные изменения наиболее выражены в стадии нарастания отека. В легких выслушиваются влажные мелкопузырчатые хрипы и крепитация. Рентгенография легких выявляет нечеткость легочного рисунка, расширение и нечеткость корней.
В периоде завершения отека аускультативная картина характеризуется множественными разнокалиберными влажными хрипами. Рентгенологически усиливается размытость легочного рисунка, появляются пятнистые фокусы, которые, чередуются с очагами просветления (эмфиземы). При исследовании крови обнаруживается нейтрофильный лейкоцитоз, увеличение содержания гемоглобина, усиление свертываемости, гипоксемия, гипер- или гипокапния, ацидоз.
В периоде обратного развития токсического отека легких исчезают хрипы, крупные а затем и мелкоочаговые тени, восстанавливается четкость легочного рисунка и структурность корней легких, нормализуется картина периферической крови. Для оценки поражения других органов производится ЭКГ, исследование общего анализа мочи, биохимического анализа крови, печеночных проб.
Лечение токсического отека легких
Всем пострадавшим первая помощь должна быть оказана незамедлительно. Больному необходимо обеспечить покой, назначить успокаивающие и противокашлевые средства. Для устранения гипоксии производятся ингаляции кислородно-воздушной смеси, пропущенной через пеногасители (спирт). Для уменьшения притока крови к легким применяется кровопускание или наложение венозных жгутов на конечности.
В целях борьбы с начавшимся токсическим отеком легких вводятся стероидные противовоспалительные препараты (преднизолон), мочегонные (фуросемид), бронходилататоры (аминофиллин), онкотически активные средства (альбумин, плазма), глюкозу, хлористый кальций, кардиотоники. При прогрессировании дыхательной недостаточности производится интубация трахеи и ИВЛ. Для профилактики пневмонии назначаются антибиотики в обычных дозировках, в целях предупреждения тромбоэмболических осложнений используются антикоагулянты. Общая продолжительность лечения может занимать от 2-3 недель до 1,5 месяцев. Прогноз зависит от причины и тяжести токсического отека легких, полноты и своевременности медицинской помощи. В острый период летальность очень высока, в отдаленные последствия нередко приводят к инвалидизации.
2. Клиническая фармакология и фармакотерапия в реальной врачебной практике: мастер-класс: учебник / Петров В. И. – 2011.
3. Фармакологическая коррекция токсического отека легких: Автореферат диссертации/ Торкунов П.А. - 2007.
Токсический синдром – это тяжелая общая реакция организма человека на внедрение микробных или пищевых токсинов. Чаще всего встречается при желудочно-кишечных заболеваниях бактериальной природы, а также может быть осложнением острых респираторных вирусных инфекций, пневмонии (воспаление легких), отита (воспаление среднего уха) и других заболеваний.
Симптомы токсического синдрома у ребенка
- Симптомы интоксикации (головная боль, тошнота, рвота, мышечная слабость, бледность кожных покровов, повышение температуры тела).
- В начале токсического синдрома превалирует кратковременный период возбуждения, затем – угнетение сознания вплоть до сопора (неполная потеря сознания), комы (полная потеря сознания).
- В начале токсического синдрома артериальное(кровяное) давление повышено, затем оно резко понижается, что проявляется холодным потом, бледностью кожных покровов, частым пульсом слабого наполнения (коллаптоидное состояние).
- Диспепсические расстройства — боли в животе, частая рвота и жидкий стул (что ведет к эксикозу (обезвоживанию)).
- Эксикоз характеризуется сухостью кожи и слизистых оболочек, чувством жажды, запавшими большим родничком и глазными яблоками, снижением тургора (упругости) кожных покровов.
- Нарушение водно-солевого баланса (в частности, снижение концентрации ионов калия в плазме крови):
- стойкая заторможенность;
- депрессия;
- мышечная гипотония (мышечная слабость);
- снижение рефлексов;
- нарушение дыхания (слабость дыхательной мускулатуры, частое, поверхностное дыхание).
Инкубационный период токсического синдрома у ребенка
Причины токсического синдрома у ребенка
- колиэнтериты (воспаление слизистой толстого и тонкого кишечника);
- вторичные токсикозы (болезненное состояние, обусловленное действием на организм экзогенных токсинов или вредных веществ эндогенного происхождения) при дизентерии (острое кишечное заболевание);
- сальмонеллез (бактериальная инфекция пищеварительной системы);
- стафилококковые энтериты (инфекционное воспаление тонкой кишки).
- непереносимость дисахаридов (наследственная или приобретенная недостаточность активности ферментов, которые расщепляют сложные сахара для их всасывания в кишечнике);
- почечный тубулярный ацидоз (наследственное или приобретенное заболевание, которое характеризуется повышенным содержанием ионов хлора в сыворотке крови; целый комплекс симптомов, включая рвоту и диспепсию (нарушение пищеварения));
- лактатацидоз (заболевание, которое характеризуется накоплением молочной кислоты (продукта энергетического обмена в мышцах) в крови, что ведет к тяжелым нарушениям в работе всех систем органов и высокому риску летального исхода);
- адреногенитальный синдром с изменением водно-солевого баланса (наследственное заболевание, которое характеризуется нарушением синтеза гормонов в надпочечниках, играющих важную роль в половом созревании и обмене веществ);
- гипоальдостеронизм (патологическое состояние, которое характеризуется недостаточной секрецией гормона альдостерона клетками коры надпочечников, что ведет к нарушению водно-солевого баланса в организме).
- пневмония (воспаление легких);
- острая респираторно-вирусная инфекция (ОРВИ);
- отиты (воспаление среднего уха), синуситы (воспаление пазух черепа, например, гайморит) и др.
LookMedBook напоминает: что данный материал размещен исключительно в ознакомительных целях и не заменяет консультацию врача!
Врач педиатр поможет при лечении заболевания
Диагностика токсического синдрома у ребенка
- Анализ анамнеза и жалоб заболевания:
- наличие сопутствующих заболеваний (инфекционных, заболеваний обмена веществ и прочих);
- время проявления симптомов токсического синдрома (тошнота, рвота, жидкий стул, боли в животе, спутанность сознания и т.п.);
- когда возникли симптомы: после или до приема пищи, через какое время;
- характер болей, частота и характер стула.
- осмотр кожи и слизистых оболочек;
- пальпация (прощупывание) живота — увеличение печени, селезенки, определение тонуса передней брюшной стенки;
- исследование условных и безусловных рефлексов, проведение простейших неврологических тестов на двигательные функции, координацию и концентрацию (выявление поражения центральной нервной системы);
- исследование шумов (аускультация) сердца и легких, измерение артериального (кровяного) давления — выявление нарушения работы других органов.
- общий анализ крови и мочи;
- биохимический анализ крови;
- серологическое исследование крови (определение возбудителя).
Лечение токсического синдрома у ребенка
- Госпитализация в стационар (в тяжелых случаях — в ОРИТ (отделение реанимации и интенсивной терапии с условиями оказания неотложной помощи и постоянным контролем сердечной деятельности, дыхания).
- Введение водного режима для профилактики обезвоживания (выпаивание каждый час небольшим количеством жидкости, внутривенное капельное введение изотонических растворов).
- Антибиотикотерапия (терапия направлена на определенного возбудителя).
- Симптоматическое лечение (гормональные препараты, сердечные гликозиды, витамины и прочее).
- Прием сорбентов внутрь (препараты, адсорбирующие (связывающие) токсины в желудочно-кишечном тракте с последующим их выведением).
- В условиях стационара: внутривенное введение физиологического раствора, мочегонных препаратов (для ускоренной фильтрации крови почками и выведения токсических веществ), гемосорбция, плазмаферез – аппаратное (внепочечное) очищение крови.
Осложнения и последствия токсического синдрома у ребенка
- При отсутствии немедленного лечения может развиться инфекционно-токсический шок – терминальное (неотложное) состояние, которое требует срочного медицинского вмешательства ввиду высокого риска летального исхода.
- При своевременном лечении выздоровление наступает через 2-3 недели.
Профилактика токсического синдрома у ребенка
- Своевременное обращение к врачу при возникновении проблем со здоровьем.
- Профилактика инфекционных заболеваний и отравлений:
- избегать контакта с инфекционными больными;
- соблюдение правил личной гигиены и гигиены питания (мыть руки, овощи и фрукты, тщательно термически обрабатывать продукты, употреблять только свежие продукты с неистекшим сроком годности).
- регулярные прогулки на свежем воздухе;
- занятия физической культурой;
- соблюдение режима дня и ночи (ночной сон не менее 10-ти часов).
ИНФОРМАЦИЯ ДЛЯ ОЗНАКОМЛЕНИЯ
Необходима консультация с врачом
Певцова Анастасия Владимировна, врач-методист, акушер-гинеколог, медицинский редактор.
Подоляк Анжелика Алексеевна, редактор.
Что делать при токсическом синдроме?
- Выбрать подходящего врача педиатр
- Сдать анализы
- Получить от врача схему лечения
- Выполнить все рекомендации
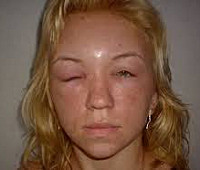
Отек Квинке у детей – это острая, внезапно развившаяся, преимущественно аллергическая реакция, сопровождающаяся выраженным отеком слизистых и подкожной клетчатки. Клинически отек Квинке у детей проявляется опуханием век, губ, всего лица, шеи, верхней половины туловища, стоп и кистей, гениталий; наиболее тяжелой формой заболевания является отек гортани. Клинико-иммунологическое обследование при отеке Квинке у детей включает сбор аллергоанамнеза, определение уровня общего и аллергенспецифических иммуноглобулинов E, исследование иммунограммы, проведение кожных аллергопроб и провокационных проб. При отеке Квинке детям назначаются антигистаминные препараты, обильное щелочное питье, энтеросорбенты; в тяжелых случаях – кислородотерапия, интубация и ИВЛ.
МКБ-10
![Отек Квинке у детей]()
Общие сведения
Отек Квинке у детей (ангионевротический отек, трофоневротический отек) - морфологическая разновидность крапивницы (гигантская крапивница), протекающая с плотным отеком дермы и подкожно-жирового слоя. В педиатрии и детской аллергологии отек Квинке диагностируется у 2% детей, чаще у девочек. Отек Квинке часто развивается у детей с аллергической крапивницей, однако может возникать и без предшествующей уртикарной сыпи. Отмечена связь отека Квинке у детей и с другими заболеваниями аллергической природы - бронхиальной астмой, поллинозом, атопическим дерматитом. В 20-25% случаев при отеке Квинке у ребенка развивается опаснейшее осложнение – отек гортани.
На основании клинических характеристик выделяют острый (до 6 недель) и хронический (свыше 6 недель) ангионевротический отек; изолированный или сочетанный с крапивницей. С учетом вероятного механизма развития отек Квинке у детей может быть аллергическим, наследственным (псевдоаллергическим), идиопатическим.
![Отек Квинке у детей]()
Причины
Аллергический отек Квинке у детей представляет собой реакцию немедленного типа. Контакт с аллергеном приводит к выбросу медиаторов из тучных клеток (гистамина, кининов, простагландинов), повышению проницаемости подкожных и подслизистых капилляров и венул с развитием массивного отека окружающих тканей.
Неаллергический отек Квинке у детей обусловлен генетической детерминированностью патологических реакций, которые наследуются по доминантному типу. В этом случае в сыворотки крови пациентов имеется сниженный уровень ингибиторов калликреина и С1-эстеразы. В таких условиях активация системы комплемента и образование С1-эстеразы приводит к расщеплению компонентов комплемента С2 и С4, что сопровождается образованием кининоподобного пептида, ответственного за развитие отека Квинке у детей.
Непосредственными причинами, приводящими к каскаду иммунопатологических реакций и развитию отека Квинке у детей, могут служить пищевые продукты (шоколад, яйца, рыба, цитрусовые, ягоды, орехи, молоко), лекарственные препараты (аспирин, витамины группы B, препараты йода, пенициллин) и другие аллергены (пыльца, пыль, укусы насекомых).
При неаллергическом отеке Квинке у детей триггерами могут выступать как аллергены, перечисленные выше, так и неспецифические причины: инфекции, интоксикации, физические факторы (холод, солнечный свет), стресс. В части случаев причина отека Квинке у детей остается неустановленной (идиопатический ангионевротический отек).
К рецидивирующему течению отека Квинке предрасполагает наличие у детей сопутствующей хронической патологии щитовидной железы (гипотиреоза), печени (гепатита), аутоиммунных, лимфопролиферативных, паразитарных заболеваний (лямблиоза, аскаридоза), хронических очагов инфекции (кариеса зубов, хронического тонзиллита).
Симптомы отека Квинке у детей
Ангиоотек у детей может развиваться в различных клинических формах: по типу отека слизистых оболочек и подкожной клетчатки, отека гортани, абдоминального синдрома, неврологических нарушений.
При поражении слизистых и подкожной клетчатки отек развивается внезапно и держится несколько часов или суток. Нарастание отека Квинке у ребенка происходит стремительно, в течение нескольких минут. Местами излюбленной локализацией отека Квинке у детей служат губы, веки, щеки, лоб, стопы, кисти, мошонка. При возникновении отека слизистой полости рта и языка у ребенка резко затрудняется речь и глотание. При осмотре зева отмечается отечность мягкого неба, глотки, маленького язычка. В случае изолированного отека миндалин картина может напоминать катаральную ангину.
Отечность тканей сопровождается небольшим давлением, напряжением и покалыванием; кожный зуд, как правило, отсутствует. Пальпация области отека Квинке у детей безболезненна, при надавливании на отечные ткани ямки не остается.
Отек Квинке, протекающий с вовлечением гортани, представляет серьезную угрозу для жизни детей. Отек гортани характеризуется молниеносным развитием. При этом из-за внезапного затруднения дыхания ребенок становится беспокойным, его лицо синеет, возникает афония. Может отмечаться кровохарканье, вызванное множественными кровоизлияниями в слизистую полости рта, глотки и гортани. Быстрое прогрессирование данной клинической формы отека Квинке может привести к асфиксии и гибели детей, если не будет выполнена срочная трахеостомия. При сочетании отека гортани с отеком трахеи и бронхов, состояние больше напоминает приступ бронхиальной астмы; при сочетании с отеком слизистой полости носа – клинику аллергического ринита.
Абдоминальный синдром при отеке Квинке у детей обусловлен поражением слизистой пищевода, желудка и кишечника. При этом отечности подкожной клетчатки может и не быть, что в значительной мере затрудняет распознавание отека Квинке у детей. Приступ развивается внезапно и характеризуется резкими болями в животе, неукротимой рвотой, профузным поносом с примесью крови.
Реже при отеке Квинке у детей поражаются мозговые оболочки и вещество мозга. В этих случаях отек Квинке протекает с эпилептиформными припадками, расстройствами зрения, гемиплегией, транзиторной афазией, головокружением, ригидностью затылочных мышц. К исключительно редким проявлениям отека Квинке у детей относятся поражения мочевых путей (дизурия, острая задержка мочи), сердца (пароксизмальная тахикардия), суставов (гидрартроз, артралгии, лихорадка).
При аллергической форме отек Квинке у детей чаще захватывает лицо, гениталии, руки, стопы, слизистые оболочки полости рта, гортани и ЖКТ; иногда сопровождается уртикарной сыпью. Неаллергический отек Квинке у детей обычно проявляется уже в раннем возрасте и протекает с тяжелыми поражениями гортани и абдоминальным синдромом.
Диагностика
При отеке Квинке в области подкожно-жировой клетчатки и видимых слизистых диагноз не вызывает сомнения. Сложности возникают при изолированном отеке мозговых оболочек и ЖКТ у детей. Существенную роль в диагностике играет аллергологический анамнез (аллергические реакции, наследственность), эффект от применения адреналина и антигистаминных препаратов, специальные методы исследования.
Абдоминальный синдром при отеке Квинке у детей необходимо дифференцировать от кишечной непроходимости, перитонита, панкреатита, аппендицита. При отеке подкожной клетчатки следует исключить контактный дерматит, лимфостаз, рожистое воспаление, периостит, синдром Мелькерсона-Розенталя. В случае преобладания неврологической симптоматики проводится дифференциальная диагностика с менингитом.
Неоднозначность трактовки диагноза отека Квинке у детей требует исключения других неотложных состояний с помощью консультаций детского невролога, детского гастроэнтеролога, детского уролога, детского ревматолога.
Лечение отека Квинке у детей
В случае диагностики отека Квинке у детей, в первую очередь, необходимо прекратить контакт с предполагаемым аллергеном. Для элиминации уже попавшего в организм аллергена ребенку необходимо дать обильное щелочное питье, энтеросорбенты (энтеросгель, активированный уголь).
Препаратами первого ряда при аллергическом отеке Квинке у детей являются антигистаминные препараты (кетотифен, клемастин, лоратадин, хлоропирамин, дифенгидрамин). Наряду с ними могут применяться системные кортикостероиды (дексаметазон, преднизолон, гидрокортизон), мочегонные средства (фуросемид, ацетазоламид). С целью снижения проницаемости сосудов назначают аскорутин.
В дальнейшем, для предотвращения возникновения повторного аллергического отека Квинке у детей может проводиться специфическая гипосенсибилизация известным аллергеном. Важным этапом лечения рецидивирующего отека Квинке у детей должно стать устранение очагов хронической инфекции, терапия хронических заболеваний ЖКТ, печени и желчных путей, дегельминтизация. При наследственном отеке Квинке детям показано введение свежей плазмы, содержащей ингибитор С1-эстеразы, ингибиторов протеаз (апротинина, аминокапроновой кислоты).
При развитии отека гортани, кроме перечисленных мероприятий, проводится ингаляционная небулайзерная терапия с адреномиметиками (сальбутамолом), кортикостероидными препаратами; кислородотерапия, гемосорбция. В случае нарастания дыхательной недостаточности необходима немедленная интубация или трахеостомия и ИВЛ.
Прогноз и профилактика
Аллергический отек Квинке у детей, как правило, имеет доброкачественное течение и благоприятный прогноз. Прогностически неблагоприятным является часто рецидивирующий отек Квинке у детей, протекающий с развитием отека гортани и внутренних органов, бронхоспазма, анафилактического шока.
Профилактика ангионевротического отека Квинке у детей требует соблюдения низкоаллергенного режима (исключения или уменьшения контакта с аллергеном), элиминационной диеты, периодического приема антигистаминных препаратов. Решение вопроса о проведении профилактической вакцинации детям, имеющим в анамнезе отек Квинке, требует индивидуального подхода и взвешенной оценки степени рисков.
2. Оказание скорой медицинской помощи при острых аллергических заболеваниях/ Балаболкин И.И., Намазова Л.С., Сидоренко И.В., Элькис И.С., Тополянский А.В., Верткин А.Л.// Русский медицинский журнал. - 2001 - №20.
3. Ангионевротический отек: принципы диагностики и терапии/ Дидковский Н.А., Зенохов С.А// Русский медицинский журнал. – 2004 – №18.
4. Дифференциальная диагностика различных форм крапивницы и отеков Квинке/ Л.А. Горячкина, Е.Ю. Борзова// АтмосферА. Пульмонология и аллергология. - 2004 - №3.
Читайте также: