Интраабдоминальных инфекциях что это такое
Обновлено: 18.04.2024
Аминогликозиды являются одними из самых часто применяющихся препаратов в клинической практике.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Аминогликозиды являются одними из самых часто применяющихся препаратов в клинической практике. Причем часто это использование ничем не обосновано. Примером классической ошибки использования этой группы препаратов является назначение их при бронхолегочной патологии, так как активность против пневмококков крайне низкая, так же как и концентрация препаратов в бронхо-легочном секрете. Поэтому аминогликозиды требуют отдельного и очень пристального рассмотрения, так как:
- Аминогликозиды обладают более мощным чем бета-лактамы бактерицидным действием, которое развивается более быстро.
- Антибактериальный эффект связан с нарушением синтеза белка на рибосомах.
- Степень бактерицидного действия зависит от их концентрации в сыворотке крови, т.е. это концентрационно-зависимые препараты. Чем выше концентрация, тем мощнее антибактериальный эффект.
- Значительно большая токсичность чем у бета-лактамы, но они редко вызывают аллергические реакции. Пациент с аллергической реакцией на аминогликозиды встречается настолько редко, что это можно считать казуистикой.
- Все аминогликозиды следует использовать исключительно и только против грамотрицательной флоры.
- Обладают общими побочными эффектами, такими как ото- и нефротоксичность.
Аминогликозиды разделены на 3 поколения исходя из их микробиологической активности и способности преодолевать приобретенную лекарственную устойчивость.
- Стрептомицин
- Неомицин
- Канамицин
- Гентамицин
- Тобрамицин
- Нетилмицин
- Нозокомиальных инфекций, вызванных аэробными грамотрицательными бактериями
- Инфекционного энодокардита используется только при лечении туберкулеза и некоторых зоонозов – самый токсичный аминогликозид и поэтому используется исключительно местно.
- Активность против синегнойной инфекции!
- Постантибиотический эффект в отношении грамотрицательных возбудителей
- Отсутствие инокулюм-эффекта (ослабление антимикробного действия в условиях высокой микробной обсемененности)
- Зависимость действия от концентрации в крови – управляемая терапия
- Синергизм с бета-лактамами
- Редкие случаи аллергии или идиосинкразии
- Возможность применения у больных с аллергией на бета-лактамы
- Высокая вариабельность фармакокинетики
- Слабое проникновение в мокроту, желчь, ликвор, внутренние среды глаза
- Снижение активности при гипоксии и ацидозе
- Высокая ото- и нефротоксичность
- Не надо лечить внебольничные пневмонии аминогликозидами. Основной возбудителем пневмонии является пневмококк, который к ним устойчив от природы. И подобная терапия является грубейшей ошибкой.
- Стрептококки, включая зеленящий, также малочувствительны к этой группе, но здесь можно использовать свойство выраженного синергизма между аминогликозидами и бета-лактамами. Главное не смешивать эти в одном шприцу
- Не смотря на то, что сальмонеллы и шигеллы in vitro чувствительны к агликозидам, для лечение шигеллеза и сальмонеллеза их применять нельзя, т.к. препараты плохо проникают внутрь клеток человека, где и локализуются эти возбудители. А потому, чтобы избежать путаницы данные микроорганизмы не следует тестировать на чувствительность к аминогликозидам вообще
Для лучшего понимания этой группы следует сказать несколько слов о фармакокинетике препаратов, чтобы внести ясность в показания для использования.
- Аминогликозиды лучше всего вводить в/м, так как после этого введения максимальная концентрация достигается через 30-60 мин. А при приеме внутрь или ректальном введении всасывается менее 1% препаратов.
- Аминогликозиды хорошо всасываются с ожоговой и раневой поверхности – поэтому применять их нужно крайне осторожно, на очень ограниченных участках и в очень малых количествах из-за риска побочных эффектов
- Кроме того аминогликозиды способны абсорбироваться из брюшной, плевральной и суставной поверхностей – отсюда такой вид введений чреват развитием токсического действия…
Отсюда получаем однозначный вывод – нельзя проводить никаких экспериментов – эту группу препаратов вводим строго в/м или если это местные формы, то используем их очень осторожно.
- Препараты плохо проходят через ГЭБ и ГОБ, в желчь.
- Концентрация в желчи составляет 30%, в ликворе на фоне воспаления 25% от концентрации в сыворотке крови.
- В бронхиальном секрете опять же нет высоких концентраций…
И это при том, что бактерицидное действие этой группы строго концентрационно-зависимое! А значит использование их при лечении инфекций в вышеуказанных областях приведет к неэффективности антибактериальной терапии.
- в тканях почек,
- перилимфе и эндолимфе внутреннего уха.
Пиковые концентрации в моче в 25-100 раз превышают концентрации в крови и отмечаются через час после введения. Выведение из кортикального слоя почек и жидкостей внутреннего уха происходит очень медленнее и период полувыведения составляет 30-100 часов! Поэтому небольшие концентрации а/гликозидов могут наблюдаться в моче до 10-20 дней после последнего введения. Кроме того, при воспалении может отмечаться накопление препаратов в полостях суставов, плевры, перикарда и брюшины!
4. Аминогликозиды не метаболизируются в печени и выводятся почками в неизмененном состоянии путем клубочковой фильтрации. При нормальной функции почек Т1/2 составляет 1,3-3,5 часа, а вот при почечной недостаточности увеличивается в 30-40 раз. При лихорадке же наоборот укорачиваться.
Как уже стало понятно амигликозиды более токсичны, чем бета-лактамы и всегда, применяя их, мы должны помнить о риске ото- и нефротоксичности, а также о риске нервно-мышечной блокады.
- Использование высоких доз аминогликозидов
- Длительное применение (более 7-10 дней)
- Короткий интервал между курсами аминогликозидов
- Короткий интервал между курсами аминогликозидов
- Неконтролируемое введение в брюшную или плевральную полость
- Сопутствующее применениедругих ототоксичных или нефротоксичных препаратов
- Сопутствующее или предшествующее введение миорелаксантов
- Пожилой возраст
- Гипокалиемию
- Гипотензию
- Септический шок
- Дегидротацию
- Анемию
- Заболевание почек
- Вестибулопатию
- Ботулизм
- Миастению
- Паркинсонизм
Ототоксичность может проявляться в виде вестибуло- и/или кохлеатоксичности и развивается в следствие повреждения 7 пары ЧМН
Нефротоксичность (при применении аминогликозидов более 7 дней встречается у четверти пациентов) проявляется в виде поражения эпителия проксимальных канальцев вплоть до тубулярного некроза и проявляется замедлением клубочковой фильтрации с формированием неолигурической почечной недостаточности.
- Повторные клинические анализы мочи
- Определение клиренса креатинина каждые 3 дня (при снижении показателя на 50% – отмена препарата)
- не превышать максимальные суточные дозы
- контролировать функцию почек до назначения аминогликозидов и затем каждые 2-3 дня, путем расчета клиренса креатинина
- максимальная продолжительность терапии 7 дней (исключение, когда польза превышает потенциальный риск: бак эндокардит – 14, и туберкулез – 2 месяца)
- нельзя назначать одновременно 2 аминогликозида, или заменять один другим после 7-ми дневного курса лечения
- повторный курс может быть не ранее чем через 4-6 недель (когда препарат уж окончательно будет выведен из организма)
- контролировать слух и вестибулярный аппарат.
1. Тяжелые инфекции различной локализации (2-е и 3-е поколение в сочетании с бета-лактамами, гликопептидами или антианаэробными, в зависимости от предполагаемых возбудителей):
- Нозокомиальная пневмония (включая вентилятор-ассоциированную)
- Пиелонефрит
- Интраабдоминальные инфекции
- Инфекции органов малого таза
- Диабетическая стопа
- Послеоперационный или посттравматический остеомиелит
- Послеоперационный или посттравматический менингит
- Сепсис
А для того, чтобы максимально избежать вышеописанных побочных реакций необходимо использовать следующие правила дозирования аминогликозидов:
1. Расчет должен проводится строго на килограмм массы тела и детям и взрослым! Самые распространенные препараты используются в следующих дозировках:
2. Дозу можно ввести либо в два либо в одно введение, но лучше это сделать в одно введение, потому что:
- Гарантированно высокая максимальная концентрация обеспечит максимальный эффект (бактерицидное действие относится к концентрационно-зависимым)
- Меньшая или одинаковая токсичность
- Более удобно и для больного, и для персонала
- Более экономично
3. При превышении идеальной массы тела на 25% и более дозу нужно снижать на 25% (так как препараты не накапливаются в жировой ткани, а распределяются в сосудистом русле и внеклеточной жидкости)
4. У пожилых дозу необходимо снижать, так как у них имеется возрастное снижение клубочковой фильтрации
- Сначала мы рассчитаем клиренс эндогенного креатинина (КК) до введения по формуле:
- Затем повторяем эту процедуру через 2-3 дня после введения.
- Если КК падает на 25% – это говорит о нефротоксическом действии, если на 50% – препарат нужно немедленно отменять.
С.В. ЯКОВЛЕВ, кандидат медицинских наук, старший научный сотрудник кафедры внутренних болезней № 4 лечебного факультета. ЭТИОЛОГИЯ, КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И ПОДХОДЫ К АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Инфекции являются наиболее частым осложнением у пациентов, находящихся в отделениях интенсивной терапии (ОИТ) и ведущей причиной летальности у этих больных. Частота развития инфекционных осложнений существенно возрастает при увеличении сроков пребывания больного в ОИТ. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов, результаты лечения инфекций остаются неудовлетворительными.
Сложности лечения бактериальных инфекций в ОИТ определяются многими факторами, среди которых следует отметить тяжесть состояния больных, как правило полимикробный характер инфекции, частое выделение так называемых проблемных микроорганизмов, высокий уровень резистентности микробов к традиционным антибиотикам, быстрое развитие устойчивости микробов в процессе лечения, частые рецидивы инфекции во время и после окончания антибактериальной терапии. Кроме того, необоснованное, бессистемное применение антибактериальных препаратов ведет к быстрой селекции и распространению по больнице устойчивых штаммов микроорганизмов.
В связи с тяжестью состояния больных и опасностью для них инфекционных осложнений антибактериальную терапию следует начинать неотложно при первых признаках инфекции, не дожидаясь результатов бактериологического исследования, так как промедление с назначением антибиотика у этих больных может иметь фатальные последствия. В таких случаях обычно назначают комбинацию двух или более антибактериальных средств, чтобы охватить максимально возможный спектр потенциальных возбудителей.
Среди факторов, способствующих развитию инфекции у больных в ОИТ, следует выделить:
основное заболевание
тяжесть состояния больного (АРАСНЕ II > 20)
возраст старше 60 лет
диагностические и лечебные инвазивные процедуры (интубация, ИВЛ, катетеризация мочевого пузыря, катетеризация центральных и периферических вен)
использование антацидов и Н2-блокаторов
длительность нахождения в ОИТ
бессистемное или широкое профилактическое использование антибиотиков.
Источником инфекции является либо сам пациент (эндогенная инфекция в результате орофарингеальной колонизации или аспирации), либо экзогенный источник (дыхательная аппаратура, катетеры, медицинский персонал, другие больные).
Распределение инфекций в ОИТ отличается от других отделений. В отделениях общего профиля превалируют инфекции мочевыводящих путей и раневая инфекция, в то время как в ОИТ наиболее частой является инфекция нижних дыхательных путей (45%), и прежде всего пневмония (около 30%). Сходные данные о преобладании в ОИТ инфекций нижних дыхательных путей получены 29 апреля 1992 года в ходе многоцентрового исследования, проведенного в 1417 отделениях интенсивной терапии в 17 странах Европы - EPIC Study (Evropean Prevalence of Infection in Intensive Care). Примерно с одинаковой частотой (10-15%) в ОИТ встречаются инфекции других локализаций (мочевыводящих путей, интраабдоминальная, кожи и мягких тканей).
Наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам.
Наиболее частыми возбудителями инфекций в реанимации, по данным EPIC Study, являются различные стафилококки (Staphylococcus aureus - 30%, Staphylococcus spp. - 19%) и P. aeruginosa (29%). Частыми патогенами являются также другие грамотрицательные бактерии, прежде всего Escherichia coli (13%), Acinetobacter spp. (9%), Klebsiella spp. (8%), Enterobacter spp. (7%), Proteus spp. (6%). Среди грамположительных микроорганизмов большое значение имеют также Enterococcus spp. (12%) и Streptococcus spp. (7%). Возбудители различных инфекций в отделениях общего профиля и в отделениях реанимации во многих случаях существенно различаются. В ОИТ преобладают так называемые проблемные микроорганизмы, к которым относятся прежде всего S. aureus и коагулазонегативные стафилококки, энтерококки, некоторые грамотрицательные энтеробактерии (Enterobacter cloaceae, Serratia spp., Proteus vulgaris, Klebsiella spp.), неферментирующие грамотрицательные палочки (P. aeruginosa и Pseuctomonas spp., Acinetobacter spp., Stenotrophomonas, maltophilia), а также некоторые анаэробы (Bacteroides fragilis). Эти микроорганизмы, как правило, характеризуются устойчивостью ко многим антибактериальным средствам.
Большинство штаммов S. aureus (85-95%) продуцирует пенициллиназу и устойчиво к бензилпенициллину и пенициллинам широкого спектра, но чувствительно к оксациллину и цефалоспоринам. Частота метициллинрезистентных штаммов S. aureus варьирует в различных регионах и в ОИТ в среднем составляет от 10 до 30%. Эти штаммы стафилококка характеризуются устойчивостью к оксациллину и другим бета-лактамным антибиотикам, а также в большинстве случаев к антибактериальным средствам других классов (макролидам, аминогликозидам, фторхинолонам). Гликопептидные антибиотики (ванкомицин, тейкопланин) являются единственными средствами, сохраняющими высокую активность в отношении этих микроорганизмов.
Коагулазонегативные стафилококки (S. epiderminis, S. haemolyticus, S. hominis) в последние годы стали значительно чаще выделяться у больных в ОИТ в связи с широким использованием внутрисосудистых катетеров. Для этих стафилококков характерна продукция пенициллиназ и более частое, чем у S. aureus, развитие резистентности к метициллину.
P. aeruginosa, второй по частоте микроорганизм, вызывающий инфекции в ОИТ, характеризуется множественной резистентностью. Многие штаммы продуцируют хромосомальные цефалоспориназы, гидролизующие цефалоспорины 3-го поколения, в том числе цефтазидим. Кроме того, Р. aeruginosa может продуцировать бета-лактамазы класса ТЕМ-1, разрушающие антисинегнойные пенициллины, и плазмидные бета-лактамазы, определяющие устойчивость микроорганизма к большинству пенициллинов и цефалоспоринов.
Acinetobacter spp., как правило, проявляет устойчивость к большинству бета-лактамов, аминогликозидам и фторхинолонам. Xanthomonas maltophilia продуцирует металлоэнзимы, разрушающие все бета-лактамы, в том числе карбапенемы. Таким образом, наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам, что определяет сложности лечения этих больных.
Принципы антибактериальной терапии
Учитывая указанные сложности лечения инфекций у больных в ОИТ (тяжесть состояния пациентов, полимикробный характер инфекции, частое выделение возбудителей с множественной устойчивостью к антибактериальным средствам), для проведения адекватной и эффективной антибактериальной терапии необходимо соблюдать следующие положения:
лечение следует начинать неотложно при первых признаках инфекции или наличии лихорадки выше 38°С;
лечение должно быть обязательно программируемым и стандартизованным;
лечение, как правило, эмпирическое, по крайней мере на начальном этапе;
первичная оценка эффективности антибактериальной терапии проводится в течение 48 часов после начала лечения по уменьшению выраженности лихорадки и интоксикации;
лечение должно проводиться под строгим бактериологическим контролем (мокрота, кровь, моча);
на первом этапе предпочтительна монотерапия.
Преимущества монотерапии перед комбинированным использованием антибактериальных средств:
уменьшение риска неадекватного взаимодействия антибактериальных средств;
уменьшение риска нежелательных взаимодействий с другими лекарственными средствами;
уменьшение риска развития токсических явлений;
уменьшение времени введения лекарств;
облегчение работы медперсонала;
уменьшение использования антибиотиков и их попадания в окружающую среду;
уменьшение стоимости лечения.
Как правило, лечение больных, находящихся в ОИТ, имеет эмпирический характер, т.к. должно начинаться неотложно при первых признаках инфекции. До настоящего времени общепринятым подходом к лечению этих больных было назначение бета-лактамного антибиотика (уреидопенициллин или цефалоспорин 2-3-го поколения) в комбинации с аминогликозидом. В последние годы в клиническую практику внедрены новые антибактериальные средства с широким спектром антимикробной активности, позволяющие проводить монотерапию и избегать использования высокотоксичных аминогликозидных антибиотиков. К таким препаратам относятся некоторые цефалоспорины 3-го поколения (цефтазидим) и 4-го поколения (цефепим, цефпиром), фторхинолоны (ципрофлоксацин), защищенные пенициллины широкого спектра с антисинегнойной активностью (пиперациллин/тазобактам, тикарциллин/ клавулановая кислота) и карбапенемовые антибиотики - меропенем и имипенем.
Антибактериальный препарат, назначаемый в режиме монотерапии, должен удовлетворять определенным требованиям:
широкий спектр бактерицидного действия, включающий Staphilococcus spp., P.aeruginosa, Enterobacteriaceae;
стабильность к бета-лактамазам;
невысокий уровень резистентности бактерий, выделяемых у больных в ОИТ;
благоприятная фармакокинетика, хорошее проникновение в ткани;
удобство дозирования и применения;
хорошая переносимость в больших дозах;
хорошее соотношение стоимость-эффективность;
доказанная эффективность в контролируемых клинических исследованиях.
Программа эмпирической антибактериальной терапии инфекций в ОИТ
В кратком обзоре нет возможности подробно рассмотреть все инфекции, встречающиеся в ОИТ. Поэтому представляется целесообразным привести рекомендации по антибактериальной терапии наиболее частых и тяжелых инфекций - пневмонии и интраабдоминальных инфекций.
1. Внебольничная пневмония. Наиболее частыми возбудителями внебольничной пневмонии тяжелого течения у больных, госпитализированных в ОИТ, являются S. pneumoniae, Legionella pneumoniae, Enterobacteriaceae, реже наблюдаются S. aureus и Mycoplasma pneumoniae. Эта пневмония характеризуется быстропрогрессирующим течением и высокой летальностью: по данным British Thoracic Society, летальность может достигать 50-75%. К сожалению, на основании анамнестических данных и клинической картины не представляется возможным установить этиологию пневмонии. В то же время для уточнение возбудителя заболевания или требуется несколько дней, или необходимы специальные и дорогостоящие серологические исследования. В связи с этим выбор схем антибактериальной терапии внебольничной пневмонии тяжелого течения основан на эмпирическом подходе с учетом наиболее вероятных возбудителей.
В настоящее время стандартной схемой начальной эмпирической терапии внебольничной пневмонии в ОИТ является комбинированное применение парентерального цефалоспорина 3-го поколения (высокоактивного в отношении пневмококка и грамотрицательных энтеробактерий) и парентерального макролидного антибиотика (активного в отношении легионеллы и микоплазмы). Среди цефалоспоринов 3-го поколения предпочтительны цефтриаксон (1 г с интервалом 24 ч) или цефотаксим (1-2 г с интервалом 8 ч); к парентеральным макролидам относятся эритромицин (1 г с интервалом 6 ч), спирамицин (1,5 млн ME с интервалом 8 ч) и кларитромицин (0,5 г с интервалом 12 ч). В качестве альтернативы цефалоспоринам 3-го поколения могут быть использованы фторхинолоны (ципрофлоксацин 0,2 г с интервалом 12 ч или офлоксацин 0,2 г с интервалом 12 ч) или цефалоспорины 4-го поколения (цефепим 1 г с интервалом 12 ч или цефпиром 1 г с интервалом 12 ч). При установленной легионеллезной этиологии пневмонии к лечению добавляют рифампицин в/в 0,5 г с интервалом 12 ч.
2. Госпитальная пневмония. Является наиболее частым инфекционным осложнением в ОИТ, особенно у больных, находящихся на ИВЛ. Риск развития вентилятор-ассоциированной пневмонии (ВАЛ) значительно увеличивается при продолжительности ИВЛ более 48 ч. Наиболее важньми факторами для прогнозирования этиологии ВАП являются предшествующая антибактериальная терапия и продолжительность механической вентиляции. У больных с ранней ВАП (к ней относятся случаи пневмонии, развившейся при искусственной вентиляции менее 7 дней), не получавших предшествующей антибактериальной терапии, ведущими этиологическими агентами являются микроорганизмы, обычно колонизирующие верхние дыхательные пути и верхние отделы ЖКТ, такие, как S. pneumoniae, Н. influenzae, S. aureus, Enterobacteriaceae. Для этих микроорганизмов характерен естественный уровень антибиотикочувствительности. В этиологии поздних ВАП (развитие пневмонии при продолжительности ИВЛ свыше 7 суток) ведущую роль играют P. aeruginosa, Acinetobacter spp., S. aureus (в том числе метициллинрезистентные штаммы), Enterobacteriaceae (см. табл. 1). Практически все возбудители поздних ВАП характеризуются множественной резистентностью к антибактериальным препаратам, поскольку такие пневмонии, как правило, развиваются на фоне длительной антибактериальной терапии или профилактики.
Таблица 1
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ГОСПИТАЛЬНОЙ ПНЕВМОНИИ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Раннее начало | ||
| Enterobacteriaceae S.pneumoniae Н.influenzae S.aureus | Цефалоспорин III 1) Фторхинолон | Цефалоспорин II 2) + аминогликозид Ко-амоксиклав + аминогликозид Оксациллин + аминогликозид АСПен 3) + аминогликозид |
| 2. Позднее начало | ||
| S.pneumoniae S.aureus Enterobacteriaceae | Цефтазидим Цефалоспорин IV 4) Ципрофлоксацин Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III + аминогликозид АСПен 3) + аминогликозид Фторхинолон + аминогликозид Ванкомицин + амикацин |
2)цефуроксим, цефамандол
3)тикарциллин, пиперациллин, азлоциллин
4)цефепим, цефпиром
Начальная антибактериальная терапия ВАП основана на эмпирическом подходе, однако до назначения антибактериального препарата обязательным является забор мокроты (желательно получение материала инвазивными методами с количественной оценкой результатов) и крови для микробиологического исследования.
В качестве начальной терапии ранней ВАП может быть использована монотерапия цефалоспоринами 3-го поколения (цефтриаксон 2 г с интервалом 24 ч или цефотаксим 2 г с интервалом 6-8 ч) или фторхинолонами (ципрофлоксацин 0,2-0,4 г с интервалом 12 ч или офлоксацин 0,2-0,4 г с интервалом 12 ч). В качестве альтернативных режимов терапии применяют комбинацию аминогликозидного антибиотика с цефалоспоринами 2-го поколения, ко-амоксиклавом или антисинегнойными пенициллинами. При назначении аминогликозидов следует учитывать высокую частоту устойчивых штаммов бактерий к гентамицину; предпочтительнее использовать амикацин 7,5 мг/кг с интервалом 12 ч или нетилмицин в суточной дозе 4-6 мг/кг (в 2-3 введения).
3. Интраабдоминальные инфекции. Являются одной из наиболее частых причин сепсиса в ОИТ и характеризуются неудовлетворительным прогнозом: частота летального исхода при абдоминальном сепсисе составляет 30-60%. Фактором, определяющим тяжесть течения абдоминального сепсиса, является количественная оценка по АРАСНЕ II: при количестве баллов до начала антибактериальной терапии 20 летальность составила
Возбудителями первичного перитонита, как правило, являются грамотрицательные энтеробактерии. Наиболее часто в ОИТ наблюдается вторичный перитонит, имеющий смешанную аэробно-анаэробную этиологию (см. табл. 2).
Таблица 2
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Перитонит первичный | ||
| Е. coli Klebsiella spp. Proteus spp. Enterobacter spp. S. pneumoniae Enterococcus spp. | Цефалоспорин III 1) Цефалоспорин IV 2) Фторхинолон Пиперациллин/тазобактам Тикарциллин/клавуланат | АСПен 3) + аминогликозид АМП/СБ + аминогликозид Цефалоспорин II 4) + аминогликозид Цефокситин + аминогликозид |
| 2. Перитонит вторичный | ||
| Как правило, полимикробной этиологии: Enterobacteriaceae P. aeruginosa Enterococcus spp. Анаэробы | Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III 1) + клиндамицин Цефалоспорин IV 2) + клиндамицин Фторхинолон + метронидазол Аминогликозид + клиндамицин АСПен 3) + аминогликозид АМП/СБ + аминогликозид |
2)Цефепим, цефпиром
3)Тикарциллин, пиперациплин, азлоциллин
4)Цефуроксим, цефамандол
5)АМП/СБ - ампициллин/сульбактам
В качестве стандартной схемы начальной эмпирической терапии перитонита обычно используют комбинацию аминогликозидного антибиотика (гентамицин, тобрамицин, нетилмицин или амикацин) и препарата с антианаэробной активностью (метронидазол или клиндамицин). В качестве альтернативы могут применяться цефалоспорины 3-го поколения (цефотаксим, цефтриаксон, цефтазидим или цефоперазон) или фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин) в сочетании с антианаэробными средствами.
В последние годы в клинической практике появились антибактериальные средства, обладающие широким спектром в отношении аэробных грамположительных и грамотрицательных бактерий в сочетании с высокой антианаэробной активностью. К ним относятся защищенные антисинегнойные пенициллины (пиперациллин/тазобактам и тикарциллин/клавуланат) и карбапенемы (имипенем, меропенем). Наличие у этих препаратов аэробной и анаэробной активности позволяет применять их в режиме монотерапии при лечении тяжелых интраабдоминальных инфекций в ОИТ, в том числе при абдоминальном сепсисе. В многочисленных контролируемых исследованиях показано, что монотерапия указанными препаратами не уступает по эффективности стандартным схемам комбинированной терапии.
Полученные в зарубежных и отечественных исследованиях данные свидетельствуют о возможности проведения монотерапии тяжелых интраабдоминальных инфекций в ОИТ.
Приведенные рекомендации по антибактериальной терапии наиболее тяжелых инфекций позволяют оптимизировать лечение и улучшить прогноз больных в ОИТ. В то же время следует подчеркнуть, что представленные схемы терапии являются наиболее общими рекомендациями. Программа эмпирической антибактериальной терапии инфекций в ОИТ в конкретном медицинском учреждении должна разрабатываться и корректироваться на основании локальных данных о возбудителях и их чувствительности к антибиотикам.
ИНТРААБДОМИНАЛЬНЫЕ ИНФЕКЦИИ
Термин "интраабдоминальная инфекция" используют для обозначения широкого спектра инфекций, которые, как правило, вызываются микроорганизмами, колонизирующими ЖКТ и проникающими в другие, обычно стерильные области брюшной полости (исключение - так называемый первичный перитонит). С клинических позиций, в отношении как хирургической тактики, так и планирования программы антимикробной терапии, целесообразно выделение двух основных категорий интраабдоминальных инфекций - неосложненные и осложненные.
При неосложненных инфекциях отсутствуют признаки перитонита и выраженной системной воспалительной реакции. Они не требуют длительной антимикробной терапии после операции, назначение АМП носит в основном профилактический характер (предупреждение раневой послеоперационной инфекции).
Осложненные инфекции характеризуются той особенностью, что инфекционный процесс распространяется за пределы зоны его возникновения, вызывая развитие перитонита или формирование абсцесса в брюшной полости или забрюшинном пространстве.
Этиологическая классификация перитонита включает первичную, вторичную и третичную формы.
Первичный перитонит или "спонтанный бактериальный перитонит" - редкая форма перитонита гематогенного происхождения с инфицированием брюшины из экстраперитонеального источника.
Вторичный перитонит - наиболее частая форма осложненной интраабдоминальной инфекции, являющаяся основной причиной абдоминального сепсиса у хирургических больных. В 80% случаев причиной вторичного перитонита являются деструктивные поражения органов брюшной полости; в 20% - различные абдоминальные хирургические операции (послеоперационный перитонит).
Третичный перитонит или "перитонит без манифестирующего источника инфекции" представляет особую проблему, в отношении как диагностики, так и лечения. Эта рецидивирующая и персистирующая форма перитонита развивается при критическом состоянии пациентов, когда у них ослаблены механизмы местной и системной противоинфекционной защиты. Имеет стертые клинические проявления: характерны гипердинамические нарушения кровообращения, умеренная гипертермия, полиорганная дисфункция, отсутствие четкой локальной симптоматики внутрибрюшной инфекции. При лапаротомии источник перитонита обнаружить не удается. Эффективная антимикробная терапия при третичном перитоните затруднительна.
ОСНОВНЫЕ ВОЗБУДИТЕЛИ
Интраабдоминальные хирургические инфекции, как правило, имеют полимикробную этиологию с участием широкого спектра грамотрицательных и грамположительных анаэробных и аэробных микроорганизмов (табл. 1).
Таблица 1. Основные возбудители интраабдоминальных инфекций
| Грамотрицательные микроорганизмы | Грамположительные микроорганизмы | Анаэробы |
|---|---|---|
| E.coli | Enterococcus spp. | B.fragilis |
| Klebsiella spp. | Staphylococcus spp. | Bacteroides spp. |
| Proteus spp. | Streptococcus spp. | Fusobacterium spp. |
| Enterobacter spp. | Clostridium spp. | |
| Другие энтеробактерии | Peptococcus spp. | |
| P.aeruginosa | Peptostreptococcus spp. |
Ведущую роль играют грамотрицательные возбудители, главным образом энтеробактерии (E.coli, Proteus spp., Klebsiella spp. и др.), псевдомонады, неспорообразующие анаэробы (особенно B.fragilis). Частота выделения грамположительных микроорганизмов составляет менее 30%.
В микробиологической структуре интраабдоминальных инфекций, развивающихся в послеоперационном периоде или во время пребывания больного в стационаре, особое значение приобретают нозокомиальные штаммы КНС и энтерококков, а также Enterobacter spp., Acinetobacter spp., P.aeruginosa. Эти микроорганизмы отличаются высокой и поливалентной резистентностью к АМП.
Первичный перитонит чаще вызывается E.coli, K.pneumoniae, пневмококками, стрептококками, реже - анаэробами. Редкое выделение анаэробов при первичном перитоните обусловлено высокой концентрацией кислорода в асцитической жидкости. Часто возбудитель остается неустановленным.
В последние годы в этиологии многих интраабдоминальных инфекций, таких как перитонит, внутрибрюшные абсцессы, деструктивный панкреатит и др., значительно возросла роль грибов Candida, что необходимо учитывать при проведении антимикробной терапии.
ПРИНЦИПЫ ЛЕЧЕНИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ
При планировании и проведении антибиотикотерапии интраабдоминальных инфекций необходимо учитывать следующие основные принципы:
- антибиотикотерапия является обязательным компонентом комплексной терапии интраабдоминальной инфекции и лишь дополняет хирургическое лечение, но не заменяет его;
- антибиотикотерапия направлена на предупреждение продолжающегося после операции интраабдоминального реинфицирования и формирования экстраабдоминальных очагов инфекции (пневмония, внутрисосудистое инфицирование и т.д.);
- применяемые АМП должны быть не только активными в отношении этиологически значимых возбудителей, но и обладать адекватными фармакокинетическими характеристиками, в частности, хорошо проникать в очаг воспаления или деструкции;
- антибиотикотерапия должна проводиться с учетом потенциальных НР препаратов, а также тяжести основного и сопутствующих заболеваний;
- следует принимать во внимание фармакоэкономические аспекты антибиотикотерапии.
Абсолютными показаниями к проведению антибактериальной терапии интраабдоминальной инфекции являются:
- различные формы перитонита любой этиологии;
- деструктивный аппендицит;
- деструктивный холецистит;
- холангит;
- перфорация язвы желудка или двенадцатиперстной кишки с давностью от начала заболевания более 6 ч;
- перфорация или некроз тонкой или толстой кишки любой этиологии;
- инфицированные формы панкреонекроза.
Решающую роль для результатов комплексного лечения интраабдоминальной инфекции играет адекватная эмпирическая терапия, то есть терапия до получения результатов бактериологического исследования у конкретного пациента.
При выборе схем терапии следует соблюдать этапность лечения. Первоначально назначаются АМП с учетом точно поставленного диагноза (локализация и характер первичного очага инфекции), клинического течения заболевания, предполагаемых возбудителей их прогнозируемой чувствительности к АМП.
Первая коррекция терапии осуществляется спустя 24-36 ч после забора исследуемого материала на основании данных антибиотикограммы, повторная - на 3-4-й день по данным полного бактериологического обследования (идентификация возбудителя, уточнение антибиотикограммы).
ПРОДОЛЖИТЕЛЬНОСТЬ АНТИМИКРОБНОЙ ТЕРАПИИ
Критерии достаточности антибиотикотерапии:
- стойкое снижение температуры тела до нормальных или субнормальных цифр, сохраняющееся не менее 2 сут;
- стойкий регресс других признаков системной воспалительной реакции (тахикардия, тахипноэ, изменения лейкоцитарной формулы крови);
- положительная динамика функционального состояния ЖКТ (восстановление моторики, возможность естественного питания);
- эффективное устранение экстраабдоминальных инфекций (нозокомиальная пневмония, ангиогенная инфекция и др.).
В тяжелых случаях, например, при перитоните с абдоминальным сепсисом или при гнойно-септических осложнениях панкреонекроза, особенно при выполнении этапных санирующих релапаротомий и некрэктомий, продолжительность антимикробной терапии с неоднократными сменами режима и пути введения препаратов (ступенчатая терапия) может превышать 3-4 нед.
ПЕРФОРАЦИЯ ЯЗВЫ ЖЕЛУДКА ИЛИ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
(первые 6 ч после перфорации)
Выбор антимикробных препаратов
ПРОНИКАЮЩИЕ РАНЕНИЯ БРЮШНОЙ ПОЛОСТИ
(в первые 12 ч после травмы)
Выбор антимикробных препаратов
Альтернативные препараты: ампициллин + аминогликозиды (гентамицин, тобрамицин или нетилмицин); при повреждении толстой кишки + метронидазол.
Длительность терапии: при отсутствии факторов риска и симптомов системной воспалительной реакции - 24-48 ч.
Выбор антимикробных препаратов
Альтернативные препараты: ампициллин + аминогликозиды (гентамицин, тобрамицин или нетилмицин) + метронидазол; цефепим + метронидазол; фторхинолоны в/в (ципрофлоксацин, офлоксацин или пефлоксацин) + метронидазол.
АБСЦЕСС ПЕЧЕНИ
(бактериальной этиологии)
Выбор антимикробных препаратов
Длительность терапии: при отсутствии факторов риска и системной воспалительной реакции - 3-5 сут.
ДИВЕРТИКУЛИТ
(не требующий оперативного вмешательства)
Выбор антимикробных препаратов
Альтернативные препараты: ампициллин + аминогликозиды (гентамицин, тобрамицин или нетилмицин) + метронидазол; цефепим + метронидазол.
Парентеральное введение АМП целесообразно сочетать с пероральной селективной деконтаминацией кишечника: фторхинолоны перорально (если парентерально используют другие препараты), либо аминогликозиды + полимиксин М (если парентерально вводятся фторхинолоны).
Длительность терапии: как правило - 5-7 сут; при сохранении локальной и системной воспалительной реакции необходимо решение вопроса о тактике хирургического лечения.
ДЕСТРУКТИВНЫЙ ДИВЕРТИКУЛИТ
ОСТРЫЙ АППЕНДИЦИТ
(без перитонита)
Выбор антимикробных препаратов
Катаральный аппендицит
Длительность терапии: профилактический режим (однократное введение в/в за 30-60 мин до операции).
Деструктивный аппендицит
Альтернативные препараты: ампициллин + аминогликозиды (гентамицин, тобрамицин или нетилмицин) + метронидазол; цефоперазон/сульбактам.
Длительность терапии: до полного регресса симптомов системной воспалительной реакции (обычно 3-5 сут).
Выбор антимикробных препаратов
Первичный перитонит
При выделении грибов рода Candida: флуконазол или амфотерицин В.
Вторичный перитонит
(кроме послеоперационного)
Послеоперационный перитонит
Инфицированные формы панкреонекроза, панкреатогенный абсцесс или перитонит
Третичный перитонит
Длительность терапии: до полного регресса локальной и системной симптоматики воспалительного процесса. В некоторых случаях, в частности, при инфицированном панкреонекрозе и его осложнениях, антибиотикотерапия может продолжаться 3-4 нед.
При распространенном перитоните и гнойно-септических осложнениях панкреонекроза (инфицированный панкреонекроз, панкреатогенный абсцесс или перитонит) парентеральное введение АМП целесообразно сочетать с пероральной селективной деконтаминацией ЖКТ (см. выше).
Профилактика интраабдоминального кандидоза: при интраабдоминальном кандидозе летальность, несмотря на проведение фунгицидной терапии, может достигать 70%. Факторами риска развития внутрибрюшного и инвазивного кандидоза являются:
- несостоятельность анастомозов ЖКТ;
- деструктивный панкреатит.
При наличии любого из этих факторов имеются основания для профилактического применения флуконазола.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ ПРИ БЕРЕМЕННОСТИ
При выборе АМП у беременных женщин необходимо учитывать его безопасность для плода. Фторхинолоны противопоказаны для применения в течение всего периода беременности. Метронидазол абсолютно противопоказан в I триместре, во II и III он может использоваться по жизненным показаниям при отсутствии более безопасной альтернативы. Применение аминогликозидов возможно лишь по жизненным показаниям. С учетом минимального риска отрицательного действия на плод препаратами выбора во время беременности являются - пенициллины, цефалоспорины, карбапенемы.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ ПРИ КОРМЛЕНИИ ГРУДЬЮ
В период кормления грудью противопоказано применение фторхинолонов. Карбапенемы следует использовать только в случаях абсолютной необходимости. Применение метронидазола возможно только при переводе ребенка в период лечения матери на искусственное вскармливание.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ У ЛЮДЕЙ ПОЖИЛОГО ВОЗРАСТА
В связи с повышением риска токсического действия применение аминогликозидов и ванкомицина у людей пожилого возраста требует особой осторожности и допустимо при отсутствии более безопасной альтернативы.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ У ДЕТЕЙ
Пиперациллин/тазобактам не применяют детям в возрасте до 12 лет. Использование фторхинолонов у детей до 16 лет допустимо лишь в случаях крайней необходимости, например, при перитоните или деструктивном панкреатите с этиологически значимой ролью P.aeruginosa или полирезистентных грамотрицательных бактерий, когда отсутствуют более безопасные альтернативы. Цефепим разрешен для применения у детей с 2 мес, меропенем - с 3 мес, линезолид - с 5 лет. Все АМП назначают в соответствующих возрастных дозировках.
Абдоминальные инфекции (боли в животе) при нейтропении - диагностика, лечение
Многие симптомы интраабдоминальных инфекций необходимо дифференцировать от проявлений основной болезни (обструкция кишечника при лимфоме) или последствий цитостатической терапии (мукозиты). Среди интраабдоминальных инфекций существуют виды, встречающиеся практически исключительно у больных с опухолевыми заболеваниями: некротизирующий энтероколит и воспалительный целлюлит с вовлечением слепой кишки.
Некротизирующий энтероколит развивается в основном у больных с острыми лейкозами, имеющих длительную нейтропению и получающих антибиотики широкого спектра действия. Он может диагностироваться у пациентов с другими заболеваниями и длительной нейтропенией. Заболевание начинается возникновением острой боли в правом нижнем квадранте живота, которая в течение нескольких часов распространяется на весь живот.
Развиваются лихорадка и спутанность сознания. Как правило, причиной этого состояния является инфекция, вызванная грамотрицательными возбудителями, в частности синегнойной палочкой. При ультразвуковом исследовании брюшной полости выявляют истончение стенки кишечника и асцит.
Лечение включает поддерживающие мероприятия: гидратация, постановка назогастрального зонда. Следует скорректировать антибактериальную терапию с учетом необходимости воздействия на резистентную грамотрицательную флору. При неэффективности этих мер ставят вопрос о резекции некротизированного участка кишки. Показанием к оперативному вмешательству являются сохраняющееся кишечное кровотечение при достаточном уровне тромбоцитов, признаки перфорации кишки или развитие септического шока. Несмотря на активные лечебные мероприятия, летальность при данном осложнении составляет 30—50 %.
Достаточно редким инфекционным осложнением является развитие перитонита и бактериемии, вызванных клостридиальной инфекцией. Клинически данное состояние проявляется острой лихорадкой, тахикардией, инфильтрацией стенки кишечника, сопровождающейся крепитацией при пальпации.
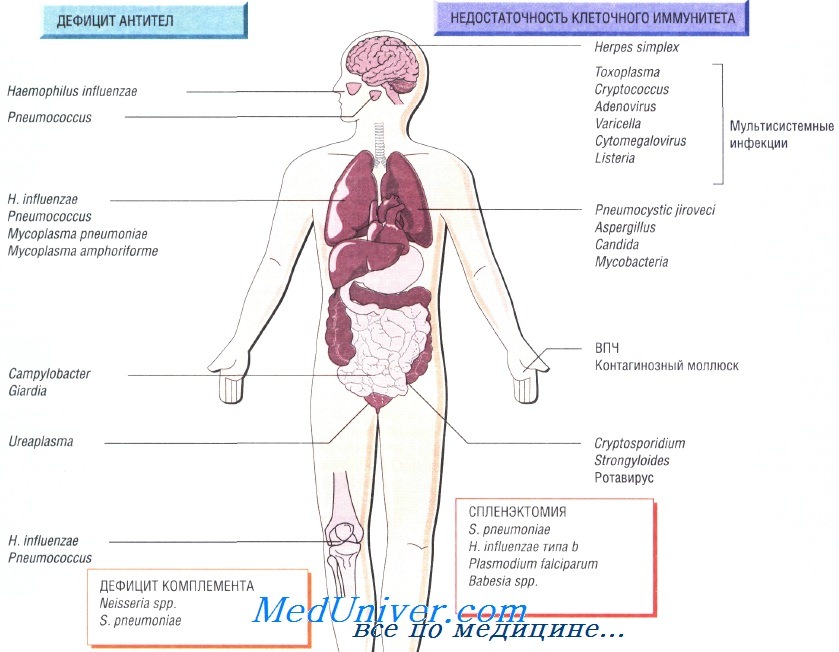
Причины инфекций при иммунодефиците
У больных, получающих клиндамицин (далацин С), ампициллин и беталактамы широкого спектра действия, нередко развивается псевдомембранозный колит. В большинстве случаев у больных при этом осложнении выделяют Clostridium difficile в фекалиях. Клиническая симптоматика во многом определяется эффектом токсина, выделяемого данным микроорганизмом. Псевдомембранозный колит часто проявляется распространенными болями в животе, лихорадкой, лейкоцитозом, водянистослизистым стулом с неприятным запахом.
Предрасполагающими к развитию псевдомембранозного колита факторами являются постхимио- и радиотерапевтический мукозит, лечение антибиотиками широкого спектра действия. При дифференциальной диагностике со сходными по симптоматике проявлениями мукозита в качестве диагностического критерия служит обнаружение клостридиального токсина в кале.
Лечение документированного клостридиального колита включает пероральное назначение ванкомицина в дозе 125 мг 4 раза в день в течение 10— 14 дней или метронидазола по 250 мг 4 раза в день в течение 10 дней. В связи с риском развития резистентности энтерококков к гликопептидам предпочтение отдается метронидазолу. У 10—20 % больных болезнь может рецидивировать, но эффективность аналогичного лечения повторно, как правило, высока.
Гепатиты могут вызываться многими инфекционными агентами, поражающими печень первично (вирусы гепатита А, В, С и частицы дельта) или вторично (вирус простого герпеса, цитомегаловирус, аденовирус, токсоплазма и др.). Вирус гепатита С выступает в качестве одной из главных причин гепатитов, передающихся при переливании продуктов крови, у больных с опухолевыми и гематологическими заболеваниями. Гепатит С клинически протекает сходно с гепатитом В, но отличается от него более продолжительным течением рецидива.
Хронизацию течения и статус хронического носительства приобретают до 50 % заболевших. В случае развития хронического гепатита С эффективным методом лечения является применение ИФН-а.
Гепатит В, также часто встречающийся у больных, получающих множественные гемотрансфузии, может протекать в острой и хронической форме. Последняя может быть хронически активной, хронически персистирующей или проявляться в виде носительства. Следует помнить, что поражение функции печени, часто встречающееся при гепатитах, может существенно сказаться на фармакокинетике некоторых химиопрепаратов, метаболизирующихся в печени, например метотрексата и доксорубицина.
У пациентов, с восстановленным нормальным гемопоэзом после химиотерапии иногда сохраняется лихорадка, сопровождающаяся признаками тяжести и болезненности в правой эпигастральной области. В этих случаях для исключения грибкового поражения печени можно проводить открытую биопсию с гистологическим исследованием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бессимптомные инфекции. Абортивная инфекция. Латентная ( скрытая ) инфекция. Инаппарантные инфекции. Дремлющие инфекции. Микробоносительство.
• Абортивная инфекция [от лат. aborto, не вынашивать, в данном контексте — не реализовывать патогенный потенциал] — одна из наиболее распространённых форм бессимптомных поражений. Такие процессы могут возникать при видовой или внутривидовой, естественной либо искусственной невосприимчивости (поэтому человек не болеет многими болезнями других животных). Механизмы невосприимчивости эффективно блокируют жизнедеятельность микроорганизмов, возбудитель не размножается в организме, инфекционный цикл возбудителя прерывается, он погибает и удаляется из макроорганизма.
• Латентная, или скрытая, инфекция [от лат. latentis, спрятанный] — ограниченный процесс с длительной и циклической циркуляцией возбудителя, аналогичной наблюдаемой при явных формах инфекционного процесса. Возбудитель размножается в организме; вызывает развитие защитных реакций, выводится из организма, но никаких клинических проявлений не наблюдают. Подобные состояния также известны как инаппарантные инфекции (от англ. inapparent, неявный, неразличимый). Так, нередко в латентной форме протекают вирусные гепатиты, полиомиелит, герпетические инфекции и т.д. Лица с латентными инфекционными поражениями представляют эпидемическую опасность для окружающих.
• Дремлющие инфекции могут быть разновидностью латентных инфекций или состояниями после перенесённого и клинически выраженного заболевания. Обычно при этом устанавливается клинически не проявляемый баланс между патогенными потенциями возбудителя и защитными системами организма. Однако под влиянием различных факторов, понижающих резистентность (стрессы, переохлаждения, нарушения питания и т.д.), микроорганизмы приобретают возможность оказывать патогенное действие. Таким образом, лица, переносящие дремлющие инфекции, — резервуар и источник патогена.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

