Инвазивная форма инфекции это
Обновлено: 24.04.2024
Симптомы грибковых болезней пазух носа и их лечение
Грибы распространены повсеместно и часто попадают в дыхательные пути, поэтому грибы в полости носа выявляют и в норме. Грибковую инфекцию делят на:
• неинвазивную (наиболее частый вид грибковой инфекции);
• инвазивную (встречается редко).
Грибы участвуют также в патогенезе эозинофильного грибкового риносинусита, для которого характерна выраженная склонность к образованию полипов и эозинофилия слизистой оболочки. По современным представлениям эозинофилы в большом количестве мигрируют в слизистую оболочку и переходят из нее в слизь, покрывающую эпителий, где они скапливаются вокруг гифов и спор грибов. При дегрануляции эозинофилов высвобождается главный основный белок, который высокотоксичен и способствует разрушению грибов. При дальнейшем вдыхании грибов этот процесс продолжается, и концентрация главного основного белка возрастает.
Неинвазивная грибковая инфекция
а) Сапрофитные формы. Грибы колонизируют слизистые корки, фрагменты нежизнеспособных тканей, инородные тела, ортопедические конструкции и шины, стенты и назогастральные зонды. Лечение состоит в удалении слизи, корок и инородных тел. Поскольку корки часто образуются на патологически измененных участках слизистой оболочки, следует исключить злокачественную трансформацию.
б) Грибковый шар. В околоносовых пазухах и их ячейках могут накапливаться грибковые массы, которые раздражают слизистую оболочку, оказывая эффект инородного тела.
Клиническая картина. Грибковый шар вызывает симптомы, напоминающие хронический синусит. Фрагменты грибкового конгломерата могут достигать полости носа, вызывая геморрагические выделения из него с неприятным запахом. Наиболее часто грибковые конгломераты образуются в верхнечелюстной и лобной пазухах.
Диагностика. При назальной эндоскопии выявляют картину хронического риносинусита. На МРТ и КТ отмечается характерное затемнение. На КТ часто выявляют обызвествление центральных участков конгломерата, связанное с отложением сульфата и фосфата кальция и металлов, которые метаболизируются грибами.
Лечение. Лечение заключается в эндоскопическом туалете пораженной околоносовой пазухи и восстановлении ее вентиляции. Грибковые массы следует полностью удалить, сохраняя при этом слизистую оболочку.
Материал, взятый из удаленных масс, отправляют на микологическое и гистологическое исследование. Антимикотическая терапия не показана.
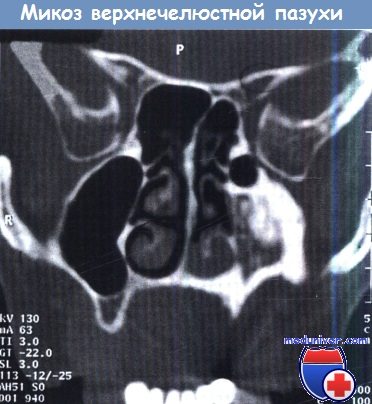
Гипоплазия левой верхнечелюстной пазухи с грибковым конгломератом
и аппозиционным разрастанием кости как реакцией на воспалительный процесс.
Инвазивные формы грибковой инфекции околоносовых пазух
а) Острая молниеносная форма. Клиническая картина. Для молниеносной формы заболевания характерны лихорадка, упадок сил и лицевая боль; позднее появляются расстройство зрения, сонливость, развивается кома.
Этиология и патогенез. Заболевание обычно наблюдается у больных, принимающих антидепрессанты, или у лиц с иммунодефицитом (например, у больных сахарным диабетом, СПИДом или при изнуряющих заболеваниях). Грибы, например Mucor spp., Absidia spp. или Aspergillus, внедряются в ткани, включая кровеносные сосуды, и могут распространиться гематогенным путем в ЦНС или глазницу.
Лечение. Пораженные ткани подлежат незамедлительному иссечению по принципам онкохирургии. Назначают длительную системную терапию амфотерицином В, кетоконазолом, итраконазолом или более современным препаратом вориконазолом. Получены доказательства эффективности итраконазола при грибковом синусите, вызванном инвазивной аспергиллезной инфекцией. Прогноз серьезный.
б) Хроническая вялотекущая гранулематозная форма. В индустриальных странах данная форма заболевания встречается редко, чаще она наблюдается в странах Северной Африки. В отличие от молниеносной формы, у больных обычно нет иммунодефицита.
Клиническая картина. Заболевание характеризуется медленно прогрессирующим течением и длится многие годы. Распространение грибов за пределы околоносовых пазух приводит к инвазии их в глазницу и отеку жировой клетчатки глазницы. Возможно распространение инфекции в подвисочную ямку, а также поражение ЧН.
Диагностика. Материал, взятый из полости носа, отправляют на микробиологическое и гистологическое исследование.
Лечение. Разросшиеся ткани подлежат иссечению. Назначают длительную противогрибковую терапию. Прогноз при таком лечении благоприятный.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гельминтоз (глистная инвазия): причины появления, симптомы, диагностика и способы лечения.
Определение
Гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями (гельминтами).
Причины появления гельминтозов
В настоящее время в России встречается более 70 видов из известных 250 гельминтов, паразитирующих в организме человека. Наиболее распространены круглые черви (аскариды, острицы, трихинеллы, власоглав), ленточные черви (свиной, бычий и карликовый цепни, широкий лентец, эхинококки), сосальщики (печеночная и кошачья двуустки).
Заражение гельминтами чаще всего происходит после попадания в организм их яиц и/или личинок. В зависимости от механизма заражения и путей передачи гельминтозы подразделяются на: геогельминтозы, биогельминтозы и контактные гельминтозы. Геогельминты развиваются без промежуточных хозяев, биогельминты - с последовательной сменой одного-двух-трех хозяев, контактные гельминты передаются контактным путем.
Свиной цепень, бычий цепень, эхинококк и другие виды червей развиваются с последовательной сменой одного-двух-трех хозяев. Промежуточными хозяевами могут быть рыбы, моллюски, ракообразные, насекомые. Человек заражается этими гельминтами, употребляя в пищу продукты, не прошедшие полноценную термическую обработку:
- мясо говядины, инфицированную финнами (личинками) бычьего цепня;
- свинину, пораженную финнами свиного цепня;
- малосоленую и сырую рыбу с личинками описторхиса или широкого лентеца;
- сырую воду или обработанные этой водой овощи, фрукты.
Контактным путем - то есть при личном контакте здорового человека с зараженным, при пользовании общей посудой, предметами туалета, бельем, при вдыхании пыли в помещении, где находится зараженный человек - передаются энтеробиоз (возбудитель – острица) и гименолепидоз (возбудитель – карликовый цепень). В случае энтеробиоза часто случается самозаражение.
Гельминты определенного вида паразитируют в определенных органах, вызывая различные гельминтозы:
- в толстой кишке - свиной, бычий, карликовый цепни, нематоды (анкилостомы, аскариды, стронгилоиды), острицы, власоглав. Из просвета кишки личинки свиного цепня могут попадать в кровоток и распространяться по организму, оседая в жировой клетчатке, сосудах мышц, камерах глаза, мозге;
- в печени и желчных путях - трематоды (описторхис, клонорхис, фасциола). В печени первично располагаются эхинококковые кисты, а после их разрыва дочерние пузыри можно обнаружить в брыжейке, листках брюшины, селезенке и других органах;
- в органах дыхания - эхинококки, альвеококки, легочные сосальщики, вызывающие парагонимоз;
- в нервной системе - шистосомозы, парагонимоз, эхинококкоз и альвеококкоз;
- в органах зрения - онкоцеркоз, лоаоз, осложненные формы тениоза;
- в органах кровообращения - некатороз, шистосомозы, дифиллоботриоз;
- в лимфатической системе - филяриатозы, трихинеллез;
- в коже и подкожной клетчатке - анкилостомидоз, онкоцеркоз, лоаоз, личиночная стадия шистосомозов;
- в костной системе - эхинококкоз;
- в скелетной мускулатуре - трихинеллез, цистицеркоз мышечной ткани.
Срок жизни гельминтов в организме окончательного хозяина может быть различным, зависит от вида паразита и колеблется от нескольких недель (острицы) до нескольких лет (цепни) и десятилетий (фасциолы).
Классификация заболевания
У человека паразитируют черви двух видов:
- Nemathelminthes – круглые черви, класс Nematoda;
- Plathelminthes – плоские черви, которые включают в себя классы
- Cestoidea – ленточных червей,
- Trematoda – класс сосальщиков.
- биогельминтозы;
- геогельминтозы;
- контактные гельминтозы.
На организм человека гельминты оказывают различное воздействие:
- антигенное воздействие, когда развиваются местные и общие аллергические реакции;
- токсическое действие (продукты жизнедеятельности гельминтов вызывают недомогание, слабость, диспепсические явления);
- травмирующее действие (при фиксации паразитов к стенке кишечника происходит нарушение кровоснабжения с некрозом и последующей атрофией слизистой оболочки; могут нарушаться процессы всасывания; механическое сдавление тканей гельминтами);
- вторичное воспаление в результате проникновение бактерий вслед за мигрирующими личинками гельминтов;
- нарушение обменных процессов;
- в результате поглощения крови некоторыми гельминтами возникает анемия;
- нервно-рефлекторное влияние - раздражение гельминтами нервных окончаний провоцирует бронхоспазм, дисфункцию кишечника и т.д.;
- психогенное действие, проявляющееся невротическими состояниями, нарушением сна;
- иммуносупрессивное действие.
Для гельминтозов характерна стадийность развития. Каждая стадия характеризуется своими клиническими симптомами.
Жалобы пациентов в острой стадии:
- повышение температуры от нескольких дней до двух месяцев (субфебрильная или выше 38ºС, сопровождающаяся ознобом, резкой слабостью и потливостью);
- зудящие рецидивирующие высыпания на коже;
- локальные или генерализованные отеки;
- увеличение регионарных лимфатических узлов;
- боли в мышцах и суставах;
- кашель, приступы удушья, боль в грудной клетке, длительные катаральные явления, бронхит, трахеит, симптомы, симулирующие пневмонию, астматический синдром, кровохарканье;
- боль в животе, тошнота, рвота, расстройства стула.
Для кишечных гельминтозов характерны следующие синдромы:
- диспепсический (дискомфорт в животе, чувство переполнения после еды, раннее насыщение, вздутие живота, тошнота);
- болевой;
- астеноневротический (чувство сильной усталости, повышенная нервная возбудимость и раздражительность).
Кишечные цестодозы (тениаринхоз, дифиллоботриоз, гименолепидоз, тениоз и другие) протекают бессимптомно или с малым количеством симптомов (с явлениями диспепсии, болевым синдромом, анемией).
Трематодозы печени (фасциолез, описторхоз, клонорхоз) вызывают:
- хронический панкреатит;
- гепатит;
- холецистохолангит;
- неврологические нарушения.
Мочеполовой шистомоз проявляется появлением в самом конце мочеиспускания крови, частыми позывами к мочеиспусканию, болью во время мочеиспускания.
Альвеококкоз, цистицеркоз, эхинококкоз могут длительное время протекать бессимптомно. На позднем этапе нагноение или разрыв кист, содержащих паразитов, приводит к анафилактическому шоку, перитониту, плевриту и другим тяжелейшим последствиям.
Для заболеваний, обусловленных паразитированием мигрирующих личинок зоогельминтов, когда человек не является естественным хозяином, различают кожную и висцеральную формы. Кожная форма обусловлена проникновением под кожу человека некоторых гельминтов животных: шистосоматид водоплавающих птиц (трематоды), анкилостоматид собак и кошек, стронгилид (нематоды). При контакте человека с почвой или водой личинки гельминтов проникают в кожу. Возникает чувство жжения, покалывания или зуда в месте внедрения гельминта. Может наблюдаться кратковременная лихорадка, признаки общего недомогания. Через 1-2 недели (реже 5-6 недель) наступает выздоровление.
Висцеральная форма развивается в результате заглатывания яиц гельминтов с водой и пищевыми продуктами. В начале заболевания может быть недомогание, аллергическая экзантема (кожная сыпь). В кишечнике человека из яиц гельминтов выходят личинки, которые проникают через кишечную стенку в кровь, достигают внутренних органов, где растут и достигают 5-10 см в диаметре, сдавливают ткани и нарушают функцию органов. При расположении личинок цепней (цистицерки, ценура) в оболочках и веществе головного мозга наблюдается головная боль, признаки церебральной гипертензии, парезы и параличи, эпилептиформные судороги. Личинки также могут располагаться в спинном мозге, глазном яблоке, серозных оболочках, межмышечной соединительной ткани и др.
Исходом гельминтозов может быть полное выздоровление с ликвидацией гельминтов или развитие необратимых изменений в организме хозяина.
Диагностика гельминтоза
Диагноз гельминтоза устанавливается на основании совокупности жалоб, полученных от пациента сведений о течении болезни, данных лабораторных и инструментальных методов обследования.В острой фазе гельминтозов имеется реакция крови на присутствие гельминта в организме, поэтому рекомендованы следующие исследования:
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пневмококковая инфекция: причины появления, симптомы, диагностика и способы лечения.
Определение
Пневмококковую инфекцию вызывают пневмококки – бактерией Streptococcus pneumoniae. Причем источником инфекции может быть только человек – больной или бактерионоситель. До начала широкого применения антибиотиков пневмококк считался причиной 95% случаев пневмонии, а до появления профилактических прививок эта инфекция ежегодно уносила жизни 1,6 млн человек, из которых до 1 млн составляли дети.
И хотя успехи в борьбе с пневмококковой инфекцией можно назвать впечатляющими, по мнению специалистов ВОЗ, до сих пор до 35% случаев внебольничной пневмонии в мире обусловлено S. pneumoniae, а в развивающихся странах пневмококк каждый год убивает почти полмиллиона детей младше пяти лет.
Распространенность пневмококковой инфекции составляет от 10 до 100 случаев на 100 тысяч населения в год.
Причины возникновения пневмококковой инфекции
Известно 96 серотипов (разновидностей) пневмококка, различающихся по способности вызывать заболевание, однако около 90% инфекций вызывают бактерии 20-25 наиболее распространенных серотипов. В разных географических регионах за инфекцию в популяции ответственны разные серотипы, и этот так называемый серотиповой состав может меняться со временем. Основной резервуар инфекции в человеческой популяции – дети до 5 лет, которые очень часто являются бессимптомными носителями (пребывание пневмококка в носоглотке ребенка не сопровождается болезненными проявлениями). Длительность вирусоносительства колеблется от 2–3 недель до 3–4 месяцев.
Заразиться пневмококком можно от больного человека или носителя при чихании и кашле. Попадая на слизистую оболочку верхних дыхательных путей, S. pneumoniae начинает размножаться. О распространении инфекции свидетельствует развитие местных форм инфекции (отита, синусита, бронхита, пневмонии) или генерализованной формы (пневмонии с бактериемией, менингита или сепсиса), если микроорганизму удалось проникнуть в кровеносное русло.
В группе высокого риска летального исхода находятся в первую очередь дети младше 2 лет и взрослые старше 65 лет. Инфекция протекает крайне тяжело на фоне сопутствующих заболеваний – хронических бронхообструктивных заболеваний легких, патологий сердечно-сосудистой системы (ИБС, сердечной недостаточности, кардиомиопатии, хронической сердечной недостаточности), онкогематологических заболеваний, при сахарном диабете и ожирении, болезнях почек и печени, после удаления селезенки, при иммунодефицитных состояниях, в т.ч. ВИЧ.
По статистике, риск развития инвазивных форм пневомококковой инфекции увеличивается при бронхиальной астме в 2 раза, хронической обструктивной болезни легких – в 4 раза, легочном фиброзе – в 5 раз, саркоидозе и бронхоэктазах – в 2–7 раз.
Установлена прямая связь частоты возникновения инвазивных форм пневомококковой инфекции с возрастом, курением и лечением системными или ингаляционными глюкокортикостероидами.
Среди новорожденных риск тяжелого течения выше у детей, находящихся на искусственном вскармливании и с нарушениями пищеварения.
Вспышки пневмококковой инфекции часто возникают в закрытых коллективах: в детских садах, школах, домах ребенка, общежитиях, тюрьмах, домах престарелых и т.д., где, кстати, выявляется и наиболее высокий уровень носительства пневмококка.
Быстрое распространение респираторных заболеваний и более тяжелое их течение отмечается у работников промышленных предприятий, где производство связано с контактом с парами металлов, минеральной или любой другой пылью или газообразными веществами.
Классификация заболевания
Выделяют инвазивные и неинвазивные формы пневмококковых заболеваний. Инвазивная пневмококковая инфекция диагностируется на основании выделения пневмококка или его ДНК из исходно стерильных органов и тканей и представляет собой целый ряд тяжелых и угрожающих жизни заболеваний: бактериемию без видимого очага инфекции, менингит, пневмонию, сепсис, перикардит, артрит.
К неинвазивным формам инфекции относятся бронхит, внебольничная пневмония, отит, синусит, конъюнктивит.
Симптомы пневмококковой инфекции
Инкубационный период составляет от 1 до 3 дней. Болезнь может проявляться в виде воспаления легких (пневмококковая пневмония), воспаления мягкой мозговой оболочки (пневмококковый менингит), воспаления среднего уха (пневмококковый отит) и слизистой оболочки околоносовых пазух и полости носа (синусит), а также в виде пневмококкового сепсиса – заражения крови.
Пневмококковый менингит всегда начинается остро – температура повышается до 40оС, пациенты жалуются на нестерпимую разлитую головную боль, к которой присоединяется рвота и светобоязнь. Выявляются также общемозговые симптомы: помимо головной боли, тошноты и рвоты появляются стопор и кома. У некоторых больных на груди, руках и ногах появляется геморрагическая сыпь. К специфическим симптомам менингита (менингеальным симптомам) относятся:
- ригидность мышц затылка (рефлекторное повышение тонуса мышц, при котором пациент не в состоянии наклонить голову);
- симптом Кернига (врач не может разогнуть ногу больного в коленном суставе, если она согнута под прямым углом в тазобедренном и коленном суставах, поскольку мешает напряжение задней группы мышц бедра (тонический оболочный рефлекс));
- симптом Брудзинского (при пассивном наклоне головы вперед происходит автоматическое сгибание нижних конечностей в тазобедренных и коленных суставах и подтягивание их к животу).
Пневмококковый острый средний отит чаще всего диагностируется у детей до 2 лет. У больных повышается температура, наблюдается заложенность и сильная боль в ухе, которая может иррадиировать в шею, челюсть, область глаз, повышается чувствительность к звукам, нарушается равновесие.
При попадании инфекции в кровь возникает системное воспаление – сепсис с характерным токсическим шоком.
На сепсис могут указывать повышенная или пониженная температура тела, учащенные сердцебиение и дыхание, сниженное артериальное давление. У больного отмечаются рвота, спутанностью сознания, присоединяются симптомы поражения других органов и систем (сердца, кишечника, почек, легких, мозга). Пневмококковый сепсис – это жизнеугрожающее состояние.
Диагностика пневмококковой инфекции
Диагностика инвазивной пневмококковой инфекции основывается на выделении пневмококка из стерильных жидкостей организма (спинномозговой жидкости, крови), для определения неинвазивной пневмококковой инфекции могут использоваться и другие среды – мокрота, жидкость из полости среднего уха и др.
Микроскопическое исследование позволяет получить предварительный результат. Далее бактерии культивируют на питательных средах. Широкое и бесконтрольное использование антибактериальных препаратов пациентами до обращения за медицинской помощью приводит к возрастанию резистентности (устойчивости) пневмококков к антибиотикам, поэтому для назначения адекватной терапии до начала лечения определяют чувствительность выделенного микроорганизма к антибиотикам.
Часто в лабораторной диагностике применяют ПЦР-тестирование (определение ДНК микроорганизма в крови, мокроте, слюне, соскобе эпителиальных клеток ротоглотки), которое обладает высокой чувствительностью, быстротой получения результата и возможностью проведения анализа после начала антибактериальной терапии.
Определение ДНК Streptococcus pneumoniae в плазме крови методом ПЦР с детекцией в режиме реального времени. Пневмококк Streptococcus pneumoniae относится к роду стрептококков. S. pneumoniae вызывает различные по локализации и степени тяжести инфекции у человека. Пневмококк может быть причиной п.
Для цитирования: Садова Н.В., Заплатников, Шипулина О.Ю. и др. Перинатальная инфекция, вызванная стрептококками группы В. РМЖ. 2010;1:25.Инфекционные заболевания, вызванные стрептококками группы В (СГВ), являются одними из наиболее частых перинатальных инфекций бактериальной этиологии. Установлено, что инфекция, вызванная стрептококками группы В (СГВ–инфекция) может приводить к бактериемии, эндометриту, хориоамниониту, воспалению мочевых и родовых путей у женщины, а также вызывать локализованные и инвазивные формы заболевания у новорожденных детей [1–3,9–12,18,19].
Этиология
Стрептококки группы В были впервые идентифицированы, как возбудители мастита у коров. Группа представлена одним видом – Streptococcus agalactiae. Стрептококки группы В – это грамположительные аэробные диплококки. Все штаммы стрептококков группы В обладают группоспецифическим полисахаридом, который состоит из глюкозы, галактозы, N–ацетилглюкозамина и рамнозы. На основании особенностей структуры полисахаридных антигенов капсулы различают 9 серотипов СГВ: Iа,Ib, II, III, IV, V, VI, VII, VIII. К настоящему времени общепризнано, что главным фактором вирулентности СГВ является полисахаридная капсула. При этом установлено, что наибольшее количество заболеваний новорожденных обусловлено III серотипом СГВ. Из белковых факторов патогенности выделяют С5а пептидазу, бета–гемолизин, альфа– и бета– С протеины и др. Среди потенциальных факторов вирулентности СГВ следует выделить С5а пептидазу и гиалуронидазу. С5а пептидаза специфически расщепляет С5а фракцию комплемента и тем самым препятствует миграции полиморфноядерных лейкоцитов в очаг воспаления. Микробная гиалуронидаза способна расщеплять гиалуроновую кислоту соединительной ткани [4,7,8,16–20].
Среди других продуктов СГВ, потенциально способных участвовать в формировании вирулентного фенотипа, следует отметить Sip белок, CAMP фактор (В–белок); комплекс протеаз; гемолизин; адгезины и др. Идентифицирован поверхностный белок FbsA стрептококков группы В, который обладает способностью связывать человеческий фибриноген. Наряду с белком FbsA, одновременно в двух независимых исследованиях был выявлен еще один белок СГВ, способный связывать фибриноген и обозначенный, как FbsB или Fgag [4,17]. Два из них были условно обозначены sspBl и sspB2. Установлено, что наличие у штаммов СГВ потенциальных адгезинов (в особенности sspB2) представляет значительную опасность, приводя к инфицированию плаценты, плацентарной недостаточности и преждевременных родов, а также приводя к развитию задержки внутрутробного развития плода и асфиксии в родах.
Эпидемиология
По данным массовых обследований, отмечено, что 15–40% женщин являются носителями СГВ, которые контаминируют слизистые влагалища или прямой кишки [1,10,19]. Установлено также, что до 50% детей, рожденных инфицированными женщинами через естественные родовые пути, колонизируются СГВ. Передача инфекции от инфицированной матери плоду происходит, как правило, незадолго до родов или непосредственно во время родов. В постнатальный период, особенно в ближайшие часы и сутки после родов, ребенок также может инфицироваться, однако это случается значительно реже по сравнению с пре– и интранатальной контаминацией. Отмечено, что инфицирование новорожденных СГВ не всегда приводит к развитию инфекционного процесса. Так, к факторам риска по реализации СГВ–инфекции у ребенка, рожденного от СГВ–инфицированной женщины, относят возраст беременной менее 20 лет, ранее случавшиеся выкидыши или медицинские аборты, амнионит, преждевременные роды (12 часов), задержку внутриутробного развития и наличие СГВ–инфекции у ранее рожденных детей [1–3,6,8–15,19].
До широкого внедрения в акушерскую практику антибактериальной профилактики СГВ неонатальная заболеваемость стрептококковой (группы В) инфекцией составляла 1–4 на 1000 живорожденных детей, среди которых в 75% случаев имела место (в первые 7 суток жизни) ранняя манифестация. При этом было отмечено, что на 100 инфицированных беременных женщин рождался 1 ребенок с тяжелой СГВ–инфекцией. Следует особо подчеркнуть, что благодаря активному использованию в акушерской практике рекомендаций по профилактике СГВ–инфекции, удалось существенно снизить уровень инфицированности новорожденных. В результате этого значимо уменьшилась частота инвазивных форм СГВ–инфекции у детей первого месяца жизни. Так, заболеваемость СГВ–инфекцией в ранний неонатальный период в последние годы удалось снизить более чем на 80%, а показатели неонатальной заболеваемости в целом не превышают 0,3 случаев на 1000 живорожденных детей [19].
Клиника, диагностика, лечение
Среди вариантов неонатальной СГВ–инфекции в зависимости от времени манифестации принято выделять заболевания с ранним (до 7 дня жизни) и поздним (после 7 суток жизни) дебютом. При этом СГВ–инфекция у новорожденных детей наиболее часто протекает в виде инвазивных форм, сопровождаясь бактериемией, поражением легких, мозговых оболочек, и нередко приобретает септический характер (особенно у недоношенных, у которых сепсис отмечен в 77–88% среди всех случаев СГВ–заболеваний). Следует отметить, что в подавляющем большинстве случаев дети при этом рождаются в нормальном состоянии, однако уже через несколько часов клиническая картина резко меняется. Манифестация ранних форм, как правило, дебютирует цианозом и респираторными нарушениями (апноэ, тахипноэ). Возможна также молниеносная форма развития заболевания, при этом очень быстро появляются все признаки септического шока [9,19]. В анализах периферической крови при этом нередко обнаруживают лейкопению. При позднем дебюте (после 7 дня жизни) СГВ–инфекция также может протекать в виде сепсиса или менингита, причем менингит может сопровождаться сепсисом или протекать без него [19,20]. Клинически при этом чаще регистрируют напряжение родничков, лихорадку, угнетение сознания вплоть до комы и тонико–клонические судороги. Реже отмечаются другие проявления СГВ–инфекции: омфалит, отит, синусит, конъюнктивит, артрит, остеомиелит, поражения кожи, мочевой системы, эндокардит, миокардит [9,11–15,19,20]. Особо следует отметить, что наиболее тяжело и нередко с драматическим финалом СГВ–инфекция протекает у недоношенных и маловесных новорожденных.
Учитывая низкую специфичность клинических проявлений СГВ–инфекции у новорожденных детей, важное значение в диагностике заболевания приобретают лабораторные методы. При этом могут быть использованы классические бактериологические, серологические, а также и молекулярно–биологические методы диагностики. При бактериоскопии обнаруживают типичные грамположительные кокки, образующие короткие цепочки. При использовании метода бактериологических посевов для выявления СГВ в биологических жидкостях организма (в крови, ликворе, моче, трахео–бронхиальный аспират и др.) необходимо использовать среды, обогащенные кровью или сывороткой. Высеваемость стрептококка на обычных средах, как правило, не превышает 10–12% [2]. Серологические методы диагностики имеют значение лишь в плане ретроспективного подтверждения диагноза, а также для выявления напряженности пассивного иммунитета, трансплацентарно полученного от матери. При этом к факторам высокого риска реализации СГВ–инфекции в неонатальный период относят указание на серонегативность или низкие титры антител к СГВ у инфицированных беременных женщин. В последние годы все большую значимость приобретают молекулярно–биологические методы диагностики. Быстрота получения результатов при использовании полимеразной цепной реакции (в течение 4–6 часов) в сочетании с высокой чувствительностью и специфичностью, делают ПЦР незаменимым методом верификации инфекционных заболеваний, особенно в неонатологической практике. В нашем пилотном исследовании был проведен анализ аспирата из трахеи у 62 новорожденных, находящихся в отделении реанимации и интенсивной терапии. У 9 из них методом ПЦР удалось выявить геном СГВ, в то время как при параллельно выполненном бактериологическом обследовании данный возбудитель обнаружить не удалось. Вероятно, ложно–отрицательные результаты бактериологического исследования были обусловлены массивной антибиотикотерапией, проводимой у детей, что могло привести к изменению культурально–морфологических характеристик возбудителя и снижению числа жизнеспособных микроорганизмов.
При подозрении на СГВ–инфекцию или при выявлении СГВ следует как можно быстрее начать этиотропную терапию. Стрептококки группы В обладают хорошей чувствительностью к b–лактамным антибиотикам. При этом в последние годы при подозрении на СГВ сепсис новорожденных назначают ампициллин в суточной дозе 200 мг/кг в комбинации с аминогликозидом (гентамицин или нетромицин, или амикацин). В качестве стартовой антибактериальной комбинации наиболее часто рекомендуют использовать ампициллин с гентамицином, при этом подчеркивая, что предпочтителен внутривенный путь введения. В случае подтверждения менингита дозы антибиотиков увеличивают, при этом ампицилин вводят из расчета 300 мг/кг/сут. При выделении СГВ лечение продолжают выбранной комбинацией антибиотиков до улучшения состояния, а в дальнейшем переходят на монотерапию ампициллином. При неинвазивных СГВ–инфекциях продолжительность монотерапии составляет не менее 10 суток, при СГВ–неосложненных менингитах – не менее 14 суток, при СГВ–артритах и остеомиелитах – 3–4 недели, при СГВ–эндокартите и СГВ–вентрикулите – не менее 4 недель [9,19].
Профилактика СГВ инфекции
у новорожденных
Разработанные в 2002 г. CDC (Центр по контролю заболеваемости и профилактики, США) рекомендации предусматривают обязательное обследование на СГВ–носительство всех беременных женщин на сроке 35–37 нед. При выделении СГВ из влагалища и/или заднепроходного канала женщинам назначают интранатальную антибиотикопрофилактику в тех случаях, когда имеются факторы риска. При этом к факторам риска относятся следующие анамнестические данные и клинические состояния: предыдущий ребенок перенес инвазивную СГВ–инфекцию, во время настоящей беременности имела место СГВ–бактериурия, угроза преждевременных родов (до 37 нед), безводный промежуток больше 18 часов, лихорадка в родах (t > 38°С)). При этом непосредственно с начала родовой деятельности вводят бензилпенициллин (в/в в дозе 5 млн ЕД), а затем по 2,5 млн ЕД в/в – каждые 4 часа до конца родов. Альтернативой является ампициллин (вначале – 2 г на введение в/в, затем по 1 г каждые 4 часа в/в до окончания родов). При аллергии к пенициллинам его заменяют клиндамицном или эритромицином, но чаще в этих случаях рекомендуют цефазолин (вначале – 2 г на введение в/в, затем по 1 г каждые 8 часов в/в до окончания родов). При высоком риске развития анафилаксии на b–лактамные антибиотики может быть использован ванкомицин – в/в по 1 г каждые 12 часов до окончания родов [15,19]. Методы специфической иммунопрофилактики СГВ–инфекции до настоящего времени не разработаны.
В заключение следует подчеркнуть, что четкое выполнение рекомендаций по своевременному выявлению СГВ–инфицированных беременных и уточнению у них факторов риска позволяет определять необходимость профилактического введения антибиотиков во время родов, что существенно снижает риск инфицирования и развития инвазивных форм СГВ–инфекции у новорожденных.Литература
1. Врожденные, перинатальные и неонатальные инфекции: Пер. с англ. / Под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд. — М.: Медицина, 2000.
2. Стрептококковая инфекция у детей.Учебно–методическое пособие под ред. проф. В.А. Воробьевой .–Нижний Новгород.:Медицина, 2005.
3. Анкирская А.С. Роль стрептококков группы В в перинатальной патологии // Акуш. и гин. – 1984. – № 9. – С. 6–10.
4. Дмитриев А.В., Шаклеина Е.В. Молекулярная эпидемиология патогенных стрептококков группы В // Ж. микроб. эпидемиол. и иммунол. – 2003. – С. 83–92.
5. Зуев В.М. Некоторые вопросы патогенеза, диагностика и комплексная терапия женщин с воспалительными процессами доброкачественными новообразованиями органов репродуктивной системы. Автореф. дисс. д–ра мед.наук. – М, 1998.
6. Оганян К.А. Течение и исход беременности при колонизации мочеполового тракта женщин стрептококками группы В и D. Автореф. дисс. канд. мед. наук.– СПБ, 2008.
7. Сидоренко СВ. Клиническое значение антибиотикорезистентности грамположительных микроорганизмов // Клин. микроб.и антимикроб. химиотер. – 2003. – Том 5. – N 2. – С. 201–208.
8. Тотолян А.А. Грабовская К.Б. Стрептококки группы В в неонатальной патологии: механизм патогенного действия, диагностики, профилактика // Вестн. АМН СССР. – 1990. – №7. – С. 36–40.
9. Шабалов Н. П. Неонатология. – С–Пб., 2006.
10. Baker CJ. Group В streptococcal infections / CJ. Baker, M.S. Edwards, J.S.Remington, Ш. Klein // Infectious diseases of the fetus and newborn infant. –Philadelphia, 2001. – P. 1091–1156.
11. Baltimore R.S. Huie S.M., Meek J.I., Schuchat A. Early–onset neonatal sepsis in the era of group В streptococcal prevention // Pediatrics. – 2001. –Vol. 108. –P. 1094–8.
12. Boyer K.M.: Neonatal group В streptococcal infections // Current Opinion Pediatrics, 1995, No. 7. –P. 13–18.
13. Castor M.L. Antimicrobial susceptibility and serotype patterns of invasive groupВ Streptococcus isolates from Georgia, Minnesota, New York and Oregon, 1996–2000
14. Castor, С Whitney, R. Facklam // International Conference on Emerging Infectious Diseases 2002: program and abstract book. – Atlanta, 2002. –P. 132
15. Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. –2002.–Vol.51.–P. 10–22
16. Fischetti V.A. Gram–Positive Pathogens, American Society Microbiology, Washington, D.C, 2000. –511 p.
17. Jacobsson K. A Novel family of fibrinogen–binding proteins in Streptococcus agalactiae // Vet. Microbiol. – 2003. – Vol. 96. – P. 103–113.
18. Kenyon S.L., Taylor PJ., Tarnow–Mordi W. Broad–spectrum antibiotics for preterm, prelabour rupture of fetal membranes, ORACLE Collaborative Group // Lancet – 2001. – Vol. 357. – P. 979–88.
19. Red Book: Report of the Committee on Infectious Diseases. 27h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
20. Weisner A.M., Johnson A.P., Lamagni T.L. et al. Characterization of group В streptococci recovered from infants with invasive disease in England and Wales // Clin Infect Dis. – 2004. – Vol. 38. – P. 1203–1208.Читайте также:

