Исследование воды бассейнов на гельминты
Обновлено: 17.04.2024
- наличие у администрации официально изданных санитарных правил и методических указаний, требования которых подлежат выполнению;
- осуществление (организацию) лабораторных исследований;
- организацию медицинских осмотров (личные медицинские книжки), профессиональной гигиенической подготовки и аттестации персонала плавательных бассейнов;
- контроль за наличием сертификатов, санитарно-эпидемиологических заключений и иных документов, подтверждающих безопасность используемых материалов и реагентов, а также эффективность применяемых технологий водообработки;
- своевременное информирование местных органов и учреждений государственной санитарно-эпидемиологической службы об авариях и нарушениях технологических процессов, создающих неблагоприятную санитарно-эпидемиологическую ситуацию для посетителей бассейна;
- визуальный контроль специально уполномоченными должностными лицами за выполнением санитарно-противоэпидемических (профилактических) мероприятий, соблюдением санитарных правил, разработкой и реализацией мер, направленных на устранение выявленных нарушений.
- официально изданных санитарных правил, методов и методик контроля;
- должностных лиц, на которых возложены функции по осуществлению производственного контроля;
- должностей сотрудников, подлежащих медицинским осмотрам;
- возможных аварийных ситуаций.
5.2.1. Разработанная программа (план) производственного контроля согласовывается с главным врачом (заместителем главного врача) центра госсанэпиднадзора в соответствующей административной территории и утверждается руководителем организации, эксплуатирующей плавательный бассейн.
5.2.2. Юридические лица и индивидуальные предприниматели, эксплуатирующие плавательные бассейны, несут ответственность за своевременность, полноту и достоверность осуществляемого производственного контроля и обязаны представлять информацию о его результатах в центры госсанэпиднадзора по их запросам.
- качеством воды (см. п. 5.3.3);
- параметрами микроклимата;
- состоянием воздушной среды в зоне дыхания пловцов;
- уровнями техногенного шума и освещенности.
5.3.1. При отсутствии производственной аналитической лаборатории, аккредитованной в установленном порядке, контроль за качеством воды проводится с привлечением лабораторий, аккредитованных в системе государственного санитарно-эпидемиологического надзора и имеющих лицензию на проведение микробиологических исследований.
5.3.2. Лабораторный контроль за качеством воды в ванне бассейна включает исследования по определению следующих показателей:
а) органолептические (мутность, цветность, запах) - 1 раз в сутки в дневное или вечернее время;
б) остаточное содержание обеззараживающих реагентов (хлор, бром, озон), а также температура воды и воздуха - перед началом работы бассейна и далее каждые 4 часа;
в) основные микробиологические показатели (общие колиформные бактерии, термотолерантные колиформные бактерии, колифаги и золотистый стафилококк) 2 раза в месяц;
г) паразитологические - 1 раз в квартал;
д) содержание хлороформа (при хлорировании) или формальдегида (при озонировании) - 1 раз в месяц.
Отбор проб воды на анализ производится не менее чем в 2-х точках: поверхностный слой толщиной 0,5-1,0 см и на глубине 25-30 см от поверхности зеркала воды.
- поступающей (водопроводной) - в бассейнах рециркуляционного и проточного типов, а также с периодической сменой воды;
- до и после фильтров - в бассейнах рециркуляционного типа и с морской водой;
- после обеззараживания перед подачей воды в ванну.
- параметры микроклимата (кроме температуры воздуха в залах ванн) - 2 раза в год;
- освещенность - 1 раз в год.
5.3.6. Для оценки эффективности текущей уборки и дезинфекции помещений и инвентаря необходимо не менее 1 раза в квартал проведение бактериологического и паразитологического анализов смывов на присутствие общих колиформных бактерий и обсемененность яйцами гельминтов.
Смывы берутся с поручней ванны бассейна, скамеек в раздевальнях, пола в душевой, ручек двери из раздевальни в душевую, детских игрушек (мячей, кругов и т.д.), предметов спортивного инвентаря.
При получении неудовлетворительных результатов исследований необходимо проведение генеральной уборки и дезинфекции помещений и инвентаря с последующим повторным взятием смывов на анализ.
5.3.7. Эффективность работы приточно-вытяжной вентиляции подлежит систематическому контролю специализированной организацией (не реже 1 раза в год).
5.3.8. Результаты производственного лабораторного контроля, осуществляемого в процессе эксплуатации плавательных бассейнов, направляются 1 раз в месяц в территориальные центры госсанэпиднадзора. В случаях несоответствия качества воды требованиям, указанным в таблице № 3 настоящих санитарных правил, информация должна передаваться немедленно.
5.3.9. Администрация бассейна должна иметь журнал, где фиксируются результаты обследования бассейна госсанэпидслужбой (акты) с выводами и предложениями по устранению выявленных недостатков, а также журнал регистрации результатов производственного лабораторного контроля (при этом в бассейнах рециркуляционного типа, а также с морской водой должна быть указана дата промывки фильтров).
5.4. При подготовке программы производственного контроля следует считать, что потенциально опасным фактором, который может оказывать наиболее неблагоприятное влияние на здоровье посетителей бассейна, является качество воды в ванне (критическая контрольная точка).
5.4.1. При получении результатов исследований по основным микробиологическим и (или) паразитологическим показателям, свидетельствующим о неудовлетворительном качестве воды в ванне, администрацией бассейна проводятся мероприятия, включающие промывку фильтров, увеличение объема подаваемой свежей воды, повышение дозы обеззараживающего агента, генеральную уборку помещений и др. с последующим отбором проб воды на исследования не только по основным, но и дополнительным микробиологическим, а также паразитологическим показателям. При обнаружении колифагов вода исследуется и на присутствие вирусов.
5.4.2. При получении неудовлетворительных результатов исследований проб воды, отобранных из ванны бассейна после осуществления мероприятий, указанных в п. 5.4.1, решение вопроса о необходимости полной смены воды в бассейне требует дифференцированного подхода в зависимости от вида и системы водообмена.
- увеличение объема добавляемой свежей воды;
- использование альтернативных методов обеззараживания воды;
- снижение нагрузки (т.е. сокращение количества посетителей);
- введение перерывов между сменами (или увеличение продолжительности при их наличии) для проведения качественной уборки;
- проведение дезинфекционных мероприятий всех помещений и оборудования;
- усиление контроля за мытьем (принятием душа) посетителей, а также представлением справок с повторным обследованием при обнаружении в пробах воды возбудителей паразитарных заболеваний и др.
Если проведенные мероприятия как предложенные администрацией бассейна, так и рекомендованные санитарно-эпидемиологической службой, не привели к нормализации качества воды, должна проводиться полная смена воды в ванне бассейна.
5.4.4. Получение неудовлетворительных результатов исследований воды по основным микробиологическим и (или) паразитологическим показателям является основанием для полной смены воды в ванне бассейнов с проточной системой водообмена, в т.ч. малых бассейнов с площадью зеркала воды не более 100 м 2 , а также бассейнов с морской водой.
5.4.5. Обнаружение в пробах воды возбудителей кишечных инфекционных, и (или) паразитарных заболеваний, и (или) синегнойной палочки является основанием для полной смены воды в ванне вне зависимости от вида бассейна и системы водообмена.
5.4.6. Полная смена воды в ванне бассейна должна сопровождаться механической чисткой ванны, удалением донного осадка и дезинфекцией (см. п. 3.9.3) с последующим отбором проб воды на анализ.
5.4.7. В случаях обнаружения возбудителей паразитарных заболеваний в воде ванны бассейна и при анализе смывов с поверхностей необходимо проведение исследований на присутствие патогенных бактерий, яиц гельминтов и цист кишечных простейших у обслуживающего персонала и посетителей, а также усиление контроля за наличием справок у детей школьного и дошкольного возраста (п. 3.12.2).
5.4.8. Администрация бассейна обязана информировать территориальный центр госсанэпиднадзора о мерах, принятых по устранению выявленных нарушений настоящих Санитарных правил, в том числе о временном прекращении эксплуатации бассейна и полной смене воды в ванне, при этом возобновление эксплуатации бассейна должно осуществляться только при наличии положительного санитарно-эпидемиологического заключения, выданного центром госсанэпиднадзора после получения результатов лабораторных исследований, подтверждающих их соответствие требованиям настоящих Санитарных правил.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы санитарно-паразитологического анализа воды
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: Институтом медицинской паразитологии и тропической медицины им. Е.И.Марциновского ММА им. И.М.Сеченова (Н.А.Романенко, А.И.Чернышенко, Г.И.Новосильцев, Е.Н.Морозов, Н.А.Турбабина); ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (А.И.Верещагин, И.В.Брагина, Т.Н.Цыбина, Т.Г.Сыскова, М.В.Зароченцев); кафедрой паразитологии, паразитарных и тропических болезней ММА им. И.М.Сеченова (В.П.Сергиев, Р.К.Мирзоева, М.В.Гузеева); ФГУЗ "Центр гигиены и эпидемиологии в г.Москве" (Н.И.Тимошенко); ГНЦ РФ Физико-энергетический институт (Б.И.Фурсов, Г.С.Жданов); ФГУЗ "Центр гигиены и эпидемиологии в г.Челябинске" (Б.Е.Рабинович); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Т.М.Гузеева, З.С.Середа); ГУ НИИ экологии человека и гигиены окружающей среды им. А.Н.Сысина РАМН (Ю.А.Рахманин, Р.И.Михайлова, А.Е.Недачин); ФГУП НИИ физических проблем им. Ф.В.Лукина (С.М.Кузьмин, Е.С.Кузьмин, С.М.Безручко); Тюменским НИИ КИП (Т.Ф.Степанова); ООО "СтайЛаб" (А.В.Галкин); РМАПО Минсоцразвития России (А.Е.Беляев); РАГС при Президенте РФ (В.В.Гутенев); Курским Госуниверситетом (Н.С.Малышева, С.С.Пехова, Н.А.Плехова, Е.Л.Дмитриева); ФГУЗ "Центр гигиены и эпидемиологии в Белгородской области" (В.В.Евдокимов, В.И.Евдокимов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 6 декабря 2007 г. N 3).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г.Г.Онищенко 18 января 2008 г.
4. ВВЕДЕНЫ ВЗАМЕН МУК 4.2.964-00 "Санитарно-паразитологическое исследование воды хозяйственного и питьевого использования"
1. Область применения
1.2. Настоящие методические указания являются обязательными для контроля питьевой воды по показателям паразитарной безопасности при проведении государственного санитарно-эпидемиологического надзора (контроля) в учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и лабораториях других организаций, аккредитованных в установленном порядке.
Допускается применение любого из указанных в настоящих МУК методов по выбору исполнителя.
Допускается использование аналогов оборудования, приборов, реагентов и материалов, указанных в настоящих МУК, разрешенных к применению в установленном порядке.
2. Отбор, хранение и транспортирование проб
2.1. Общие требования к отбору проб питьевой воды
Отбор проб воды на объектах надзора проводится в соответствии с действующими нормативно-методическими документами (СанПиН, ГОСТ, МУК) и настоящими методическими указаниями.
Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения. Многоразовая посуда (емкости) должна быть изготовлена из материалов, выдерживающих обработку кипячением.
При исследовании воды из распределительной сети отбор проб производится из крана с предварительным спуском воды не менее 3-5 мин, с применением гибких шлангов, водораспределительных сеток, насадок. При отборе проб воды с концентрированием осадка на мембранных или порошковых фильтрах применяют насадки аппаратов напорного фильтрования, напор воды при этом регулируют с таким расчетом, чтобы он был достаточным для фильтрации через мембранные фильтры (МФАСП или ATM).
При исследовании воды на объектах транспорта (водном, воздушном, железнодорожном) отбор проб воды производится на выходе из гидротехнических сооружений, осуществляющих водоснабжение данных транспортных средств.
Из открытых (поверхностных) водоемов, плавательных бассейнов пробы отбирают с поверхности, с различных глубин объемом 25-50 л, емкостями 1,5-2,0 л с интервалом 2-3 мин.
Забор проб воды с объекта (точки пробозабора) проводят несколькими способами:
1) отбор воды с каждой точки пробозабора обследуемого объекта по 25-50 л непосредственно в большие закрывающиеся емкости (фляги, бутыли, канистры и т.п.) и соответственно доставкой этих объемов воды для исследования в лабораторию;
2) отбор воды (по 25-50 л с каждой точки) с последующим концентрированием проб с применением химреактивов (коагулянтов) непосредственно на обследуемом объекте и доставкой на исследование в лабораторию уменьшенного в 10 и более раз объема (осадок с надосадочной жидкостью);
3) отбор проб воды с помощью фильтровальных приборов на объектах водозабора и доставкой на исследование в лабораторию концентрированного осадка на мембранных или порошковых фильтрах.
2.2. Хранение и транспортирование проб
В лабораторию доставляют маркированные емкости с пробами исследуемой воды или осадок с надосадочной жидкостью после применения коагулянтов, или концентрированный осадок на фильтрах (мембранных или порошковых).
Фильтры, через которые проводилось фильтрование исходной воды с помощью фильтровальных приборов непосредственно на объекте надзора, помещают в широкогорлый флакон или стеклянную банку, добавляют исходной (исследуемой) воды с таким расчетом, чтобы вода покрывала поверхность фильтра, закрывают флакон или банку завинчивающейся или притертой крышкой и доставляют в лабораторию. При использовании фильтровальных приборов с порошковым фильтром в лабораторию доставляют концентрат пробы в пластиковой емкости, входящей в состав прибора.
Емкости с пробами воды, мембранными фильтрами с концентрированным осадком или с порошковым концентратом маркируют с указанием даты и номера пробы, количества мембранных фильтров с одной точки пробоотбора. Маркированные пробы в лабораторию транспортируют для дальнейшего исследования с сопроводительным актом отбора проб воды, где указывается место отбора (населенный пункт, водный объект и т.п.), дата, время забора, количество точек пробоотбора, номера проб, количество воды или количество фильтров и другая информация.
Пробы воды должны быть доставлены в лабораторию в течение 24 ч после отбора. Пробы, не прошедшие предварительную обработку, хранят при комнатной температуре 15-20 °С не более двух суток. Концентрированные пробы можно хранить в холодильнике при температуре 2-4 °С в течение не более трех суток.
3. Оборудование, расходные материалы, реактивы
3.1. Фильтровальное оборудование*
* Допускается применение аналогичных приборов отечественных и зарубежных производителей, разрешенных к применению в установленном порядке.
Приборы мембранного фильтрования:
1) вакуумные фильтровальные установки типа ПВФ-142, ПВФ-35, ПВФ-47;
2) напорного фильтрования типа ПНФ, УППВ.
Приборы порошкового фильтрования:
1) напорного фильтрования - типа ПробоКонг и его модификации;
2) отборник флотанта фильтрующий типа "ОФФ-25".
3.2. Вспомогательное оборудование и расходные материалы
Лабораторная центрифуга типа ОПН-3, ОПН-8, ЦЛС-31М, ОС-6М со сменным ротором или другие марки с аналогичными параметрами, обеспечивающие 1500-3000 об./мин, позволяющие центрифугировать пробы воды в центрифужных пробирках объемом от 10 мл.
Низкотемпературный холодильный шкаф или холодильник бытовой, поддерживающий температуру 2-6 °С.
Термостат, поддерживающий рабочую температуру 37 °С и обеспечивающий градиент температуры в камере ±1 °С.
Весы лабораторные механические равноплечие (аптекарские) с наибольшим пределом взвешивания 1000 г, с допустимой погрешностью не более 0,1 г с разновесами или электронные с наибольшим пределом взвешивания 200 г, с допустимой погрешностью не более 0,01 г.
Ареометры с пределами измерения от 1,000 до 1,400 кг/м.
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже ГОСТа 6709-72.
Шкаф сушильный, стерилизационный, обеспечивающий температуру до 180 °С.
Световые микроскопы отечественные типа МИКМЕД-2 (вариант 2) и других фирм, оснащенные окулярами с увеличением 10 (дополнительно могут быть 7 и 5), объективами 10, 40, 100. Окуляр-микрометр и объект-микрометр.
Мембранные фильтры для фильтрования воды на основе ацетатов целлюлозы типа МФАС-СПА с размерами пор от 1,5 до 3,0 мкм, МФАС-СПА-4 с размерами пор от 2,5 до 4,5 мкм или прозрачные аналитические трековые мембраны ATM на основе полиэтилентерефталата с размерами пор от 1,0 до 5,0 и более мкм. Диаметр фильтровальных дисков 25, 35, 47, 70 и до 142 мкм, в зависимости от диаметра фритты фильтродержателя используемого фильтровального оборудования.
Предфильтры - капроновая сетка с ячейками 60-70 мкм.
Емкости для отбора проб воды из нейтрального материала, пригодные для обеззараживания (широкогорлые стеклянные или пластиковые флаконы емкостью 100-500 мл с притертым или завинчивающимися крышками, металлические или пластиковые канистры емкостью 10-25 л, стеклянные бутыли, фляги молочные металлические, эмалированные бидоны и др.).
Дозаторы пипеточные полуавтоматические с наконечниками.
Лабораторный вортекс, лабораторный ротатор.
Лабораторная посуда стеклянная одноразового или многоразового использования (химические стаканы, колбы, чашки Петри, цилиндры измерительные, пробирки центрифужные градуированные, микропробирки полипропиленовые, стеклянные палочки, стекла предметные, стекла покровные, пипетки стеклянные или разовые и т.п.).
Инструментарий металлический: пинцеты для работы с мембранными фильтрами, ножницы, иглы препаровальные, шпатели.
Лотки эмалированные, металлические, эмалированные кастрюли, ведра.
Горелки газовые или спиртовки.
Штативы лабораторные для пробирок и микропробирок.
Часы песочные на 3-5 мин, часы сигнальные или электронный таймер.
Кисти акварельные широкие (мягкие или полужесткие).
4. Методы концентрирования проб питьевой воды
Концентрация больших объемов воды (50 л и более) на объектах позволяет пробу воды, предназначенную для доставки в лабораторию на исследование, уменьшить до 0,5-1,0 л.
Концентрирование больших объемов воды применимо также непосредственно в лабораториях, что позволяет не только уменьшить объемы исследуемых проб воды, но и хранить пробы перед исследованием в холодильнике до 3-х суток (п.2.2).
Все пробы воды, которые сконцентрированы с применением химических реактивов (коагулянтов), исследуются после предварительной фильтрации через мембранные фильтры.
4.1. Концентрирование проб воды с применением химических веществ
4.1.1. Концентрирование пробы воды гидрокарбонатом кальция
К 10 л пробы добавить 100 мл 1 моль/л CaCl, затем 100 мл 1 моль/л NaHCO. Встряхнуть емкость для перемешивания.
Добавить 100 мл 1 моль/л NaOH. Встряхнуть емкость для перемешивания.
Дать отстояться не менее 2 ч.
После осаждения хлопьев осторожно удалить из емкости надосадочную жидкость, оставив 4-5 см жидкости над осадком (даже если осадок невидим).
В осадок с надосадочной жидкостью добавить 100-200 мл 10%-ной сульфаминовой кислоты (NHSOH) для полного растворения хлопьев.
Хорошо перемешать содержимое емкости и перелить в центрифужные флаконы объемом 1000 мл или 500 мл, пронумерованные в соответствии с номером пробы.
Вода во флаконах должна иметь рН=6±0,5, чтобы не было повторного образования хлопьев. При несоответствии рН осторожно отрегулировать раствором 1 моль/л NaOH.
Центрифугировать флаконы 10 мин при 1500-2000 об./мин.
Сразу после центрифугирования осторожно удалить (слить) надосадочную жидкость или отсосать лабораторным вакуумным насосом с давлением не более 0,2 бар.
Энергично перемешать оставшуюся жидкость, ресуспендируя осадок, и перенести его в градуированную центрифужную пробирку объемом 50 мл.
Довести объем в ней до 50 мл фильтрованной дистиллированной водой (сполоснуть центрифужный флакон дистиллированной водой и перенести в 50 мл центрифужную пробирку).
Центрифугировать пробирки 15 мин при 2000-2500 об./мин.
Записать объем осадка сразу после центрифугирования.
Удалить надосадочную жидкость или отсосать пипетками, оставив 1 см над осадком.
Добавить дистиллированную воду в центрифужную пробирку, доведя объем до 5 мл.
3.2. ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ
МЕТОДЫ САНИТАРНО-ПАРАЗИТОЛОГИЧЕСКОЙ ЭКСПЕРТИЗЫ РЫБЫ, МОЛЛЮСКОВ, РАКООБРАЗНЫХ, ЗЕМНОВОДНЫХ, ПРЕСМЫКАЮЩИХСЯ И ПРОДУКТОВ ИХ ПЕРЕРАБОТКИ
Дата введения 2001-01-01
Главный государственный санитарный врач Российской Федерации - Первый заместитель министра здравоохранения Российской Федерации Г.Г.Онищенко 25 октября 2000 г.
1. Область применения и общие положения
1.1. Настоящие методические указания устанавливают методы санитарно-паразитологической экспертизы рыбы и нерыбных объектов промысла (моллюсков, ракообразных, земноводных, пресмыкающихся), а также продуктов их переработки (далее по тексту - рыбная продукция).
1.2. Методические указания предназначены для применения в аккредитованных (или аттестованных, или лицензированных) лабораториях (в т.ч. контрольно-производственных) и лабораториях учреждений государственной санитарно-эпидемиологической и ветеринарной служб Российской Федерации, осуществляющих контроль качества гидробионтов и продуктов их переработки на соответствие СанПиН 2.3.2.560-96* и 3.2.569-96**, а также научных учреждений, занимающихся изучением паразитарных болезней.
** На территории Российской Федерации действует СанПиН 3.2.1333-03, здесь и далее по тексту. - Примечание изготовителя базы данных.
Специалисты лабораторий должны пройти подготовку в заявленной области аккредитации (аттестации, лицензирования), владеть метрологически аттестованными методиками и методами, утвержденными или допущенными к применению Госстандартом и госсанэпидслужбой России и соответствующих требованиям ГОСТ Р 8.563-96 "Методики выполнения измерений".
1.3. Среди всех классов паразитов (простейшие, ракообразные, гельминты и др.), встречающихся в рыбе и других гидробионтах, опасными для здоровья человека являются только личинки гельминтов: цестод, трематод, нематод и скребней. К наиболее социально значимым и широко распространенным заболеваниям, передающимся через рыбу и других гидробионтов, относятся описторхоз, дифиллоботриозы и эндемичные для Дальнего Востока России метагонимоз, нанофиетоз и клонорхоз. Определенную опасность для здоровья людей могут представлять гельминты, приживающиеся, но не развивающиеся до взрослой стадии у человека (использующие его в качестве резервуарного хозяина), что затрудняет диагностику заболевания. Это спирометра, гнатостомы, болбозомы, коринозомы и некоторые виды анизакид и парагонимид. Заражение человека пирамикоцефалусами, апофаллами, криптокотилюсами происходит крайне редко. Других гельминтов (меторхисов, псевдамфистомумов, гетерофиесов, эхинохазмусов и др.) можно отнести к паразитам, спорадически встречающимся у человека на определенных территориях.
1.4. Объектами исследований являются промысловые пресноводные и морские рыбы, моллюски, ракообразные, земноводные, пресмыкающиеся и продукты их переработки.
1.5. Потенциальную опасность для здоровья человека представляют только живые личинки гельминтов. В связи с этим, при паразитологическом инспектировании гидробионтов и продуктов их переработки следует определить жизнеспособность выявленных плероцеркоидов, метацеркарий, акантелл и личинок нематод (см. раздел 5).
1.6. При исследовании гидробионтов и продуктов их переработки следует соблюдать режим работы с инвазионным материалом, регламентированный санитарными правилами 1.2.731-99* "Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами".
* Действуют СП 1.3.2322-08. - Примечание изготовителя базы данных.
2. Отбор, хранение и подготовка к анализу проб гидробионтов и продуктов их переработки
Отбор и объем проб рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки для исследования на соответствие требованиям безопасности для здоровья человека по паразитарным показателям осуществляется в соответствии с требованиями:
- ГОСТ 7631-85 "Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний";
- Изменений N 2 к ГОСТ 7631-85 (п.1.2), утвержденному Постановлением Госстандарта СССР от 25.10.89 N 3195;
- СанПиН 3.2.569-96 "Профилактика паразитарных болезней на территории Российской Федерации", приложение 3, п.6.2 (при лабораторном контроле рыбной продукции) и п.п.15.12, 15.13 (при оценке и контроле паразитологического состояния районов промысла (биотопов);
- правил по сертификации "Типовой порядок обращения с образцами, используемыми при проведении обязательной сертификации. ПР 50.3.002-95".
2.1. Отбор, хранение и подготовка к анализу проб гидробионтов при оценке и контроле паразитологического состояния районов промысла (биотопов)
Необходимые реактивы и оборудование:
1. Химические реактивы: глицерин; эфир или хлороформ
2. Кюветы эмалированные
4. Пинцеты хирургические и глазные
5. Препаровальные иглы
6. Химические стаканы
7. Кастрюли эмалированные
10. Весы с набором разновесов или весы электронные
11. Сантиметр или линейка
13. Фильтровальная бумага
2.1.1. При оценке паразитологического состояния водоема (района промысла) следует начинать исследовать виды гидробионтов, наиболее подверженные заражению. Так, наилучшими индикаторами неблагополучия водоема в отношении инвазии личинками описторхисов является язь, далее по убывающей - елец, линь и т.д. (см. табл.2), а в отношении Diphyllobothrium latum - щука и налим (см. табл.1).
Дифференциальные признаки плероцеркоидов сем. Diphyllobothriidae, опасных для здоровья человека

Многие источники пресной воды в настоящее время отвечают требованиям санитарной безопасности далеко не в полной мере.
Поэтому, чтобы обеспечить её соответствующую обработку, выполняется комплекс санитарно-микробиологических анализов, в число которых входит и анализ паразитологический.
О порядке его проведения пойдет речь в статье.
Исследования санитарно-паразитологические
Третья глава документа регламентирует собственно паразитологические исследования. В комплекте с указанным документом в обязательном порядке рассматриваются требования иных действующих нормативных актов. Например, СанПиН 2.1.5.980-00.
Методика указанных исследований для различных источников водоснабжения имеет свою специфику. Например, если забор осуществляется из поверхностных водоёмов, используют методики, ориентированные на выявление в воде наличия цист простейших кишечных патогенов (дизентерийных амёб, криптоспоридий, балантидий, лямблий), а также яиц гельминтов, которые непосредственно угрожают здоровью и жизни человека при попадании внутрь организма.
Вся эта патогенная микрофлора выявляется в процессе контроля качества, содержащейся в источнике питьевого и/или хозяйственного водоснабжения, а также в водоёмах, имеющих рекреационное назначение.
Методика исследований с использованием флотантов
Выполняя микроскопические исследования тех осадков, которые получаются после центрифигурирования раствора флотанта, разведённого минимум в четыре раза (исходная плотность — 1,26) можно получить выпадающих из данного осадка паразитных агентов.
Осаждение указанной патогенной микрофлоры достигается тем, что плотность флотанта резко понижается (1,03 и меньше). Этот показатель гораздо ниже плотности самих паразитных агентов.
Метод исследований с использованием аналитических прозрачных трековых мембран
Мембраны этого типа производятся из прозрачной тонкой полиэтилентеренфалатной плёнки, имеющей сквозные поры, диаметр которых лежит в диапазоне 0,1 – 5,0 мкм.
Выполнить дифференциацию пор указанных мембран с осевшими на них объектами паразитологии несложно. Объясняется это тем, что яйца гельминтов почти в 20 раз, а цист лямблий почти в 4 раза по своим размерам больше размеров пор.
Метод исследований на наличие таких паразитов, как ооцисты криптоспоридий
Главным назначением данной методики является, как видно из названия, выявление наличия ооцист криптоспоридий. Метод позволяет определить наличие яиц гельминтов и цист лямблий.
Указанный метод предусматривает последовательную фильтрацию воды через специальную систему аналитических трековых (АТМ) мембранных фильтров.
Идентификация возбудителей паразитарных болезней кишечника, выявленных в процессе вышеперечисленных исследований
Выполняется микроскопирование, в процессе, которого проводится подсчёт паразитарных патогенов, содержащихся в полном объёме выпавших осадков. Таким образом, получается число паразитических организмов во всей пробе, взятой на исследование. Параллельно с этим обнаруженных паразитов систематизируют и идентифицируют.
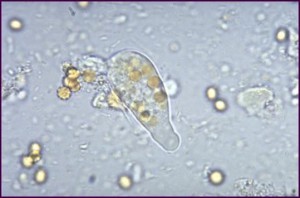
Для этого руководствуются рядом характерных признаков, присущих тому или иному паразиту. А также учитывают тот факт, что весьма часто природная вода содержит формы цисты Entamoeba dispar, которые практически неотличимы от дизентерийной амёбы, на патогенного влияния на организм человека они не оказывают.
В таких случаях поступают следующим образом. Их отмечают в протоколе, не указывая видовой принадлежности. А для более точной идентификации выполняют дополнительную серию исследований.
Если выявлен хотя бы один экземпляр патогенного паразита, обязательно указывается на то, что данная вода относится к категории экономически неблагополучных.
Приборы для выполнения паразитологического анализа
Наиболее часто применяемыми для целей паразитологического анализа воды приборами являются сегодня приборы напорного и вакуумного фильтрования. С их помощью концентрируется осадок и осуществляется выделение в исходном продукте паразитарных объектов. Далее исследуемая проба проходит фильтрацию через специальный мембранный фильтр.
По завершению процесса фильтрации из прибора изымается фильтр. С поверхности его мембраны смывают сконцентрировавшийся на ней осадок, либо сразу проводят микроскопирование.
Прибор ПВФ-142Б (вакуумного фильтрования)
Это изделие позволяет выполнить быстрое фильтрование с последующим сливом отфильтрованной воды. Прибор изготовлен специально под мембранный фильтр, диаметр которого составляет 142мм.

Потребитель получает ПВФ-142 в следующей комплектации:
- собственно вакуумная станция;
- ячейка фильтровальная;
- устройство заборно-фильтровальное;
- устройство заборное;
- шланги соединительные в комплекте.
Габариты прибора 180*210*310. Масса – 3,2 кг.
Прибор ПВФ-142Б (вакуумного фильтрования), оснащённый дополнительным комплектом
В указанной комплектации можно одновременно выполнять фильтрование не одной, а двух проб:
- первая проба на фильтре мембранном, диаметр которого составляет 142мм. Здесь выполняются исследования на цисты лямблий, личинки гельминов, яйца;
- вторая – на мембранном фильтре, диаметр которого составляет 35мм (вариант – 47мм). Осуществляется выявление ооцисты криптоспоридий.
Потребитель получает прибор в следующей комплектации:
- ячейка фильтровальная с воронкой для установки фильтра 47/35 мм (объём воронки 300мл);
- ячейка фильтровальная для установки основного фильтра диаметром 142мм;
- собственно вакуумная станция;
- ячейка фильтровальная;
- устройство заборно-фильтровальное;
- устройство заборное;
- шланги соединительные в комплекте.
Габариты прибора 180*210*310. Масса – 3,2 кг.
Прибор ПВФ-142Э Б (вакуумного фильтрования)
Изделие функционирует без потребления электричества, исключительно под давлением воды, поступающей из водопроводной сети. После прибора вода сбрасывается в канализацию. Оснащается стандартным фильтром диаметром 142 мм.
Прибор поставляется потребителю в следующей комплектации:
- ячейка фильтровальная;
- насос водоструйный;
- устройство заборно-фильтровальное;
- устройство заборное;
- шланги соединительные в комплекте.
Габариты прибора 180*210*310. Масса – 3,2 кг.
Прибор ПВФ-142П Б (вакуумного фильтрования)
Это мобильный прибор, работоспособность которого не зависит от внешних источников питания. Он представляет собой узел фильтрации для выполнения работ непосредственно на исследуемом водоёме. В нём вакуумная станция и фильтровальная ячейка смонтированы на переносной раме. Такие приборы дают возможность выполнять предварительную обработку проб непосредственно во время их забора.
Прибор НПФ-142П Б (напорного фильтрования)

Используется для выполнения фильтрования воды, поступающей непосредственно из водоёма на объект надзора.
Комплектация прибора: ячейка фильтровальная; насос ножной; устройство заборно-фильтровальное; шланги соединительные в комплекте.
Прибор НПФ-70 Б (напорного фильтрования).
Позволяет фильтровать воду из крана водопровода. Работает от давления водопроводной сети. Рассчитан на работу с фильтром, диаметр которого составляет 70мм. Изделие состоит из: ячейки фильтровальной; насоса ручного; ёмкости мерной.
Паразитологический анализ позволяет своевременно выявить угрозу жизни и здоровья человека, исходящую от потребления зараженной патогенной микрофлорой питьевой воды и принять необходимые меры для её обеззараживания.
Читайте также:

