Исторические факты инфекции дыхательных путей
Обновлено: 26.04.2024
Цель исследования: выявление эволюции этиологических особенностей и клинических проявлений сочетанных острых респираторных вирусных инфекций (ОРВИ) у детей за последние 17 лет.
Материал и методы: проведен сравнительный ретроспективный анализ этиологической структуры, контингента заболевших и клинической картины болезни в 2 группах детей, лечившихся в стационарах г. Москвы в разное время: в 2002–2003 гг. (1-я группа, n=130) и 2018–2019 гг. (2-я группа, n=133). Этиологию ОРВИ определяли методами полимеразной цепной реакции (исследование мазков и/или отделяемого слизистой полости рта, носа, мокроты), иммуноферментного анализа (с определением антител к герпес-вирусам 1, 2, 6 типов, вирусу Эпштейна — Барр,цитомегаловирусной, хламидийной, микоплазменной инфекциям) при поступлении ребенка в стационар.
Результаты исследования: в сравниваемые периоды времени преобладали дети в возрасте до 6 лет (84,7% и 88% соответственно, р>0,05). Гендерных различий среди госпитализированных также получено не было. В 2018–2019 гг. отмечено более равномерное инфицирование в течение года, без четкой сезонности. По сравнению с началом 2000-х гг. отмечено увеличение доли расшифрованных (с 61,3% в 2002–2003 гг. до 76,3% в 2018–2019 гг.) и доли сочетанных (с 12,1% в 2002–2003 гг. до 17,3% в 2018–2019 гг.) ОРВИ у госпитализированных детей. Отмечено уменьшение доли детей 1-го года жизни и увеличение доли детей 3–6 лет, посещающих детские дошкольные учреждения. В этиологической структуре ОРВИ сочетанной этиологии в последние годы произошла смена ведущего вирусного агента — с респираторно-синцитиального вируса (53% сочетанных ОРВИ в 2002–2003 гг.) на риновирус (34,8% в 2018–2019 гг.). Клинические проявления сочетанных ОРВИ у госпитализированных детей в указанные годы характеризовались острым началом, повышением температуры, катаральным синдромом. Установлена тенденция к большей выраженности температурной реакции, но меньшей ее длительности в 2018–2019 гг. В 2018–2019 г. выявлено уменьшение доли пневмоний по сравнению с 2002–2003 гг., что привело к более редкому назначению антибактериальной терапии во всех группах госпитализированных детей. Кроме того, в 2018–2019 гг. отмечено уменьшение выраженности аускультативных изменений в легких и их длительности.
Выводы: полученные данные позволят рационально планировать профилактические и/или лечебные мероприятия, исходя из возрастных особенностей контингента детей, сезона года, клинических особенностей течения сочетанных ОРВИ.
Ключевые слова: дети, вирусные инфекции, ОРВИ, сочетанные инфекции, профилактика.
Для цитирования: Николаева С.В., Хлыповка Ю.Н., Музыка А.Д. и др. Эволюция острых респираторных вирусных инфекций сочетанной этиологии у детей. РМЖ. 2020;12:66-70.
Evolution of acute respiratory viral coinfections in children
S.V. Nikolaeva 1 , Yu.N. Khlypovka 1,2 , A.D. Muzyka 1 , D.V. Usenko 1 , S.V. Shabalina 1 , A.Yu. Medkova 2 , A.V. Gorelov 1,3 , Zh.B. Ponezheva 1
1 Central Research Institute of Epidemiology of the Russian Federal Service for Supervision
of Consumer Rights Protection and Human Well-Being, Moscow
2 Central Clinical Hospital and Polyclinic, Moscow
3 I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow
Aim: to analyze the changes in the etiology and clinical presentations of coexisted acute respiratory viral infections (ARVIs) in children over a 17-year period.
Patients and Methods: the comparative retrospective analysis of the etiology, population, and clinical presentations of ARVIs in children admitted to Moscow hospitals in 2002–2003 (group 1, n=130) and 2018–2019 (group 2, n=133) was performed. At admission, ARVI etiology was identified by polymerase chain reaction (oral or nasal smears and/or discharge, sputum) and enzyme immunoassay (antibodies to herpesvirus type 1, 2, and 6, cytomegalovirus, Epstein–Barr virus, Chlamydia, and Mycoplasma).
Results: children younger than 6 years predominated in both groups (84.7% and 88%, respectively, p>0.05). No gender differences were reported. In 2018–2019, the children were infected more evenly across the year, without clear seasonality. The increase in the percentage of the identified etiology of ARVIs (from 61.3% in 2002–2003 to 76.3% in 2018–2019) and the portion of ARVI coinfections (from 12.1% in 2002–2003 to 17.3% in 2018–2019) in children admitted to hospitals was revealed. Meanwhile, the percentage of children younger than 1 year reduced but the percentage of children aged 3–6 years visiting preschool facilities increased. Over the last years, the etiology of ARVI coinfections has changed from respiratory syncytial virus (53% of ARVI coinfections in 2002–2003) to rhinovirus (34.8% of ARVI coinfections in 2018–2019). The clinical presentations of ARVIs were characterized by acute onset, high temperature, and catarrhal syndrome. Temperature reaction tended to be more severe but of less duration in 2018–2019. The percentage of pneumonias reduced in 2018–2019 compared to 2002–2003. The result was less often prescription of antibacterial therapy in all groups of children. Additionally, reduced severity and duration of abnormal breath sounds revealed by auscultation was seen in 2018–2019.
Conclusions: our findings allow for a rational planning of preventive and/or therapeutic measures considering age-related characteristics of children, season, and the clinical features of ARVI coinfections.
Keywords: children, viral infections, ARVI, coinfections, prevention.
For citation: Nikolaeva S.V., Khlypovka Yu.N., Muzyka A.D. et al. Evolution of acute respiratory viral coinfections in children. RMJ. 2020;12:66–70.
Введение
Острые респираторные вирусные инфекции (ОРВИ) остаются актуальной проблемой педиатрии — из-за их распространенности, тяжести течения и исходов, наносимого экономического ущерба [1]. Возбудителями ОРВИ являются респираторные вирусы (аденовирусы, риновирусы, респираторно-синцитиальный вирус (РСВ), метапневмовирус, бокавирус, коронавирусы, вирусы гриппа, парагриппа). Разнообразие клинических форм заболеваний (от легкого ринита до тяжелой пневмонии), отсутствие патогномоничных симптомов и схожесть клинической картины затрудняют установление этиологических агентов, ответственных за развитие болезни. Между тем быстрое и точное выявление каждого вирусного патогена, участвующего в инфекционном процессе, имеет решающее значение для тактики ведения пациентов. В последние десятилетия активно внедряются в клиническую практику и повседневную рутинную диагностику ОРВИ молекулярно-генетические методы (полимеразная цепная реакция (ПЦР)), что позволило повысить выявляемость возбудителей респираторных инфекций по сравнению с традиционными методами. Однако в большей степени данные методы диагностики доступны на этапе стационарного лечения и практически не применяются в амбулаторном звене. Очевидно, что раннее обнаружение и идентификация возбудителя могут поддержать решение врача относительно выбора подходящего лечения и немедленного использования противовирусных препаратов, таких как ингибиторы нейраминидазы (в случае выявления гриппа) — для пациента, членов семьи или контактных лиц. Клиницисты часто назначают антибактериальную терапию в тех случаях, когда этиологический агент инфекции не выявлен [2]. Поэтому, несмотря на отсутствие специфических противовирусных препаратов и симптоматическое лечение при большинстве ОРВИ, быстрое обнаружение вирусного возбудителя может помочь избежать излишнего использования антибиотиков.
В последние годы возрастает роль сочетанных респираторных инфекций у детей. По данным литературы, частота сочетанных ОРВИ может варьировать от 15% до 50% [3–8]. Сочетанная патология изменяет течение болезни, ее клинико-лабораторную картину, что затрудняет диагностический поиск и может приводить к развитию бактериальных осложнений и неблагоприятным исходам. Поскольку информация о состоянии здоровья и особенностях течения ОРВИ у детей на современном этапе является крайне важной, это и определило актуальность проведенной работы.
Цель исследования: проанализировать эволюцию этиологических особенностей и клинических проявлений сочетанных ОРВИ у детей за последние 17 лет.
Материал и методы
Был проведен сравнительный ретроспективный анализ этиологической структуры, контингента заболевших и клинической картины болезни в 2 репрезентативных группах детей, лечившихся в стационарах г. Москвы в разное время: в 2002–2003 гг. (1-я группа, n=130) и 2018–2019 гг. (2-я группа, n=133).
Этиологию ОРВИ определяли методами ПЦР (исследование мазков и/или отделяемого слизистой полости рта, носа, мокроты), иммуноферментного анализа (с определением антител к герпес-вирусам 1, 2 типов, вирусу герпеса человека 6А/В, вирусу Эпштейна — Барр, цитомегаловирусной, хламидийной, микоплазменной инфекциям) при поступлении ребенка в стационар. При госпитализации всем пациентам проводили исследования, включающие клинический анализ крови с анализом лейкоцитарной формулы и определением скорости оседания эритроцитов (СОЭ), общий анализ мочи, микробиологическое исследование биологического материала из зева с определением чувствительности к антибактериальным препаратам. При наличии показаний использовали инструментальные методы диагностики: рентгенографию грудной клетки, электрокардиографию, исследование функции внешнего дыхания, ультразвуковое исследование. Все дети были осмотрены оториноларингологом.
Статистическую обработку данных проводили с использованием программы IBM SPSS Statistics 20. Для сравнения количественных показателей при подтвержденном нормальном распределении совокупностей использовались методы параметрической статистики. Сравнение показателей, измеренных в номинальной шкале, проводилось при помощи критерия χ 2 Пирсона, точного критерия Фишера. Сравнение средних значений проводилось с использованием t-критерия Стьюдента. Результаты считались достоверными при р
Результаты и обсуждение
При сравнении контингента заболевших детей (табл. 1) установлено, что в обеих группах преобладали пациенты в возрасте до 6 лет (84,7% и 88% соответственно, р>0,05). Достоверных гендерных различий среди госпитализированных получено не было, однако мальчики заболевали несколько чаще, чем девочки (59,2% / 59,4% против 40,8% / 40,6%), что характерно для многих инфекционных заболеваний.

По сравнению с началом 2000-х гг. отмечено увеличение доли расшифрованных (с 61,3% в 2002–2003 гг. до 76,3% в 2018–2019 гг.) и доли сочетанных (с 12,1% в 2002–2003 гг. до 17,3% в 2018–2019 гг.) ОРВИ у госпитализированных детей (рис. 1). По-видимому, это может быть связано с использованием современных высокочувствительных методов этиологической диагностики (в частности, ПЦР), а также с открытием новых возбудителей ОРВИ у человека (бокавируса, метапневмовируса, коронавирусов и др.).

Одновременно с эволюцией этиологической структуры сочетанных ОРВИ произошло и изменение возрастной структуры госпитализированных детей (рис. 2). Отмечено уменьшение доли детей 1-го года жизни и увеличение доли детей 3–6 лет, посещающих детские дошкольные учреждения.

В сравниваемые периоды времени изменилась годовая динамика госпитализации детей с сочетанными респираторными инфекциями (рис. 3): на фоне возрастания активности риновирусной инфекции, характеризующейся круглогодичной циркуляцией, сокращения числа случаев РСВ-инфекции (наиболее активной в зимне-весенний период) среди детей грудного и младшего возраста наблюдается более равномерная госпитализация в течение года, без четкой сезонности в холодное время, что также, вероятно, обусловлено и активным образом жизни родителей и их детей. При этом, как правило, одновременно заболевали не только дети, но и другие члены семьи, что может способствовать поддержанию циркуляции ОРВИ в популяции.
В сравниваемые периоды не выявлено изменения тяжести состояния госпитализированных с сочетанными ОРВИ детей, что, по-видимому, связано с сохраняющимися подходами к их госпитализации (табл. 2).

Для выявления эволюции особенностей клинического течения сочетанных ОРВИ в сравниваемые периоды анализ проводился в 4 группах наиболее частых сочетаний: РСВ + риновирус, риновирус + аденовирус, риновирус + парагрипп, РСВ + грипп (табл. 3). Клинические проявления сочетанных ОРВИ у госпитализированных детей характеризовались острым началом, повышением температуры, катаральным синдромом. При более детальном изучении температурной реакции установлена тенденция к ее большей выраженности, но меньшей длительности в 2018–2019 гг. Исключение составляет группа РСВ + риновирус, для которой отмечено достоверное уменьшение доли гипертермии выше 39,5° С. В 2019 г. выявлено уменьшение доли пневмоний по сравнению с 2002–2003 гг., что привело к более редкому назначению антибактериальной терапии во всех группах госпитализированных детей, за исключением группы РСВ + риновирус. Кроме того, уменьшение выраженности аускультативных изменений в легких и их длительности отмечено во всех группах в 2018–2019 гг. Вышеперечисленные изменения клинической симптоматики, по-видимому, происходят в результате раннего назначения противовирусных препаратов, арсенал которых широко известен и доступен повсеместно.

Выводы
За 17 лет наблюдений в возрастной структуре детей с респираторными инфекциями сочетанной этиологии снизилась доля детей 1-го года жизни и увеличилась доля детей в возрасте 3–6 лет, посещающих детские дошкольные учреждения.
В этиологии сочетанных ОРВИ возрос вклад риновирусной инфекции (до 34,8%), снизилась частота выявления РСВ, что отразилось на динамике госпитализации.
Клиническая картина сочетанных ОРВИ характеризуется острым началом, катаральным синдромом и лихорадкой, длительность которой сократилась.
Выявлено снижение осложнений от ОРВИ, а также более редкое использование антибактериальной терапии у госпитализированных детей.
Тестирование на основные респираторные патогены по-прежнему необходимо для оптимизации тактики терапии.
Полученные нами данные позволят рационально планировать профилактические и/или лечебные мероприятия, исходя из возрастных особенностей контингента детей, сезона года, клинических особенностей течения сочетанных ОРВИ.
Болезни дыхательных путей зачастую обостряются в холодный период года. Существует много разновидностей заболеваний верхних и нижних их отделов. Наиболее часто встречаются бронхиты, трахеиты, пневмония и т.д. Болезни дыхательных путей, особенно у детей, чаще всего возникают вследствие переохлаждения, а также недолеченных простудных заболеваний.
Симптомы
Болезни дыхательных путей имеют различные симптомы. Симптоматика этих недугов напрямую зависит от особенностей заболевания. Наиболее распространенными из них является кашель, сила которого возрастает в утреннее и ночное время. Также к симптомам болезней верхних дыхательных путей относятся болевые ощущения в глотке и повышенная утомляемость.
Болезни нижних дыхательных путей характеризуются наличием отдышки, болей в области груди во время вдоха, слабость. Также очень часто пациенты жалуются на появление:
- Головной боли;
- Состояние озноба;
- Болевые ощущения в мышцах;
- Обильное потение и т.д.
Все эти симптомы являются сигналом тревоги, которые требуют немедленного обращения больного в медицинское учреждение.
Лечение
При болезнях дыхательных путей требуются комплексное лечение, которое заключается в применении противовирусных препаратов, а также иммуномодуляторов. Также лечение болезней дыхательных путей требует произведения разнообразных физиопроцедур.
К основным из них относят паровые и ультразвуковые ингаляции, баночные массажи, магнитотерапия. Очень часто наряду с медикаментозной и симптоматической терапией используют и фитопрепараты. Применять эти средства самовольно не стоит. Лучше всего изначально посоветоваться с лечащим врачом. Курс лечения верхних дыхательных путей напрямую зависит от особенностей заболевания. В среднем курс лечения пациента составляет две недели.
Также процедуры могут проводиться в домашних условиях. При ринитах необходимо закапывать нос соком алоэ и делать ингаляции, для которых применяется теплая вода и сода. Высокоэффективными средствами при лечении этого заболевания является прополис, трава душица, ромашка и т.д. Эффективными методами фарадизации при ларингите, фарингите, тонзиллите являются употребление лимона, полоскание горла отварами из ромашки, мать-и-мачехи, эвкалипта, цвета липы и т.д.
Не смотря на то, что лечение народными средствами достаточно эффективное, лучше всего обратиться к врачу при первых признаках заболеваний дыхательных путей, который сможет поставить правильный диагноз и назначить рациональное лечение.
Профилактика
В целях профилактики необходимо придерживаться баланса между работой и отдыхом, а также обеспечить здоровый сон. Для профилактики болезней дыхательных путей у детей необходимо регулярно выполнять разнообразные дыхательные упражнения, а также очень часто пребывать на свежем воздухе, независимо от времени года. Лучше всего приучить детский организм к закаливанию, что убережет его от возникновение заболеваний в дальнейшем. Болезни дыхательных путей могут иметь очень серьезные последствия.
Поэтому при первых проявлениях этого заболевания лучше всего обратиться в медицинское учреждение, где смогут поставить пациенту правильный диагноз и назначить рациональное лечение. Для этого человеку не обходимо знать такие факты о болезнях дыхательных путей, как причины и симптомы. Благодаря этому при первых признаках заболевания вы сможете начать его лечение.
Что такое острые респираторные заболевания (ОРЗ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Острые респираторные заболевания (ОРЗ) — группа острых инфекционных заболеваний, при которых возбудители проникают в организм человека через дыхательные пути и вызывают синдром поражения респираторного тракта и общей инфекционной интоксикации. Употребление термина ОРВИ (острое респираторное вирусное заболевание) при отсутствии лабораторно подтверждённой этиологической расшифровки является некорректным.
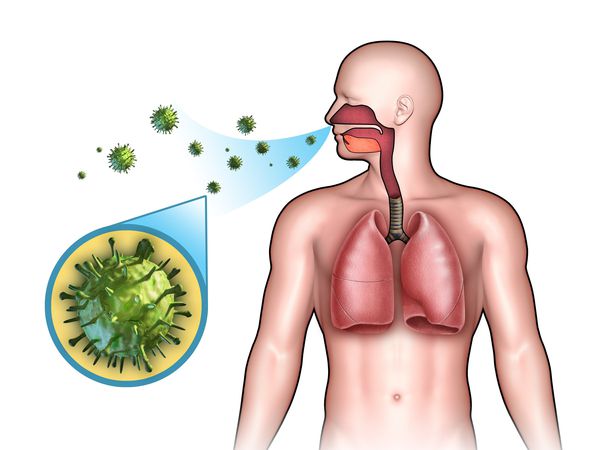
Этиология
ОРЗ — полиэтиологический комплекс заболеваний, т. е. они могут быть вызваны различными видами возбудителей:
- бактерии (стафилококки, стрептококки, пневмококки, гемофильная палочка, моракселла катаралис и др.);
- вирусы (риновирусы, аденовирусы, респираторно-синцитиальный вирус, реовирусы, коронавирусы, энтеровирусы, герпесвирусы, вирусы парагриппа и гриппа);
- хламидии (х ламидия пневмония , хламидия пситаки, хламидия трахоматис );
- микоплазмы (м икоплазма пневмония ).
Чаще всего возбудителем ОРЗ являются вирусы, поэтому термин ОРВИ используют небезосновательно. В последнее время иногда встречается употребление термина ОРИ (острая респираторная инфекция) [2] [4] .
Эпидемиология
ОРЗ — это преимущественно антропонозы, т. е. болезни, способные поражать только человека . Являются самой многочисленной и частой группой заболеваний у человека (до 80 % всех болезней у детей). Поэтому они представляют серьёзную проблему для здравоохранения различных стран вследствие наносимого ими экономического ущерба.
Источник инфекции — больной человек с выраженными или стёртыми формами заболевания. Восприимчивость всеобщая, иммунитет к некоторым возбудителям (аденовирусы, риновирусы) стойкий, но строго типоспецифичный. Это значит, что заболеть ОРЗ, вызванным одним видом возбудителя, но разными серотипами (их могут быть сотни), можно многократно. Заболеваемость повышается в осенне-зимний период, может принимать вид эпидемических вспышек, довлеет к странам с прохладным климатом. Чаще болеют дети и лица из организованных коллективов (особенно в период адаптации).
Основной механизм передачи — воздушно-капельный (аэрозольный, в меньшей степени воздушно-пылевой путь), но может также играть роль контактно-бытовой механизм (контактный — при поцелуях, бытовой — через загрязнённые руки, предметы или воду) [2] [7] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острых респираторных заболеваний (ОРЗ)
Инкубационный период различен и зависит от вида возбудителя, может варьироваться от нескольких часов до 14 дней (аденовирус).
Для каждого возбудителя ОРЗ имеются свои специфические особенности протекания заболевания, однако все их объединяет наличие синдромов общей инфекционной интоксикации (СОИИ) и поражения дыхательных путей в той или иной степени. СОИИ проявляется общей слабостью, адинамией, быстрой утомляемостью, повышенной температурой тела, потливостью и др.
Синдром поражения респираторного тракта (СПРТ) — основной синдром для данных заболеваний, он включает:
- Ринит — воспаление слизистой оболочки носа. Характеризуется заложенностью носа, снижением обоняния, чиханием, выделениями из носа — сначала прозрачными слизистыми, затем слизисто-гнойными (более плотные выделения жёлто-зелёного цвета появляются в результате присоединения вторичной бактериальной флоры). — воспаление слизистой оболочки глотки. Основные симптомы: першение и боли в горле различной интенсивности, сухой кашель — "горловой".
- Ларингит — воспаление слизистых оболочек гортани. Проявляется осиплостью голоса, иногда афонией (отсутствием голоса), кашлем и болью в горле.
- Трахеит — воспаление трахеи. Сопровождается мучительным, преимущественно сухим кашлем, саднением и болями за грудиной.
- Бронхит — воспаление слизистой оболочки бронхов. При этом возникает кашель с наличием мокроты и без, сухие хрипы, редко крупнопузырчатые хрипы при аускультации (выслушивании).
- Бронхиолит — воспаление бронхиол (мелких бронхов). Характеризуется наличием кашля различной интенсивности и хрипов разных калибров.
Дополнительными синдромами могут быть:
- синдром экзантемы (высыпания на кожных покровах);
- тонзиллита (воспаления миндалин);
- лимфаденопатии (ЛАП) — увеличения лимфатических узлов ; ( воспаления слизистой оболочки глаза) ;
- гепатолиенальный синдром (увеличение печени и селезёнки);
- геморрагический синдром ( повышенная кровоточивость) ;
- синдром энтерита (воспаления слизистой оболочки тонкого кишечника) .
Алгоритм по распознаванию ОРЗ различной этиологии:
Наиболее распространенным заболеванием, имеющим тяжёлое течение и высокий риск развития осложнений является грипп. Инкубационный период гриппа длится от нескольких часов до 2-3 дней. В отличие от других острых респираторных заболеваний, при гриппе сначала появляется синдром общей инфекционной интоксикации (высокая температура, озноб, сильная головная боль, слезотечение, боль при движении глазных яблок, ломота в мышцах и суставах). На 2-3-день присоединяются симптомы поражения респираторного тракта: першение в горле, насморк, сухой надсадный кашель.
Типичное ОРЗ начинается с чувства дискомфорта, першения в носу и горле, чихания. В течение непродолжительного периода симптоматика нарастает, першение усиливается, появляется чувство интоксикации, повышается температура тела (обычно не выше 38,5 ℃), появляется насморк, неярко-выраженный сухой кашель. В зависимости от вида возбудителя и свойств микроорганизма могут последовательно появляться все перечисленные синдромы ОРЗ в различных сочетаниях и степени выраженности. Возможно появление осложнений и неотложных состояний [6] [7] .
Патогенез острых респираторных заболеваний (ОРЗ)
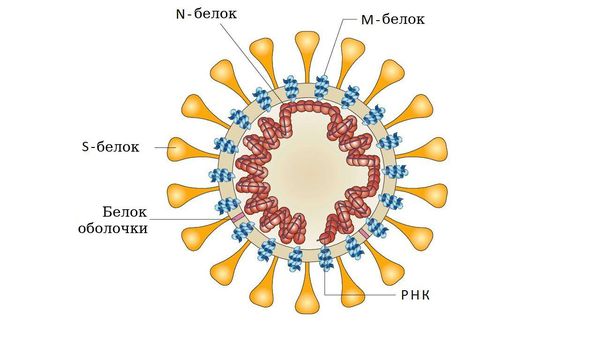
- у аденовирусов — гликопротеином (фибриллы);
- у парамиксо- или ортомиксовирусов шипами гемагглютинина;
- у коронавирусов — S-белком соединения и гликолипидами.
Взаимодействие болезнетворного агента с клеточными рецепторами необходимо не только для прикрепления его к клетке, но и для запуска клеточных процессов, подготавливающих клетку к дальнейшей инвазии. Т. е. наличие соответствующих рецепторов на поверхности клеток — это один из важнейших факторов, определяющих возможность или невозможность возникновения инфекционного процесса. Внедрение возбудителя в клетку хозяина вызывает поток сигналов, активирующих целый ряд процессов, с помощью которых организм пытается от него освободиться, например, ранний защитный воспалительный ответ, а также клеточный и гуморальный иммунный ответ. Повышение метаболизма клеток представляет собой защитный процесс, но с другой стороны в результате накопления свободных радикалов и факторов воспаления запускается патологический процесс:
- нарушается липидный слой клеточных мембран эпителия верхних отделов респираторного тракта и лёгких;
- нарушаются матричные и барьерные свойства внутриклеточных мембран, увеличивается их проницаемость;
- развивается дезорганизация жизнедеятельности клетки вплоть до её гибели.
Второй этап инфицирования характеризуется вирусемией — попаданием вируса в кровь и распространением по всему организму. В совокупности с повышением деятельности защитных механизмов и появлением в крови продуктов распада клеток этот процесс вызывает интоксикационный синдром.
Третий этап характеризуется усилением выраженности реакций иммунной защиты, элиминацию (выведение) микроорганизма и восстановление строения и функции поражённой ткани хозяина [5] [7] .
Классификация и стадии развития острых респираторных заболеваний (ОРЗ)
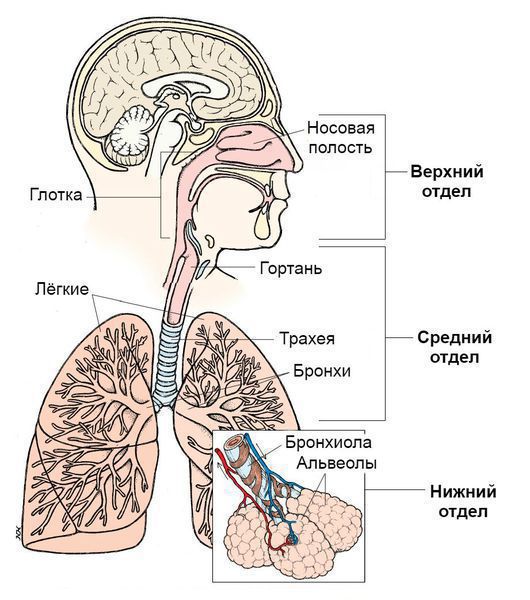
По вовлечению отдельных частей дыхательной системы:
- Инфекции верхних дыхательных путей. Верхние дыхательные пути начинаются с носа и включают голосовые связки в гортани, придаточные пазухи носа и среднее ухо.
- Инфекции нижних дыхательных путей. Нижние дыхательные пути начинаются с трахеи и бронхов и заканчиваются бронхиолами и альвеолами.
По клинической форме:
- Типичная.
- Атипичная:
- акатаральная (отсутствие признаков поражения дыхательных путей при наличии симптомов общей инфекционной интоксикации);
- стёртая (маловыраженная клиника);
- бессимптомная (полное отсутствие клинической симптоматики).
По течению:
По степени тяжести:
По длительности течения:
- острое (5-10 дней);
- подострое (11-30 дней);
- затяжное (более 30 дней) [8] .
Осложнения острых респираторных заболеваний (ОРЗ)
Если острое респираторное заболевание не пролечить вовремя, могут появиться различные более серьёзные заболевания:
- Связанные с ЛОР-органами: отит, синуситы, бактериальный ринит, ложный круп.
- Связанные с лёгочной тканью: вирусные пневмонии, вирусно-бактериальные и бактериальные пневмонии, абсцесс лёгкого ( ограниченный очаг гнойного воспаления в лёгочной ткани) , эмпиема плевры ( скопление гноя в плевральной полости) . Пневмония проявляется значимым ухудшением общего состояния, выраженным кашлем, усиливающимся на вдохе, при аускультации звуком крепитации ( потрескиванием или похрустыванием) , влажными мелкопузырчатыми хрипами, иногда одышкой и болями в грудной клетке.

- Связанные с поражением нервной системы: судорожный синдром, неврит ( воспаление нерва) , менингит ( воспаление оболочек головного и спинного мозга) , менингоэнцефалит (воспаление оболочек и вещества головного мозга), синдром Гийена—Барре и др. [10]
- Связанные с поражением сердца: миокардит (воспаление сердечной мышцы).
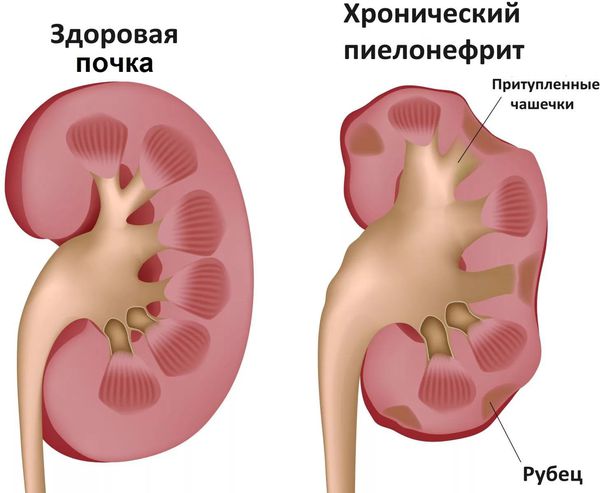
- Связанные с обострением хронических заболеваний: обострение ревматизма, тонзиллита, туберкулёза, пиелонефрита (воспаление почки) и др. [7]
Диагностика острых респираторных заболеваний (ОРЗ)
В широкой рутинной практике лабораторная диагностика ОРЗ (особенно при типичном неосложнённом течении) обычно не проводится. В отдельных случаях могут использоваться:
- Развёрнутый клинический анализ крови. При этом может обнаружиться лейкопения ( снижение количества лейкоцитов) и нормоцитоз ( нормальный размер эритроцитов) , лимфо- и моноцитоз ( увеличение числа лимфоцитов и моноцитов) , при наслоении бактериальных осложнений — нейрофильный лейкоцитоз со сдвигом влево (увеличение количество нейтрофилов и появление их незрелых форм );
- Общеклинический анализ мочи (изменения малоинформативны, указывают на степень интоксикации).
- Биохимические анализы крови. Может выявляться С-реактивный белок (указывает на наличие инфекции). При некоторых системных возбудителях, например аденовирусной инфекции, характерно повышение АЛТ.
- Серологические реакции. Возможна ретроспективная диагностика методами РСК, РА, ИФА, однако она редко используется в практической деятельности. В настоящее время широко применяется ПЦР-диагностика мазков-отпечатков, но её применение ограничено в основном стационарами и научно-исследовательскими группами.
При подозрении на развитие осложнений проводят соответствующие лабораторные и инструментальные исследования (рентген придаточных пазух носа, органов грудной клетки, КТ и др.) [3] [5] .
Лечение острых респираторных заболеваний (ОРЗ)
ОРЗ встречается очень часто и в большинстве случаев протекает в лёгкой и средней степени тяжести, поэтому обычно больные проходят лечение дома. При тяжёлых формах (с риском развития или развившимися осложнениями) пациенты должны проходить терапию в условиях инфекционного стационара до нормализации процесса и появления тенденций к выздоровлению. В домашних условиях лечением ОРЗ занимается терапевт или педиатр (в некоторых случаях инфекционист).
Пища должна быть разнообразной, механически и химически щадящей, богатой витаминами, рекомендуются мясные нежирные бульоны (идеально подходит негустой куриный бульон и т. п.), обильное питьё до — 3 л/сут. (тёплая кипячёная вода, чай, морсы). Хороший эффект оказывает тёплое молоко с мёдом, чай с малиной, отвар брусничных листьев.
Медикаментозная терапия ОРЗ включает в себя этиотропную (т. е. воздействующую на возбудителя заболевания), патогенетическую (дезинтоксикация) и симптоматическую (уменьшение беспокоящих симптомов) терапию.
Этиотропная терапия имеет смысл лишь при назначении в раннем периоде и лишь при ограниченном спектре возбудителей (в основном при гриппе). Использование средств отечественной фарминдустрии ("Арбидол", "Кагоцел", "Изопринозин", "Амиксин", "Полиоксидоний" и т. п.) не обладают никакой доказанной эффективностью и могут иметь эффекта, лишь в качестве плацебо.
В качестве симптоматической терапии могут быть использованы препараты следующих групп:
- жаропонижающие при температуре у взрослых свыше 39,5, у детей — свыше 38,5 ℃ (парацетамол, ибупрофен);
- противовирусные и антибактериальные глазные капли при конъюнктивите;
- сосудосуживающие капли в нос при заложенности носа и насморке (не более 5 дней);
- солесодержащие капли в нос при рините для разжижения слизи;
- противоаллергические препараты при аллергическом компоненте ОРЗ;
- средства противовоспалительного и противомикробного действия местного действия (таблетки, пастилки и др.);
- средства для улучшения образования, разжижения и выделения мокроты (муколитики);
- антибиотики широкого спектра действия (при отсутствии улучшения в течении 4-5 дней, присоединении вторичной бактериальной флоры и развитии осложнений) [2][6] .
Прогноз. Профилактика
Прогноз при ОРЗ — положительный. Больные обычно выздоравливают в течение 5-10 дней без неблагоприятных последствий. Осложнения респираторных заболеваний могут возникнуть при гриппе, другие возбудители менее агрессивны. Также неблагоприятные последствия возможны у пациентов с ослабленным иммунитетом. После выздоровления организмом вырабатывается иммунитет к той инфекции, которой человек переболел .
Ведущую роль в профилактике распространения ОРЗ (исключая грипп) является:

Перелом борьбы с болезнью пришелся на начало 60-х годов и был связан с внедрением массовой вакцинации. Успехи породили недопустимое благодушие, которое привело к снижению охвата прививками в 80-е годы. Результат – медленное, но характерное для дифтерии нарастание числа случаев. Это закончилось небывалой эпидемией с заболеваемостью 25 на 100 000 в 1994-95 гг., в ходе которой в СНГ заболело 120 000 человек и умерло более 6 000.
Введение в 1994 г. массовой иммунизации населения России против дифтерии с повторной ревакцинацией взрослых в 2003-2004 гг. позволило обеспечить достаточную специфическую защиту населения от этой инфекции, что привело к снижению заболеваемости дифтерией в России с 26,8 в 1994 г. до 0,01 на 100 тыс. населения в 2009-2011 гг.

Общие сведения
Дифтерия — инфекционное заболевание, известное очень давно, вызываемое бактерией Corynebacterium diphtheriae (бацилла Лёффлера).
Дифтерия чаще всего поражает ротоглотку, но нередко затрагивает гортань, бронхи, кожу и другие органы. Инфекция передаётся воздушно-капельным путём от больного человека к здоровому. Возможен контактно-бытовой путь передачи заболевания, особенно в жарких странах, где часты кожные формы проявления.
Тяжесть протекания дифтерии обусловлена крайне ядовитым токсином, который выделяет дифтерийная палочка. Именно дифтерийный токсин, поражающий нервную, сердечно-сосудистую и выделительную системы, представляет главную опасность для здоровья и жизни. Если дифтерия поражает ротоглотку, то помимо тяжёлой интоксикации возможно развитие крупа – удушья, развивающегося при непроходимости дыхательных путей из-за развивающегося отека и механической обтурации (закупорки) их дифтерийной плёнкой. Современная медицина выделяет несколько видов дифтерии. Это дифтерия носа, глаз, зева, гортани, кожи, раны, а также половых органов. Бывают случаи, когда данное инфекционное заболевание захватывает сразу несколько зон человеческого организма. Наиболее опасны для окружающих люди, страдающие дифтерией зева, носа и гортани, интенсивно выделяющие инфекцию в окружающую среду с выдыхаемым воздухом.
Вероятность заболеть
Опустошительные эпидемии дифтерии, жертвами которых, главным образом, являются дети, описаны во многих странах на протяжении всей истории. В странах с низким уровнем охвата прививками дифтерия по-прежнему является значительной проблемой для здоровья детей. Там, где уровень охвата прививками высокий, а естественный бустерный эффект незначительный (что наблюдается в большинстве промышленно развитых стран), значительная часть взрослого населения постепенно становится восприимчивой к дифтерии в результате снижения иммунитета.
Симптомы
Осложнения после перенесенного заболевания
Серьезность дифтерии определяется опасными осложнениями. Токсин может вызывать инфекционно-токсический шок (комплексный патологический сдвиг деятельности всех жизненно важных систем организма), миокардит (воспаление сердечной мышцы), множественные поражения нервных стволов, воспаление и дистрофию почечных канальцев и др.
Чаще всего дифтерия протекает с осложнением в виде паралича мягкого неба, голосовых связок, мышц шеи, дыхательных путей и конечностей. Из-за паралича дыхательных путей может наступить асфиксия (при крупе), провоцирующая летальный исход.
При локализированной форме дифтерии зева осложнения возникают в 5-20 % случаев; при более серьезных формах заболевания процент развития осложнений значительно увеличивается. Чем сложнее клиническая форма дифтерии, тем быстрее осложнения проявляются у больного.
Раньше всех страдает сердце: в конце 1-й – на 2-й неделе болезни возникает миокардит (воспаление сердечной мышцы), что является самой частой причиной смерти. Воспаление почек происходит в наиболее острый период болезни. Нервная система поражается как при клинических проявлениях дифтерии, так и спустя 2-3 месяца после выздоровления
Типичное осложнение дифтерии – периферические параличи, они могут быть ранними и поздними. Ранние параличи появляются в остром периоде заболевания, в процесс вовлекаются преимущественно черепные нервы. При этом голос становится гнусавым, больной поперхивается во время еды, жидкая пища выливается через нос, нёбная занавеска неподвижно свисает. При параличе аккомодации больной не может различать мелкие предметы на близком расстоянии, читать, становится дальнозорким. Возможны косоглазие, птоз, паралич лицевого нерва.
Смертность
До получения противодифтерийной антитоксической сыворотки летальность от дифтерии достигала 50-60%. После появления антитоксической сыворотки началось прогрессивное последовательное снижение летальности: 20% – у взрослых и 10% – у детей. Вслед за введением активной иммунизации заболеваемость стала быстро снижаться, дифтерия в смертности детского населения почти перестала играть роль.
Лечение
Лечение дифтерии проводится только в условиях стационара. Госпитализация обязательна для всех больных, а также больных с подозрением на дифтерию и бактерионосителей. Антибиотики (пенициллин или эритромицин) не оказывают влияния на вызванные экзотоксином поражения, но ограничивают дальнейший рост бактерий и продолжительность носительства возбудителя дифтерии, которое нередко продолжается даже после клинического выздоровления. Главным в лечении всех форм дифтерии (кроме бактерионосительства) является введение антитоксической противодифтерийной сыворотки (ПДС), которая подавляет дифтерийный токсин. Доза противодифтерийной сыворотки определяется тяжестью болезни. При подозрении на локализованную форму можно отсрочить введение сыворотки до уточнения диагноза. Если же врач подозревает токсическую форму дифтерии, то лечение сывороткой должно быть начато немедленно.
К сожалению, заболевание дифтерией не всегда создает защитный иммунитет. Поэтому лица, выздоравливающие от дифтерии, в процессе поправки должны завершить активную иммунизацию дифтерийным анатоксином.
Эффективность вакцинации
Вакцины
Последние эпидемии
До начала XX века дифтерия ежегодно уносила тысячи детских жизней, а медицина была бессильна облегчить их страдания и спасти от тяжелой агонии.
Перелом с начала 60-х годов связан с внедрением массовой вакцинации против дифтерии. Успехи породили недопустимое благодушие, которое привело к снижению охвата прививками в 80-е годы. Результат – медленное, но характерное для дифтерии нарастание числа случаев. Все это закончилось небывалой эпидемией с заболеваемостью 25 на 100 000 населения в 1994-95 гг., в ходе которой в СНГ заболело 120 000 человек и умерло более 6 000.
Исторические сведения и интересные факты

В настоящее время в европейских странах регистрируется 26-43 случаев заболеваний Хиб-инфекцией на 100.000 детей, смертность составляет 1-3 %, высок уровень неврологических осложнений.
ХИБ-инфекция плохо поддается лечению, поскольку гемофильная палочка рекордно устойчива к антибиотикам. По этой причине даже своевременное лечение современными антибиотиками зачастую оказывается безрезультатным.
В России, у детей до 6 лет до трети всех случаев гнойных менингитов вызвано гемофильной палочкой типа Б. Гемофильные менингиты плохо поддаются лечению, поскольку их возбудитель вырабатывает ферменты, которые делают его устойчивым к антибиотикам, поэтому результаты лечения не всегда удачны, и смертность при тяжелых формах заболевания может достигать 16–20%.
Пневмония, вызванная гемофильной палочкой типа Б, возникает преимущественно у детей с 2 до 8 лет, и ее течение в 60% случаев также имеет различные осложнения, в том числе со стороны сердца и легких.
В 2000 году до широкого внедрения Hib-вакцины в странах с ограниченными ресурсами Hib-инфекция была причиной 8,13 миллионов случаев возникновения серьезного заболевания у детей в возрасте 1-59 месяцев (амплитуда колебаний 7,33-13,2 миллионов случаев) и 371 000 случаев смерти (амплитуда колебаний 247 000 – 527 000). К 2008 году, когда 136 государств - членов ВОЗ внедрили вакцину, по оценкам, было 203 000 случаев смерти, обусловленных Hib-инфекцией, среди детей в возрасте младше 60 месяцев (амплитуда колебаний 136 000 – 281 000).
Заболеваемость Хиб-менингитом в России оценивается как 16,9 на 100 тыс. детей 0–5 лет, летальность при нем 15–20%, у 35% развиваются стойкие дефекты.

Общие сведения
Гемофильная инфекция (ХИБ-инфекция) вызывается гемофильной палочкой типа b – Haemophilus influenzae type b. Она может стать причиной острых инфекционных болезней – гнойного менингита, пневмонии (воспаления легких), эпиглоттита (воспаления надгортанника), артрита (воспаления суставов), а также гнойного поражения всего организма – сепсиса. Гемофильная инфекция характеризуется преимущественным поражением органов дыхания, центральной нервной системы и развитием гнойных очагов в различных органах. Бактерия H. influenzae локализуется в носоглотке, откуда может передаваться другим людям воздушно-капельным путем. Только у очень небольшого числа из тех, у кого в носоглотке локализуется возбудитель, развивается заболевание с клиническими проявлениями. Однако носители H. influenzae в носоглотке являются важным источником распространения возбудителя.
Вероятность заболеть
Выделяют несколько групп риска для данного заболевания. Во-первых, наиболее часто страдают от этой инфекции дети. По данным разных исследований, носительство гемофильной палочки в детском коллективе достигает 50%. У детей 6-12 мес., находящихся на искусственном вскармливании и не получающих небольших дополнительных количеств материнских антител с грудным молоком, особенно высок риск развития самых тяжелых форм инфекции – воспаления легких и менингита. По этой причине искусственное вскармливание является дополнительным показанием к прививке против ХИБ-инфекции, начиная с 3-месячного возраста.
Люди экстремальных возрастов (дети до 2-х лет, пожилые люди) и лица с низким социально-экономическим статусом также подвержены гемофильной инфекции. Кроме того, заболеванию подвержены лица с низким социально-экономическим статусом, крайне ослабленные и страдающие алкоголизмом, больные лимфогранулематозом (болезнь Ходжкина), серповидно-клеточной анемией; лица, подвергшиеся спленэктомии (удалению селезёнки).
Заболеваемость повышается в конце зимы и весной. За последние годы заметно увеличилась заболеваемость взрослых.
Симптомы
Длительность инкубационного периода установить трудно, так как заболевание нередко является следствием перехода латентной инфекции в манифестную. Может развиться как местный воспалительный процесс слизистой оболочки верхних дыхательных путей, так и заболевания, обусловленные гематогенной диссеминацией.
Осложнения после перенесенного заболевания
Часто гемофильная инфекция протекает у детей в виде обычной респираторной инфекции с соответствующими симптомами. Однако нередки случаи и более тяжелых форм инфекции. Наиболее тяжелой формой гемофильной инфекции является гнойный менингит. По некоторым данным в России у детей до 6 лет до трети всех случаев гнойных менингитов вызвано Haemophilus influenzae type b. Гемофильные менингиты плохо поддаются лечению, поскольку их возбудитель вырабатывает ферменты, которые делают его устойчивым к антибиотикам (около 20-30% гемофильных палочек, выделенных от больных, не чувствительны ко многим антибиотикам). Поэтому результаты лечения не всегда удачны, и смертность при тяжелых формах заболевания может достигать 16–20%.
У трети больных, перенесших гемофильный менингит, развиваются необратимые неврологические осложнения – судороги, задержка нервно-психического развития, глухота, слепота и др.
Пневмония, вызванная гемофильной палочкой типа b, возникает преимущественно у детей с 2 до 8 лет, и ее течение в 60% случаев также имеет различные осложнения, в том числе со стороны сердца и легких.
С гемофильной инфекцией связывают до половины всех гнойных инфекций уха, горла, носа, в частности, рецидивирующих гнойных отитов (воспаление среднего уха) и синуситов (воспаление придаточных пазух носа).
Гемофильный сепсис чаще развивается у детей 6-12 мес., предрасположенных к этому заболеванию. Протекает бурно, нередко как молниеносный, с септическим шоком и быстрой гибелью больного.
Гнойные артриты являются следствием гематогенного заноса гемофильной палочки, нередко сопровождаются остеомиелитом.
Смертность
В настоящее время в европейских странах регистрируется 26-43 случаев заболеваний, вызванных гемофильной палочкой, на 100 000 детей, смертность составляет 1-3%, высок уровень неврологических осложнений.
Лечение
Гемофильная ХИБ-инфекция плохо поддается лечению, поскольку гемофильная палочка рекордно устойчива к антибиотикам. По этой причине даже своевременное лечение современными антибиотиками зачастую оказывается безрезультатным. Пенициллиновые антибиотики, эритромицин, левомицетин, тетрациклин – процент устойчивости гемофильной палочки к ним составляет 80-100% (от числа выделенных образцов бактерий). Без этиотропной терапии некоторые формы гемофильной инфекции (менингит, эпиглоттит) почти всегда заканчиваются смертью больного. Необходимо как можно раньше начать лечение от гемофильной инфекции.
Эффективность вакцинации
В 2000 году, до широкого внедрения ХИБ-вакцины в странах с ограниченными ресурсами, ХИБ-инфекция была причиной 8,13 миллионов случаев возникновения серьезного заболевания у детей в возрасте 1-59 месяцев (амплитуда колебаний – 7,33-13,2 миллионов случаев) и 371 000 случаев смерти (амплитуда колебаний – 247 000=527 000). К 2008 году, когда 136 государств - членов ВОЗ внедрили вакцину против гемофильной палочки, по оценкам, произошло 203 000 случаев смерти, обусловленных ХИБ-инфекцией, среди детей в возрасте младше 60 месяцев (амплитуда колебаний – 136 000-281 000).
Эффективность ХИБ-вакцин — 95-100%, защитный титр антител сохраняется не менее 4-х лет.
Среди вакцинированных в 10 странах Европы, Израиле и Австралии ХИБ-инфекция развилась с частотой всего 2 случая на 1 млн; у 18% этих детей имелись проблемы, в т. ч. недоношенность; у 33% отмечались низкие уровни иммуноглобулинов.
Вакцины
В настоящее время единственное средство для профилактики этой инфекции – вакцинация. По рекомендациям ВОЗ, прививка против гемофильной инфекции показана всем детям. Эффективность вакцинации сегодня оценивается на уровне 95-100%. Проводились многочисленные испытания полисахаридных конъюгированных ХИБ-вакцин в Европе и Северной Америке. В частности, клиническое испытание в Великобритании (1991-1993) показало снижение на 87% заболеваемости менингитом гемофильной этиологии. В Голландии, при проведении аналогичного исследования, было зафиксировано полное отсутствие случаев менингита гемофильной этиологии в течение 2-х лет после начала иммунизации.
Современные вакцины представляют собой химически связанные антиген капсулы гемофильной палочки и столбнячного анатоксина, который нужен для того, чтобы основной антиген вырабатывал иммунитет у детей в возрасте до 18 месяцев.
Рекомендованные календари. ВОЗ рекомендует какой-либо один из следующих календарей прививок против ХИБ-инфекции:
- 3 дозы в рамках первичного курса вакцинации без бустерной дозы (3р+0);
- 2 дозы в рамках первичного курса вакцинации и бустерная доза (2р+1);
- 3 дозы в рамках первичного курса вакцинации и бустерная доза (3р+1).
В странах, где пик бремени тяжёлого заболевания гемофильной инфекцией типа b ложится на младенцев младшего возраста, введение 3-х доз вакцины в раннем возрасте может принести пользу.
Приказом Министерства здравоохранения российской Федерации №125 от 21.03.14 г. вакцинация против гемофильной инфекции тип b введена и в Национальный календарь профилактических прививок РФ для детей из групп риска.
Последние эпидемии
Исторические сведения и интересные факты
Читайте также:

