Из-за сифилиса может быть белок в моче
Обновлено: 17.04.2024
Белок в моче - как признак заболевания. Является ли белок в моче основанием для отказа к призыву в армию?
Словосочетание "белок в моче" известно многим, но вот что это значит, и как этот белок в мочу попадает, знают далеко не все.
Можно сказать, что моча - это результат переработки и очищения крови двумя биологическими фильтрами - почками. Почки фильтруют несколько литров крови ежедневно, выделяя из нее ненужные организму вещества - продукты жизнедеятельности. Из них и образуется моча. Однако почка должна "различать", что непригодно и должно пойти в мочу, а что нужно вернуть обратно в кровь. Именно поэтому нужные организму белки в состав мочи не входят, они фильтруются и возвращаются назад в кровоток. Таким образом, наличие белка в моче говорит о нарушении функции почек, либо о его большом количестве в самой крови. В принципе белок в моче может присутствовать, но лишь в небольших следовых количествах - это, так сказать, разовые "промахи" в работе почек. Допустимая концентрация белка в моче составляет 0.033 г/л, все, что выше этого показателя говорит о нарушении работы этих парных органов. Но лучше всего, когда белка в моче все же нет совсем.
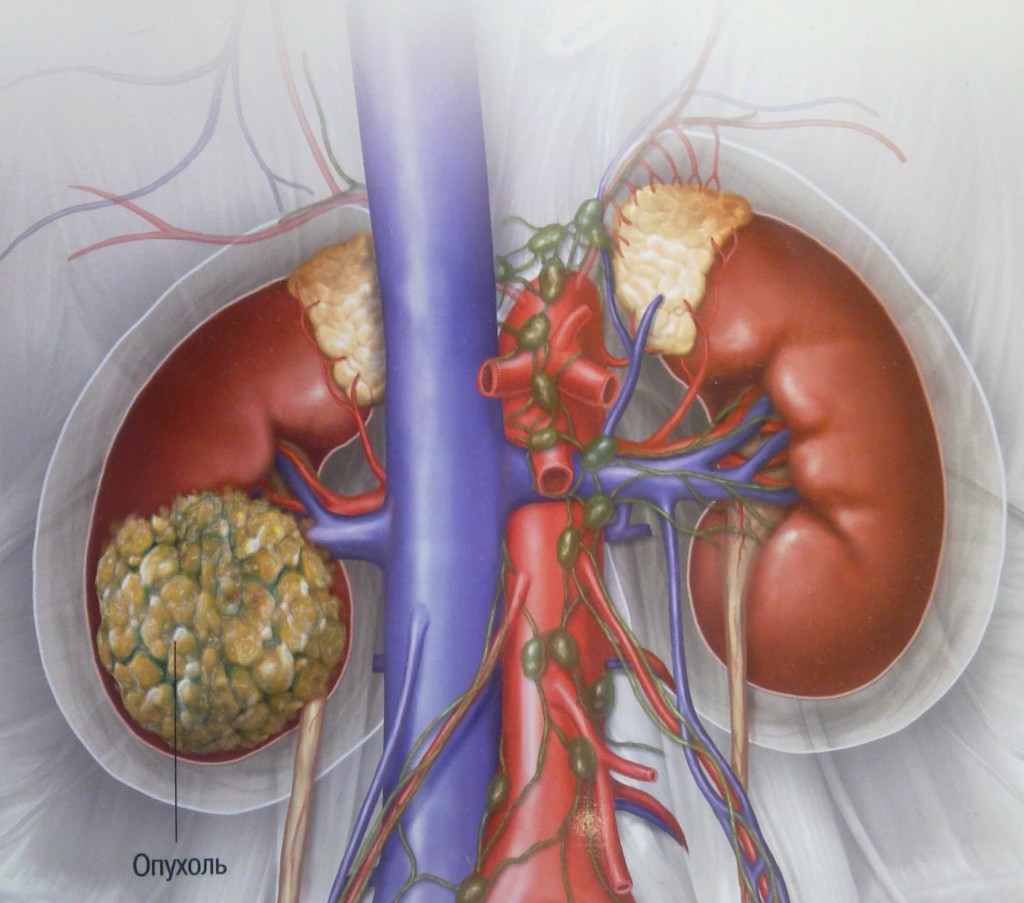
А какие именно заболевания сопровождаются выделением белка с мочой? Их достаточно много и по одному наличию белка в моче поставить точный диагноз и сказать, что человек не годен к прохождению военной службы, невозможно, врачу нужна сопутствующая клиническая картина, другие симптомы и признаки болезни, результаты анализов. Однако существует ряд конкретных заболеваний, которые белок в моче (протеинурию), скорее всего, спровоцируют. Во-первых, это, конечно, сами заболевания почек. При них фильтрационная способность этих органов нарушается, и белок проскакивает в мочу. Сюда относятся острый или хронический гломерулонефрит, при этом наряду с белком в моче могут быть и клетки крови - эритроциты. Пиелонефрит также приводит к протеинурии, но вместе с белком в моче часто обнаруживаются еще и лейкоциты - признак бактериального воспаления чашечно-лоханочной системы почек. При сахарном диабете в моче также будет белок, а вместе с ним и глюкоза. Если по каким-то причинам почки склерозировались, то есть нормальная функционирующая ткань заместилась соединительной, протеинурия становится ярко выраженной. Также злокачественные опухоли почек характеризуются наличием белка в моче.
Во-вторых, белок в моче может появляться из-за сложных заболеваний крови, например, лейкозов, в результате нарушения кроветворения - миеломной болезни.
Протеинурия часто возникает при злокачественных опухолях мочевыделительной системы, например, при раке мочеточников или мочевого пузыря. Инфекционные воспалительные процессы мочевыводящих путей тоже вызывают появление протеинурии.

А вообще белок в моче может повышаться при серьезных воспалительных процессах любых органов и систем, протекающих в организме, после серьезных хирургических вмешательств. Однако это обычно временное явление, стоит вылечить основное заболевание, и протеинурия исчезнет.
В связи с тем, что белок в моче может быть признаком достаточно грозных заболеваний, таких как рак, нефросклерозы и воспаления почек, призыв в армию людей, у которых обнаружилась протеинурия, ставится под большой вопрос. Но естественно, что белок в моче может быть временным явлением, например, при отравлении или инфекционном воспалении почек. В таком случае парень будет временно негодным к прохождению военной службы, его внесут в список Г. Этот призывник отправляется в больницу для дальнейшей диагностики и установления точной причины, по которой у него появился белок в моче. Сдаются с мочой и другие анализы: крови, УЗИ почек. После того, как основная причина протеинурии была выявлена, необходимо начать лечение, а оно весьма специфично для каждой конкретной болезни, приводящей к нарушению фильтрационной способности почек. Через определенный срок приемная комиссия выносит окончательное решение на основе сданных анализов и результатов лечения о том, годен ли призывник к прохождению военной службы, и если да, то на каких условиях.

Говоря конкретно о заболеваниях почек - самой распространенной причине протеинурии, нельзя не отметить, что все они многообразны и имеют различную степень тяжести. Понятно, что и больные призывники будут попадать в разные списки. Сразу отметим, что при наличии временных нарушений функции почек, которые могут быть связаны с острым заболеванием, обострением хронического процесса или хирургическим вмешательством, призывник подлежит внесению в список Г, то есть считается временно негодным к военной службе. Однако, скорее всего, после должного обследования и лечения на повторном прохождении комиссии его признают годным или годным к службе с незначительными ограничениями.
Большую роль в решении вопроса пригодности к службе лиц с заболеваниями мочеполовой системы играет стадия патологического процесса. Чем больше прогрессирует болезнь, тем выше вероятность того, что призывник будет не годен к прохождению военной службы, либо годен к службе ограничено и подлежит зачислению в запас. Однозначно можно сказать, что те парни, которые имеют заболевания почек с хронической почечной недостаточностью (ХПН), являются негодными к службе в армии.
А вот если ХПН у них нет, то они считаются ограничено годными к прохождению военной службы. Что касается других заболеваний, например, мочекаменной болезни, гидронефроза, кисты почек, уретритов и циститов, то здесь все весьма неоднозначно и основным критерием является степень нарушения функции органов мочеполовой системы, в результате которых появляется белок в моче. Чтобы определить эту степень, комиссия может назначить призывнику дополнительные анализы и пробы. Наконец онкологические заболевания, которые нередко сопровождаются протеинурией, однозначно освобождают от прохождения военной службы, равно как и тяжелые заболевания крови.
Почему в моче появляется белок
Как было сказано выше, причины протеинурии очень многочисленны. В зависимости от этого выделяются:
- Физиологическая протеинурия. Это небольшое количество белка в моче — не выше 150 мг, которое допустимо для здоровых людей.
- Патологическая протеинурия. Вызвана заболеваниями сердца, почек, эндокринными расстройствами, тяжелыми травмами, ожогами, сепсисом.
Случаи физиологической (функциональной) протеинурии:
- У новорожденных протеинурия вызвана тем, что еще не до конца развит почечный фильтр.
- У 12-40% дошкольников и школьников наблюдается ортостатическая протеинурия, провоцируемая длительным стоянием и ходьбой (в горизонтальном положении уровень выделяемого белка нормализуется).
- Уровень белка повышается после тяжелой физической нагрузки: работы, интенсивной тренировки, игровых видов спорта, длительных походов.
- Другой причиной выступает употребление большого количества белковой пищи (алиментарная протеинурия).
- Учеными доказано возникновение протеинурии на фоне экзаменов.
- При повышенной температуре тела тоже может повышаться белок (уровень падает, когда лихорадка исчезает).
Патологические причины протеинурии
Все патологические виды протеинурии по происхождению делятся на 3 вида:
Преренальной
При преренальной протеинурии повышен уровень низкомолекулярных белков, из-за чего происходит перегрузка почечного фильтра. Их концентрацию увеличивают следующие заболевания:
- онкологические заболевания крови;
- сердечная недостаточность (из-за застоя крови в почечных сосудах);
- множественная миелома;
- макроглобулинемия Вальденстрема;
- миодистрофии;
- рабдомиолиз (разрушение мышц).
Ренальной
Самый частый тип протеинурии — ренальная. Ее вызывают заболевания почек. В зависимости от того, что нарушено в работе органов, выделяют:
- Клубочковую протеинурию. Еще называется гломерулярной, поскольку поражается гломерулярный аппарат почек. Причинами выступают артериальная гипертензия (высокое давление), нефропатия у беременных или на фоне сахарного диабета, гломерулонефрит.
- Канальцевую протеинурию. В канальцах почек нарушается нормальное обратное всасывание белков. Это может быть вызвано приемом препаратов, вредных для почек, отравлением тяжелыми металлами, нефритом, поликистозом почек;
- Отторжением почечного импланта.
- Смешанную протеинурию. Характерна для большинства заболеваний почек.
Постренальной
Симптомы протеинурии могут быть связаны с воспалительными или дегенеративными изменениями в мочевыводящих путях. Здесь к причинам повышенного белка относятся:
- цистит; ;
- полипоз мочевого пузыря;
- мочекаменная болезнь;
- кровотечение из мочевыделительных органов; .
Как проявляется протенурия и что делать
Характерные жалобы при протеинурии отсутствуют, поскольку повышенный белок не имеет самостоятельных признаков. Если проблема вызвана каким-либо заболеванием, то у пациента наблюдаются симптомы этой болезни. Но при выявлении протеинурии даже без жалоб важно проконсультироваться с урологом или нефрологом, чтобы предположить причину и назначить дополнительные исследования.
Лечение протеинурии напрямую зависит от того, чем вызвано повышение белка. Если это физиологические причины, то коррекция не требуется. В остальных случаях назначают терапию, которая включает:
- диету с ограничением простых углеводов и животных жиров;
- отмену препаратов, токсичных для почек (если такие принимались пациентом);
- инъекции инсулина и сахароснижающие средства (при сахарном диабете);
- антибиотики (при пиелонефрите);
- гормональные препараты (при гломерулонефрите).
При поликистозе и раке почки может быть назначено хирургическое лечение — резекция, т. е. удаление пораженной части, или тотальная нефрэктомия (полное удаление).
Прогноз напрямую зависит от причины протеинурии. Поскольку провоцирующих факторов очень много, при получении результатов анализа, где повышен белок, важно сразу обратиться к специалисту. Если своевременно пройти дополнительные исследования и вовремя начать коррекцию, прогноз при серьезных заболеваниях будет более благоприятным.
Акопян Гагик Нерсесович - врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова
Даже при осмотре врачу сложно обнаружить опухоль почки, поскольку прощупать забрюшинное пространство очень непросто, особенно если новообразование пока небольших размеров. В то же время ранняя диагностика улучшает прогноз. Но как обнаружить болезнь, если, как и многие виды онкологических заболеваний, рак почки на ранней стадии практически никак себя не проявляет? Необходимо замечать самые незначительные изменения в состоянии здоровья. Некоторые симптомы могут говорить о начале злокачественного процесса в почке.
Какой симптом первым указывает на рак почки
Отсутствие ярких признаков рака почки на ранней стадии — главная проблема. Пациенты с незапущенной формой болезни, когда она еще полностью излечима, не испытывают никаких симптомов. В результате диагноз ставят случайно при УЗИ или КТ, проводимых в рамках планового обследования по другим поводам.
Заподозрить проблему можно по комплексу странных признаков, появившихся примерно одновременно. Самые ранние симптомы рака почки — это могут быть боль в животе и пояснице, резь при мочеиспускании и почечная колика, возникающая из-за того, что сгусток крови перекрыл мочеточник.
Гематурия
У кого-то в качестве первого симптома рака почки была гематурия — внезапное появление крови в моче. В сочетании с болью в спине это говорит о том, что опухоль начинает прорастать в соседние отделы и распространяться на мочеточник. На такой стадии уже начинают появляться первые симптомы. Они могут сопровождаться общей слабостью, повышенной утомляемостью и ночной потливостью.
Кровь появляется в моче сначала в небольшом количестве. Затем исчезает на пару дней или недель. Но затем симптом возвращается, и в моче обнаруживаются уже сгустки крови. Это объясняется тем, что опухоль давит на соседние ткани, вызывая их кровоизлияние. Если этот процесс слишком интенсивный, появляется сильная слабость, развивается анемия (недостаток гемоглобина в крови).
Боль в боку и объемное образование в животе
Гематурия входит в классическую триаду симптомов. Кроме нее появляются:
- боль, дискомфорт в боку (ноющая, то нарастающая, то отступающая);
- уплотнение, объемное образование, ощутимое под передней брюшной стенкой, под ребрами.
Но нужно понимать, что даже классическая триада наблюдается не у всех пациентов. По статистике менее чем у 10%.
Общее ухудшение самочувствия
Рак почки первой стадии, как другие онкологические заболевания, вызывает общую интоксикацию организма. Это проявляется в виде слабости, похудения при том же питании, бессоннице. Человек ощущает нехватку энергии, по вечерам у него повышается температура и артериальное давление. Распространенная ситуация, когда симптомы списываются на усталость, простуду, депрессию. Из-за этого человек не придает внимания признакам, а болезнь только усугубляется.
Изменение биохимии крови
Даже на ранней стадии опухоль нарушает работу кровеносной системы. Это можно заметить по изменениям показателей биохимии крови. В анализе обнаруживается повышение щелочной фосфатазы, билирубина, кальция, а также снижение количества глюкозы и альбумина. В сочетании с анемией, увеличением скорости оседания эритроцитов, повышением количества инсулина и ХГЧ это может говорить о раке почки.
Варикозное расширение вен
В качестве первого признака рака почки у мужчин можно назвать расширение вен семенного канатика и яичка — варикоцеле. Это один из наиболее характерных признаков. Связан с опухолевым тромбозом, при котором опухоль сдавливает нижнюю полую вену. По той же причине отекают ноги, расширяются подкожные вены.
Что делать при появлении первых признаков рака почки
Итак, подведем итог, как определить рак почки на ранней стадии:
- В моче появилась кровь (это может быть даже единичный случай с небольшим количеством).
- В боку и пояснице ощущается боль и дискомфорт.
- Ухудшается общее состояние: может быть лихорадка, слабость, повышенное давление, нехватка энергии.
- В районе живота под ребрами может нащупываться постороннее новообразование.
- Из-за воздействия опухоли на кровеносную систему нарушается кровоток, что проявляется варикозным расширением вен, причем у мужчин варикоз поражает и семенные канатики (развивается варикоцеле).
- Меняются некоторые показатели крови: повышается фосфатаза, кальций, билирубин, снижается глюкоза и альбумин.
Если у вас есть перечисленные симптомы, один или несколько, стоит обратиться к урологу. Специалист назначит дополнительные исследования: УЗИ, КТ или МРТ, рентгенографию и пр. Это поможет подтвердить диагноз или найти другую причину появления симптомов. Если рак почки обнаружить на ранней стадии, можно решить проблему с помощью органосохраняющей операции путем лапароскопии. Главное — вовремя обратиться к врачу. Запишитесь на прием к урологу в Государственном центре урологии и пройдите диагностику бесплатно по полису ОМС.
Акопян Гагик Нерсесович - врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова
Ложноположительные (ЛПР) и ложноотрицательные серологические реакции на сифилис

Ложноположительные серологические реакции на сифилис (ЛПР) – это положительные реакции у людей, которые никогда не болели и в момент обследования не болеют сифилисом. То есть специфической инфекции в организме нет и не было, а серологические реакции дают положительный результат.
Ложноположительными, или неспецифическими результатами называют положительные результаты серологических реакций на сифилис у лиц, не страдающих сифилитической инфекцией, и не болевших сифилисом в прошлом.
Ошибочный анализ на сифилис из-за технических причин

ЛПР могут быть обусловлены техническими погрешностями и ошибками при выполнении исследований, а также качеством реагентов. Несмотря на многочисленные достоинства диагностикумов для РПГА, ИФА и РИФ и их модификаций, применяемых для диагностики сифилиса, в отдельных случаях отмечаются недостоверные результаты анализов. Это может быть связано как с недостаточным уровнем квалификации и профессиональной ответственности персонала (так называемые небиологические или технические ошибки), так и с особенностями тестируемых образцов (биологические ошибки).
Ошибки небиологического характера могут возникать на любом этапе проведения исследований: преданалитическом, аналитическом, и постаналитическом т.е. при заборе, транспортировке, хранении биоматериала, использовании хилезной, проросшей сыворотки, при неоднократном замораживании и оттаивании тестируемых образцов, а также при использование диагностикумов с истекшим сроком годности и т.д. В частности, несоблюдение условий и сроков хранения диагностических наборов является причиной снижения чувствительности реакции и получения ложноотрицательных результатов.
Ложноположительные результаты может вызвать контаминация сывороток пациентов, серонегативных в отношении бледной трепонемы, следами сывороток серопозитивных лиц, что может иметь место при приготовлении сывороток.
Существует множество других технических ошибок, приводящих к получению недостоверных (ложноотрицательных и ложноположительных), сомнительных результатов исследования. В некоторых лабораториях не осуществляется внутри- и внешнелабораторный контроль качества исследований на сифилис, что ведет к получению диагностических ошибок и неуверенности врачей-лаборантов в результатах анализа.
Источником ошибок при постановке неспецифических тестов могут быть неиспользование контрольных сывороток, неравномерная концентрация антигена в опыте из-за недостаточного перемешивания ее перед использованием, контаминация образцов и посуды микроорганизмами, нарушение сроков и условий хранения компонентов реакции, нарушение техники взятия крови.
В современных тест-системах в качестве антигена нашли применение рекомбинантные или синтетические пептиды. Первые получили большее распространение. Но при плохой очистке в смесь антигенов T. pallidum попадают белки Escherichia coli, что приводит к ложной серодиагностике сифилиса у больных эшерихиозом или здоровых, в сыворотке которых обнаружены антитела к кишечной палочке.
В определенной степени к диагностическим ошибкам следует отнести и неправильную трактовку результатов исследования.
Острые и хронические ЛПР
Помимо технических ошибок при выполнении тестов, ЛПР могут быть обусловлены и особенностями организма. Условно ЛПР разделяют на острые (хронические (сохраняются более 6 месяцев).
Острые ЛПР могут наблюдаться при беременности и во время менструации, после вакцинации, после недавно перенесенного инфаркта миокарда, при многих инфекционных заболеваниях. Инфекции, при которых могут отмечаться ЛПР — пневмококковая пневмония, скарлатина, инфекционный эндокардит, туберкулез, лепра, венерическая лимфогранулема, шанкроид (мягкий шанкр), лептоспироз и другие спирохетозы, ВИЧ-инфекция, инфекционный мононуклеоз, малярия, ветряная оспа, вирусные гепатиты, паротит, корь, респираторные заболевания, грипп и дерматозы.
Хронические ЛПР возможны при аутоиммунных заболеваниях, системных болезнях соединительной ткани, онкологических заболеваниях, хронической патологии печени и желчевыводящих путей, при сердечно-сосудистой и эндокринной патологии, при заболеваниях крови, при хронических заболеваниях легких, при инъекционном применении наркотиков и др. При большинстве этих состояний выявляют антикардиолипиновые антитела классов IgG и IgM ("реагины").
Хронические ложноположительные реакции могут являться преклиническими проявлениями тяжелых заболеваний. При злокачественных новообразованиях, диффузных болезнях соединительной ткани титр ЛПР может быть очень высоким.
Среди причин хронических положительных реакций выделяют физиологические состояния (пожилой возраст). С возрастом количество ЛПР увеличивается, у женщин они наблюдаются в 4,5 раза чаще, чем у мужчин. В возрастной группе 80-летних лиц распространенность ЛПР составляет 10%.
Причиной ЛПР могут быть частое использование вводимых внутривенно препаратов, частые переливания и инфузии.
Хронические инфекции (туберкулез, лепра, инфекционный эндокардит, малярия), миелома также могут стать причинами ЛПР.
Заражение другими видами спирохет
Ложноположительные реакции трепонемных и нетрепонемных тестов могут наблюдаться при инфекционных заболеваниях, возбудители которых имеют антигенное сходство с бледной трепонемой. Это возвратный тиф, лептоспироз, клещевой боррелиоз, тропические трепонематозы (фрамбезия, беджель, пинта), а также воспалительные процессы, обусловленные сапрофитными трепонемами полости рта и гениталий.
Возбудители эндемических трепонематозов (фрамбезия, пинта, беджель) — это трепонемы, которые обладают родоспецифическими антигенами, сходными с антигенами T.pallidum. В связи с этим антитела, образующиеся к ним, способны вступать в перекрестные взаимодействия с антигеном возбудителя сифилиса.
Россия не является территорией, эндемичной по данной группе заболеваний. Эти инфекции встречаются главным образом, в странах Африки, Латинской Америки и Южной Азии, и случаи заболеваний редки в практике лечебных учреждений.
Пациента с положительными серологическими реакциями на сифилис, прибывшего из страны с эндемическими трепонематозами, необходимо обследовать на сифилис и назначить противосифилитическое лечение, если оно ранее не проводилось.
Начиная с 1938 года, и особенно во время Второй Мировой войны, в США стали широко проводиться скрининговые серологические исследования для выявления сифилиса. Исследователи сопоставили полученные данные и выяснили, что положительная или сомнительная реакция обнаруживалась у людей не имевших клинических и эпидемиологических признаков сифилитической инфекции или контактов по сифилису. Причем такие результаты возникали гораздо чаще, чем предполагалось ранее. Положительные результаты нетрепонемных тестов с липидными или кардиолипиновыми антигенами (VDRL, в тестах Колмера, реакции Кана) были обнаружены у пациентов с различными заболеваниями, но не имеющих признаков сифилитической инфекции. Биологические ложнополжительные результаты были выявлены у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями.
Оказалось, что Б-ЛПРВ может встречаться в двух основных вариантах — остром и хроническом. В первом случае у больных, перенесших какую-либо, но не сифилитическую инфекцию, Б-ЛПРВ исчезает в процессе выздоровления, и длительность ее обнаружения не превышает шести месяцев. Во втором случае Б-ЛПРВ может устойчиво сохраняться в течение многих лет в отсутствие очевидного причинного фактора. В начале 50-х годов было установлено, что наиболее часто хроническая Б-ЛПРВ выявляется при аутоиммунных заболеваниях, особенно СКВ, при которой частота ее обнаружения достигает 30—44%
Ложноположительность нетрепонемных (кардиолипиновых) тестов
Липидные антигены T. pallidum cоставляют значительную часть клетки, однако в организме могут присутствовать и имеющие такое же строение липиды – аутоантигены, образующиеся в результате разрушения органов и тканей (в основном липиды митохондриальных мембран).
Сифилитическая инфекция сопровождается образованием иммунных комплексов и аутоиммунным ответом на кардиолипин, фибронектин, коллаген и мышечную креатинкиназу. В нетрепонемных тестах в качестве антигена используют раствор трех высокоочищенных липидов (кардиолипин, стабилизированный лецитином и холестерином) в этиловом спирте. Кардиолипин не является специфичным компонентом для T. pallidum, а также описан как один из фосфолипидов биомембран человека. Поэтому антитела к этому антигену регистрируют в сыворотке практически при любой альтерации клеток человека в результате инфекций и при некоторых физиологических и патологических состояниях.
Так как антиген, используемый в нетрепонемных реакциях, обнаруживается в других тканях, тесты могут давать положительные результаты у лиц без трепонемной инфекции (1—2 % в общей популяции).
Наиболее частой причиной биологических ложноположительных нетрепонемных тестов является антифосфолипидный синдром — аутоиммунный процесс, встречающийся при заболеваниях соединительной ткани (системной красной волчанке, дерматомиозите, склеродермии).
Другими факторами возникновения ложноположительных результатов считаются некоторые хронические бактериальные инфекции (лепра и др.), заболевания вирусной этиологии (инфекционный мононуклеоз), системные болезни соединительной ткани.
Причины также могут заключаться в пожилом возрасте (старше 70 лет), беременности, обширной соматической патологии, нарушениях обмена липидов, иммунодефицитных состояниях различной этиологии, системными хроническими заболеваниями сердца, легких.
Среди других причин следует отметить онкологические заболевания, туберкулез, энтеровирусные инфекции, вирусные гепатиты, болезнь Лайма, пневмонии, алкоголизм, наркоманию, сахарный диабет, вакцинацию, другие инфекции (малярия, ветряная оспа, корь, эндо- и миокардиты), подагру.
При этих состояниях отмечается развитие иммунологических нарушений, приводящих к аномальной продукции антител, способных перекрестно реагировать и с трепонемными антигенами.
Ложноположительность трепонемных тестов
Проблема усугубляется тем, что трепонемные тесты также могут быть ложноположительными. Причинами могут являться аутоиммунные заболевания, коллагенозы, болезнь Лайма, беременность, лепра, герпес, малярия, инфекционный мононуклеоз, опухоли, наркомания. В последние годы для дифференциации ЛПР за рубежом начали активно использовать иммуноблоттинг — один из самых современных методов диагностики сифилиса.
Сохранение антител после успешного лечения
Специфические диагностические реакции длительное время остаются положительными даже после полноценной терапии. После эффективного лечения сифилитической инфекции, у большинства больных титры в нетрепонемных тестах снижаются в 4 раза через 6–12 месяцев после лечения. Однако, при позднем начале терапии, титры даже в нетрепонемных тестах могут сохраняться на прежнем уровне, но никогда не увеличиваться.
Ложноотрицательные результаты анализов

Различные методы диагностики демонстрируют различную чувствительность и специфичность в зависимости от формы и стадии сифилиса. Вероятность ошибочного диагноза возрастает, особенно в случаях латентного, скрытого, сочетанного течения заболевания.
Ложноотрицательные серологические реакции на сифилис могут наблюдаться при вторичном сифилисе вследствие феномена прозоны при тестировании неразведенной сыворотки, а также при обследовании лиц с иммунодефицитным состоянием, например ВИЧ-инфицированных пациентов.
В ИФА такие реакции можно объяснить наличием серонегативной фазы при первичном сифилисе, а при вторичном — иммунной недостаточностью, наличием ВИЧ-инфекции. При получении отрицательного результата серологических исследований на сифилис следует учитывать свойство бледных трепонем проникать и размножаться в различных органах и тканях — поиск возбудителя в лимфе (лимфатических узлах) в ряде случаев приводит к достоверному результату. Целесообразно повторить также анализ образцов, давших положительный результат. Повторное, через 5–7 и более дней, исследование сывороток, как правило, позволяет получить достоверные результаты.
Реакции иммунной системы организма при заражении сифилисом

Сифилис - это инфекционное заболевание, вызываемое бледной трепонемой (бактерией Treponema pallidum). Организм человека, заболевшего сифилисом, защищается от возбудителя заболевания с помощью механизмов иммунитета. Проникновение, длительное сохранение в организме (персистенция) и размножение возбудителя заболевания в организме хозяина приводят к выраженным изменениям со стороны иммунной системы.
После попадания бледных трепонем в организм и при их дальнейшем размножении, в организме больного человека происходят иммунные сдвиги. Механизм иммунного ответа при сифилисе исследован не полностью, однако имеются достаточно убедительные данные о том, что в этом процессе участвуют все звенья иммунной системы.
Активируются механизмы как врожденного неспецифического иммунитета, свойственного человеку как биологическуому виду, так и адаптивного, антиген-опосредованного иммунного ответа, вызванного контактом с антигеном. В иммунном ответе организма принимают участие как клеточные (макрофаги, Т-лимфоциты), так и гуморальные механизмы (синтез специфических иммуноглобулинов — антител).
Иммунную реакцию вызывают белки, входящие в состав структур бледной трепонемы; они являются чужеродными веществами для организма человека и относятся к антигенам. Все антигены трепонемы способны стимулировать организм больного вырабатывать антитела соответствующих классов. Вследствие этого, в сыворотке крови больных сифилисом отмечается множественность антител: протеиновых, комплементсвязывающих, полисахаридных реагинов, иммобилизинов, агглютининов.
Классы вырабатываемых антител меняются на разных этапах течения сифилиса — в различных стадиях болезни преобладают то одни, то другие антитела, относящиеся к разным классам иммуноглобулинов. Сила иммунного ответа и спектр антител, выявляемых на разных стадиях развития инфекции, зависит от особенностей организма у данного человека.
Во многих случаях иммунологический ответ не предотвращает поэтапного развития инфекции. Организм хозяина неспособен уничтожить сифилитическую инфекцию, что приводит к дальнейшей эволюции патологического процесса. Болезнь, начавшись с местного процесса, распространяется на весь организм и продолжается много лет.
Клеточный и гуморальный иммунный ответ на внедрение бледной трепонемы в организм
В иммунном ответе организма на заражение принимают участие клеточные и гуморальные механизмы иммунитета.
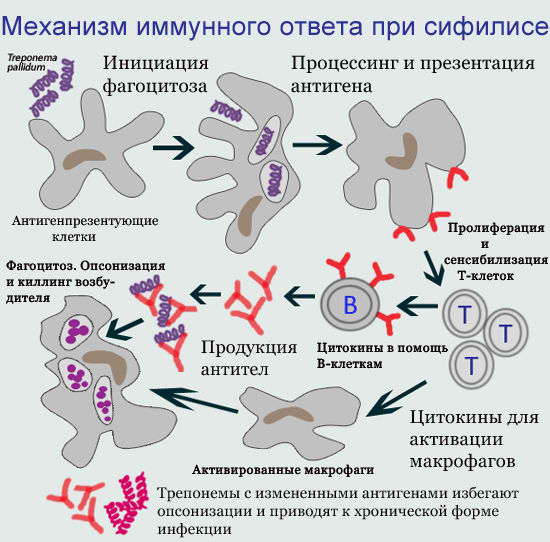
1. Клеточный иммунитет при заражении сифилисом
На клеточном уровне бледной трепонеме противодействуют высокоспециализированные клетки иммунной системы — макрофаги, T-лимфоциты, B-лимфоциты. Происходит изоляция и частичное уничтожение трепонем фагоцитами, в основном макрофагами. Фагоцитоз носит преимущественно незавершенный характер — при поглощении фагоцитом возбудитель не погибает, а остается в клетке, сохраняя свою структуру и способность к размножению. Более того, фагоцит оберегает от антител и воздействия антибиотиков бледную трепонему, которая становится недоступной для защитных сил организма.
Ранний сифилис характеризуется частичным угнетением клеточного иммунитета и развитием состояния иммуносупрессии, постепенно нарастающей активизацией гуморального иммунитета. Клеточное звено страдает в первую очередь, так как Т-лимфоциты более чувствительны к воздействию бактерий T. pallidum.
У больных вторичным, латентным и третичным сифилисом формируется клеточный иммунитет, признаки которого выявляются в реакциях in vivo (кожные пробы) и in vitro (стимуляция Т-лимфоцитов трепонемными антигенами).
2. Гуморальный иммунитет при заражении сифилисе
Гуморальный иммунный ответ заключается в продукции широкого спектра противосифилитических антител. В структуре бледной трепонемы выявлено большое количество соединений, имеющих выраженные антигенные свойства для иммунной системы человека. На начальных этапах развития сифилиса происходит более выраженный синтез антител к антигенам, имеющим высокое содержание в клетке T. pallidum и локализующимся в структуре мембран наружной клеточной стенки или протоплазматического комплекса.
3. Уклонение бледных трепонем от иммунного ответа
Клеточное и гуморальное звенья иммунитета не в состоянии обеспечить полное уничтожение и элиминацию бледных трепонем. Благодаря своему необычному молекулярному строению, T. pallidum обладает замечательной способностью уклоняться от защитной реакции макроорганизма.
Электронно-микроскопические исследования показали, что при сифилисе преобладает незавершенный фагоцитоз трепонем (захват и поглощение трепонем лейкоцитами, макрофагами и другими клетками). При этом трепонемы не погибают, а получают защиту от антибиотиков и антител, и могут даже размножаться в фагоцитирующей клетке. В течение всего инкубационного периода, а также в конце первичного и в начале вторичного периодов сифилиса, возбудители активно размножаются и распространяются по всему организму.
Гуморальный иммунный ответ. Противосифилитические антитела.
1. Неспецифические антитела при сифилисе
Реагиновые антитела у больного сифилисом — это иммуноглобулины класса IgG и IgM. Они являются комплексным ответом на высвобождение липоидных молекулярных фрагментов из поврежденных клеток хозяина, а также на появление липопротеиноподобных структур, сходных с кардиолипином, входящих в состав бактериальной клетки бледной трепонемы.
Липидные антигены cоставляют значительную часть бактериальной клетки T. pallidum. Помимо других антигенов, в клеточной стенке бледной трепонемы содержится фосфолипид кардиолипин; на его долю приходится около 30% сухого вещества клетки спирохеты. В организме человека, больного сифилисом, могут присутствовать липиды, имеющие сходное строение с липоидными структурами клеточной стенки бледной трепонемы. Это аутоантигены, образующиеся в результате разрушения органов и тканей, в основном липиды митохондриальных мембран.
Аутоантигены - это компоненты клеток и тканей собственного организма, которые распознаются при определённых условиях как частично чужеродные. Аутоантитела к кардиолипину – это антитела, направленные организмом против собственного кардиолипина.
Клетки человека, больного сифилисом выделяют в большом количестве липоидный и липопротеиноподобный материал, сходный с кардиолипином. Бледная трепонема приводит к поражению внутренних органов, в частности, к повреждению печени и сердца, освобождая некоторые фрагменты тканей. При интенсивном размножении спирохет в организме больного происходит распад тканей, в результате чего из поврежденных клеток высвобождаются липоидные молекулярные фрагменты.
Иммунная система пациента реагирует, вырабатывая реагиновые антитела на эти фрагменты. Продукты распада клеток — липоидные белки — поступают в кровяное русло. Эти белки являются чужеродными для организма человека, поэтому реакция организма проявляется в виде выработки неспецифических антител (иммуноглобулинов) класса IgM и IgG к липоидному и липопротеиноподобному материалу. Именно эти антитела исторически называются реагинами.
Следует иметь в виду, что реагины с помощью кардиолипиновых тестов могут обнаруживаться в организме людей, никогда не болевших сифилисом, т.к. их количество повышается при различных физиологических и патологических состояниях, не связанных с сифилисом, например у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями. Эти реагины могут быть причиной так называемых биологических ложноположительных серологических реакций на сифилис.
Антилипидные (неспецифические) антитела появляются в организме человека со стадии первичного сифилиса —примерно через 7-14 дней после образования твердого шанкра, через 4-5 недель после заражения.
Антитела против кардиолипина выявляют посредством нетрепонемных серологических тестов. При нетрепонемных методах анализа на сифилис не различают тип антител (IgG, IgM или др.), а определяют суммарный ответ.
2. Специфические антитела при сифилисе
Специфические антитрепонемные антитела направлены против бледной трепонемы. Плазматические клетки организма вырабатывают специфические антитела, направленные против соответствующих антигенов возбудителя заболевания.
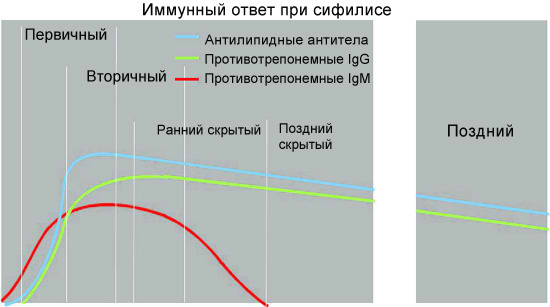
На ранних этапах развития сифилиса, как бактериальной инфекции, у заболевшего человека осуществляется выработка специфических антител, относящихся преимущественно к иммуноглобулинам класса M (первичный иммунный ответ). Трепонемоспецифические Ig класса M у больных сифилисом могут регистрироваться даже в период инкубации. Позднее происходит переключение на синтез IgG (вторичный иммунный ответ).
Параметры иммунного ответа могут изменяться в результате проводимого лечения. Адекватное лечение раннего сифилиса приводит к быстрому снижению титров неспецифических антител и специфических IgM.
По мере развития патологического процесса постепенно включаются механизмы образования антител классов G и А. Ведущая роль в гуморальном ответе переходит к специфическим антителам IgG и IgА. При этом специфические IgG обычно сохраняются в сыворотке крови в течение длительного периода времени,а иногда и всю жизнь
Динамика образования специфических антител у больного при сифилисе
По данным современных исследований, гуморальный ответ при сифилисе происходит в соответствии с общими закономерностями для бактериальных инфекций. Вначале вырабатываются иммуноглобулины класса M против наиболее иммуногенных и специфичных антигенов возбудителя. Специфические антитела класса M способны выявляться в крови пациентов, инфицированных T. pallidum, на самых ранних этапах развития инфекции, уже через 1,5-2 недели после заражения, что клинически соответствует скрытому инкубационному периоду заболевания. При первичном и вторичном сифилисе содержание указанных антител в крови больных быстро нарастает и сохраняется на высоком уровне; максимальное их содержание у больных сифилисом приходится на 6—9-ю неделю заболевания.
После успешного лечения антибактериальными препаратами специфические IgM у больных относительно быстро элиминируют из кровотока (через 3—12 месяцев). При лечении раннего сифилиса IgM исчезают через 3-6 месяцев, позднего – через 1 год. Большое диагностическое значение приобретает выявление антитрепонемных антител IgM в крови новорожденных. Так как IgM не проходит через плаценту, выявление антитрепонемных IgM-антител у новорожденного указывает на врожденный сифилис. Точно так же IgM-антитела не проникают через гематоэнцефалический барьер, и их появление в спиномозговой жидкости говорит о нейросифилисе.
Многие лабораторные методики диагностики сифилиса основаны именно на выявлении трепонемоспецифических IgM. Например, иммуноферментный анализ (ИФА) на твердой фазе и линейный иммуноблоттинг (ИБ) на микропористых стрипах с использованием антивидовых конъюгатов на основе моноклональных антител к тяжелой мю-цепи в структуре IgМ человека, а также реакция непрямой иммунофлюоресценции (РИФ) с исследованием 19S-фракции сыворотки крови, содержащей тяжелые IgМ.
Раннее определение специфических IgM также может быть применено для своевременного выявления случаев раннего врождённого сифилиса (определение специфических IgM в крови новорожденных) или случаев реинфекции у пациентов, ранее перенесших сифилис.
Без лечения, по мере развития болезни и разрешения клинических проявлений вторичного периода, уровень специфических IgМ в крови больных сифилисом постепенно понижается и начинает преобладать синтез IgG. Развитие иммунного ответа на антигенную стимуляцию в организме больного сифилисом сопровождается постепенным переключением с синтеза антител класса M на продукцию более мелких молекул иммуноглобулинов класса G.
Специфические иммуноглобулины класса G в кровотоке больных сифилисом появляются более поздно, в конце 3-й или на 4-й неделе после заражения и, как правило, достигают более высоких титров, чем IgM. Уже на 6 неделе после инфицирования уровень IgG преобладает над уровнем IgM и может сохраняться в таком состоянии годы.
Содержание специфических IgG, постепенно увеличиваясь, достигает максимальной выраженности через 1—1,5 года, после чего несколько снижается, подвергаясь волнообразным колебаниям в зависимости от активности инфекционного процесса. Количество специфических IgG в циркулирующей крови после адекватно проведенного лечения снижается медленно. Антитела этого класса могут сохраняться даже после клинического излечения пациента в течение десятков лет или пожизненно.
Кроме перечисленных видов антител, в гуморальном иммунитете при сифилисе принимают участие иммуноглобулины класса А. Антитела IgA вырабатываются в сравнительно небольших количествах. Вопрос о синтезе IgE и IgD в настоящее время изучен недостаточно.
Читайте также:

