Избавиться от очага инфекции
Обновлено: 15.04.2024
Для эффективного лечения хронических инфекционнных заболеваний предлагаются инновационные подходы, включающие: диагностику - оценку аутоиммунитета, комплексную терапию, направленную на элиминацию возбудителей, восстановление иммунитета, в том числе иммуни
For effective treatment of chronic infectious diseases some innovative approaches were suggested that include: diagnostic, autoimmunity assessment, complex therapy targeted to eliminate the agents, immunity restoration including intestine immunity and further rehabilitation.
Нерешенные проблемы патогенеза, лечения хронических заболеваний встают все острее. В настоящее время показано, что при большинстве хронических заболеваний, ранее считавшихся неинфекционными, выявляются латентные или активные бактериально-вирусные процессы [1, 2].
Хронические инфекционные заболевания, как правило, являются сочетанными (микст-инфекции). Вcе чаще они трудно поддаются лечению, носят рецидивирующий характер, в ряде случаев отмечается их непрерывное течение.
Многократно проводимая антибактериальная терапия оказывается не всегда эффективной, часто имеет место иммуносупрессивное, выраженнное побочное действие антибиотиков. То есть иммуносупрессивная терапия при хронических инфекционных процессах и хронических заболеваниях патогенетически не всегда обоснована. Есть ли альтернатива?
При проведении вакцинации также могут отмечаться побочные эффекты, в том числе выраженные. Введение вакцин в ряде случаев вызывает развитие слабого специфического иммунного ответа, или, наоборот, выявляется гиперреактивность, при этом могут активироваться очаги хронической инфекции, нарушаться механизмы иммунорегуляции, приводящие к развитию аутоиммунных процессов [3].
К решению данных вопросов можно подойти с позиций современных знаний в области иммунофизиологии и иммунопатологии [1–3, 5–7].
Все болезни являются инфекционными, если не доказано другого [1]
Колонизация микроорганизмами слизистых начинается еще внутриутробно (во время беременности, от матери). После рождения микроорганизмы поступают во внутреннюю среду через дыхательные пути, пищеварительный тракт с пищей, по мере взросления этот процесс ассимиляции увеличивается.
Факторами, усиливающими поступление микроорганизмов, являются вредные привычки (например, курение), поездки в различные страны, заболевания желудочно-кишечного тракта.
Один из механизмов воздействия генов микроорганизмов на геном человека следующий. Гены микроорганизмов участвуют в активации ключевого ядерного фактора транскрипции NF-каппа-би, который запускает продукцию ряда белков, поддерживающих воспалительные процессы (ферменты, медиаторы, цитокины).
T. Marshall в своих исследованиях показал, что при аутоиммунных заболеваниях в клетках различных органов, в крови выявляются геномы вируса Эпштейна–Барр, цитомегаловируса, вируса гепатита С, Chlamydia trachomatis, грибов.
То есть геном микроорганизмов (в настоящее время обнаружено более 1 миллиона генов микроорганизмов по сравнению с 25 тысячами генов человека) при большинстве хронических заболеваний выявляется во многих клетках организма.
Феномен антигенной молекулярной мимикрии
При частых обострениях хронических инфекционных процессов, определенном генотипе (особенности HLA-системы), нарушениях в регуляции иммунного ответа может возникнуть аутоиммуный процесс.
Комплексная оценка аутоиммунитета — инновационный подход к диагностике при хронических заболеваниях
В настоящее время хорошо известно, что все основные события, связанные с воспалительными процессами, развиваются в органах, т. е. местно. Изменения в периферической крови указывают на системность, распространенность, наличие выраженной активности воспалительного процесса.
В течение 20 последних лет активно развивается инновационный подход к диагностике различных заболеваний: появился иммунологический метод, позволяющий оценивать наличие и степень выраженности воспалительного процесса в основных органах и системах [5, 6].
Новые подходы к лечению хронических инфекционных процессов
В клетках человека, в лимфоцитах присутствует ядерный рецептор (VDR-рецептор), который участвует в синтезе Toll-подобных рецепторов, распознающих общие детерминанты многих микроорганизмов. Этот механизм участвует в подавлении активности различных патогенов (бактерий, вирусов).
При хронических инфекционных процессах VDR-рецептор заблокирован, инактивирован микроорганизмами.
В настоящее время обнаружено [1], что препарат олмесартана медоксомил (Кардосал) обладает высокой противовоспалительной активностью при различных заболеваниях, в том числе аутоиммунных, он способен восстанавливать активность VDR-рецептора. При этом прием данного препарата должен осуществляться длительно, практически постоянно. Этот препарат относится к группе сартанов (антагонисты рецепторов ангиотензина II) (Диован, Лозап и др.), которые применяются для лечения артериальной гипертензии.
Противовоспалительным эффектом, основанным на новом механизме действия, обладают экстракты босвеллиевой кислоты (из ладанного дерева), экстракты семян сибирской кедровой сосны. При применении данных препаратов происходит блокада активности ядерного фактора NF-каппа-би [4], при этом подавляется синтез провоспалительных цитокинов и др. (интерлейкина-1, фактор некроза опухолей альфа, бета, ряда металлопротеиназ).
В комплексную терапию включается специфическое лечение активной, преобладающей в данный момент бактериально-вирусной инфекции с последующей длительной реабилитацией, которая может осуществляться в течение нескольких месяцев. При этом показали свою высокую эффективность препараты — Глицирам 2 табл. 3 раза в день, производные бетулина — Суперантитокс 50 мг 1 раз в день, экстракты из босвеллиевой кислоты 10 мг 1 раз в день.
В комплексном лечении и реабилитации пациентов с хроническими инфекционными (воспалительными) процессами нами обязательно применяется коррекция состояния кишечника (важнейшего органа иммунитета) и органов желудочно-кишечного тракта, билиарной системы. В частности, пробиотики рекомендуется применять длительно: 2 и более месяцев.
Немного фактов: более 60% всех иммунокомпетентных клеток находится в кишечнике, площадь которого в 10 раз больше площади кожных покровов и составляет более 300 м 2 , кишечник имеет большую метаболическую активность, чем печень, он синтезирует три четверти всех нейротрансмиттеров, в кишечнике находится клеток в 10 раз больше, чем во всем остальном организме.
Состояние иммунитета кишечника ослабляется наличием дисбиоза (синдрома избыточного бактериального роста, повышенной проницаемости, пищевой непереносимости).
Нарушенное состояние кишечника невозможно восстановить без нормализации работы вышележащих органов — желудка, печени, желчного пузыря, поджелудочной железы. Поэтому в комплексную терапию хронических инфекционных заболеваний входит лечение патологий желудочно-кишечного тракта (ЖКТ).
Вакцинация. Спорные вопросы. Предлагаемые решения
Известные иммунологи (академик РАН Черешнев В. А., Shoenfeld Y., 2012) указывают, что введение комплексных вакцин не всегда согласовывается с основными законами функционирования иммунитета: силы, конкуренции антигенов, интервалов, суммации раздражений.
При использовании вакцин описана еще одна достаточно новая проблема — синдром ASIA [3]. Адъюванты, используемые в вакцинах для усиления действия антигенов, могут вызывать у лиц с особенностями генотипа (HLA) повышенную предрасположенность к развитию аутоиммунных процессов. Подобный эффект могут оказывать латекс, силикон.
В наших работах [8, 9] убедительно показано, что у детей с увеличенной вилочковой железой, регистрируемой в момент вакцинации, или имевших гиперплазию тимуса в анамнезе у 60% не вырабатывался защитный титр антител к дифтерийному компоненту вакцин АКДС и АДС (независимо от фирмы-производителя вакцин и лабораторий, в которых контролировался уровень антител). После проведения иммунотропной терапии содержание специфических антител достигало защитного уровня.
В связи с этим мы рекомендуем перед вакцинациями, прежде всего у детей первых месяцев и первых лет жизни, определять величину тимуса (по УЗИ).
Можно ли избежать осложнений при проведении вакцинаций?
Заключение
Рекомендуется перед проведением первой вакцинации детям первых месяцев жизни проводить УЗИ тимуса (диагностика тимомегалии или гипоплазии тимуса) для определения дальнейшей тактики ведения ребенка.
Литература
А. В. Симонова*, доктор медицинских наук, профессор
Л. Г. Кузьменко**, доктор медицинских наук, профессор
И. С. Лебедева*
И. Д. Баранова*, кандидат медицинских наук
В. В. Арзямова**, кандидат медицинских наук
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Герпес: причины появления, симптомы, диагностика и способы лечения.
Определение
Герпесом, или герпетической инфекцией, называют несколько заболеваний, вызываемых вирусами отряда Herpesvirales семейства Herpesviridae.
Все они характеризуются поражением кожи, слизистых оболочек с локализацией либо в области глаз, носа и губ, гениталий, а также нервных волокон.
У лиц с иммунодефицитом могут наблюдаться генерализованные формы инфекции с вовлечением в процесс других органов и тканей.

Среди известных науке восьми типов герпеса самым распространенным является вирус герпеса простого типа (Herpes simplex virus).
Простой вирус герпеса достаточно неустойчив во внешней среде. В условиях комнатной температуры сохраняется до 24 часов, на металле — до 2 часов. Под действием температуры выше 50°C погибает за 30 минут, под действием спирта и хлорсодержащих веществ - в течение нескольких минут, при замораживании сохраняется до пяти суток.
Причины герпетической инфекции
Источником инфицирования всегда служит человек. Он заразен в любую фазу болезни или носительства, но преимущественно при обострении.
Возбудитель может передаваться воздушно-капельным, контактно-бытовым или половым путем, а также от матери плоду через плаценту, во время родов или грудного вскармливания.
К вирусу восприимчивы все люди, хотя у многих отмечаются бессимптомные формы заболевания. Попадая через слизистую рта, половых органов или дыхательные пути в организм человека, герпесная инфекция остается в нем навсегда. Вирус, скрытый внутри клетки-хозяина, не доступен для иммунных клеток, уничтожающих возбудителей. Вирус активизируется при ослаблении иммунитета в результате переохлаждения, перегрева, простудного заболевания, недостатка витаминов, переутомления, стресса, нехватки сна. Рецидив инфекции могут вызвать травмы, оперативные вмешательства, а также половой контакт при условии повреждения слизистой оболочки. Использование лекарственных и косметических средств, содержащих стероидные гормоны, также способствует манифестации вируса герпеса.
Классификация герпеса
В МКБ-10 (Международной классификации болезней) выделяют две группы заболеваний, связанных с вирусом простого герпеса:
- Инфекционные герпетические заболевания:
- герпетическая экзема (экзема Капоши);
- герпетический везикулярный дерматит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический энцефалит;
- офтальмогерпес;
- диссеминированная герпетическая болезнь (герпетический сепсис);
- другие формы герпетических инфекций;
- неуточненная герпетическая инфекция.
- Генитальные герпетические инфекции:
- герпетические инфекции перианальных кожных покровов и прямой кишки;
- неуточненная аногенитальная герпетическая инфекция.
По клинической картине и локализации высыпаний:
- Типичные формы:
- герпес кожи — с поражением губ, крыльев носа, лица, рук, ягодиц и других частей тела;
- герпес глаз — иридоциклит, кератит, конъюнктивит, неврит зрительного нерва;
- герпес слизистых оболочек желудочно-кишечного тракта — стоматит, гингивит, фарингит, эзофагит;
- герпес половых органов — поражение слизистой оболочки полового члена, влагалища, вульвы, цервикального канала;
- герпес внутренних органов — гепатит, пневмония, панкреатит, трахеобронхит;
- герпес нервной системы — неврит, менингит, менингоэнцефалит, поражения бульбарных нервов, энцефалит;
- генерализованный простой герпес — висцеральная форма (пневмония, гепатит, эзофагит) и диссеминированная форма (сепсис).
- Атипичные формы:
- герпетиформная экзема Капоши — обширные сливающиеся высыпания по всему телу;
- абортивный герпес — почти незаметные папулы на грубой коже или дискомфорт без высыпаний;
- язвенно-некротический герпес — с развитием некроза тканей;
- эрозивно-язвенный герпес — с образованием язв и эрозий;
- геморрагический герпес — с кровянистым пропитыванием высыпаний и тканей;
- отечный герпес — с отеком тканей и болью в области губ и век;
- зостериформный простой герпес — с локализацией по ходу нервного ствола;
- диссеминированный герпес — с тенденцией перехода в генерализованную форму при ВИЧ;
- рупиоидный герпес — возникает на лице с присоединением вторичной бактериальной флоры;
- мигрирующий герпес — с тенденцией к изменению локализации высыпаний.
- латентная стадия — носительство с отсутствием симптомов;
- локализованная стадия — наличие одного очага поражения;
- распространенная стадия — наличие не менее двух очагов поражения;
- генерализованная стадия — висцеральная, диссеминированная.
При заражении герпесом детей в возрасте от 6 месяцев до 3 лет чаще всего развивается герпетический стоматит, для которого характерно острое начало с симптомами интоксикации и подъемом температуры.
На слизистой оболочке полости рта появляются сгруппированные пузырьки с прозрачным содержимым, на месте которых после вскрытия образуются болезненные эрозии. У детей старшего возраста первичный герпес характеризуется появлением зудящих пузырьков на красной кайме губ и коже носогубного треугольника. После их вскрытия остаются неглубокие язвочки, которые покрываются корочками. Корочки, отпадая, не оставляют следов на коже.
При первичном заражении взрослых вирусом простого герпеса симптомы более выражены, чем при дальнейших рецидивах. Больной испытывает озноб, головные боли, повышенную утомляемость, у него отсутствует аппетит, может наблюдаться расстройство сна. Покраснение, а затем характерные пузырьки появляются на губах, возле крыльев носа. В некоторых случаях увеличиваются подчелюстные лимфоузлы.
Герпетические нейроинфекции сопровождаются наиболее тяжелым течением, особенно если вирус поражает оболочки или ткань головного мозга.
В этих случаях симптомы включают головные боли, подъем температуры тела, напряжение затылочных мышц, психомоторное возбуждение (болезненное состояние, при котором наблюдается беспокойство и двигательная активность различной степени выраженности, вплоть до судорог). При несвоевременной диагностике заболевания существует риск летального исхода.
Офтальмогерпес сопровождается покраснением глаза, развитием блефаро- или кератоконъюнктивита, эрозиями роговицы.
Диагностика герпеса
Типичные случаи герпетической инфекции выявляются на основании клинической картины и анамнеза заболевания. Характерно его волнообразное течение со сменой периодов обострения и ремиссии.
Косвенным признаком служит склонность к простудным заболеваниям, чувствительность к переохлаждению, периодически возникающие состояния, сопровождаемые подъемом температуры, усталостью, депрессией.

При атипичных формах герпетической инфекции необходимы дополнительные обследования: клинический анализ крови, биохимический анализ крови (общий белок, белковые фракции, С-реактивный белок, АЛТ, АСТ, ЛДГ, креатинин, электролиты: калий, натрий, хлор, кальций) и клинический анализ мочи - для выявления поражения внутренних органов и предупреждения осложнений.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Ротавирусная инфекция: причины появления, симптомы, диагностика и способы лечения.
Определение
Ротавирусная инфекция (ротавирус) – это острое инфекционное заболевание, вызываемое ротавирусом и характеризующееся поражением желудочно-кишечного тракта по типу гастроэнтерита с развитием синдрома дегидратации (обезвоживания).
Причины появления ротавирусной инфекции
Возбудителем заболевания выступает вирус семейства Reoviridae, рода Rotavirus. Ротавирусы устойчивы к воздействию факторов окружающей среды, в питьевой воде, открытых водоемах и сточных водах они сохраняют жизнеспособность до нескольких месяцев, на овощах и фруктах – до 30 дней.
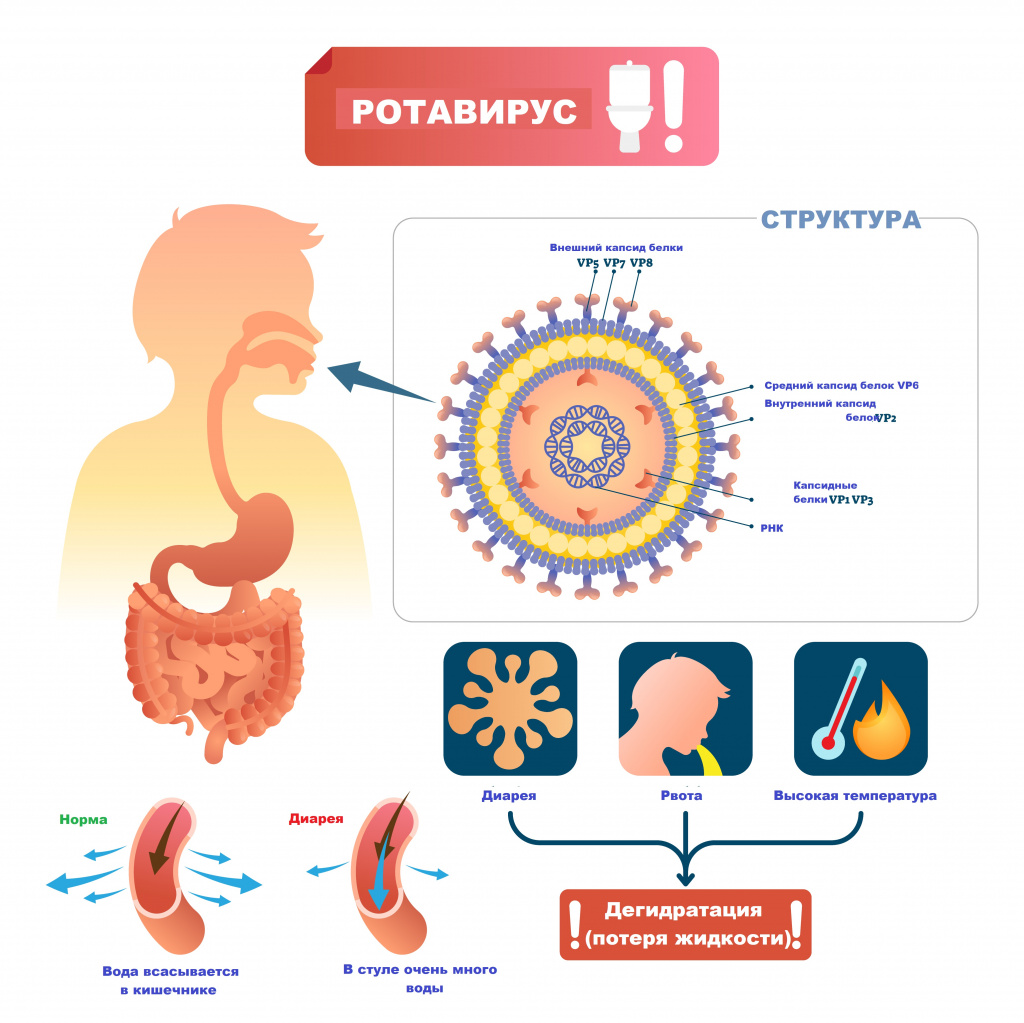
Основной источник и резервуар ротавирусной инфекции – больной человек в конце инкубационного периода и в первые дни болезни, выделяющий с фекалиями вирус, а также вирусоносители. Механизм передачи возбудителя – фекально-оральный.
- контактно-бытовой (через грязные руки и предметы обихода);
- водный (при употреблении воды, в которой присутствуют вирусы);
- пищевой (чаще всего при употреблении молока, молочных продуктов);
- реже – воздушно-капельный путь.
Ротавирусным гастроэнтеритом болеют люди любого возраста, но максимальная заболеваемость отмечается у детей первых двух лет жизни, людей пожилого возраста и лиц с нарушением функционирования иммунной системы.
Наблюдается зимне-весенняя сезонность, спорадические случаи заболевания регистрируются в течение всего года.
Ротавирусы проникают внутрь эпителия слизистой оболочки двенадцатиперстной кишки и верхних отделов тощей кишки. Размножение и накопление вируса приводит к гибели зрелых эпителиоцитов кишки и их отторжению. В результате нарушается абсорбция углеводов и простых сахаров, и они накапливаются в избыточном количестве. В просвете кишечника повышается осмотическое давление, нарушается всасывание воды и электролитов. Возникает водянистая диарея. Образование большого количество органических кислот, водорода, углекислого газа в процессе ферментации нерасщепленных дисахаридов кишечной микрофлорой ведет к повышению газообразования в кишечнике.
У детей с иммунными нарушениями ротавирус может стать причиной развития гепатита, нефрита, пневмонии, экзантемы, энцефалита с высоким риском летального исхода.
Классификация заболевания
Формы ротавирусной инфекции:
- типичная (гастрит, гастроэнтерит, энтерит);
- атипичная (стертая, бессимптомная);
- вирусоносительство.
- легкое;
- среднетяжелое;
- тяжелое.
- гладкое;
- негладкое (с обострениями и рецидивами).
- острое (до 1 месяца);
- затяжное (до 3 месяцев);
- хроническое (более 3 месяцев).
Инкубационный период ротавирусной инфекции составляет от 14 часов до 7 дней (в среднем 1-4 дня). Заболевание чаще всего начинается остро с повышения температуры тела от субфебрильных до фебрильных значений, появляются симптомы интоксикации (вялость, слабость, снижение аппетита), диарея и повторная рвота.
Кишечная дисфункция характеризуется жидким, водянистым, пенистым стулом желтого цвета без патологических примесей. При обильном жидком стуле развивается обезвоживание.
В тяжелых случаях возможно уменьшение количества мочи вплоть до полного ее отсутствия, снижение артериального давления.
В течение 3–6 дней могут присутствовать умеренные или сильные схваткообразные или постоянные боли в верхней половине живота. У детей младшего возраста в начале заболевания могут наблюдаться катаральные явления, которые предшествуют дисфункции кишечника: покашливание, насморк или заложенность носа, редко – конъюнктивит, катаральный отит. У детей раннего возраста на фоне высокой температуры могут развиться генерализованные судороги, сопровождающиеся потерей сознания.
Для легких форм ротавирусной инфекции характерны следующие симптомы:
- температура тела 37,1-38,0°C;
- умеренная интоксикация в течение 1–2 дней;
- нечастая рвота;
- стул жидкой кашицей до 5-10 раз в сутки.
- температура тела 38,0-39,0°C;
- выраженная интоксикация;
- повторная рвота в течение 1,5-2 дней;
- обильный водянистый стул от 10 до 20 раз в сутки;
- обезвоживание I–II степени.
- бурным началом;
- значительными потерями жидкости (обезвоживание II–III степени),
- многократной рвотой;
- водянистым стулом более 20 раз в сутки;
- снижением артериального давления.
Типичный ротавирусный гастроэнтерит характеризуется доброкачественным циклическим течением, наличием специфических признаков заболевания, а также обнаружением возбудителя в фекалиях.
К атипичным формам ротавирусного гастроэнтерита относятся:
- стертая и субклиническая формы со слабо выраженными и быстро проходящими симптомами;
- бессимптомная форма с отсутствием клинических признаков болезни, но с нарастанием титров специфических антител в крови;
- носительство ротавирусов после перенесенного острого ротавирусного гастроэнтерита, у здоровых лиц в очагах с инфекционной диареей;
- хроническая форма, сохраняющаяся более 3 месяцев.
Сочетание поражения желудочно-кишечного тракта и симптомов интоксикации, развитие обезвоживания, наличие ротавирусной инфекцией у лиц, контактирующих с больным, имеют большое значение в диагностике заболевания.
Окончательный диагноз ротавирусной инфекции ставится только на основании лабораторного подтверждения. Используют:
- методы, основанные на обнаружении ротавируса и его антигенов в фекалиях (электронная и иммуноэлектронная микроскопия, РЛА, ИФА);
- методы обнаружения вирусной РНК в копрофильтратах (метод молекулярных зондов – ПЦР и гибридизации, электрофорез РНК в полиакриламидном геле или агарозе);
- методы обнаружения специфических антител к ротавирусам в сыворотке крови (ИФА, РСК, РТГА, РНГА).
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Читайте также:

