Изменение иммунного статуса при сифилисе
Обновлено: 24.04.2024
Сифилис — инфекционное заболевание, вызываемое бледной трепонемой (Treponema pallidum), передаваемое преимущественно половым путем, характеризующееся поражением кожи, слизистых оболочек, нервной системы, внутренних органов и опорно-двигательного аппарата.
Сифилис скрытый ранний – это разновидность сифилиса, принимающая латентное течение с момента заражения, без клинических признаков болезни, с положительными серологическими реакциями с давностью инфекции до 2-х лет.
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| А51.5 | Ранний сифилис скрытый |
Дата разработки/пересмотра протокола: 2013 года (пересмотрен 2017 г.).
Сокращения, используемые в протоколе:
МНН – международное непатентованное название
ИФА – иммуноферментный анализ
ПЦР – полимеразная цепная реакция
ПИФ – прямая иммунофлюоресценция
РИФ – реакция иммунофлюоресценции
РИБТ – реакция иммобилизации бледных трепонем
РМП – реакция микропреципитации
РПГА – реакция пассивной гемагглютинации
КСР – комплекс серологических реакций
RW – реакция Вассермана
ИБ - иммуноблотинг
ИХЛ – иммунохемилюминесценция
ИХГ – иммунохроматография
ЛПР – ложноположительные серологические реакции на сифилис
СМЖ – спинномозговая жидкость
Мл – миллилитр
Мг - милиграмм
Пользователь протокола: врач - дерматовенеролог.
Категория пациентов: взрослые, дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Классификация
Классификация[5]:
Сифилис скрытый ранний
В настоящее время используется международная классификация болезней 10-го пересмотра (МКБ-10), которая не всегда адекватно отражает клинические формы заболевания. Так, A51.4 (другие формы вторичного сифилиса) включает раннее поражение нервной системы, внутренних органов и опорно-двигательного аппарата. Также нет разделения асимптомного нейросифилиса на ранний и поздний, вследствие чего все больные с бессимптомным течением нейросифилиса независимо от давности заболевания относятся к позднему сифилису (А 52.2). Следует отметить, что шифр, оканчивающийся цифрой 9 (A 50.9; A 51.9, А 52.9 и А 53.9), а также А50.2 и А50.7 отражают формы инфекции, не подтвержденные лабораторными методами диагностики.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 2
Диагностические критерии
Жалобы: нет
Анамнез:
· прием в последние 2 года антибиотиков и других антибактериальных препаратов, гемотрансфузии и др.;
· наличие в прошлом высыпных элементов-эрозий, язв, как правило, после половых связей.
Физикальное обследование:
Общий статус:
· осмотр и оценка общих свойств кожи;
· осмотр миндалин, ушных раковин, носа, глаз;
· оценка состояния периферических лимфатических узлов, легких, кровеносной системы, пищеварительного тракта, почек, печени (пальпация, перкуссия и аускультация).
Локальный статус:
· наличие вторичных остаточных элементов - рубцов, пятен;
Основные субъективные и объективные симптомы: нет
Лабораторные исследования8:
Для постановки диагноза необходимо проведение следующих лабораторных исследований.
· Нетрепонемные - РМП с плазмой и инактивированной сывороткой или ее аналоги:
1. RPR (РПР) – тест быстрых плазменных реагинов (Rapid Plasma Reagins), или экспресс-тест на реагины плазмы;
или
2. VDRL – Venereal Disease Research Laboratory test – тест Исследовательской лаборатории венерических заболеваний;
или
3. TRUST – тест с толуидиновым красным и непрогретой сывороткой (Toluidin Red Unheated Serum Test);
или
4. RST - тест на скрининг реагинов (Reagin Screen Test); USR – тест на реагины с непрогретой сывороткой (Unheated Serum Reagins).
Преимущества нетрепонемных тестов:
– низкая стоимость;
– техническая простота выполнения;
– быстрота получения результатов.
Показания к применению нетрепонемных тестов:
– определение активности течения инфекции (определение титров антител);
– контроль эффективности терапии (определение титров антител).
· Трепонемные:
1. ИФА;
или
2. РИФ (FTA);
или
3. Иммуноблотинг;
или
4. РПГА (MHA-tp);
или
5. РИТ;
или
6. ИХЛ (ИХГ)
Преимущества трепонемных тестов: высокая чувствительность и специфичность.
Показания к применению трепонемных тестов:
– подтверждение положительных результатов нетрепонемных тестов;
– подтверждение в случае расхождения результатов скринингового трепонемного теста и последующего нетрепонемного теста, а также скринингового и подтверждающего трепонемных тестов;
– проведение методами ИФА, РПГА, ИХЛ, ПБТ скрининга отдельных категорий населения на сифилис (доноры, беременные, больные офтальмологических, психоневрологических, кардиологических стационаров, ВИЧ-инфицированные).
Примечания:
– трепонемные тесты не могут быть использованы для контроля эффективности терапии, т.к. антитрепонемные антитела длительно циркулируют в организме больного, перенесшего сифилитическую инфекцию;
– трепонемные тесты дают положительные результаты при невенерических трепонематозах и спирохетозах;
– трепонемные тесты могут давать ложноположительные реакции у больных с аутоиммунными заболеваниями, лепрой, онкологичекими заболеваниями, эндокринной патологией и при некоторых других заболеваниях.
Ложноположительные серологические реакции на сифилис (ЛПР)
Ложноположительными, или неспецифическими, называют положительные результаты серологических реакций на сифилис у лиц, не страдающих сифилитической инфекцией, и не болевших сифилисом в прошлом.
ЛПР могут быть обусловлены техническими погрешностями при выполнении исследований и особенностями организма. Условно ЛПР разделяют на острые ( 6 месяцев). Острые ЛПР могут наблюдаться при беременности и во время менструации, после вакцинации, после недавно перенесенного инфаркта миокарда, при многих инфекционных заболеваниях (лепра, малярия, респираторные заболевания, грипп, ветряная оспа, вирусный гепатит, ВИЧ-инфекция), при дерматозах; хронические ЛПР - при аутоиммунных заболеваниях, системных болезнях соединительной ткани, онкологических заболеваниях, хронической патологии печени и желчевыводящих путей, при сердечно-сосудистой и эндокринной патологии, при заболеваниях крови, при хронических заболеваниях легких, при инъекционном применении наркотиков, в старческом возрасте и др.
Ложноположительные реакции трепонемных и нетрепонемных тестов могут наблюдаться при эндемических трепонематозах (фрамбезия, пинта, беджель), боррелиозе, лептоспирозе. Пациента с положительными серологическими реакциями на сифилис, прибывшего из страны с эндемическими трепонематозами, необходимо обследовать на сифилис и назначить противосифилитическое лечение, если оно ранее не проводилось.
Количество ЛПР увеличивается с возрастом. В возрастной группе 80-летних лиц распространенность ЛПР составляет 10%.
Ложноотрицательные серологические реакции на сифилис могут наблюдаться при вторичном сифилисе вследствие феномена прозоны при тестировании неразведенной сыворотки, а также при обследовании лиц с иммунодефицитным состоянием, например ВИЧ-инфицированных пациентов.
Лабораторные тесты для подтверждения или исключения нейросифилиса.
Скрытый ранний сифилис входит в показания для проведения спинномозговой пункции для исследования СМЖ.
К рекомендуемым методам исследования СМЖ относятся: цитологическое исследование с подсчетом количества форменных элементов (определение в 1 мм 3 ликвора свыше 5 клеток лимфоцитарного ряда свидетельствует о наличии патологических изменений в нервной системе), определение количества белка (> 0,45 г/л), а также серологические тесты для выявления антител к T. pallidum в РМП, РИФц (РИФ с цельным ликвором), РПГА, ИФА, иммуноблоттинг.
Тестированию с помощью данного алгоритма подлежат лица с подозрением на наличие нейросифилиса, в том числе больные скрытым сифилисом и лица, перенесшие сифилис в прошлом, при сохранении положительных нетрепонемных серологических реакций крови.
Тестирование начинается с исследования ликвора пациента методами ИФА или иммуноблоттинга. При отрицательном результате с высокой степенью вероятности может быть сделан вывод об отсутствии у пациента нейросифилиса. При положительном результате ИФА/ИБ проводится исследование с помощью одного из нетрепонемных тестов (РМП, РПР). Если ИФА/ИБ и РМП/РПР дают положительный результат, больному устанавливается диагноз нейросифилиса и дальнейшее тестирование прекращают. Если РМП/РПР дает отрицательный результат, проводится тестирование ликвора с помощью второго высокочувствительного и специфичного трепонемного метода – РПГА. При положительном результате РПГА делается вывод о наличии у больного нейросифилиса. При отрицательном результате РПГА делается вывод об отсутствии у пациента нейросифилиса и ложноположительном результате первого трепонемного теста.
Инструментальные исследования: нет.
Показания для консультации специалистов:
· консультация невропатолога – при наличии неврологических симптомов, появившихся во время применения специфической терапии;
· окулист – при наличии соответствующих симптомов, появившихся во время применения специфической терапии;
· оториноларинголог – при наличии соответствующих симптомов, появившихся во время применения специфической терапии;
· консультация терапевта – при наличии сопутствующих заболеваний.
Диагностический алгоритм: (схема)
| Цель обследования | Рекомендуемые тесты | Результат исследования | Заключение |
| Диагностика скрытых форм приобретенного сифилиса, дифференциальная диагностика скрытого сифилиса и ложноположительных результатов нетрепонемных и трепонемных тестов | 1. Нетрепонемный (РМП, РПР, VDRL и другие аналоги) тест в количественном варианте постановки / 2. Два трепонемных теста (РПГА, ИФАIgM+IgG, РИФабс/200, РИТ, ИБ, ИХЛ). Возможны различные варианты комбинаций из перечисленных тестов, но обязательно применение - не менее двух. | положительный/положительный | диагноз подтвержден |
| отрицательный/ положительный | диагноз подтвержден | ||
| отрицательный/отрицательный | диагноз не подтвержден |
Дифференциальный диагноз
Поскольку клинические проявления для данной формы сифилиса не характерны, то положительные результаты серологического обследования при скрытых формах сифилиса дифференцируют с ложноположительными серологическими реакциями на сифилис, которые встречаются при следующих состояниях: беременность, аутоиммунные заболевания, ВИЧ – инфицирование, заболевания печени и т.д.
Реакции иммунной системы организма при заражении сифилисом

Сифилис - это инфекционное заболевание, вызываемое бледной трепонемой (бактерией Treponema pallidum). Организм человека, заболевшего сифилисом, защищается от возбудителя заболевания с помощью механизмов иммунитета. Проникновение, длительное сохранение в организме (персистенция) и размножение возбудителя заболевания в организме хозяина приводят к выраженным изменениям со стороны иммунной системы.
После попадания бледных трепонем в организм и при их дальнейшем размножении, в организме больного человека происходят иммунные сдвиги. Механизм иммунного ответа при сифилисе исследован не полностью, однако имеются достаточно убедительные данные о том, что в этом процессе участвуют все звенья иммунной системы.
Активируются механизмы как врожденного неспецифического иммунитета, свойственного человеку как биологическуому виду, так и адаптивного, антиген-опосредованного иммунного ответа, вызванного контактом с антигеном. В иммунном ответе организма принимают участие как клеточные (макрофаги, Т-лимфоциты), так и гуморальные механизмы (синтез специфических иммуноглобулинов — антител).
Иммунную реакцию вызывают белки, входящие в состав структур бледной трепонемы; они являются чужеродными веществами для организма человека и относятся к антигенам. Все антигены трепонемы способны стимулировать организм больного вырабатывать антитела соответствующих классов. Вследствие этого, в сыворотке крови больных сифилисом отмечается множественность антител: протеиновых, комплементсвязывающих, полисахаридных реагинов, иммобилизинов, агглютининов.
Классы вырабатываемых антител меняются на разных этапах течения сифилиса — в различных стадиях болезни преобладают то одни, то другие антитела, относящиеся к разным классам иммуноглобулинов. Сила иммунного ответа и спектр антител, выявляемых на разных стадиях развития инфекции, зависит от особенностей организма у данного человека.
Во многих случаях иммунологический ответ не предотвращает поэтапного развития инфекции. Организм хозяина неспособен уничтожить сифилитическую инфекцию, что приводит к дальнейшей эволюции патологического процесса. Болезнь, начавшись с местного процесса, распространяется на весь организм и продолжается много лет.
Клеточный и гуморальный иммунный ответ на внедрение бледной трепонемы в организм
В иммунном ответе организма на заражение принимают участие клеточные и гуморальные механизмы иммунитета.
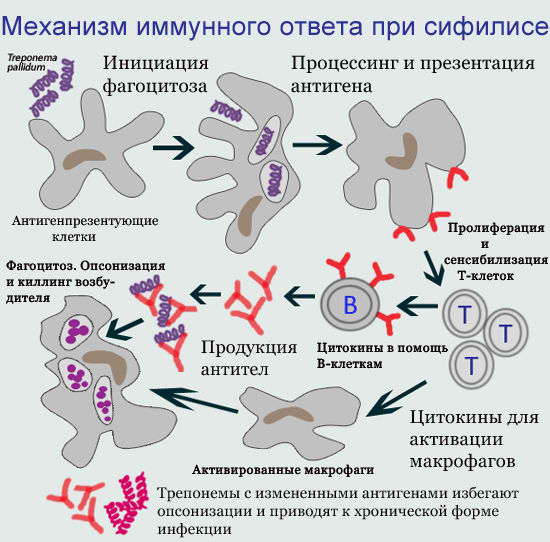
1. Клеточный иммунитет при заражении сифилисом
На клеточном уровне бледной трепонеме противодействуют высокоспециализированные клетки иммунной системы — макрофаги, T-лимфоциты, B-лимфоциты. Происходит изоляция и частичное уничтожение трепонем фагоцитами, в основном макрофагами. Фагоцитоз носит преимущественно незавершенный характер — при поглощении фагоцитом возбудитель не погибает, а остается в клетке, сохраняя свою структуру и способность к размножению. Более того, фагоцит оберегает от антител и воздействия антибиотиков бледную трепонему, которая становится недоступной для защитных сил организма.
Ранний сифилис характеризуется частичным угнетением клеточного иммунитета и развитием состояния иммуносупрессии, постепенно нарастающей активизацией гуморального иммунитета. Клеточное звено страдает в первую очередь, так как Т-лимфоциты более чувствительны к воздействию бактерий T. pallidum.
У больных вторичным, латентным и третичным сифилисом формируется клеточный иммунитет, признаки которого выявляются в реакциях in vivo (кожные пробы) и in vitro (стимуляция Т-лимфоцитов трепонемными антигенами).
2. Гуморальный иммунитет при заражении сифилисе
Гуморальный иммунный ответ заключается в продукции широкого спектра противосифилитических антител. В структуре бледной трепонемы выявлено большое количество соединений, имеющих выраженные антигенные свойства для иммунной системы человека. На начальных этапах развития сифилиса происходит более выраженный синтез антител к антигенам, имеющим высокое содержание в клетке T. pallidum и локализующимся в структуре мембран наружной клеточной стенки или протоплазматического комплекса.
3. Уклонение бледных трепонем от иммунного ответа
Клеточное и гуморальное звенья иммунитета не в состоянии обеспечить полное уничтожение и элиминацию бледных трепонем. Благодаря своему необычному молекулярному строению, T. pallidum обладает замечательной способностью уклоняться от защитной реакции макроорганизма.
Электронно-микроскопические исследования показали, что при сифилисе преобладает незавершенный фагоцитоз трепонем (захват и поглощение трепонем лейкоцитами, макрофагами и другими клетками). При этом трепонемы не погибают, а получают защиту от антибиотиков и антител, и могут даже размножаться в фагоцитирующей клетке. В течение всего инкубационного периода, а также в конце первичного и в начале вторичного периодов сифилиса, возбудители активно размножаются и распространяются по всему организму.
Гуморальный иммунный ответ. Противосифилитические антитела.
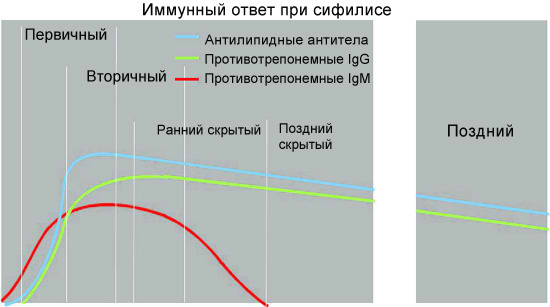
1. Неспецифические антитела при сифилисе
Реагиновые антитела у больного сифилисом — это иммуноглобулины класса IgG и IgM. Они являются комплексным ответом на высвобождение липоидных молекулярных фрагментов из поврежденных клеток хозяина, а также на появление липопротеиноподобных структур, сходных с кардиолипином, входящих в состав бактериальной клетки бледной трепонемы.
Липидные антигены cоставляют значительную часть бактериальной клетки T. pallidum. Помимо других антигенов, в клеточной стенке бледной трепонемы содержится фосфолипид кардиолипин; на его долю приходится около 30% сухого вещества клетки спирохеты. В организме человека, больного сифилисом, могут присутствовать липиды, имеющие сходное строение с липоидными структурами клеточной стенки бледной трепонемы. Это аутоантигены, образующиеся в результате разрушения органов и тканей, в основном липиды митохондриальных мембран.
Аутоантигены - это компоненты клеток и тканей собственного организма, которые распознаются при определённых условиях как частично чужеродные. Аутоантитела к кардиолипину – это антитела, направленные организмом против собственного кардиолипина.
Клетки человека, больного сифилисом выделяют в большом количестве липоидный и липопротеиноподобный материал, сходный с кардиолипином. Бледная трепонема приводит к поражению внутренних органов, в частности, к повреждению печени и сердца, освобождая некоторые фрагменты тканей. При интенсивном размножении спирохет в организме больного происходит распад тканей, в результате чего из поврежденных клеток высвобождаются липоидные молекулярные фрагменты.
Иммунная система пациента реагирует, вырабатывая реагиновые антитела на эти фрагменты. Продукты распада клеток — липоидные белки — поступают в кровяное русло. Эти белки являются чужеродными для организма человека, поэтому реакция организма проявляется в виде выработки неспецифических антител (иммуноглобулинов) класса IgM и IgG к липоидному и липопротеиноподобному материалу. Именно эти антитела исторически называются реагинами.
Следует иметь в виду, что реагины с помощью кардиолипиновых тестов могут обнаруживаться в организме людей, никогда не болевших сифилисом, т.к. их количество повышается при различных физиологических и патологических состояниях, не связанных с сифилисом, например у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями. Эти реагины могут быть причиной так называемых биологических ложноположительных серологических реакций на сифилис.
Антилипидные (неспецифические) антитела появляются в организме человека со стадии первичного сифилиса —примерно через 7-14 дней после образования твердого шанкра, через 4-5 недель после заражения.
Антитела против кардиолипина выявляют посредством нетрепонемных серологических тестов. При нетрепонемных методах анализа на сифилис не различают тип антител (IgG, IgM или др.), а определяют суммарный ответ.
2. Специфические антитела при сифилисе
Специфические антитрепонемные антитела направлены против бледной трепонемы. Плазматические клетки организма вырабатывают специфические антитела, направленные против соответствующих антигенов возбудителя заболевания.
На ранних этапах развития сифилиса, как бактериальной инфекции, у заболевшего человека осуществляется выработка специфических антител, относящихся преимущественно к иммуноглобулинам класса M (первичный иммунный ответ). Трепонемоспецифические Ig класса M у больных сифилисом могут регистрироваться даже в период инкубации. Позднее происходит переключение на синтез IgG (вторичный иммунный ответ).
Параметры иммунного ответа могут изменяться в результате проводимого лечения. Адекватное лечение раннего сифилиса приводит к быстрому снижению титров неспецифических антител и специфических IgM.
По мере развития патологического процесса постепенно включаются механизмы образования антител классов G и А. Ведущая роль в гуморальном ответе переходит к специфическим антителам IgG и IgА. При этом специфические IgG обычно сохраняются в сыворотке крови в течение длительного периода времени,а иногда и всю жизнь
Динамика образования специфических антител у больного при сифилисе
По данным современных исследований, гуморальный ответ при сифилисе происходит в соответствии с общими закономерностями для бактериальных инфекций. Вначале вырабатываются иммуноглобулины класса M против наиболее иммуногенных и специфичных антигенов возбудителя. Специфические антитела класса M способны выявляться в крови пациентов, инфицированных T. pallidum, на самых ранних этапах развития инфекции, уже через 1,5-2 недели после заражения, что клинически соответствует скрытому инкубационному периоду заболевания. При первичном и вторичном сифилисе содержание указанных антител в крови больных быстро нарастает и сохраняется на высоком уровне; максимальное их содержание у больных сифилисом приходится на 6—9-ю неделю заболевания.
После успешного лечения антибактериальными препаратами специфические IgM у больных относительно быстро элиминируют из кровотока (через 3—12 месяцев). При лечении раннего сифилиса IgM исчезают через 3-6 месяцев, позднего – через 1 год. Большое диагностическое значение приобретает выявление антитрепонемных антител IgM в крови новорожденных. Так как IgM не проходит через плаценту, выявление антитрепонемных IgM-антител у новорожденного указывает на врожденный сифилис. Точно так же IgM-антитела не проникают через гематоэнцефалический барьер, и их появление в спиномозговой жидкости говорит о нейросифилисе.
Многие лабораторные методики диагностики сифилиса основаны именно на выявлении трепонемоспецифических IgM. Например, иммуноферментный анализ (ИФА) на твердой фазе и линейный иммуноблоттинг (ИБ) на микропористых стрипах с использованием антивидовых конъюгатов на основе моноклональных антител к тяжелой мю-цепи в структуре IgМ человека, а также реакция непрямой иммунофлюоресценции (РИФ) с исследованием 19S-фракции сыворотки крови, содержащей тяжелые IgМ.
Раннее определение специфических IgM также может быть применено для своевременного выявления случаев раннего врождённого сифилиса (определение специфических IgM в крови новорожденных) или случаев реинфекции у пациентов, ранее перенесших сифилис.
Без лечения, по мере развития болезни и разрешения клинических проявлений вторичного периода, уровень специфических IgМ в крови больных сифилисом постепенно понижается и начинает преобладать синтез IgG. Развитие иммунного ответа на антигенную стимуляцию в организме больного сифилисом сопровождается постепенным переключением с синтеза антител класса M на продукцию более мелких молекул иммуноглобулинов класса G.
Специфические иммуноглобулины класса G в кровотоке больных сифилисом появляются более поздно, в конце 3-й или на 4-й неделе после заражения и, как правило, достигают более высоких титров, чем IgM. Уже на 6 неделе после инфицирования уровень IgG преобладает над уровнем IgM и может сохраняться в таком состоянии годы.
Содержание специфических IgG, постепенно увеличиваясь, достигает максимальной выраженности через 1—1,5 года, после чего несколько снижается, подвергаясь волнообразным колебаниям в зависимости от активности инфекционного процесса. Количество специфических IgG в циркулирующей крови после адекватно проведенного лечения снижается медленно. Антитела этого класса могут сохраняться даже после клинического излечения пациента в течение десятков лет или пожизненно.
Кроме перечисленных видов антител, в гуморальном иммунитете при сифилисе принимают участие иммуноглобулины класса А. Антитела IgA вырабатываются в сравнительно небольших количествах. Вопрос о синтезе IgE и IgD в настоящее время изучен недостаточно.
В последние годы большое внимание уделяется изучению врожденного и адаптивного иммунитета в развитии сифилиса. Показано, что изменения иммунного статуса могут привести к диссеминации бледной трепонемы с формированием вторичных форм и серорезистентности. Цель исследования: анализ показателей иммунофенотипирования клеток крови и сывороточных иммуноглобулинов у пациентов с серорезистентным, ранним и поздним скрытым сифилисом. Обследовано 100 человек с сифилитической инфекцией: 41 пациент с серорезистентным сифилисом, 35 – с ранним скрытым сифилисом, 24 – с поздним скрытым сифилисом. Установлено, что у пациентов с серорезистентным, ранним и поздним скрытым сифилисом отмечается перераспределение состава иммунокомпетентных клеток с увеличением количества цитотоксических/эффекторов. Признаки дефицита Т-клеточного звена иммунитета определяются преимущественно у пациентов с серорезистентным сифилисом в виде уменьшения количества Т-хелперов, NK-клеток.

2. Чеботарев В.В., Чеботарева Н.В., Асхаков М.С. Сифилис: была ли предсказуема ситуация? / В.В. Чеботарев, Н.В. Чеботарева, М.С. Асхаков // Medicus. – 2015. – № 1. – С.12-14.
3. Современные представления о серологической резистентности при сифилисе (обзор литературы) / Г.М. Бондаренко [и др.] // Дерматологiя та венерологiя. – 2015. – № 4. – С.5-16.
4. Кытманова Л.Ю., Москвичева М.Г., Радзиховская М.В. Сравнительный анализ динамики эпидемического процесса при сифилисе, ВИЧ-инфекции и гепатитах В и С / Л.Ю. Кытманова, М.Г. Москвичева, М.В. Радзиховская // Южно-Уральский медицинский журнал. – 2014. – № 3. – С.7-11.
5. Современные представления об иммунных изменениях при сифилисе / В.И. Прохоренков [и др.] // Сибирское медицинское обозрение. – 2014. – № 4. – С.20-27.
6. Qin J., Yang T., Wang H., Feng T., Liu X. Potential Predictors for Serofast State after Treatment among HIV-Negative Persons with Syphilis in China: A Systematic Review and Meta-Analysis // Iran J. Public Health. 2015. Vol. 44, № 2. P. 155-169.
7. Salazar J.C., Cruz A.R., Pope C.D., Valderrama L., Trujillo R., Saravia N.G., Radolf J.D. Treponema pallidum Elicits Innate and Adaptive Cellular Immune Responses in Skin and Blood during Secondary Syphilis: A Flow-Cytometric Analysis // J. Infect Dis. 2007. Vol. 195. № 6. P. 879-887.
8. Li J., Zheng He-Yi. Characteristics of Patients with Primary and Late Latent Syphilis Patients Who Were Initially Non-Reactive to the Rapid Plasma Reagin Test // Jpn. J. Infect. Dis. 2013. Vol. 66. P. 36-40.
10. Новгородова Т.И. Особенности цитокинового профиля и функционального состояния эндотелия у больных нейросифилисом: автореф. дис. … канд. мед. наук. – Екатеринбург, 2013. – 24 с.
11. Bao T.Y., Yu N.S., Zeng K., Li L., Fang L. Cellular immunity in patients with seroresistance of syphilis // Practical Preventive Medicine(China). 2006. Vol. 13. № 2. P. 254–256.
12. Zhang C.Y. Clinical analysis of serofast patients among syphilitic patients // Lab. Med.Clin.(China). 2013. Vol. 10. № 7. P. 887– 888.
13. Charmie B.T., Godornes C., Van Voorhis W.C., Ukehart S.A., CD4+Lymphocytes and Gamma Interferon Predominate in Local Immune Responses in Early Experimental Syphilis. Infect. Immun. 2007. Vol. 75, № 6. P. 3021-3026.
14. Спиридонов В.Е., Майстренок А.М. Особенности эпидемиологической ситуации по сифилису в Витебской области / В.Е. Спиридонов, А.М. Майстренок // Достижения фундаментальной, клинической медицины и фармации:материалы 72-ой научной сессии сотрудников университета. – Витебск: Изд-во Витебского гос. мед. ун-та, 2017. – С.77-78.
Сифилис – одно из самых распространенных венерических заболеваний на планете. По данным Всемирной Организации Здравоохранения ежегодно в мире регистрируется не менее 12–15 миллионов новых случаев сифилитической инфекции [1]. В последние десятилетия отмечается структурное перераспределение клинических форм заболевания с распространением эпидемиологически неблагоприятных ранних скрытых форм сифилиса, а также поздних скрытых форм с развитием висцерального и нейросифилиса [2, 3]. Несмотря на успехи современной венерологии, у 2–20 % больных после лечения наблюдается развитие серорезистентности [2, 3, 4].
Цель исследования: анализ показателей иммунофенотипирования клеток крови и сывороточных иммуноглобулинов у пациентов с серорезистентным, ранним и поздним скрытым сифилисом.
Материал и методы исследования. В работе представлены данные, полученные при иммунологическом обследовании 100 больных сифилитической инфекцией, находившихся под наблюдением в Краевом клиническом кожно-венерологическом диспансере. В группу I вошли 35 пациентов с ранним скрытым сифилисом, в группу II – 24 пациента с поздним скрытым сифилисом, в группу III – 41 пациент с серорезистентным сифилисом. Контрольную группу составили 50 здоровых респондентов, сопоставимых по возрасту и полу.
Для обеспечения репрезентативности полученных результатов из исследования были исключены ВИЧ-инфицированные пациенты, больные сахарным диабетом, аутоиммунными, аллергическими и онкологическими заболеваниями.
Общее количество лейкоцитов, относительное и абсолютное содержание субпопуляций лимфоцитов определяли с использованием одноплатформенной технологии с помощью гетерогенного гейтирования по панлейкоцитарному маркеру CD45+ и показателям светорассеяния с применением калибровочных частиц Flow-Count Fluorоspheres фирмы Beckman Coulter, США.
Определение иммуноглобулинов A, G, M в сыворотке крови выполняли методом количественной иммунотурбодиметрии с помощью биохимического анализатора AU 680 500 фирмы Beckman Coulter, США. Для анализа использовали реактивы фирмы Beckman Coulter, США. Оценку внутриклеточного кислородзависимого метаболизма нейтрофилов крови проводили с помощью НСТ-теста в модификации А.Н. Маянского и М.Е. Виксмана (1979). Фагоцитарную активность нейтрофилов и моноцитов крови исследовали на модели поглощения частиц латекса (Фрейдлин И.С., 1986).
Для оценки межгрупповых различий применяли однофакторный дисперсионный анализ, критерии Ньюмена – Кейлса, Данна. Достоверными считали различия при p
Результаты исследования и их обсуждение. Показатели фагоцитоза и оксидазной активности нейтрофильных гранулоцитов у пациентов с сифилисом не отличались от здоровых респондентов (таблица).
Показатели иммунного статуса у пациентов с сифилисом
Показатель
Ранний скрытый сифилис (I) (n=35)
Поздний скрытый сифилис (II)
(n=24)
Серо-
резистентный сифилис (III)
(n=41)
Контрольная
группа
(IV)
(n=50)
P
У больных всех клинических групп отмечалось снижение относительного содержания лимфоцитов, что согласуется с данными, представленными в литературе.
Содержание Т-лимфоцитов и Т-хелперов при раннем и позднем скрытом сифилисе не отличалось от аналогичных показателей у здоровых доноров (таблица).
У пациентов всех групп установлено увеличение средних показателей HLADR+ Т-лимфоцитов (таблица, рис.1a, 1б).
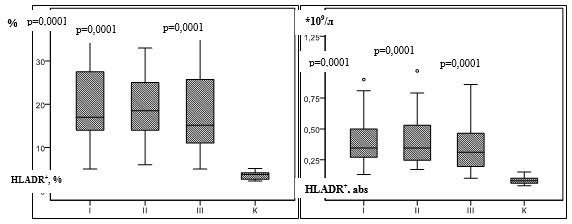
Рис. 1. Содержание HLADR + -лимфоцитов у пациентов с сифилисом
Примечание: p – достоверные отличия по сравнению с контрольной группой; К – контрольная группа, I – ранний скрытый сифилис II – поздний скрытый сифилис, III – серорезистентный сифилис (критерий Ньюмена – Кейлса, критерий Данна).
В группе с серорезистентным сифилисом определялось снижение абсолютного содержания CD3+- и CD4+-клеток по сравнению со здоровыми людьми. Установлены достоверные различия абсолютных показателей CD4+-лимфоцитов при серорезистентном сифилисе по сравнению с ранним и поздним скрытым сифилисом (таблица, рис. 2б).
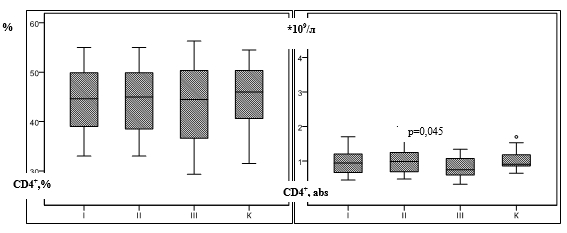
Рис. 2. Содержание CD4 + -лимфоцитов у пациентов с сифилисом
Примечание: p – достоверные отличия по сравнению с контрольной группой; К – контрольная группа, I – ранний скрытый сифилис II – поздний скрытый сифилис, III – серорезистентный сифилис (критерий Ньюмена-Кейлса, критерий Данна).
Примечание: p – достоверные отличия по сравнению с контрольной группой; К – контрольная группа, I – ранний скрытый сифилис II – поздний скрытый сифилис, III – серорезистентный сифилис (критерий Ньюмена-Кейлса, критерий Данна).
Развитие серорезистентности при сифилисе нередко связано с изменением баланса CD4 + /CD8 + -лимфоцитов [6]. Низкие показатели CD3 + - и CD4 + -лимфоцитов у пациентов с серорезистентностью подтверждаются ранее проведенными исследованиями [7, 10]. Содержание и функциональная активность Т-хелперов (CD4 + ) имеет ключевое значение в развитии реакций гиперчувствительности замедленного типа (ГЗТ) и может рассматриваться в качестве одного из факторов, способствующих формированию серорезистентности [6]. Известно, что отсутствие негативации комплекса серологических реакций с высокой частотой отмечается у ВИЧ-инфицированных и иммунокомпрометированных больных сифилисом, что сопровождается ухудшением течения заболевания и отрицательно влияет на результаты лечения [8]. Вероятно, снижение количества CD4 + -лимфоцитов у пациентов с серорезистентным сифилисом может быть связано с недостаточным синтезом IL2 и IL12 мононуклеарами периферической крови [6].
Существует мнение, что дефицит Th1 при вторичном сифилисе обусловлен высоким уровнем апоптоза периферических лимфоцитов посредством активации Fas-опосредованного пути, что затрудняет санацию организма и создает предпосылки для хронизации инфекции [7]. Кроме того, установлено снижение функциональных показателей Th1 по сравнению со здоровыми респондентами [6].
При оценке субпопуляций Т-лимфоцитов нами выявлено увеличение относительного содержания CD8 + -лимфоцитов у пациентов всех групп (таблица, рис.3а).
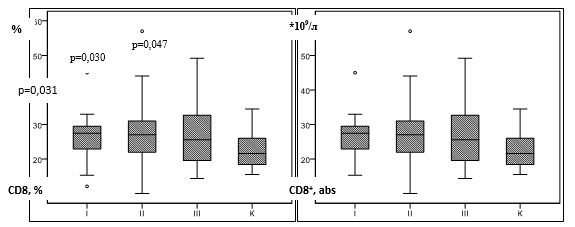
Рис. 3. Содержание CD8 + -лимфоцитов у пациентов с сифилисом
Примечание: p – достоверные отличия по сравнению с контрольной группой (критерий Ньюмена – Кейлса, критерий Данна); К – контрольная группа, I – ранний скрытый сифилис, II – поздний скрытый сифилис, III – серорезистентный сифилис.
Примечание: p – достоверные отличия по сравнению с контрольной группой (критерий Ньюмена – Кейлса, критерий Данна); К – контрольная группа, I – ранний скрытый сифилис, II – поздний скрытый сифилис, III – серорезистентный сифилис.
Роль Т-цитотоксических/эффекторов в клиренсе бледных трепонем до конца не определена. По мнению ряда авторов их увеличение может отражать динамику иммунного ответа, направленного на элиминацию внутриклеточного патогена и имеет компенсаторный характер [6, 11, 12].
В случае экспериментальной инфекции ранее было показано, что появление CD8 + - клеток в месте внедрения T. Pallidum регистрируется уже на 11–18 день после заражения, при этом их преобладание над CD4 + -клетками отмечается в период разрешения процесса между 25 и 39 днем [13]. Установлено, что сифилитические инфильтраты при твердом шанкре у пациентов с сифилисом содержат преимущественно Т-хелперы, в то время как Т-цитотоксические/эффекторы преобладают при вторичных сифилитических поражениях [13]. Вероятно, активированные CD8 + -лимфоциты могут вносить свой вклад в увеличение IFɤ, необходимого для активации макрофагов и реализации ГЗТ или лизировать эпителиальные клетки, инфицированные T. Pallidum, что подтверждается присутствием матричной РНК перфорина и гранзима [9].
Вместе с тем существует мнение, что активация CD8 + -лимфоцитов при сифилисе подавляет реакцию ГЗТ и синтез опсонизирующих антител [9], имеющих определяющее значение в клиренсе T. Pallidum.
При иммунофенотипировании клеток крови у пациентов с серорезистентным сифилисом нами выявлено статистически достоверное уменьшение количества NK-клеток (таблица).
Известно, что NK-клетки играют основную роль в иммунном ответе на внутриклеточные патогены, способствуя синтезу IFNɤ, поляризации Т-лимфоцитов и созреванию дендритных клеток. Натуральные киллеры являются основным источником IFNɤ при стимуляции мононуклеаров периферической крови липопротеинами T. Pallidum [11], что согласуется с существующими в литературе сведениями об уменьшении активности NK-клеток при развитии сифилиса [9, 12].
В исследованиях последних лет у пациентов с вторичной сифилитической инфекцией выявлено появление нетипичной популяции циркулирующих NK (CD56 - CD16 + ) с низким потенциалом секреции IFɤ и других интерлейкинов [9].
Таким образом, при иммунофенотипировании клеток крови у пациентов с серорезистентным, ранним и поздним скрытым сифилисом отмечается перераспределение состава иммунокомпетентных клеток с увеличением количества Т-цитотоксических/эффекторов. Увеличение количества активированных лимфоцитов свидетельствует об активации иммунного ответа в условиях персистенции T. Pallidum.
Признаки дефицита Т-клеточного звена иммунитета определяются преимущественно у пациентов с серорезистентным сифилисом в виде уменьшения количества Т-хелперов, NK-клеток. Полученные данные целесообразно использовать при интерпретации результатов серологических исследований у пациентов с сифилисом и для прогнозирования различных форм заболевания.
Большое клиническое значение в современной медицине является поиск биологических маркеров заболевания, которые могут использоваться для оценки потенциального риска его развития и реализации его клинических фенотипов. Цель исследования: определение клинико-патогенетического значения генного полиморфизма рецепторов врожденного иммунитета в развитии скрытого и серорезистентного сифилиса. В исследование включено 100 человек с сифилитической инфекцией, в том числе 35 – с ранним скрытым сифилисом, 24 – с поздним скрытым сифилисом и 41 пациент с серорезистентным сифилисом. Установлено, что полиморфизмы генов врожденного иммунитета TLR2 Arg753Gln (rs5743708), TLR6 Ser249Pro (rs5743810) ассоциированы с развитием скрытого и серорезистентного сифилиса у пациентов Юга России. Показано, что высокий риск развития скрытых форм сифилиса и сифилиса с серорезистентностью определяется у носителей генотипов TLR2-753 Gln/Gln, TLR2-753 Arg/Gln, TLR6-249 Ser/Ser и аллеля Gln/753. Протективными свойствами обладают гомозиготные генотипы TLR2-753 Arg/Arg, TLR6 –249 Pro/Pro и аллель Pro/249. Развитие серорезистентности при сифилисе ассоциировано с генотипами 753 Arg/Gln, 753 Gln/Gln, 249 Pro/Pro и наличием аллелей Gln/753, Pro/249.

1. Заболеваемость сифилисом в Российской Федерации за период 2004-2014 гг. / А.А. Кубанова и др. // Вестник дерматологии и венерологии. – 2014. – № 5. – С. 24-31.
2. Чеботарев В.В., Чеботарева Н.В., Асхаков М.С. Сифилис: была ли предсказуема ситуация? // Medicus. – 2015. – № 1. – С. 12-14.
3. Актуальные аспекты первичной заболеваемости сифилисом в республике Башкортостан на основе динамики многолетних показателей / А.Б. Латыпов и др. // Здоровье и образование в XXI веке. – 2016. – Вып. 18. – № 12. – С. 102-106.
4. Эпидемиология сифилиса в современных условиях / Н.Н. Потекаев и др. // Клиническая дерматология и венерология. – 2015. – № 1. – С. 22-34.
5. Мирошниченко И.И., Птицына С.Н. Биомаркеры в современной медико-биологической практике // Биомедицинская химия. – 2009. - Т. 55, вып. 4. – С. 425-440.
6. Mukherjee S., Karmakar S., Prasad S., Babu S. TLR2 and TLR4 mediated host immune responses in major infectious diseases: a review // Braz. J. Infect. Dis. 2016. Vol. 20. № 2. P. 193-204. doi: org/10.1016/j.bjid.2015.10.011.
7. Skevaki C., Pararas M., Kostelidou K. et al. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infectious diseases / C. Skevaki, M. Pararas, K. Kostelidou [et al.] // Clin. Exp. Immunol. 2015. Vol. 180. № 2. P. 165-177.
8. Trejo-de la O.A., Hernández-Sancén P., Maldonado-Bernal C. Relevance of single-nucleotide polymorphisms in human TLR genes to infectious and inflammatory diseases and cancer // Genes. Immun. 2014. Vol. 15. № 4. P. 199-209.
9. Medvedev A.E. Toll-like receptor polymorphisms, inflammatory and infectious diseases, allergies, and cance // J. Interferon Cytokine Res. 2013. Vol. 33. № 9. P. 467-484. doi: 10.1089/jir.2012.0140.
10. Ahmad-Nejad P., Denz C., Zimmer W. et al. The presence of functionally relevant toll-like receptor polymorphisms does not significantly correlate with development or outcome of sepsis // Genet Test Mol. Biomarkers. 2011. Vol. 15. P. 645-651.
11. Xiong Y., Song C., Snyder G.A. et al. Arg753Gln polymorphism inhibits Toll-like Receptor (TLR) 2 tyrosine phosphorylation, dimerization with TLR6 and myeloid differentiation primary response protein 88 recruitment // J. Biol. Chem. 2012. Vol. 287. P. 38327-38337.
12. Marra C.M., Sahi S.K., Tantalo L.C. et al. Toll-like Receptor Polymorphisms Are Associated with Increased Neurosyphilis Risk // Sex. Transm. Dis. 2014. Vol. 41 (7). P. 440–446.
13. Cameron C.E. The T. pallidum outer membrane and outer membrane proteins // Pathogenic Treponema: Molecular and Cellular Biology / ed.: J.D. Radolf, S.A. Lukehart. – Norwich, UK: Caister Academic Press, 2006. P. 237-266.
14. Desrosiers D.C., Anand A., Luthra A. et al. TP0326, a Treponema pallidum β-barrel assembly machinery A (BamA) orthologue and rare outer membrane protein // Mol. Microbiol. 2011. Vol. 80. P. 1496-1515.
15. Randhawa A.K., Shey M.S., Keyser A. et al. Association of Human TLR1 and TLR6 Deficiency with Altered Immune Responses to BCG Vaccination in South African Infants // PLOS Pathog. 2011. Vol. 7. e1002174.
Несмотря на снижение заболеваемости сифилисом в Российской Федерации, ее уровень по-прежнему остается высоким и превышает показатели развитых европейских стран и США [1; 2]. Особенности сифилитической инфекции в последнее десятилетие определяются увеличением персистирующих скрытых и поздних форм заболевания, частым формированием серорезистентности, сложностями диагностики и терапии вследствие неоправданно широкого использования антибактериальных средств, приводящих к формированию иммунной компрометированности и изменяющих клинику и течение инфекционного процесса 3.
Перспективным направлением современной медицины является поиск информативных биомаркеров персистенции инфекции и прогрессирования заболевания, позволяющих прогнозировать сценарий инфекционного процесса и своевременно осуществлять терапевтические мероприятия [5].
Актуальными для изучения при сифилисе являются рецепторы врожденного иммунитета (TLR) 6. Установлено, что нарушение структуры и функции рецепторов TLR сопровождается снижением продукции ключевых интерлейкинов, обеспечивающих интенсивность реакций врожденного и адаптивного иммунитета, что лежит в основе развития инфекционного процесса 9.
Частоты полиморфных генов, влияющих на реализацию иммунного ответа, остаются постоянными в течение жизни и могут использоваться в качестве предикторов развития заболевания и реализации его клинических фенотипов [5].
Цель исследования: определение клинико-патогенетической роли TLR-рецепторов в развитии скрытого сифилиса и формировании серорезистентности.
Материал и методы исследования
Иммуногенетические исследования выполнены у 100 человек с сифилитической инфекцией, восточнославянской популяции Юга России, находившихся под наблюдением в Ставропольском краевом клиническом кожно-венерологическом диспансере (СККВД). В группу I включены 35 пациентов с ранним скрытым сифилисом, в группу II – 24 пациента с поздним скрытым сифилисом, в группу III – 41 пациент с сифилисом с серорезистентностью.
Средний возраст у пациентов в группе I составил 35,2±1,8 года, в группе II – 40,9 ±2,09 года, в группе III – 41,1 ±1,74 года.
Контрольную группу составили 50 здоровых жителей восточнославянской популяции Южного региона России, средний возраст – 37,1±1,44 года. Группы пациентов, больных сифилисом и контрольная группа имели близкий социально-экономический статус.
Достоверность различий в частотах аллельных вариантов и генотипов оценивалась с помощью критерия χ 2 Пирсона, при множественных сравнениях – с помощью критерия χ 2 с поправкой Йетса. Степень риска развития событий оценивали по величине отношения шансов (OR) с расчетом доверительного интервала CI.
Результаты исследования и их обсуждение
При изучении аллелей полиморфизма 753 Arg/Gln (rs5743708) гена TLR2 отмечено частотное преобладание дикого аллеля Arg/753 в гомозиготном состоянии как у больных сифилисом (71%), так и у здоровых респондентов (94%) (табл. 1).
Распределение частот аллелей и генотипов TLR2 у больных со скрытым сифилисом и сифилисом с серорезистентностью
Иммуноблот при сифилисе на Джи и М антитела — высокочувствительное, специфичное исследование. Позволяет опровергнуть/подтвердить диагноз при получении неопределенных или позитивных данных, полученных при помощи классических тестов. Отличается информативностью и 99-100% достоверностью.
Метод рекомендован как референтный (максимально точный) при необходимости выполнения дифференциальной диагностики, для подтверждения диагноза латентного сифилиса.
Лабораторная диагностика сифилиса
Серологические исследования базируются на иммунных связях, которые наблюдаются в сыворотке крови.
Белковые соединения сливаются с антигенами, в результате этого взаимодействия антигены микробов купируются.
После внедрения возбудителя (Treponema pallidum) в организме начинают вырабатываться защитные антитела.
Они атакуют микробы и предотвращают распространение болезни.
Для анализа берется кровь, добавляется в нее суспензия микробов.
Если реакция не произошла — человек здоров, произошла — болен.
Иммуноглобулины при сифилисе (иммуноглобулины к бледной трепонеме) — белки-защитники, продуцируемые для его нейтрализации.
Они выявляют инфекцию в крови, ее остатки после проведенной терапии.
Каждый из антител к Treponema pallidum имеет конкретный информативный статус, назначение и конфигурацию.
Иммуноглобулины А при сифилисе
Осуществляют контроль за местным иммунным ответом — ранней защитой, реагирующей на попадание инфекционного агента в определенный сегмент организма.
Производятся в значительной концентрации на слизистых кишечника, легких, полости рта, в незначительной — в крови.
Являются маркером активной инфекции, считаются неспецифическими, поскольку дают ответ и на другие бактерии.
Иммуноглобулины М при сифилисе
Курируют общий иммунитет.
Отличаются слабой специфичностью.
Способствуют эвакуации антигенов, предупреждают их фиксацию в тканях и запуск патологических процессов.
Их наличие указывает на активную стадию заболевания, после лечения эти белки пропадают.

Иммуноглобулины G при сифилисе
Основные иммуноглобулины вторичного иммунитета.
Обеспечивают высокую напряженность иммунного ответа в течение длительного срока.
Клетки памяти этих белков организм способен продуцировать несколько лет после приема профильных лекарственных препаратов.
Что такое титры иммуноглобулинов и как они падают
Титры иммуноглобулинов — термин, применяемый для определения концентраций белковых молекул.
На 4-5 сутки после заражения в крови определяются IgA.
Но вследствие того, что данный период инфекционного процесса выраженной клиники не дает, анализы на них проводятся крайне редко.
Через 7-8 суток после инфицирования клетки плазмы начинают синтезировать IgM.
Белки вырабатываются в первичном/вторичном периоде сифилиса, в третичном — ликвидируются.
Контролировать, как падает их концентрация, очень важно для оценки качества лечения.
Если на протяжении 2-3 недель после их титры снижаются медленно, можно говорить о микробиологической неэффективности назначенной терапии.
Иммуноглобулины класса G появляются спустя 35-40 дней после заражения
Через 55-60 суток их уже можно увидеть в обычных скрининговых анализах.
Когда исчезают из крови иммуноглобулины при сифилисе?
IgM продуцируются 3-4 года после подтвержденной клинической ремиссии.
У некоторых пациентов белок способен выделяться на протяжении всей жизни, что не гарантирует 100% защиты от повторного заражения.
Иммуноглобулины при сифилисе: кто назначает, когда проводится анализ

Специфические антитела M появляются через одну-две недели после внедрения возбудителя в организм.
Максимальная концентрация трепонемы фиксируется на 40-60 день, пропадает — спустя 3-5 месяцев после лечебного курса, 12-18 месяцев — без бактериальной терапии.
Выявляются у лиц на первой/второй фазе сифилиса.
Позволяют установить точные сроки заражения.
IgG обнаруживаются на 25-30 сутки патологического процесса.
Их титры постоянно растут, максимальная концентрация отмечается через 2 года после инфицирования.
Особой подготовки тест не требует: перед забором крови пациенту нужно воздержаться от еды и курения 4-5 часов.
От употребления спиртосодержащих напитков — 24 часа.

Показания:
- наличие явной клинической симптоматики;
- сомнительные/положительные результаты, полученные в ходе предыдущих тестов, особенно на фоне онкологии, туберкулеза, алкоголизма, диабета в анамнезе;
- подозрение на болезнь при приеме антисептических и антибактериальных препаратов;
- врожденная форма;
- половой акт с больным человеком;
- ВИЧ-инфекция;
- выявленные венерические болезни;
- язвенные поражения гениталий; .
Интерпретация результатов иммуноблота при сифилисе
Положительный результат указывает на недавнее заражение.
Повторный (+) при проведении исследования через 1-1,5 месяца служит подтверждением диагноза сифилис.
Обнаружение IgM у новорожденных младенцев говорит о наличии сифилитической инфекции.
Поскольку плацентарная передача материнских IgM невозможна.
Отрицательный результат предполагает 2 варианта событий: инфицирования не было, анализ был проведен до выраженной реакции иммунной системы.
В сомнительных случаях через 7 дней проводится еще одно тестирование.
Критерии положительности иммуноблота:
- (+): для M — 1 четкая полоса, для G — 2 четких полосы;
- (-): для G, M — полосы отсутствуют;
- (-/+): для G — 1 четкая полоса, для M — 1 слабая полоса.
Сравнение с другими методами анализов на сифилис
В клинической практике для скринингового (предварительного) обследования на сифилис проводят исследование РМП или улучшенный вариант (РПР).
При положительных данных ставится подтверждающий трепонемный тест — ИФА, РПГА, РИТ (РИБТ), РИФ:
Главное преимущество иммуноблота по сравнению с другими тестами заключается в том, что ответ антиген-антитело не требует дорогих технологий и зависит от массы белка.

Второй плюс — на результат не влияют отсутствие растворимости, нестабильность антигенов.
В анализе есть возможность определить реакцию иммуноглобулинов с несколькими антигенами.
Это имеет большую диагностическую ценность, особенно в сложных случаях.
Тест достаточно прост в исполнении, при необходимости позволяет выявить IgM, IgG изолированно друг от друга.
Ложноположительные и ложноотрицательные анализы на сифилис
Ложные серологические реакции могут быть обусловлены качеством реагентов, погрешностями в ходе выполнения исследования, техническими неточностями.
Ложноотрицательные анализы выдаются при нарушениях сроков хранения приборов для диагностики.
Это влечет за собой снижение чувствительности реакции.
Ложноположительные результаты возникают вследствие ошибок при приготовлении сывороток, неравномерной концентрация антигена, нарушений при заборе крови.
Инфекции/состояния, при которых фиксируются ложноположительные результаты:
- беременность;
- пневмония;
- мононуклеоз;
- ВИЧ;
- гепатит;
- онкологический процесс.

Причины ложноотрицательных реакций:
- иммунодефицитные состояния;
- наличие конкуренции между G и M иммуноглобулинами;
- при ИФА ложный результат может быть обусловлен иммунной недостаточностью, ВИЧ (вторичный сифилис), наличием серонегативной фазы (первичный сифилис).
Если тест вызывает сомнения, целесообразно его повторить через 5-10 дней, пройти дополнительные обследования по назначению врача-венеролога.
Для диагностики сифилиса обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
Читайте также:


