Изменение миокарда при отравлениях
Обновлено: 24.04.2024
Сердечно-сосудистая система при отравлении лекарствами - причины
Химические токсины и сердечно-сосудистые заболевания:
а) Атеросклеротическая ишемическая болезнь сердца:
Сероуглерод (1)
Угарный газ (3)
Продукты сгорания (3)
Мышьяк (3)
б) Неатеросклеротическая ишемическая болезнь сердца:
Органические нитраты (1)
в) Асфиксия миокарда:
Угарный газ (1)
Цианид (1)
Сероводород (1)
г) Непосредственное поражение миокарда
Кобальт (3)
Мышьяк (1)
Арсин (1)
Свинец (3)
Сурьма (2)
Органические растворители (3)
д) Аритмии:
Галогенуглеводороды (1)
Фосфорорганические соединения (1)
Сурьма (2)
Мышьяк (2)
Арсин (1)
е) Гипертензия:
Свинец (2)
Кадмий (3)
Сероуглерод (2)
Органические растворители (3)
ж) Окклюзионная болезнь периферических артерий:
Мышьяк (2)
Свинец (2)
Сероуглерод (2)
* Вероятность причинно-следственной связи: (1) — определенная, (2) — вероятная, (3) — возможная.
Аллергический миокардит следует подозревать, когда у больного с развившейся аллергической реакцией на лекарство, обычно с признаками эозинофилии, наблюдаются новые изменения на электрокардиограмме, слегка повышенный уровень ферментов, кардиомегалия или необъяснимая тахикардия.
Трепетание-мерцание желудочков. Можно подозревать противоаритмические средства (например, хинидин, дизопирамид, прокаинамид, лидокаин, амиодарон), психотропные средства (например, фенотиазины, трициклические и тетрациклические антидепрессанты) и фосфорорганические соединения.
Полная сердечная блокада. Ее могут вызвать противоаритмийные средства I класса (прокаинамид, хинидин), блокаторы кальциевых каналов, бета-блокаторы, наперстянка, фосфорорганические соединения, кокаин, клонидин, фенитоин, нейролептики и циклические антидепрессанты.
Аритмии могут вызывать противоаритмийные агенты (трициклические антидепрессанты, фенотиазины, седативные и снотворные средства [например, хлоралгидрат]), а также стимуляторы, углеводороды, фосфор, угарный газ, яды скорпионов и пауков.
Аритмии, вызванные лекарствами и токсинами
| Нарушения ритма | Возможная причина |
| Синусовая брадикардия или предсердие-желудочковая блокада | Бета-блокаторы, антагонисты кальция, циклические антидепрессанты, дигоксин и другие сердечные гликозиды, фосфорорганические и карбаматные инсектициды, фенилпропаноламин и другие альфа-адренергические стимуляторы |
| Синусовая тахикардия | Кокаин, амфетамины, фенилциклидин, антигистаминные препараты, антихолинергики, циклические антидепрессанты, фенотиазины, теофиллин, синдром отмены этанола или седативных и снотворных средств, угарный газ |
| Удлинение комплекса QRS | Циклические антидепрессанты, хинидин, прокаинамид, дизопирамид, энкаинид, флекаинид, бета-блокаторы, антагонисты кальция, дифенгидрамин (массивные дозы), фенотиазины (особенно тиоридазин) |
| Удлинение интервала Q—T (включая трепетание и мерцание) | Циклические антидепрессанты, хинидин,прокаинамид, дизопирамид, энкаинид, флекаинид, бета-блокаторы, антагонисты кальция, литий, антигистаминные препараты (дифенгидрамин, терфенадин, астемизол), фенотиазины, мышьяк, фосфорорганические соединения |
| Желудочковые тахиаритмии | Кокаин, амфетамины, хлоралгидрат и хлоруглеводороды, теофиллин, дигоксин и другие сердечные гликозиды, трициклические антидепрессанты |
Краткий перечень отрицательных воздействий лекарств на сердечно-сосудистую систему
| Лекарства, используемые для лечения преимущественно сердечно-сосудистых заболеваний | Отрицательное воздействие | Лекарства, используемые для лечения преимущественно не при сердечных заболеваниях | Отрицательное воздействие |
| Гликозиды наперстянки | Различные сердечные аритмии | Пероральные контрацептивы | Тромбоэмболия Гипертензия |
| Хинидин | Удлинение интервала Q—T Нарушения внутрижелудочковой проводимости Гипотензия Хинидиновый обморок | Доксорубицин и даунорубицин (адриамицин и дауномицин) | Неспецифический сегмент ST, аномалии зубца T Фармакогенная кардиомиопатия Эндокардиальный фиброз |
| Прокаинамид | Гипотензия Нарушения внутрижелудочковой проводимости Фармакогенный волчаночный синдром | Циклофосфамид | Некроз миокарда (при крайне высоких дозах) |
| Фенитоин (дифенилгидантоин) | Гипотензия Аритмии Фармакогенный волчаночный синдром | Лития карбонат | Различные аритмии |
| Пропранолол | Застойная сердечная недостаточность Брадиаритмии Гипотензия (редко) Реактивная стенокардия (при резкой отмене в случае тяжелой ишемической болезни сердца) | Фенотиазины | Сердечные аритмии Неспецифические аномалии ЭКГ Гипотензия |
| Симпатомиметические амины | Тахикардия Ишемия миокарда | Кортикостероиды | Замедленное заживление миокарда после инфаркта |
| Симпатомиметические амины | Тахикардия Ишемия миокарда | Метилсергид | Эндокардиальный фиброз |
| Диазоксид и гидралазин (парентерально) | Тахикардия Ишемия миокарда | Калия пенициллин | Гиперкалиемия |
| Празозин | Постуральная гипотензия (при избыточной первой дозе или быстром увеличении дозы) | Карбенициллин | Гипокалиемия |
| Клофибрат | Различные сердечные аритмии Повышение уровней сывороточной глутаматоксалоацетаттрансаминазы, сывороточной глутаматпируваттрансаминазы и креатинфосфокиназы Синергизм с антикоагулянтами | Линкомицин | Брадикардия, остановка сердца (при быстром вливании высоких доз) |
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Поражение мышцы сердца при отравлении. Токсическая миокардиодистрофия
При острых отравлениях мышца сердца поражается очень часто, а при тяжелых интоксикациях, как правило. При этом в основе патологического процесса лежит миокардиодистрофия. В одних случаях миокардиодистрофию можно связать с непосредственным воздействием яда на обменные процессы в миокарде (специфический кардиотоксический эффект), в других — с косвенным влиянием нарушений, возникающих в организме при интоксикациях (неспецифический кардиотоксический эффект). К последним относят гипоксические состояния, циркуляториые расстройства (шок, коллапс), нарушения кислотно-основного состояния, водно-солевого баланса, дефицит витаминов, увеличение катехоламинов, повышенную нагрузку на мышцу сердца и др. Значение каждой из перечисленных причин может быть различным в зависимости от характера яда, тяжести интоксикации и сопровождаемых осложнений.
При многих интоксикациях основным фактором, приводящим к миокардиодистрофии, являются гипоксические состояния. Они могут носить характер гипоксических гипоксии (отравления веществами наркотического и удушающего действия и др.), гемических (отравления окисью углерода и метгемоглобинообразователями), тканевых (отравления цианидами) и циркуляторных. Последние наблюдаются при самых различных тяжелых интоксикациях и чаще всего проявляются в виде интоксикационного шока. Если интоксикация сопровождается печеночной или почечной недостаточностью, то в патогенезе миокардиодистрофии большое значение приобретают аутоинтоксикация, нарушение электролитного и водного баланса; ацидоз и др.
Миокардиодистрофия при интоксикациях может усиливаться в результате повышенной работы сердца (при психомоторном возбуждении, длительной тахикардии, повышении давления в малом или большом круге кровообращения), а также при различных инфекционных осложнениях, среди которых цераое место занимают пневмонии.

В основе патологического процесса при миокардиодистрофиях лежит нарушение активности окислительно-восстановительных процессов в миокарде. Прогноз при миокардиодистрофиях во многом определяется характером яда, степенью интоксикации и проводимыми лечебными мероприятиями. В одних случаях миокардиодистрофия проходит через несколько дней после прекращения интоксикации^в других — через многие недели.
При тяжелых интоксикациях практически во всех случаях проявляется в той или иной степени кардиотоксическое действие яда (например, при отравлении хлорированными углеводородами, уксусной эссенцией, снотворными и др.). Среди веществ, способных вызвать отравление, находятся фармакологические препараты, химические соединения, яды животного и растительного происхождения, обладающие выраженным кардиотоксическим эффектом. К таким веществам относятся сердечные гликозиды, хинин и хинидин, пахикарпин; растительные алкалоиды — мускарин (грибы мухоморы), вератрин (чемерица), кониин (болиголов), аконит (иссык-кульский корешок) и др. Выраженным кардиотоксическим действием обладают фосфорорганические соединения.
При отравлениях кардиотоксическими веществами патологический процесс в миокарде становится ведущим и сопровождается нарушениями ритма, проводимости и сократимости сердца; при тяжелой интоксикации может наступить скоропостижная смерть при клинической картине кардиогенного шока.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Метаболические сдвиги в миокарде при отравлении кадмием. Влияние невротизации на миокард
Иллюстрацией к рассмотренным механизмам кардиотоксичности тяжелых металлов в известной мере могут быть данные, характеризующие определяемые у контактирующих с Cd рабочих артериальную гипертензию, тахикардию и изменения показателей ЭКГ (у 45 % обследованных). Однако в экспериментальных исследованиях таких изменений прослежено не было. Именно этот аспект требовал проверки в наших экспериментальных исследованиях.
При введении хлорида кадмия белым крысам в течение 4 нед в дозе 0,05 LD50 снижались вольтаж зубцов R и Т, рост отношения Р/Т на ЭКГ, удлинение интервалов PQ и QN, тенденция к снижению ЧСС (на 28 %), более четко прослеживаемая к концу опыта. Невротизация сопровождалась четкими полярными (по отношению к животным, затравленным Cd) сдвигами примерно той же степени выраженности.
В частности, обращали на себя внимание рост вольтажа зубца R на 50 % в первые недели опыта, укорочение интервалов PQ и QT, повышение ЧСС, стабильное в течение всего опыта на уровне 140—160 % по отношению к контролю.
Весьма сложная картина наблюдалась при сочетанном воздействии кадмия и невротизации: для нее было характерно в общем плане преобладание показателей, идентичных по направленности с невротизированными животными, на первых двух неделях опыта. Это особенно четко прослеживалось, например, при анализе значения ЧСС, вольтажа зубца R, интервала QT.
Введение Cd на фоне невротизации после краткого периода активации симпатического звена вызывало существенное угнетение всех учитываемых показателей при выраженном преобладании парасимпатических влияний над симпатическими (резкий рост Р/Т). Это хорошо согласовывалось и с данными оценки поведенческих реакций, и с характером динамики выведения КА с мочой у подопытных животных, которые были проанализированы при характеристике нейротоксических эффектов кадмия в предыдущем разделе.
В обычных условиях для компенсирования вышеназванного комплекса метаболических сдвигов должен срабатывать регуляторный механизм удаления Са2+ из клетки, ингибирования аденилатциклазы и активации фосфодиэстераз, приводящих к инактивации цАМФ. Этого не происходит в условиях продолжающегося процесса интоксикации (за счет кумуляции и повторного поступления ионов металлов-стрессоров), что ведет к дальнейшим нарушениям ионного баланса (накопление в клетке Са2+ и Na+ при снижении концентрации К+), окислительного фосфорилирования в митохондриях кардиомиоцитов и функционального состояния биомембран.
Последнему способствуют липотропные эффекты КА (активация активности липаз, фосфолипаз и процессов ПОЛ, рост уровня и проявлений детергентного действия на липиды мембран лизофосфатидов и жирных кислот), а также гипоксический по своей природе и направленности характер изменений основных звеньев энергетического обмена (активация анаэробного гликолиза, снижение активности ферментов трикарбонового цикла и дыхательной Цепи, переключение на использование липидов в качестве субстратов энергообмена с активацией процессов свободнорадикального окисления в миокарде).
Такого рода неспецифические изменения безусловно доминируют в патогенезе кардиотоксического действия тяжелых металлов. Тем не менее нельзя исключать участия в этих процессах и специфических механизмов, определяющих их токсическое действие как тиоловых ядов. Среди них безусловно ведущими являются такие, как снижение активности ферментов энергетического обмена (ПВДГ, Г-6-ФДГ, сс-КДГ, ИЦДГ, СДГ) вследствие блокады SH-групп, нарушение активного транспорта ионов за счет снижения энергетического потенциала клетки и конкуренции ионов токсичных металлов с эссециальными (прежде всего Са2+), возможное прямое мембранотоксическое действие на кардиомиоциты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Описана морфология алкогольной миокардиопатии, отдифференцированы острые изменения от хронических, возникающих вследствие употребления алкоголя. Показано повреждающее действие однократного приема токсических доз этанола.
код для вставки на форум:
Изучили случаи отравления этиловым алкоголем и скоропостижной смерти от заболеваний органов кровообращения, наступившей при явлениях острой сердечно-сосудистой недостаточности. Диагноз отравления алкоголем в этих случаях основывался главным образом на результатах определения содержания этанола в крови.
При анатомических же признаках атеросклероза аорты, коронаро- и кардиосклероза даже при концентрации этанола в крови 3—4,5%о алкоголь оценивали чаще всего как способствующий фактор. Так, за 10 лет в 37,5% случаев эксперты ставили диагноз скоропостижной смерти на фоне алкогольной интоксикации, когда количество этилового спирта в крови соответствовало IV степени опьянения в стадии элиминации. Все это указывает на недооценку роли алкоголя в развитии сердечно-сосудистой недостаточности, что приводит к гипердиагностике скоропостижной смерти.
При изучении влияния этанола на миокард изучили 26 случаев смерти от отравления алкоголем.
Во всех наблюдениях концентрации этилового спирта в крови соответствовали смертельным. Контролем служили 4 случая скоропостижной смерти от ишемической болезни сердца на фоне атеросклероза или гипертонической болезни и 6 случаев быстрой смерти от травм, когда в крови и тканях умерших этиловый алкоголь не был обнаружен.
Все секционные наблюдения разделили на четыре группы: 1-я — отравления без сопутствующих сердечно-сосудистых заболеваний; 2-я — отравления с сопутствующим атеросклерозом или гипертонической болезнью; 3-я — скоропостижная смерть; 4-я — контроль.
Сердце вскрывали методом, предложенным группой ВОЗ в 1966—1967 гг.: взвешивали дважды — до вскрытия и после удаления субэпи кардиального жира. Измеряли пути кровотока, раздельно взвешивали камеры сердца, вычисляли желудочковый индекс (ЖИ). Выясняли обстоятельства смерти и сведения о хроническом алкоголизме и заболеваниях органов кровообращения.
Для изучения влияния острой алкогольной интоксикации на метаболизм и морфологические структуры миокарда без предшествующего фона, обусловленного хроническим алкоголизмом, 242 белым крысам однократно вводили 48% раствор этилового спирта (12 мл на 1 кг массы тела). Сердце, печень, скелетные мышцы и надпочечники исследовали гистологически, гистохимически, а также фазово-контрастной и поляризационной микроскопией. Для сопоставления результатов гистохимических реакций применяли комбинированные блоки. Белковый обмен в сердце и печени оценивали по количественному содержанию белка в гомогенате по методу Лоури и скорости включения S 35 -метионина в тотальный белок и митохондриальные фракции.
В случаях смерти людей от отравления алкоголем, как правило, обнаруживали признаки сердечной декомпенсации: отек легких, полнокровие внутренних органов, в сердце — изменение наружных размеров, путей кровотока, ЖИ. Дилатация полостей сердца отмечена в 22 случаях, в 13 из них — в обоих желудочках. Таким образом, по крайней мере в 50% случаев отравления алкоголем уже на секции можно было предполагать кардиальный механизм смерти.
Гистологически в сердце отмечали комплекс деструктивных, склеротических и компенсаторных процессов (Г.П. Казанцева, 1975). Выраженное застойное полнокровие сердца, ожирение, значительный отек стромы и набухание мышечных волокон, а также жировая дистрофия миокарда приводили к увеличению массы сердца до 420—480 г. Количество же гипертрофированных волокон было незначительным, встречались они в пограничных с очагами склероза участках миокарда. Иногда значительную долю в общей массе (до 92 г) составляла субэпикардиальная жировая клетчатка. Описанные изменения имели диффузный характер, но больше были выражены справа, что способствовало увеличению ЖИ, который превышал 0,6.
Обращает на себя внимание избирательный коронаросклероз при отравлении алкоголем. Изменения аорты и других сосудов были выражены значительно меньше, а иногда отсутствовали вовсе. Коронарокардиосклероз, ожирение сердца, а также бурая атрофия миокарда в разной степени наблюдались во всех случаях с длительным алкогольным анамнезом независимо от возраста.
В печени обнаруживали дистрофические и дисциркуляторные изменения, а также явления гепатита и склероза. В скелетной мышце дистрофические изменения были менее выражены, чем в сердце, а признаки регенерация были более отчетливы. В надпочечниках наблюдались делипоидизация коркового слоя, дисциркуляторные, дистрофические и склеротические процессы.
Эксперимент показал, что и однократное введение токсической дозы этанола вызывает глубокие метаболические расстройства и структурные изменения. В миокарде уже через 30 мин после введения этанола наступило выраженное венозное и капиллярное полнокровие с парезом сосудов и явлениями стаза, набухание стенок сосудов и периваскулярные кровоизлияния (рис. 1, см. вклейку); характерно было поражение мелких сосудов со значительным сужением просвета артериального русла. Через 3 ч наблюдались распространенная фрагментация мышечных волокон, появление фуксинофильных вставочных дисков, мышечных сегментов. При окраске гематоксилин-эозином эти волокна имели гомогенную базофильную саркоплазму. Через 24—48 ч в сердце постоянно встречались коагуляционные микронекрозы мышечных волокон с накоплением в саркоплазме ШИК-положительного материала и образованием перифокальных круглоклеточных инфильтратов (рис. 2, см. вклейку). На месте погибших волокон, подвергшихся резорбции, располагались макрофаги, нагруженные зернистым веществом, дающим интенсивную реакцию с галлоцианинхромовыми квасцами.
В печени и надпочечниках наблюдали сочетание дисциркуляторных и дистрофических процессов, динамика развития которых отражала метаболические расстройства. Эти процессы в сердце, печени и надпочечниках сопровождались угнетением белоксинтетической активности печеночных клеток и миоцитов и снижением количества белка в миокарде через 3 ч после введения токсической дозы алкоголя. Включение общих и внутриклеточных адаптивных механизмов в ответ на повреждение сопровождалось анаболической реакцией, о чем свидетельствовало значительное увеличение включения S 35 -метионина в тотальный белок и митохондриальные фракции через 5 ч после введения алкоголя по сравнению с таковым в предыдущем периоде. В последующие сроки изучаемые показатели постепенно нормализовались, хотя полного восстановления их, так же как и гистохимических реакций, не наблюдалось. Обращает на себя внимание односторонняя направленность динамики белкового обмена в сердце и печени, как подтверждение прямого цитотоксического эффекта алкоголя. Не менее важным механизмом действия алкоголя на сердце является гипоксия, вызванная описанными выше структурными нарушениями микроциркуляторного русла. Определенную роль играет и опосредованное воздействие алкоголя на миокард нервнорефлекторным путем и через эндокринную систему. Доказательством последнего служат морфологические признаки изменения функциональной активности надпочечников.
Таким образом, при установлении сердечно-сосудистой недостаточности и обнаружении этилового спирта в крови эксперт должен иметь в виду, что причиной смерти может быть:
- 1) острое отравление алкоголем с развитием токсической дистрофии миокарда и первичной остановкой сердца (кардиальный механизм),
- 2) хронический алкоголизм с алкогольной миокардиопатией и сердечно-сосудистой недостаточностью, связанной с последним приемом алкоголя,
- 3) ишемическая болезнь сердца на фоне алкогольной интоксикации.
Диагноз отравления алкоголем при высоком содержании этанола в крови не вызывает затруднений. Сложнее дифференцировать два последних состояния, когда в крови определяются малые концентрации спирта.
Обнаруженные склеротические изменения сердца и сосудов могут быть обусловлены длительным употреблением алкоголя, а не только гипертонической болезнью или атеросклерозом, на фоне которых развивается ишемическая болезнь сердца.
В связи с этим при дифференциальной диагностике указанных состояний мы рекомендуем:
- Выяснить давность и частоту злоупотребления алкоголем, дозы и ответную реакцию; обстоятельства смерти; наличие и клиническое течение сердечно-сосудистых заболеваний.
- Учитывать, что хронический алкоголизм приводит к развитию миокардиопатии и может быть причиной сердечно-сосудистой недостаточности.
- Считать, что при сочетании с заболеваниями органов кровообращения отравление алкоголем может вызвать смерть при концентрациях спирта в крови и моче ниже общепринятых смертельных, на которых обычно основывают суждение эксперты.
- При подобных сочетаниях следует проводить биометрическое исследование сердца, а также гистологическое и гистохимическое изучение миокарда, печени, скелетных мышц, надпочечников и других органов для подтверждения цитотоксического эффекта алкоголя и его роли как непосредственной причины смерти.
При этом можно использовать следующие дифференциально-диагностические признаки:
- а) увеличение ЖИ при отравлении алкоголем (при скоропостижной смерти — обычно в пределах нормы),
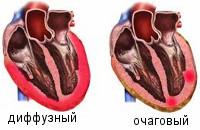
- б) диффузный характер острых дисциркуляторных и дистрофических изменений миокарда при отравлении алкоголем и очаговый при скоропостижной смерти,
- в) распространенное набухание и гиалиноз стенок мелких артерий миокарда, характерные для отравления этанолом,
- г) тотальное обеднение липидами коры надпочечников при отравлении алкоголем и менее выраженная делипоидизация коркового слоя при скоропостижной смерти,
- д) более значительное, чем при скоропостижной смерти, снижение содержания гликогена в печени, сочетающееся с белковой и липидной дистрофией гепатоцитов и признаками гепатита.
К статье Ю. Л. Сутулова и соавт.
Рис. 1. Набухание и вакуолизация мышечных элементов мелкой межмышечной артерии сердца со значительным сужением ее просвета. Периваскулярное кровоизлияние.
Рис. 2. Клеточные скопления вокруг некротизированного мышечного волокна.
похожие статьи
К вопросу о саморазрывах сердца / Кечек К.С. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 109-111.
Миокардит – воспаление мышечной оболочки сердца (миокарда), чаще ревматического, инфекционного или инфекционно-аллергического характера. Течение миокардита может быть острым или хроническим. Острый миокардит проявляется одышкой, цианозом, отеками на ногах, набуханием вен на шее, болями в сердце, сердцебиением, аритмиями. Часто развитию миокардита предшествует перенесенная инфекция (дифтерия, ангина, скарлатина, грипп и др.). В дальнейшем возможны рецидивы заболевания (при ревматическом миокардите), развитие сердечной недостаточности и тромбоэмболий сосудов различных органов.
Общие сведения
Миокардит – воспаление мышечной оболочки сердца (миокарда), чаще ревматического, инфекционного или инфекционно-аллергического характера. Течение миокардита может быть острым или хроническим. Острый миокардит проявляется одышкой, цианозом, отеками на ногах, набуханием вен на шее, болями в сердце, сердцебиением, аритмиями. Часто развитию миокардита предшествует перенесенная инфекция (дифтерия, ангина, скарлатина, грипп и др.). В дальнейшем возможны рецидивы заболевания (при ревматическом миокардите), развитие сердечной недостаточности и тромбоэмболий сосудов различных органов.
Частота заболеваемости миокардитом намного выше статистической из-за поздней диагностики и латентных форм, когда заболевание протекает стерто или в легкой форме. Признаки воспалительного процесса в миокарде в 4–9% случаев обнаруживаются только на аутопсии (по результатам патологоанатомических исследований). От острого миокардита умирает от 1 до 7% больных, у людей молодого возраста в 17-21% случаев он становится причиной внезапной смерти.
Миокардит приводит к развитию сердечной недостаточности и нарушению ритма сердца, что является ведущими причинами летального исхода. Миокардиты встречаются чаще у молодых людей (средний возраст пациентов 30 – 40 лет), хотя заболевание может возникнуть в любом возрасте. Мужчины заболевают миокардитом несколько реже женщин, но у них чаще развиваются тяжелые формы заболевания.

Причины миокардита
Миокардиты включают большую группу заболеваний сердечной мышцы воспалительного генеза, проявляющихся поражением и нарушением функции миокарда. Частой причиной миокардита являются различные инфекционные заболевания:
- вирусные (вирусы Коксаки, гриппа, аденовирусы, герпеса, гепатита В и С);
- бактериальные (коринеобактерии дифтерии, стафилококки, стрептококки, сальмонеллы, хламидии, риккетсии);
- грибковые (аспергиллы, кандиды),;
- паразитарные (трихинеллы, эхинококки) и др.
Тяжелая форма миокардита может возникать при дифтерии, скарлатине, сепсисе. Высокой кардиотропностью обладают вирусы, вызывающие миокардит в 50% случаев. Иногда миокардит развивается при системных заболеваниях соединительной ткани: системной красной волчанке, ревматизме, васкулитах, ревматоидном артрите, при аллергических заболеваниях. Также причиной миокардита может служить токсическое воздействие некоторых лекарственных препаратов, алкоголя, ионизирующее излучение. Тяжелое прогрессирующее течение отличает идиопатический миокардит невыясненной этиологии.
Провоцирующими моментами возникновения миокардита являются острые инфекции (чаще вирусные), очаги хронической инфекции; аллергозы, нарушенные иммунологические реакции; токсическое воздействие на организм (лекарств, алкоголя, наркотиков, ионизирующего излучения, при тиреотоксикозе, уремии и др.).
Патогенез
Миокардит в большинстве случаев сопровождается эндокардитом и перикардитом, реже воспалительный процесс затрагивает только миокард. Повреждение миокарда может возникать при прямом миокардиоцитолитическом действии инфекционного агента; под влиянием токсинов, циркулирующих в крови (в случае системной инфекции); и как результат аллергической или аутоиммунной реакции. Нередко встречаются инфекционно-аллергические миокардиты.
Иммунные нарушения, наблюдаемые при миокардите, проявляются расстройством всех звеньев иммунитета (клеточного, гуморального, фагоцитоза). Инфекционный антиген запускает механизм аутоиммунного повреждения кардиомиоцитов, приводящий к значительным изменениям миокарда: дистрофическим изменениям мышечных волокон, развитию экссудативных или пролиферативных реакций в интерстициальной ткани. Следствием воспалительных процессов при миокардите является разрастание соединительной ткани и развитие кардиосклероза. При миокардите заметно снижается насосная функция сердечной мышцы, что часто носит необратимый характер и приводит к тяжелому состоянию недостаточности кровообращения, нарушениям сердечного ритма и проводимости, служит причиной инвалидности и летального исхода в молодом возрасте.
Классификация
В зависимости от механизма возникновения и развития миокардита выделяют следующие формы:
- инфекционные и инфекционно-токсические (при гриппе, вирусах группы Коксаки, дифтерии, скарлатине и др.);
- аллергические (иммунные) (сывороточный, инфекционно-аллергический, трансплантационный, лекарственный, миокардиты при системных заболеваниях);
- токсико-аллергические (при тиреотоксикозе, уремии и алкогольном поражении сердца);
- идиопатические (невыясненной природы).
По распространенности воспалительного поражения миокардиты делятся на диффузные и очаговые. По течению различают острые, подострые, хронические (прогрессирующие, рецидивирующие) миокардиты. По степени тяжести - легкий, миокардит средней тяжести, тяжелый.
По характеру воспаления выделяют экссудативно-пролиферативный (воспалительно-инфильтративный, васкулярный, дистрофический, смешанный) и альтернативный (дистрофически-некробиотический) миокардиты. В развитии инфекционного миокардита (как наиболее часто встречающегося) выделяют 4 патогенетические стадии:
- Инфекционно-токсическая
- Иммунологическая
- Дистрофическая
- Миокардиосклеротическая
По клиническим вариантам (по преобладающим клиническим симптомам) различают миокардиты:
- малосимптомный
- болевой или псевдокоронарный
- декомпенсационный (с нарушением кровообращения)
- аритмический
- тромбоэмболический
- псевдоклапанный
- смешанный
Симптомы миокардита
Клиническая симптоматика миокардита зависит от степени поражения миокарда, локализации, остроты и прогрессирования воспалительного процесса в сердечной мышце. Она включает проявления недостаточности сократительной функции миокарда и нарушения ритма сердца. Инфекционно-аллергический миокардит в отличие от ревматического начинается обычно на фоне инфекции или сразу после нее. Начало заболевания может протекать малосимптомно или латентно.
Основные жалобы пациентов - на сильную слабость и утомляемость, одышку при физической нагрузке, боли в области сердца (ноющие или приступообразные), нарушения ритма (сердцебиение, перебои), повышенную потливость, иногда боль в суставах. Температура тела обычно субфебрильная или нормальная. Характерными проявлениями миокардита являются увеличение размеров сердца, понижение артериального давления, недостаточность кровообращения.
Кожные покровы у больных миокардитом бледные, иногда с синюшным оттенком. Пульс учащенный (иногда уреженный), может быть аритмичным. При выраженной сердечной недостаточности наблюдается набухание шейных вен. Возникает нарушение внутрисердечной проводимости, которое даже при небольших очагах поражения может стать причиной аритмии и привести к летальному исходу. Нарушение сердечного ритма проявляется суправентрикулярной (наджелудочковой) экстрасистолией, реже приступами мерцательной аритмии, что заметно ухудшает гемодинамику, усиливает симптомы сердечной недостаточности.
В большинстве случаев в клинической картине миокардита преобладают лишь отдельные из перечисленных выше симптомов. Примерно у трети пациентов миокардит может протекать малосимптомно. При миокардитах, возникающих на фоне коллагеновых заболеваний, а также вирусной инфекции часто возникает сопутствующий перикардит. Идиопатический миокардит имеет тяжелое, иногда злокачественное течение, приводящее к кардиомегалии, тяжелым нарушениям ритма и проводимости сердца и сердечной недостаточности.
Осложнения
При длительно текущем миокардите развиваются склеротические поражения сердечной мышцы, возникает миокардитический кардиосклероз. В случае острого миокардита при тяжелых нарушениях работы сердца быстро прогрессирует сердечная недостаточность, аритмия, становящиеся причиной внезапной смерти.
Диагностика
Существенные трудности в диагностике миокардитов вызывает отсутствие специфических диагностических критериев. Мероприятия по выявлению воспалительного процесса в миокарде включают:
- Сбор анамнеза
- Физикальное обследование пациента - симптомы варьируют от умеренной тахикардии до декомпенсированной желудочковой недостаточности: отеки, набухание шейных вен, нарушение ритма сердца, застойный процесс в легких.
- ЭКГ - нарушение сердечного ритма, возбудимости и проводимости. ЭКГ-изменения при миокардите не являются специфичными, так как сходны с изменениями при различных заболеваниях сердца.
- ЭхоКГ - выявляется патология миокарда (расширение полостей сердца, снижение сократительной способности, нарушение диастолической функции) в разной степени в зависимости от тяжести заболевания.
- Общий, биохимический, иммунологический анализы крови не являются столь специфичными при миокардите и показывают увеличение содержания α2 и γ - глобулинов, повышение титра антител к сердечной мышце, положительную РТМЛ (реакцию торможения миграции лимфоцитов), положительную пробу на С-реактивный белок, повышение сиаловых кислот, активности кардиоспецифичных ферментов. Исследование иммунологических показателей должно проводиться в динамике.
- Рентгенография легких помогает обнаружить увеличение размеров сердца (кардиомегалию) и застойные процессы в легких.
- Бакпосев крови для выявления возбудителя, или ПЦР диагностика.
- Эндомиокардиальная биопсия при помощи зондирования полостей сердца, включающая гистологическое исследование биоптатов миокарда, подтверждает диагноз миокардита не более чем в 37% случаев в связи с тем, что может иметь место очаговое поражение миокарда. Результаты повторной биопсии миокарда дают возможность оценить динамику и исход воспалительного процесса.
- Сцинтиграфия (радиоизотопное исследование) миокарда является физиологичным исследованием (прослеживается естественная миграция лейкоцитов в очаг воспаления и нагноения).
- Магнитно-резонансная томография (МРТ сердца) с контрастированием дает визуализацию воспалительного процесса, отека в миокарде. Чувствительность данного метода составляет 70-75%.
Лечение миокардита
Острая стадия миокардита требует госпитализации в отделение кардиологии, ограничения физической активности, строгого постельного режима на 4 - 8 недель до достижения компенсации кровообращения и восстановления нормальных размеров сердца. Диета при миокардите предполагает ограниченное употребление поваренной соли и жидкости, обогащенное белковое и витаминизированное питание для нормализации метаболических процессов в миокарде.
Терапию миокардита проводят одновременно по четырем направлениям, осуществляя этиологическое, патогенетическое, метаболическое симптоматическое лечение. Этиологическое лечение направлено на подавление инфекционного процесса в организме. Терапию бактериальных инфекций проводят антибиотиками после выделения и определения чувствительности патогенного микроорганизма. При миокардитах вирусного генеза показано назначение противовирусных препаратов.
Необходимым условием успешного лечения миокардитов служит выявление и санация инфекционных очагов, поддерживающих патологический процесс: тонзиллита, отита, гайморита, периодонтита, аднексита, простатита и др. После осуществления санации очагов (хирургической или терапевтической), курса противовирусной или антибактериальной терапии необходимо проведение микробиологического контроля излеченности.
В патогенетическую терапию миокардитов включают противовоспалительные, антигистаминные и иммуносупрессивные препараты. Назначение нестероидных противовоспалительных средств осуществляется индивидуально, с подбором дозировок и длительности курса лечения; критерием отмены служит исчезновение лабораторных и клинических признаков воспаления в миокарде. При тяжелом, прогрессирующем течении миокардита назначаются глюкокортикоидные гормоны. Антигистаминные средства способствуют блокированию медиаторов воспаления.
Для улучшения метаболизма сердечной мышцы при миокардитах применяют препараты калия, инозин, витамины, АТФ, кокарбоксилазу. Симптоматическое лечение миокардитов направлено на устранение аритмий, артериальной гипертензии, симптомов сердечной недостаточности, профилактику тромбоэмболий. Длительность лечения миокардита определяется тяжестью заболевания и эффективностью комплексной терапии и составляет в среднем около полугода, а иногда и дольше.
Прогноз
При латентном малосимптомном течение миокардита возможно самопроизвольное клиническое излечение без отдаленных последствий. В более тяжелых случаях прогноз миокардитов определяется распространенностью поражения миокарда, особенностями воспалительного процесса и тяжестью фонового заболевания.
При развитии сердечной недостаточности у 50% пациентов отмечается улучшение по результатам лечения, у четверти наблюдается стабилизация сердечной деятельности, у оставшихся 25% состояние прогрессирующе ухудшается. Прогноз при миокардитах, осложненных сердечной недостаточностью, зависит от выраженности дисфункции левого желудочка.
Неудовлетворительный прогноз отмечается при некоторых формах миокардитов: гигантоклеточном (100%-ая смертность при консервативной терапии), дифтерийном (смертность составляет до 50–60%), миокардите, вызванном болезнью Шагаса (американским трипаносомозом) и др. У этих пациентов решается вопрос о трансплантации сердца, хотя и не исключается риск развития повторного миокардита и отторжения трансплантата.
Профилактика
Для снижения риска заболеваемости миокардитом рекомендуется соблюдать меры предосторожности при контакте с инфекционными больными, санировать очаги инфекции в организме, избегать укусов клещей, осуществлять вакцинацию против кори, краснухи, гриппа, свинки, полиомиелита.
Пациенты, перенесшие миокардит, проходят диспансерное наблюдение у кардиолога 1 раз в 3 месяца с постепенным восстановлением режима и активности.
Читайте также:

