К каким антибиотикам чувствителен стрептококк агалактия
Обновлено: 19.04.2024
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
Журнал: Российский вестник акушера-гинеколога. 2017;17(6): 96‑100
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
Streptococcus agalactiae (Streptococcus group B по R. Lancefield) — грамположительные кокки, образующие короткие цепочки, факультативные анаэробы, способные проявлять гемолитическую активность. Стрептококк группы В (СГВ), являющийся обитателем прямой кишки, периодически распространяется на другие локусы (влагалище, урогенитальный тракт, кожу и пр.). У большинства взрослых людей колонизация протекает бессимптомно, однако СГВ может быть причиной воспалительных заболеваний урогенитальной области, таких как вульвовагинит, уретрит, цистит и др. Наиболее высокий уровень колонизации отмечен у сексуально активных женщин репродуктивного возраста и беременных [1—3]. Известно, что S. agalactiae выделяется из влагалища у 20—40% женщин. У беременных СГВ выделяют в 7—30% наблюдений [4]. Из них 60—75% остаются СГВ-носителями до конца беременности, что достоверно связано с самопроизвольными выкидышами, преждевременными родами, преждевременным излитием околоплодных вод, ранними септицемиями новорожденных. Кроме того, у колонизированных стрептококком группы В беременных чаще развиваются инфекции мочевыводящих путей, возможен хориоамнионит в родах, а также послеродовой эндометрит [5—7]. Контаминация плода в родах стрептококком группы В происходит у каждой второй роженицы, но только у 2—5% инфицированных новорожденных развиваются тяжелые формы СГВ-инфекций с летальностью 20—70%, особенно при преждевременных родах [8]. Тяжелые инфекции ассоциированы с длительными родами и ранним разрывом плодных оболочек. Чаще всего стрептококковый сепсис регистрируют у новорожденных, родившихся у матерей с высокой степенью колонизации влагалища, тем не менее около 30% неонатального сепсиса регистрируют при небольшом количестве S. agalactiae в родовых путях [9]. Заражение плода происходит при заглатывании и аспирации инфицированных околоплодных вод или интраканаликулярно [10—12].
Согласно клиническим рекомендациям, показаниями для обследования женщин на наличие стрептококка группы В являются воспалительные заболевания урогенитального тракта, бессимптомная бактериурия беременной, преждевременные роды, СГВ-инфекция новорожденного в анамнезе, повышение температуры тела в родах, длительный безводный промежуток [13].
Выделение S. agalactiae из мочи и/или вагинально-ректального содержимого считается основанием для назначения этиотропной терапии при наличии клинических проявлений. Показаниями для антибиотикопрофилактики в родах являются положительный скрининг на СГВ в поздние сроки беременности (35—37 нед) и наличие акушерских факторов риска [14].
Поиск новых лекарственных препаратов, действующих на СГВ, является весьма актуальным. Кроме того, крайне важна возможность использования этих препаратов в ранние сроки беременности.
Материал и методы
Депантол — это вагинальные суппозитории, содержащие 100 мг декспантенола и 16 мг хлоргексидина биглюконата в виде 20% раствора. В качестве вспомогательных веществ используется смесь макроголов (макрогол 400, макрогол 1500).
В исследовании использовали основы препаратов (декспантенол, хлоргексидин и макрогол), входящих в состав депантола.
Декспантенол (ДП-гель, ДП 1:10) — прозрачная вязкая гелевая субстанция, хорошо растворимая в дистиллированной воде. Чувствительность микроорганизмов определяли как к цельному препарату, так и в разведении 1:10. Декспантенол относится к фармакологическим группам витаминов и витаминоподобных веществ, регенерантов и репарантов, а также к дерматотропным средствам. Он восполняет дефицит пантотеновой кислоты, обладает противовоспалительным действием, стимулирует процессы регенерации.
Хлоргексидин (ХГ) — прозрачная жидкость. Чувствительность микроорганизмов определяли к 20% раствору вещества, входящему в состав препарата Депантол. Хлоргексидин является антисептическим препаратом, активным в отношении широкого спектра микроорганизмов, включая грамположительные и грамотрицательные бактерии, простейшие и вирусы.
Макрогол 400 (М) — прозрачная жидкость.
Готовили микробную взвесь чистой культуры S. agalactiae, доводили до 0,5 по МакФарланду, наносили на Blood Muller-Hinton Agar и равномерно с помощью шпателя распределяли по поверхности среды. После этого 50 мкл тестируемого раствора вносили в пробитые в агаре отверстия диаметром 5 мм. Гель наносили стерильной калиброванной петлей непосредственно на поверхность агара. Инкубировали 24 ч при 37 °C в атмосфере 5% CO2.
Учет результатов чувствительности микроорганизмов к препарату проводили визуально, замеряя диаметр зоны задержки роста в миллиметрах.
Результаты
Все 25 штаммов S. agalactiae (100%) оказались чувствительными к хлоргексидину (ХГ). Зоны задержки роста вокруг отверстий с внесенным препаратом составили от 16 до 26 мм (рис. 1, 2, Рис. 1. Доля штаммов S. agalactiae, чувствительных к действующим веществам, входящим в состав депантола. Рис. 2. Рост S. agalactiae (штамм № 2) на чашке Петри с BloodMuller-HintonAgar. Зона задержки роста вокруг ДП 1:10 составляет 23 мм, вокруг ХГ — 26 мм. Рост крупных колоний стрептококка на поверхности агара в месте нанесения ДП-геля. Отсутствие зоны задержки роста вокруг М. Примечание. МК — молочная кислота, К — клотримазол. 3). Данные результаты подтверждают, что в настоящее время хлоргексидин остается одним из наиболее активных катионных антисептиков, принцип бактерицидного действия которого, как известно, заключается в последовательно протекающих процессах диссоциации солей хлоргексидина, связывании катионов с отрицательно заряженной мембраной и нарушении осмотического равновесия бактериальной клетки (потеря калия, фосфора) [15].
Интересные результаты получены и при определении чувствительности клинических изолятов S. agalactiae к декспантенолу. Чувствительными к декспантенолу в разведении 1:10 (ДП 1:10) оказались 17 (68%) штаммов стрептококков. Зоны задержки роста составили от 18 до 28 мм (см. рис. 1). Резистентными были квалифицированы штаммы, не имеющие зоны задержки роста вокруг отверстия с внесенным препаратом.

На поверхности агара, обработанной неразведенным декспантенолом (ДП-гель), в 80% случаев наблюдался следующий эффект: имело место видимое увеличение размеров колоний S. agalactiae при одновременном снижении их количества. Наблюдался рост не в форме газона, а в виде отдельных, более крупных колоний (см. рис. 2). Один штамм (4%) имел зону задержки роста вокруг нанесенного неразведенного геля (см. рис. 3). Рис. 3. Рост S. agalactiae (штамм № 15) на чашке Петри с BloodMuller-HintonAgar. Зона задержки вокруг ДП 1:10 составляет 22 мм, вокруг ХГ — 23 мм. Рост крупных колоний стрептококка на поверхности агара в месте нанесения ДП-геля и небольшая зона задержки роста (3 мм). Отсутствие зоны задержки роста вокруг М. Примечание. МК — молочная кислота, К — клотримазол.
Все штаммы стрептококков оказались резистентны к макроголу 400, используемому в качестве вспомогательного вещества суппозитория.
СГВ проявляет стабильную чувствительность к пенициллину и другим β-лактамным антибиотикам. В последние годы значительно возросла резистентность S. agalactiae к линкозамидам, макролидам, тетрациклинам, хлорамфениколу. В некоторых странах частота выделения устойчивых к клиндамицину штаммов достигла 13—20%, а к эритромицину — 25—32%. В ряде случаев встречается сочетание устойчивости к нескольким группам антибиотиков одновременно. В последнее время в Японии и США выделили штаммы S. agalactiae с высоким уровнем устойчивости к широкому спектру фторхинолонов [16, 17]. Проблема селекции микроорганизмов, устойчивых к антимикробным препаратам, в том числе стрептококков группы В, является поводом к поиску новых средств для этиотропной терапии и профилактики передачи СГВ от матери плоду.
F. Facchinetti и соавт. [18] в рандомизированном контролируемом исследовании показали высокую эффективность интравагинального применения 140 мл 0,2% раствора хлоргексидина каждые 6 ч в сравнении с внутривенным введением ампициллина в дозе 2 г каждые 6 ч для предупреждения вертикальной передачи стрептококка группы В. Полученные результаты свидетельствуют о том, что в группе хлоргексидина (109 беременных) число колонизации новорожденных стрептококком группы В составило 15,6%, что было сопоставимо с показателями группы ампициллина (108 беременных) — 12%, причем в группе хлоргексидина показатели колонизации новорожденных E. coli были статистически достоверно лучшими (лишь 1,8%; p<0,05) по сравнению с группой ампициллина (7,4%).
В 2006—2008 гг. нами была проведена оценка эффективности суппозиториев и вагинальных таблеток Гексикон, содержащих в своем составе хлоргексидина биглюконат, в лечении бактериального вагиноза. Была установлена клиническая и микробиологическая эффективность применения разных схем терапии препаратом Гексикон по окончании лечения, которая составила 66,7% для схемы в 1 суппозиторий в течение 7 дней и 96,7% для схемы в 2 суппозитория в течение 7 дней. Что касается вагинальных таблеток Гексикон, нами проведена III фаза сравнительного открытого рандомизированного исследования эффективности и безопасности препарата Гексикон (таблетки вагинальные) в сравнении с препаратом Трихопол (таблетки вагинальные) у пациенток с бактериальным вагинозом. Было показано, что вагинальные таблетки Гексикон, применяемые по 1 и 2 таблетки в течение 7 дней, сопоставимы по эффективности с вагинальными таблетками Трихопол, используемыми для лечения бактериального вагиноза. Эффективность терапии бактериального вагиноза препаратом Гексикон составила 93,3 и 100% соответственно при использовании их 1 и 2 раза в сутки.
Настоящее исследование подтвердило высокую эффективность ХГ и в отношении S. agalactiae.
Декспантенол входит в состав широкой линейки коммерческих препаратов и известен как стимулятор регенерации тканей с противовоспалительным и дерматопротективным действием. Прямой антимикробный эффект декспантенола мало изучен. В нашем опыте более 2/3 штаммов стрептококков группы В оказались чувствительными к декспантенолу в разведении 1:10, что доказывает перспективность применения декспантенола, особенно в сочетании с антисептическим средством, для комплексной терапии и химиопрофилактики инфекций, вызываемых стрептококками группы В.
Выводы
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Микробиологические аспекты
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста. Так что без клинической картины острого фарингита не надо хвататься за антибиотики, как собственно и что-то сеять вне обострений.
100% штаммов чувствительны к пенициллинам, при этом Резистентность к макролидам в Европе – от 2 до 32%, в США – 7%. У нас в связи с великой любовью к этой группе, особенно среди педиатров, скорее всего, как в Европе. То есть о макролидах в этой ситуации надо забыть, к тому же тем же азитромицином не получится создать необходимую экспозицию в связи с ограничениями по срокам применения.
Клинические аспекты
При всем вышеперечисленном БГСА – зверь страшный, и основная проблема в том, что страх к нему мы почти потеряли. Лирическое отступление on. Именно этот зверь был постоянной причиной хирургических инфекций и родильной горячки (послеродового сепсиса) в доантибиотиковую эру. А женщины, как вы помните, умирали от нее, как мухи, пока Земмельвейс не заставил врачей мыть руки (за что закончил в психушке), но они их хотя бы на руках таскать перестали. Но даже сейчас, не дай бог, хирургу со стрептококковой ангиной подойти к операционному столу, и к концу первых суток стрептококк организует очень больную и страшно воняющую проблему в конкретной послеоперационной ране. Лирическое отступление off.
Потому напомним, что S.pyogenes может вызывать следующие заболевания:
- Фарингиты
- Поражения кожи и мягких тканей – целлюлиты, эризипелоид, лимфангит, рожа
- Некротические миозиты и фасцииты
- Послеродовый сепсис
- Пневмонии
- Сепсис
- Бактериальные эндокардиты (раньше редко, все же ангины и скарлатины старая школа требовала лечить строго 14 дней и ампициллином в задницу: сейчас стали встречаться почаще – привет коротким курсам антибиотиков при лечении ангин)
- Действие токсинов запускают синдром токсического шока и скарлатину
- Аутоиммунное воздействие приводит к ревматическим лихорадкам, с последующими возможным формированием пороков сердца и острому гломерулонефриту
- Послеоперационные раневые инфекции первых суток
Практические вопросы диагностики:
Микробиологическая диагностика S.pyogenes не представляет никакого труда, здесь в прямом смысле достаточно покрасить мазок по Граму. Все упирается в организационные аспекты – пока мазок доберется до лаборатории, пока покрасят. Пока ответят, пациент успеет много раз осложнится, если это стрептококк, или выздороветь, если это был фарингит и вызвавший его вирус (все-таки до 60% фарингитов вызваны вирусами, а не бактериальной флорой). Не хотелось бы останавливаться подробно на каждом перечисленном заболевании, но не упомянуть о диагностике острого фарингита, которая чаще всего и запускает множество вторичных осложнений, мы не можем. Для облегчения диагностики острого существуют несколько диагностических шкал. Автору более всего симпатична шкала Мак-Айзека в виду максимальной простоты ее использования.
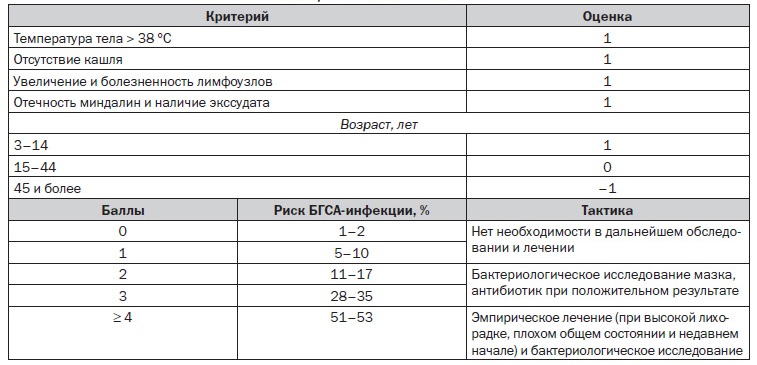
Но самым быстрым тестом для точной диагностики на месте является стрептатест, который в течение пяти минут дает ответ о вероятности наличия БГСА у больного с острым фарингитом.
Аспекты медикаментозного лечения
- Итак, мы определили, что имеем дело с БГСА, и тогда препаратами выбора в амбулаторной практике будут являться аминопенициллины, так как их много, они доступны, и главное, к ним 100% чувствительность у возбудителя.
Если ангина произошла впервые в жизни – лечим 10 дней. Если имеем дело с постоянными рецидивами – 14 дней, так как зверь может уйти во внутриклеточное состояние, оттуда руля процессом, и, чтобы до него добраться, доза должна быть выше средней, а курс лечения соответствующим.
Когда БГСА может уйти внутрь клетки? На тех самых пресловутых 5-7 днях, когда налеты с миндалин только сошли, температура только-только нормализовалась, а антибиотик взяли и отменили. И хорошо, если после подобного произойдет только рецидивирование фарингита, а не начнутся такие осложнения, как ревматизм, гломерулонефриты и далее по списку.
- Если пациент оказался в стационаре и ему обеспечен венозный доступ, то могут использоваться и пенициллины, и ампициллин в разных его вариациях. Главное – правильная доза, правильная кратность и ПРАВИЛЬНАЯ ДЛИТЕЛЬНОСТЬ КУРСА. Идеальный вариант из серии "дешево и сердито". Но обязательно должна быть доказанная микробиология.
При непереносимости пенициллинов помним о клиндамицине как об их адекватной замене.
- Пиогенный стрептококк, как мы выше упомянули, является причиной ранней послеоперационной раневой инфекции. Напомним, что стандартная послеоперационная раневая инфекция развивается к седьмым суткам. А если это произошло в первые сутки, да к тому же страшно завоняло (пиогенный стрептококк недаром называют мясоедным), немедленно делаем мазок, бежим с ним в лабораторию (можно даже своими ногами – это же ваш пациент осложнился, там так же бегом делают мазок по Граму, обнаруживают цепочки, и после этого начинаем лить аминопенициллин в вену, если не использовали его для периоперационной антибиотикопрофилактики (если использовали, то просто продолжаете дальше). Если совсем все бедно, можно пенициллин – 12 млн в сутки. Но если вы провели правильную периоперационную антибиотикопрофилактику, учли все риски и не забыли про свой личный стрептококк в горле, то риск ранней раневой минимален, а если профилактика продленная на 72 часа, то она и раскрутиться не успеет.
- При инфекциях кожи и мягких тканей, а также стрептококковом сепсисе препаратами выбора будут клиндамицин (который блокирует выработку токсических продуктов) в сочетании с пенициллином (24 млн ЕД в сутки) – это наиболее предпочтительная и малозатратная комбинация
Альтернативой в режиме монотерапии могут служить:
-
600 мг в/в каждые 6 часов 2,0 каждые шесть часов 2-3 г в/в каждые 6 часов или цефтриаксон по 2 г в сутки внутривенно в расчете 15 мг/кг в/в каждые 12 часов
Почему максимально важно соблюдать как дозировку, так и кратность введения читаем тут – /vracham/antibiotikoterapiya/polozheniya (часть 1 и часть 2).
В заключение хочется снова воскликнуть – пожалуйста, помните о пиогенном стрептококке и о правильной длительности его лечения.
Тема эта очень узконаправленная, и вопрос в том, насколько она может быть интересна широкому кругу читателей. Однако ради одних только отдаленных последствий заболеваний, вызванных S. agalactiae, ее стоит рассмотреть.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Для начала капелька истории.
Микробиологические аспекты
Согласно современной классификации S. agalactiae относится к стрептококкам группы В и является единственным представителем в указанной группе. Общим с остальными стрептококками является то, что и этот зверь плохо растет в лабораторных условиях на обычных питательных средах, и ему тоже необходимы специальные среды с 5% бараньей кровью (вопрос капризности стрептококков мы обсуждали в первой статье этого года).
Несмотря на капризы вне естественной среды обитания (коей является кишечник), внутри организма человека S. agalactiae проявляет одно из своих главных свойств – устойчивость к фагоцитозу нейтрофилами и моноцитами, что позволяет ему спокойно выживать и колонизировать доступные слизистые оболочки.
Клинические аспекты
S. agalactiae способен вызывать следующие состояния:
- неонатальный сепсис
- менингиты у новорожденных
- хориоамниониты
- аборты в поздние сроки беременности
- спонтанные аборты
- инфекции мочевыводящих путей
- эндокардиты
- сепсис (у матерей)
- инфекции кожи и мягких тканей, как осложнение после кесарева сечения
- маститы и эндометриты у родильниц
- септический артрит
Наиболее чувствительны к S. agalactiae:
- беременные женщины
- новорожденные
- больные с сахарным диабетом
- дети с низкой массой тела и дистрофией
- пожилые пациенты
- иммунокопрометированные пациенты (вне зависимости от причины этих состояний)
Давайте рассмотрим наиболее уязвимые (и актуальные) категории, а именно беременных женщин и новорожденных.
Как мы знаем, основным местом жительства S. agalactiae в организме человека является ЖКТ, еще точнее – кишечник. Считается, что именно оттуда и происходит колонизация влагалища. Правда, тут же у автора возникает логичный вопрос – как? Стрептококки ног не отрастили, данный представитель также не является исключением. Проблемы с гигиеной? В таких масштабах и в странах с нормальным доступом к воде? Ответ нашелся достаточно быстро – колонизации S. agalactiae наиболее подвержены женщины, ведущее бурную сексуальную жизнь в течение года до развития заболевания/беременности, причем ведущие ее с многочисленными непостоянными партнерами. А судя по наличию кишечной флоры в непредназначенной для ее жизни локации, практики этой самой жизни тоже весьма разнообразны. Поэтому при сборе анамнеза, если, конечно, удастся, стоит выяснять регулярность анальных практик (автор с уверенностью может утверждать, что это сложно), и если удалось выяснить этот аспект, в голове должен прозвучать звоночек о том, что пациентка оказывается в группе риска, особенно если она уже беременна. Хотя следует отметь, что роль именно полового пути до сих пор вызывает определенные споры (даже несмотря на многочисленные исследования связи с ЗППП и с носительством S. agalactiae в уретре мужчин). Но автор согласен оставить этот вопрос дискутабельным.
Когда лучше всего определять факт носительства S. agalactiae для принятия адекватных мер по профилактике вышеперечисленных состояний? На 35-37 неделе беременности. Но следует учитывать, что носительство может быть непостоянным (транзиторным или перемежающимся), что затрудняет его обнаружение в скрининговых исследованиях, то есть если при исследованиях его нет, это не значит, что его там действительно нет, особенно если дама вела активную добеременную жизнь.
Какие факторы могут влиять на наличие носительства S. agalactiae?
- Женщины старшего возраста с репродуктивными проблемами ранее
- Расовые различия – у белых женщин частота колонизации в разы меньше (автор уже не может угадать, откуда его читают, поэтому решил указать и этот фактор)
- Количество предыдущих беременностей
Можно ли проводить скрининг до беременности? Можно, но смысла в нем не будет, ибо даже фаза менструального цикла влияет на выявляемость S. agalactiae.
Какие именно осложнения вызывает носительство S. agalactiae у беременных:
- преждевременные роды
- длительный безводный период
- малый вес новорожденных
- мертворождение
А к числу факторов риска развития этих состояний относят:
- кесарево сечение
- сахарный диабет
- общее снижение иммунитета
- массивную колонизацию S. agalactiae
Учитывая вышеперечисленное, массивная колонизация родовых путей матери создает серьезные угрозы инфекции у новорожденных – почти половина новорожденных от таких матерей будет иметь массированную колонизацию кожи и слизистых оболочек S. agalactiae. Заболеет ли каждый из них? Конечно, нет. Статистика говорит, что из таких детей-носителей заболеет не более 2%, которые будут иметь следующий набор факторов риска:
- Факторы, которые непосредственно связаны с матерью:
- Самый главный – наличие S. agalactiae на слизистой шейки матки у беременных
- Инфекции, связанные с S. agalactiae у ранее рожденных детей
- Длительный безводный период
- Преждевременные роды
- Подъем температуры во время родов
- Бактериурия
- Хориоамнионит
- Факторы, связанные непосредственно с новорожденным:
- Недоношенность и малый вес при рождении
- Кесарево сечение
- Длительное инструментальное обследование внутриутробно
У детей S. agalactiae может стать причиной:
- Менингитов
- Пневмоний
- Остеомиелитов
- Сепсиса
- Заболеваний глаз
- Артритов
- Ангин
- Нейтропений
У новорожденных заболевания могут развиваться в разные сроки. Чаще всего инфекции развиваются в течение первых 12 часов (сепсис, менингит, пневмония и нейтропения). Заражение происходит во время родов или внутриутробно перед родами через разорванный плодный пузырь. Летальность при раннем развитии колоссальная – более 50% и развивается в первые сутки. Как вы помните, в таких сроках антибиотики фактически бессильны (вспоминаем правило 48 часов для бактерицидных препаратов). У половины выживших детей затем могут развиваться осложнения со стороны ЦНС (например, ДЦП).
Значительно реже инфекция раскручивается в поздние сроки (от недели до трех месяцев), и чаще всего это будет менингит. Течет более благоприятно, летальность значительно ниже, но она есть. Также могут встречаться инфекции кожи и мягких тканей, септические артриты. После выздоровления в дальнейшем половина детей наблюдаются у неврологов в связи с серьезными неврологическими осложнениями.
Отдельного упоминания требует внутрибольничное распространение S. agalactiae в случае, когда мать не является его носителем и речь идет об инфекциях, связанных с медицинскими вмешательствами. Со всеми вытекающими, которые мы обсуждали в соответствующей статье.
Что со всем этим делать?
- Скрининг – мазок из влагалища и прямой кишки. То есть активное выявление беременных женщин – носителей S. agalactiae для последующей профилактики в родах, если наличие микроорганизма подтвердится. Руководства и рекомендации говорят о проведении скрининга в сроках 35-37 недель. Положительным считается наличие S. agalactiae в любом локусе.
- Далее должна быть проведена оценка факторов риска – если они есть, то рекомендуется назначение препаратов пенициллинового ряда во время родов (по аналогии с периоперационной антибиотикопрофилактикой, с одной существенной разницей – там препараты назначаются за 30-40 минут до оперативного вмешательства, а здесь непосредственно во время родов, и в идеале внутривенно капельно для создания максимальной времязависимой концентрации в тканях и крови, которые сдержат размножение патогенна).
- Если скрининг не проводился и женщина поступила в роддом как есть, то в случае длительного безводного периода и/или подъема температуры в родах выше 38°С также назначается пенициллин в родах.
- Если на скрининге S. agalactiae не выявлен, а также нет факторов риска (лихорадка и безводный период в родах), то профилактика не проводится.
Если имеется аллергия на пенициллиновый ряд, используем клиндамицин, так как эритромицин нам не помощник в виду высочайшего уровня резистентности у почти всех стерептококков.
К сожалению, профилактика не всесильна. Конечно, она предупреждает раннее развитие инфекции, но ничего не может сделать с мертворождением, преждевременными родами или инфекциями, развивающимися в более поздние сроки. Так что вопрос инфекций, связанных с S. agalactiae, будет еще достаточно длительное время очень актуальным, и в нем, к сожалению, нет простых решений.
Streptococcus agalactiae (стрептококк агалактия) — вид грамположительных факультативно анаэробных β-гемолитических бактерий. По классификации R. Lancefield является стрептококком серогруппы B, распространённая аббревиатура GBS и др. Клетки Streptococcus agalactiae, как и другиих стрептококков, имеют сферическую форму. Чаще всего встречаются парами. Не образует спор. Все штаммы Streptococcus agalactiae обладают группоспецифическим полисахаридом, который состоит из глюкозы, галактозы, N–ацетилглюкозамина и рамнозы.
Инфекции Streptococcus agalactiae наиболее опасны для новорожденных. Однако в последние годы отмечается относительный рост числа заболеваний, вызываемых Streptococcus agalactiae у пожилых лиц, у которых они чаще всего вызывают инфекцию кожи и костей, сепсис без явного источника его происхождения, уросепсис, пневмонию и перитониты.
Инфекция Streptococcus agalactiae новорожденных
Streptococcus agalactiae — стрептококк, встречающийся у некоторых лиц в составе нормальной микрофлоры кишечника, у 20-30 % здоровых женщин — в урогенитальном тракте. Передача инфекции от инфицированной матери происходит, как правило, незадолго до родов или непосредственно во время родов. В первые часы и сутки после рождения ребенок также может инфицироваться, однако это случается значительно реже по сравнению с пре– и интранатальным заражением. Streptococcus agalactiae новорожденных не всегда приводит к развитию инфекционного процесса у новорожденных. Факторами риска заболевания ребенка, рожденного инфицированной Streptococcus agalactiae женщиной, являются: возраст беременной (12 часов), задержка внутриутробного развития и наличие инфекции Streptococcus agalactiae у ранее рожденных детей.
Стандартную антибиотикопрофилактику проводят бензилпенициллином (в дозе 5 млн ЕД в/в с момента начала родовой деятельности, переходя в дальнейшем на дозу 2,5 млн ЕД каждые 4 часа до окончания родов) или ампициллином (в/в, первоначально в дозе 2 г на введение, а затем – по 1 г каждые 4 часа). При аллергии к пенициллинам их заменяют клиндамицином или эритромицином, но чаще в этих случаях рекомендуют цефазолин (в/в, начиная с 2 г на введение, затем по 1 г каждые 8 часов до окончания родов). При высоком риске развития анафилаксии на бета-лактамные антибиотики может быть использован ванкомицин в/в по 1 г каждые 12 часов до окончания родов.**
Инфекция Streptococcus agalactiae у младенцев
Инфекции Streptococcus agalactiae у младенцев в возрасте от недели до трёх месяцев называются поздними. Заражение происходит или в процессе родов, или позже при контакте с матери, другими родственниками, работниками медицинских учреждений. Наиболее часто проявляется в виде менингита. Летальность — до 50 %. У выздоровших остаются неврологические дефекты, такие как задержка речевого развития, тугоухости умственная отсталость, слепота, эпилептические припадки.
Streptococcus agalactiae в систематике бактерий
По современным представлениям вид Streptococcus agalactiae относится к серогруппе B рода стрептококков, род стрептококки (Streptococcus) входит в семейство Streptococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
Антибиотики, активные в отношении Streptococcus agalactiae
При подозрении на инфекцию Streptococcus agalactiae препаратом выбора является ампициллин. Предпочтителен внутривенное введение. При менингите дозы ампицилина увеличивают. При неинвазивных формах инфекции Streptococcus agalactiae продолжительность монотерапии составляет 10 суток, при вызванных Streptococcus agalactiae неосложненных менингитах — две недели, артритах и остеомиелитах — 3–4 недели, эндокардите и вентрикулите — не менее 4 недель.
Из представленных в данном справочнике антибактериальных средств в отношении Streptococcus agalactiae активны: ципрофлоксацин, норфлоксацин, левофлоксацин, моксифлоксацин, ванкомицин, клиндамицин, азитромицин.
Обнаружение Streptococcus agalactiae у взрослых пациентов, не относящихся к группам риска (беременных женщин и др.) в относительно небольшом количестве (10*3. 10*4 КОЕ на мл) не требует специального лечения, в особенности антибиотикотерапии, если иного не назначит лечащий врач, консультация с которым в данном случае необходима.
Читайте также:

