К стоматологу после отравления
Обновлено: 19.04.2024
Отравление мышьяком и его побочные эффекты
Данные о неорганических и органических соединениях мышьяка представлены в таблице ниже.
Эпидемиологические исследования по изучению роли мышьяка, содержащегося в питьевой воде, позволяют сделать вывод, что мышьяк может вызывать рак кожи, печени, легких, почек и мочевого пузыря. В таблице ниже представлена оценка риска смерти от рака после экспозиции к мышьяку в сопоставлении с экспозицией к содержащемуся в окружающей среде табачному дыму и радоновым излучениям внутри помещений. Клинические признаки острых и хронических отравлений мышьяком в обобщенном виде представлены в отдельной таблице.
а) Токсичная доза мышьяка. Пятивалентный мышьяк As5+ (арсенат, или органическая форма) менее токсичен, чем трехвалентная форма As3+ (арсенит, или неорганическая форма), что обусловлено более низкой растворимостью первого. В целом нерастворимые соли мышьяка (триоксид мышьяка, арсенат свинца) и органические алканарсенаты обладают значительно более слабыми токсическими свойствами, чем растворимые неорганические соединения мышьяка (арсенит натрия, мышьяковая и мышьяковистая кислоты). Наиболее токсичная форма — арсин (AsH3). Существует широкий диапазон токсичности в зависимости от конкретного соединения и формы.
Концентрации менее 1 мг/кг могут обусловить серьезные заболевания у детей; 2 мг/кг могут вызвать смерть. Летальный диапазон — от 120 до 200 мг, хотя у взрослых отмечается выживаемость и при более высоких дозах. Проглатывание 9— 14 мг триоксида мышьяка 16-месячным ребенком вызвало тяжелые признаки отравления, потребовавшие хелатирующей терапии.
Как показали наблюдения Kingstrom и соавт., однократное проглатывание низкой дозы (менее 5 мл) пятивалентного арсената (менее 3 %) — содержащего арсенат натрия средства против муравьев — незначительно токсично, что можно лечить в домашних условиях. Необходимость хелатообразования после экспозиции к пятивалентным соединениям мышьяка должна быть подтверждена дополнительными исследованиями.
Даже в случаях обычной экспозиции (по данным подробного анамнеза) у пациентов, подвергшихся экспозиции к арсенату натрия, содержащемуся в средстве против муравьев, отмечается значительное повышение концентраций мышьяка в 24-часовых пробах мочи (диапазон — от 3500 до 5300 мкг/л, в норме
Газ арсин, который может вытечь из цилиндров и полупроводников на производстве, представляет собой бесцветный, нераздражающий газ, который обладает слабыми обонятельно-предупредительными свойствами, и может выделяться из соединений мышьяка при добавлении кислоты. ВПП-СВВК — 0,05 млн-1. Мгновенная смерть наступает при 150 млн-1. Смерть с обширным гемолизом наступает через 30 мин после экспозиции к 25—50 млн-1 и менее чем через 30 мин после экспозиции к 100 млн-1.
Полупериод существования неорганического мышьяка в крови составляет примерно 2 ч; период полувыведения метилированных метаболитов варьирует от 5 до 20 ч.
- Всасывание. Пятивалентный мышьяк хорошо всасывается в кишечнике, но трехвалентная форма более липидорастворима. Токсичность обусловлена арсенитной формой (As3+), особенно при чрескожной абсорбции. Вдыхание обусловливает хронические симптомы, особенно для газа арсина, вызывающего появление тяжелых симптомов при вдыхании. Соединения мышьяка хорошо всасываются парентерально в течение 24 ч.
- Распределение. Мышьяк первоначально локализуется в крови, связываясь с глобулином. В течение 24 ч происходит перераспределение мышьяка в печень, легкие, стенки кишечника и селезенку, где мышьяк связывается с сульфгидрильными группами тканевых белков. Лишь небольшое количество мышьяка проникает через гематоэнцефалический барьер. Мышьяк замещает фосфор в костях, где он может оставаться годами.
На протяжении 30 ч после проглатывания мышьяк откладывается в волосах. Концентрации мышьяка в срезах волос могут служить показателем времени экспозиции, определяемого по длине от точки роста. Волосы человека, умершего через 6—8 ч после проглатывания сверхвысокой дозы, обычно не содержат мышьяк.
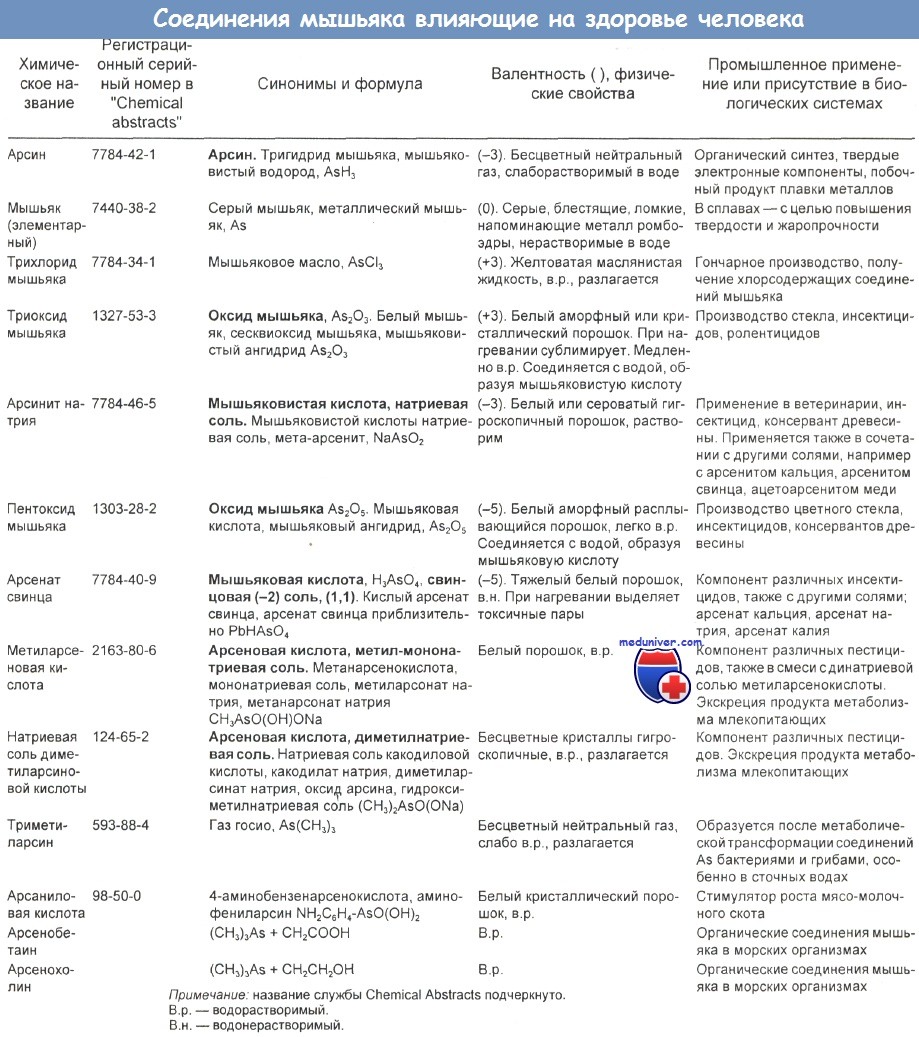
б) Источники органических соединений мышьяка. Два наиболее распространенных органических нетоксичных соединения мышьяка, обнаруживаемых в пище, регулярно потребляемой людьми, — это арсенобетаин и арсенохолин. Значительные концентрации органической кислоты обнаруживают в моллюсках, треске и пикше. После проглатывания арсенобетаин и арсенохолин быстро выводятся в мочу и полностью выводятся в течение 1—2 дней. Остаточные токсичные метаболиты не выявляются. Период полувыведения органического мышьяка составляет от 4 до 6 ч.
- Желудочно-кишечный тракт. Расширение висцеральных сосудов вызывает образование субмукозных везикул. Их разрыв приводит к выделению испражнений в виде рисового отвара и к кровотечению. Впоследствии может развиться энтеропатия с потерей белка.
Несмотря на применение интенсивного лечения при мышьяковой интоксикации и быстрое снижение концентраций мышьяка в крови и моче, неврологические нарушения могут сохраняться. По-видимому, распространение мышьяка в нервных тканях происходит быстро и может оказаться необратимым даже при хелатиро-вании.
- Мышцы. Сообщалось о случаях, когда после сильной передозировки мышьяка острый некроз скелетных мышц приводил к смерти.
- Воздействие на метаболизм и функцию печени. Отмечались отрицательный азотный баланс, жировая дегенерация печени, центральный некроз и цирроз, антагонизм тироидного гормона.
- Дериваты кожи. Наблюдаются алопеция (на поздней стадии), ломкость ногтей, линии Миса (горизонтальные белые линии, которые появляются после экспозиции вследствие роста ногтевого ложа в направлении кнаружи).
в) Беременность и отравление мышьяком. Неорганический мышьяк проникает через плаценту. 22-летняя женщина на 20-й неделе беременности проглотила 340 мг арсената мышьяка. Первоначальная концентрация мышьяка в моче через 24 ч составляла 3030 мкг/л. Был введен димеркапрол. Тоны сердца плода были нормальные. Через 36 нед родился здоровый ребенок. При рождении концентрации мышьяка в суточной порции мочи составляли
В другом случае, когда мать проглотила мышьяк на 30-й неделе беременности, младенец умер вскоре после рождения. Димеркапрол, по-видимому, является средством выбора. D-пеницилламин обладает тератогенными свойствами.

г) Клиника отравления мышьяком:
- Острая экспозиция к газу арсину. В классических случаях клинические проявления мышьякового отравления наступают после латентного периода — до 24 ч, после чего начинаются боли в животе, гемолиз и почечная недостаточность. При чрезмерно сильной экспозиции внезапная смерть может наступить в отсутствие отека легких и гемолиза.
- Болезнь черных ног. Болезнь черных ног — это редкое заболевание периферических артерий, наблюдаемое в эндемическом регионе хронического отравления мышьяком — на Юго-Западном побережье Тайваня. Гуминовая кислота, содержащаяся в колодезной воде, возможно, является главной причиной этой болезни. В развитии болезни, по-видимому, играют роль активация тромбоцитов и гиперкоагуляция.
- Арсенат свинца. Проглатывание арсената свинца может вызвать тошноту, рвоту и боли в брюшной полости. Рвотные массы напоминают молоко из-за образования хлорида свинца. Во рту появляется металлический вкус. Могут отмечаться диарея или запор. Испражнения бывают черного цвета, что обусловлено присутствием сульфида свинца. Могут наблюдаться парестезия и мышечная слабость. В тяжелых случаях происходит острый гемолитический кризис, наблюдаются олигурия и шок. Если пациент выживает, у него развивается синдром хронического свинцового отравления. Курс лечения включает лаваж желудка с последующей хелатирующей терапией с применением как димеркапрола, так и кальций-ЭДТА.

д) Лабораторные данные при отравлении мышьяком:
- Аналитические методы. Современным стандартом является анализ мышьяка методом атомно-абсорбционной спектроскопии, который позволяет измерить общую концентрацию мышьяка, но не проводить разграничение между пятивалентными, трехвалентными или органическими формами мышьяка.
- Уровни в крови. Короткий период полувыведения мышьяка из крови означает, что уровни мышьяка в крови менее пригодны для оценки степени отравления, чем концентрации в моче, если только анализ не проводится в день экспозиции. Концентрации мышьяка в сыворотке (крови) определяются только в первые 2—4 ч после проглатывания, после чего мышьяк в любой из форм трудно обнаружить в крови или сыворотке.
- Уровни в моче. Неорганические As+3 и As+5. As+3 более токсичен, чем As+5. As+3 и As+5 обнаруживаются в организме вскоре после проглатывания. Более чем через 24 ч после проглатывания преобладающими метаболитами являются монометилмышьяк и диметилмышь-як. Повышенные концентрации As+3 и As+5 выявляются в моче примерно через 10 ч и снова становятся нормальными через 20 ч. Концентрации монометилмышьяка и диметилмышьяка достигают максимума через 40—60 ч и возвращаются к исходному уровню через 6—20 дней после проглатывания. Полупериод существования неорганического мышьяка в крови составляет 2 ч, а полупериод существования в крови метилированных метаболитов от 5 до 20 ч. Концентрации мышьяка в сыворотке (или в крови) определяются только в первые 2—4 ч после проглатывания.
Органический As. Период полувыведения арсенобетаина и арсенохолина составляет примерно 4 ч, а через 1—2 дня они полностью выводятся.
В моче: в отсутствие экспозиции — менее 25 мкг в сутки. Токсичные концентрации — от 50 до 50 000 мкг в сутки.
После потребления морских продуктов — от 50 до 2000 мкг в сутки.
- Уровни в волосах. Анализ мышьяка, содержащегося в волосах, является недостаточно надежным методом установления хронической интоксикации. Этот метод не позволяет провести разграничение между мышьяком, откладывающимся из внешней среды, и мышьяком, обнаруживаемым в стержне волоса.
- Ногти. Содержание мышьяка в ногтях может служить показателем степени экспозиции рабочего к мышьяку, содержащемуся в воздухе.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
На сегодняшний день одной из наиболее сложных проблем интенсивной терапии является эндогенная интоксикация организма, сопровождающаяся множеством патологических состояний, которые по мере своего развития могут приводить к летальному исходу. Хронические стоматогенные очаги инфекции составляют более 50 % очагов хронической инфекции, что значительно повышает их роль в вопросе об эндогенных интоксикациях организма человека.Под понятием эндогенная интоксикация подразумевают нарушение жизнедеятельности, вызванное токсическими веществами, образовавшимися в организме. В качестве токсических веществ могут выступать активированные ферменты, продукты обмена веществ в высоких концентрациях, продукты перекисного окисления липидов, медиаторы воспаления, компоненты комплемента, бактериальные токсины. Важную роль в этиологии хронических очагов одонтогенной инфекции играет микробный фактор. В очагах одонтогенной инфекции обнаруживаются ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий.В настоящее время изучено множество механизмов развития интоксикации, исходя из которых разрабатываются способы диагностики заболевания, а также консервативные методы лечения, направленные на сохранение зубов. Особое внимание следует уделить профилактике стоматогенных инфекций, чтобы предупредить возникновение эндогенной интоксикации на ранних сроках.

1. Беляов, Н.А. Критерии и диагностика эндогенной интоксикации/ Н.А. Беляков, М.Я. Малахова// Эндогенная интоксикация. – СПб., 1994. – 60 с.
2. Воложин, А.И. Аллергия и другие виды непереносимости в стоматологии. Этиология, патогенез, принципы лечения: Учебное пособие для студентов стоматологического факультета. – М.: Знание, 1990. – 160 с.
3. Иорданишвили, А.К. Заболевания, повреждения и опухоли челюстно-лицевой области. – СПб. СпецЛит, 2007. – 496 с.
4. Максимовский, Ю.М., Максимовская, Л.Н., Орехова, Л.Ю. Терапевтическая стоматология: Учебник. - М.: Медицина, 2002. - 640 с.
5. Малахова, М.Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме/ М.Я. Малахова // Эфферентная тер. – 2000. – Т.6, №4 – 3-14 с.
Еще в XIX в. врач Понтер заметил нездоровый цвет лица некоторых больных, наличие у них невротических расстройств, анемии, нарушений пищеварения. При этом в последствии выявилось, что у всех пациентов в полости рта имелись зубы с некротизированной пульпой. После удаления таких зубов наступило значительное улучшение состояния больного или полное выздоровление. В 1910 г. Гюнтер сформулировал понятие об очаговой инфекции полости рта и ротовом сепсисе, которое быстро распространилось за рубежом и имело много сторонников.
В XX в. в работах американских ученых Биллингса и Розенау была разработана доктрина ротового сепсиса. В своей работе ученые обращали внимание на то, что стрептококки и стафилококки могут изменять свою вирулентность в зависимости от условий внешней среды, а именно от содержания в ней кислорода. Кроме этого, патогенные микроорганизмы через ток крови могут проникать из очага одонтогенной инфекции во внутренние органы, по отношению к которым они обладают определенным сродством. Отсюда следовал вывод, что любой зуб с некротизированной пульпой подлежит обязательному удалению. На практике данная доктрина проявлялась массовым удалением зубов с хроническими очагами одонтогенной инфекции и некрозом пульпы.
В дальнейшем доктрина подверглась критике, так как были получены новые данные и вскрыт ряд методических ошибок в экспериментах, проведенных Биллингсом и Розенау. Также были разработаны новые методы консервативного лечения, направленные на сохранение зубов.
Под понятием эндогенная интоксикация подразумевают нарушение жизнедеятельности, вызванное токсическими веществами, образовавшимися в организме. В качестве токсических веществ могут выступать активированные ферменты, продукты обмена веществ в высоких концентрациях, продукты перекисного окисления липидов, медиаторы воспаления, компоненты комплемента, бактериальные токсины [5].
Важную роль в этиологии хронических очагов одонтогенной инфекции играет микробный фактор. В очагах одонтогенной инфекции обнаруживаются ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий.

Микроорганизмы рода Микроорганизмы рода
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. Выделяемые токсины нарушают тонус периферических сосудов, механические свойства форменных элементов крови, вследствие этого развивается тканевая гипоксия, которая является одним из важных звеньев патогенеза эндогенной интоксикации [4]. Токсины также блокируют места связывания молекул альбумина, это в свою очередь приводит к снижению эффективности медикаментозного лечения, так как данный белок является транспортным агентом для многих фармакологических препаратов.
В течение последних лет были выяснены некоторые механизмы хронизации острых инфекционных одонтогенных. Данные механизмы заключается в том, что в период острого воспаления в периодонте накапливаются антигены, прежде всего эндотоксины грамотрицательных бактерий. Эндотоксины оказывают антигенное воздействие на иммунное состояние периодонта и окружающих его тканей. Реакция тканей периодонта на непрерывное раздражение антигенами, поступающими из канала корня зуба, проявляется в виде антигенозависимых и клеточно-обусловленных процессов [4]. К антигенозависимым относятся иммунокомплексы реакции типа Артюса и IgЕ-обусловленные реакции, к клеточно-обусловленным — реакции гиперчувствительности замедленного типа [2].
Хроническое воспаление в периодонте при нормальном состоянии иммунной системы рассматривается как защитный барьер, предотвращающий распространение продуктов распада тканей, микроорганизмов и их токсинов в общий кровоток из зоны инфекционного воспаления.
Масштаб иммунного ответа может быть различным, он может протекать на уровнях всего организма, то есть генерализовано или быть локализованным, например, при пульпите отмечаются изменения в иммунологических показателях преимущественно материала из десневой борозды, в меньшей степени — в иммунограмме ротовой жидкости, и совсем едва заметные сдвиги — в иммунограмме периферической крови [4].
К хроническим стоматогенным очагам инфекции относят верхушечные периодонтиты, околокорневые и фолликулярные кисты зубов, многие заболевания краевого пародонта и слизистой оболочки полости рта (гингивиты, пародонтиты, язвенно-некротические стоматиты и т. п.), кариес зубов и др. Хронические стоматогенные очаги инфекции составляют более 50 % очагов хронической инфекции организма.
При появлении стоматогенной инфекции происходит мобилизация защитных сил организма человека, которая достаточна для компенсации влияния этого очага за его пределами. Такое состояние компенсации может поддерживаться неопределенно длительное время. Однако самые различные экзогенные и эндогенные факторы, чаще неспецифического характера (перегревание или переохлаждение организма, переутомление, резкое изменение микроклимата или условий труда и быта человека, перенесенные заболевания и т. п.), приводят к быстрому истощению компенсаторных возможностей организма, активизации инфекции и возникновению обусловленных заболеваний [3].
Взаимосвязь очага хронической стоматогенной инфекции и организма имеет весьма сложный характер. Условно можно выделить несколько основных патогенетических механизмов.
1. Рефлекторный механизм.
Главным фактором является сам инфекционный агент (микробы и их токсины), который создает в очаге активные рецепторные поля раздражения. Рецепторные поля в свою очередь рефлекторно через центры головного мозга вызывают нарушение функции вегетативной нервной системы и регуляции работы внутренних органов и систем организма с последующим развитием в них функциональных и дистрофических изменений.
В клинической практике можно наблюдать такое явление, как проглатывание больным гноя, выделяющегося из зубодесневых карманов при пародонтите или из свища при хроническом гранулематозном или гранулирующем периодонтите и околокорневой кисте челюсти.
3. Низкий уровень иммунологической реактивности организма человека.
Под этим механизмом подразумевается, что микробы из очага стоматогенной инфекции проникают в кровеносное русло, что клинически определяется как острый сепсис. С целью подтверждения диагноза проводят бактериологическое исследование, то есть посев крови на питательные среды для выявления возбудителя и определения его антибиотикорезистентности.
Поступление в кровь токсинов микроорганизмов, находящихся в очаге хронической стоматогенной инфекции, обусловливает затяжной субфебрилитет, изменения в картине крови и другие характерные клинические симптомы.
5. Аллергические механизмы.
Бактерии, находящиеся в очагах инфекции, вызывают образование специфических антител и как следствие, сенсибилизацию организма. При вторичном инфицировании человека тем же видом микроорганизма возникают более выраженные симптомы воспалительной реакции.
6. Аутоиммунный механизм.
В крови человека появляются цитотоксины (антигены тканевого происхождения), которые образуются вследствие повреждения тканей и распада белка. Цитотоксины, являясь аутоантигенами, также изменяют чувствительность организма человека и вызывают его сенсибилизацию и хронизацию воспалительного процесса.
Воспалительные процессы, локализующиеся в челюстно-лицевой области, сопровождаются эндогенной интоксикацией, которая связана с поступлением в кровь эндотоксинов лизосомального происхождения, продуктов распада тканей, токсинов микроорганизмов и других токсических продуктов, которые образуются в самом организме в результате нарушений жизненных функций.
Клинические симптомы эндогенной интоксикации могут быть вариабельны, они зависят от иммунологической реактивности организма человека.
К субъективным проявлениям хронической стоматогенной интоксикации относятся головная боль, головокружение, быстрая утомляемость, чувство тяжести в голове, общая слабость, дрожание рук, потливость, плохой сон.
К объективным проявлениям относятся субфебрильная лихорадка, лимфаденит в области подчелюстных и подбородочных лимфатических узлов, изменения в картине крови. Отмечается лабильность лейкоцитарной формулы (лимфо- и моноцитоз, лейкопения, эозинофилия). Уменьшается количество гемоглобина и снижается количество эритроцитов (вторичная анемия). СОЭ возрастает до 40 мм/ч и более. Отмечаются сдвиги в белковых фракциях крови за счет увеличения процента глобулинов [1].
Для определения нарушений капиллярного кровообращения в очаге воспаления были предложены: 1) методика капилляроскопии;
2) гистаминовая проба;
4) проба на конгорот;
5) определение чувствительности к адреналину;
6) вакцинодиагностика и некоторые другие.
Наиболее доступным методом является гистаминовая проба. Ее проводят в виде гистаминового подслизистого теста, для этого в слизистую оболочку десны в области предполагаемого хронического одонтогенного очага вводят 0,3—0,5 мл гистамина (1: 1000). Через 1 - 2 ч в области пораженного периодонтитом зуба появляются самопроизвольные боли, а также положительная перкуторная реакция (боли при накусывании).
Более практичным методом является конъюнктивальная гистаминовая проба, для ее проведения в конъюнктивальный мешок закапывают 1 - 2 капли гистамина в разведении 1: 100 000 или 1 :500 000 [1]. При наличии в челюстно-лицевой области очагов хронической интоксикации уже через 1 мин появляется расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Реакция не сопровождается неприятными ощущениями и исчезает через 10 мин.
Однако, по мнению многих авторов, чувствительность этой пробы недостаточна высока, так как положительная реакция может наблюдаться у лиц с аллергическими заболеваниями.
Более точным способом является электротест. Методика проведения заключается в том, что пассивный электрод от аппарата постоянного тока больной удерживает в руке, а активным электродом в виде кисточки, смоченной в изотоническом растворе хлорида натрия, проводят по обследуемому участку кожи в течение нескольких секунд. Сила тока при проведении исследования доводят до 15 мА, а напряжение в пределах 15—25 В. При наличии очага на коже лица появляется реакция в виде покраснения с одновременным покалыванием в области проекции больного зуба [1,2].
Лечение при стоматогенных очагах инфекции и интоксикации оно должно быть строго индивидуально. Больной с подозрением на ротовую интоксикацию должен быть детально обследован в условиях стационара.
Выявление одонтогенных очагов производится по следующей схеме:
1) клинически выявляют все зубы с некротизированной пульпой и находящиеся под искусственными коронками;
2) производят рентгенологическое обследование всех корней и каждого в отдельности зуба, подозреваемого на первичный инфекционный очаг;
3) выявляют десневые и пародонтальные карманы, особенно те, которые вызывают обострение воспалительного процесса;
4) исследуют регионарные лимфатические узлы (подбородочные, подчелюстные, шейные);
5) производят анализ крови;
6) делают гистаминовую пробу, электротест и т. д.
На первом этапе стоматологической санации проводят хирургическое удаление инфекционных околозубных очагов воспаления. Стоматологическое вмешательство должно сочетаться с лечением основного заболевания. Клинические проявления обострений ликвидируются уже на 3—4-й день после хирургического удаления стоматогенных очагов инфекции, а восстановление биохимических показателей наблюдается через 1,5—2 недели [2].
На втором этапе санации проводят консервативное лечение кариеса зубов, а также болезней пародонта, хронических заболеваний слизистой оболочки рта.
В качестве профилактики хронической стоматогенной интоксикации служит плановая санация полости рта как у организованного населения (в детских садах, школах, на промышленных предприятиях), так и у всех лиц, обратившихся за стоматологической помощью. Необходимо 2 раза в год проводить профилактические осмотры, которые позволяют выявить новые инфекционные локальные очаги хронической инфекции и интоксикации организма и своевременно провести их консервативное или хирургическое лечение.

Не так давно на одном из нестоматологических форумов я наблюдал историю, которая, к сожалению, очень печально закончилась. Она стала поводом создания этой заметки. Очень хочется надеяться, что после ее прочтения подобных роковых ошибок по отношению к своему здоровью никто не допустит, а также убережет от них своих знакомых и близких.
Историю эту я приведу прямыми выдержками от автора, немного опустив не очень значимые теперь уже подробности борьбы за жизнь 36-летнего мужчины.
17.01.11 "может у кого такое было?! 9 числа у молодого человека под вечер заболел очень сильно зуб, выпил обезболивающие лег спать. ночью проснулся от того что поднялась высокая температура, под 40, По дням 10,11,12,13 высокая температура, ни чем не сбивается, боль по всему телу, болят все суставы, слабость такая что ни чего не ест. Сильная сухость во рту, ни чего не есть , только пьет, к этому ко всему стали очень сильные боли в голове. ВЫзвали скорую, приехала бригада, в больницу не взяли, укололи анальгин и. уехали, температура снизилась, на день до 36.6, потом поднялась до 38.вызвали участкового врача. пришел померил давление - низкое, обнаружил пятна по всему телу как крапивница и отеки по всему телу. сказал поджелудочная осталось не больше 3 дней жить(((, выписал лекарство и все. пьет лекарство , лучше не становится, стало падать зрение, появилась отдышка, очень тяжело дышать. 14,15,16, температура, появился понос. болит очень голова. вызвали опять врача, эта ставит пневманию, все таки увозят в больницу. положили, сделали ЭКГ- все в норме. рентген - в норме, сдал кровь, не все результата но те которые сделали вполне нормальные. И вот он треперь лежит в больнице, и ему ни чего не делают, а ему все хуже и хуже."
"симптомы такие, болит сильно голова, пропадает зрение, на виске вздулась шишка мягкая, которая пульсирует. потом болят все суставы, слабость сильная, тяжело дышать, когда ложится болит спина очень, если поест, то начинает болеть желудок, хотя он не есть а только пьет, сильные отеки и по всему телу пятнышки, похожие на крапивницу."
24.01.11. "дела плохо(((. сегодня его карточку отдали знакомому кардиологу. шансов нет((("
12.02.11. "Умер((("
13.02.11. "Сказали что все от инфекции полости рта. Во рту был и жил стафилококк, попал в кровь и начал оседать в организме. сколько он там бесследно был, врачи сказать не могут, но предполагают что достаточно долго, иммунитет снизился и они стали себя активно вести и пожирать весь организм, сердце, печень,легкие инфекция съела за 2 недели. И ни чего не помогало, операцию делать естественно никто не взялся,говорили что какая операция, когда там такой процесс. Надо бороться с инфекцией и надеется на чудо. Но ему с каждым днем было все хуже и хуже, а самое главное очень больно. Он плакал, и умолял ему помочь, врачи делали обезболивающие но ему от них еще было хуже. диагноз поставили : сепсис, инфекционный эндокардит ( стафилококк)."
Конечно, в этой истории роковым для пациента образом сошлись сразу несколько обстоятельств, приведших к летальному исходу, в т.ч. и слабости нашей медицины. Однако в медицине всегда важно разобраться в причине болезни, найти начальное звено цепочки. В данном случае изначальная причина, запустившая всю цепочку, очевидна – отсутствие должного отношения к своему здоровью, в частности к состоянию своих зубов. К сожалению, приходится замечать, что для многих из нас такое отношение является нормой. Причины у каждого разные – отсутствие времени, денег, страх перед стоматологическим лечением… В результате в лучшем случае вспомнить про врача стоматолога приходится только тогда, когда что-то заболит. Это еще хорошо, если боль вынудит-таки дойти именно до врача, а не до ближайшей аптеки за пачкой продающихся всем подряд без лишних вопросов антибиотиков и обезболивающих таблеток. Ведь идти к стоматологу дорого и страшно, а за таблеткой можно заехать в любую аптеку… и забить-заглушить боль, загнав проблему поглубже внутрь.
Когда нас с экранов ТВ подобным видеорядом настойчиво убеждают, что любая проблема с зубной болью решается на "раз-два" одной таблеткой, хочется дать возможность "креативным" рекламщикам посетить отделения ЧЛХ и посмотреть на плоды лечения зубных проблем их замечательными таблетками.
Чем опасны инфекции полости рта, как и почему это происходит?
Инфекции полости рта, как и почему это происходит?
Примерно так и даже более агрессивно выглядят вышедшие из-под контроля иммунной системы микробы. С большим удовольствием они вырываются из своего замкнутого очага в полости рта в кровь, штурмуя другие органы и ткани и вызывая серьезные проблемы со здоровьем.
Что нужно понять и запомнить для себя?
К врачу стоматологу нужно обращаться регулярно для профилактических наблюдений, даже если ничего не беспокоит и не болит. В стоматологии любая возникающая проблема не проходит и не рассасывается бесследно сама. Лечение запущенных проблем всегда будет более длительным и дорогим. Поэтому экономить свое время и деньги, забивая какие-то первые симптомы таблетками, мазями, полосканиями и прочими домашними процедурами, не стоит. В итоге придется потерять потом и больше времени, и больше денег. И хорошо если только это, а не здоровье или жизнь. Очень хочется надеяться, что случаи, подобные описанному, не будут иметь место в наше время при таком-то уровне развития современной стоматологии.
Отравление ртутью стоматологов, пломбы с ртутью
В США дантисты применяют свыше 100 т ртути ежегодно. Отдельные стоматологи в частной практике применяют в среднем 2—3 фунта ртути в год. В США ежегодно около 100 млн пломб ставят с использованием амальгамы.
а) Стоматологические кабинеты. Примерно в 14 % стоматологических кабинетов общая концентрация ртути (пары и частицы) превышает ПДК 0,1 мг/м1. Концентрация частиц, по-видимому, возрастает в большей степени, чем концентрация паров ртути. Многие дантисты все еще разминают амальгамную массу в ладонях. При сжатии массы для выдавливания избытка ртути (что тоже делается вручную) капли ртути иногда падают на пол, где остаются и испаряются. Высокие концентрации ртути можно обнаружить в покрытых коврами приемных.
б) Стоматологи — уровни ртути в моче. Концентрации ртути в моче коррелируют с количеством часов работы в неделю и с числом амальгамовых пломб, поставленных за неделю. По данным одного исследования, средний уровень ртути в моче у стоматологов составлял 14,2 мкг/л мочи, примерно у 1,3 % врачей концентрации ртути в моче были выше 100 мкг/л — уровня, при котором могут появиться физиологические эффекты.
в) Стоматологи — уровни ртути в тканях. Определение концентраций ртути у стоматологов посредством флюоресцентной рентгенографии позволяет предположить, что у врачей с высоким уровнем ртути в тканях могут развиваться полиневропатии, незначительная визуографическая дисфункция и некоторые признаки слабой нейропсихопатии и дистресса.
г) Стоматологи — уровни ртути в крови. У стоматологов, по-видимому, происходит повышение общего содержания ртути и уровня неорганической ртути в крови. Уровень ртутьорганических соединений не повышается. In vivo не происходит значительного ферментативного преобразования неорганических соединений ртути. Постулируемые пути не отмечены in vivo.
д) Беременность персонала стоматологических учреждений. Проведенное в Швеции обследование 8157 младенцев, родившихся от женщин-стоматологов, их ассистенток или зубных техников, позволяет заключить, что не отмечается влияния ртути на число спонтанных абортов, перинатальную выживаемость или распределение массы тела при рождении при профессиональной экспозиции в зубоврачебных кабинетах.
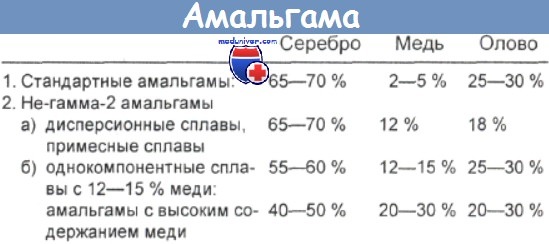
е) Амальгамы для зубных пломб:
- Традиционный состав — трансформация. Коррозия вызывает выделение примерно 30 мкг ртути в день. Стирание обусловливает выделение 101 мкг Hg в день. В Германии амальгамы, содержащие гамма-2, могут быть запрещены в связи с неустойчивостью и риском выделения ртути в процессе пломбирования.
Среднее время существования амальгамы — примерно 10 лет. Есть следующие альтернативы амальгаме: а) составы из пластических материалов (они не всегда пригодны для задних зубов, где прикус сильнее; при усадке и отвердении создаются зазоры между пломбами и зубами; такие материалы нелегко применять), б) фарфор (требует нескольких посещений врача) и в) золото (требует нескольких посещений и значительно дороже).
Период полувыведения ртути из крови после удаления амальгамы составляет примерно 30 сут. Удаление амальгамы вызывает дополнительную экспозицию — около 1,5 нг/мл, ртуть быстро удаляется из крови; период полувыведения равен 2,9 сут.
Ежедневное потребление ртути в результате удаления около 14 амальгамных поверхностей составляет примерно 1,3 мкг. Концентрации ртути в крови вследствие поступления из амальгамных источников составляют 1,12 нг/мл, в то время как признаки ртутной интоксикации начинают появляться при концентрации в крови около 30 нг/мл.
- Жевательная резинка и экспозиция к ртути. Эмиссия ртутных паров после нескольких минут интенсивного жевания обычно увеличивается в 3—5 раз. У людей без амальгамовых пломб и не подвергающихся профессиональной экспозиции к ртути средняя скорость выведения с мочой составляет 0,6 мкг Hg/24 ч (0,5 мкг Hg/л).
Хотя у людей с ртутными амальгамами с мочой выделяется больше ртути, чем у людей без амальгам, нет данных, что это вызывает интоксикацию почек.
ж) Рекомендации. Группа экспертов по зубоврачебным установкам при FDA (США) убеждает потребителей, что нет необходимости удалять амальгамовые пломбы. Нет достоверных данных, которые показывали бы, что пломбы вредны при клиническом использовании или что их удаление предотвратит неблагоприятное воздействие на здоровье или скорректирует течение существующей болезни.
Единственная документально подтвержденная проблема для здоровья, обусловленная зубной амальгамой, — аллергия на один из металлов, чаще на медь или серебро, чем на ртуть. Более вероятны сильные аллергические реакции на композитные пластиковые пломбы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

