Как иммунитет борется с инфекцией
Обновлено: 19.04.2024
— Есть простое, но емкое определение: иммунитет — это способ защиты организма от всего генетически чужеродного. Для людей это могут быть как внешние факторы — бактерии, паразиты, грибы, вирусы, — так и внутренние, например, клетки, мутировавшие в онкологические. Или же клетки самой иммунной системы, которые могут быть агрессорами и вызывать аутоиммунные заболевания. Таким образом, иммунитет защищает и от инфекций, и от онкологии, и от аутоиммунных заболеваний, и сохраняет целостность организма.
— Может ли он сам по себе так сильно упасть, что потребуется пить иммуностимуляторы/модуляторы?
— Падение, ослабление, поднятие иммунитета — это все сленг и не имеет отношения к реальной иммунологии. Конечно, бывают иммунодефициты, но это серьезные заболевания, развивающиеся либо в результате генетической поломки, либо из-за инфекций, каких-то сопутствующих патологий, вредных внешних воздействий. Они требуют специфического лечения, причем не только иммуномодулирующего, но и зачастую стационарного.
В таких случаях иммунолог может назначить препараты с рядом побочных эффектов, некоторые могут вводиться только в стационаре. Все остальные иммуномодуляторы, которые рекламируются как средства для лечения ОРВИ, поддержания и стимуляции иммунитета, людям без диагностированного иммунодефицита не требуются. Польза этих препаратов не доказана, поэтому здоровому человеку они не нужны.
по теме

Лечение
Аллергия как проклятие большого города. Интервью с врачом
— А такие средства вообще работают?
— Чтобы точно это сказать, как и понять, насколько они безопасны для повышения иммунитета, нужно проводить большие исследования. В них описываются поэтапные действия препарата в организме, все его побочные эффекты, когда и как препарат выводится, а главное — объяснение, что конкретно стимулирует препарат. Может ли это привести к гиперстимуляции и, например, к аутоиммунному заболеванию или к аллергии. Но таких исследований нет, поэтому врач не должен их назначать.
— Конечно, нет больших исследований о том, что кисломолочные продукты влияют на иммунитет. Это устроено совершенно иначе: хорошо работающий желудочно-кишечный тракт (у которого прекрасная микрофлора) помогает иммунитету бороться с инфекцией. Дело в том, что в кишечнике очень ярко представлена иммунная система — там есть лимфоидная ткань. О прямой связи с тем, что нужно пить препараты или кисломолочные продукты, я не могу говорить. Но если человек питается полноценно и кишечник его функционирует отлично — это большая помощь иммунной системе.
— А про витамины миф или нет? Они помогают иммунитету, их вообще надо пить?
— Когда ребенок часто болеет, родители хотят найти волшебную таблетку, которая укрепит иммунитет, но, опять же, это работает иначе. Во-первых, у людей есть иммунологическая конституция — определенная данность. Простым языком: у кого-то иммунитет крепче, а у кого-то — слабее, кто-то болеет реже, кто-то — чаще. На генетическом уровне изменить это мы не можем. Поливитаминами — точно нет. А образом жизни — стопроцентно да.
Отдельно хочу сказать о витамине D. Это гормоноподобный витамин очень серьезного действия. Он имеет доказательную базу по воздействию на иммунитет, поэтому рекомендован для профилактического приема детям и взрослым практически во всех странах мира, в том числе в нашей.
— А другие витаминные комплексы?
— У них нет доказательной эффективности в отношении часто болеющих людей. Я всегда своим пациентам рекомендую поменять образ жизни на более правильный, то есть человек должен все микроэлементы и витамины пытаться получить из пищи. Моя настоятельная просьба: не тратить деньги на поливитаминные комплексы и БАДы, а лучше потратить их на качественные овощи и фрукты, это будет намного эффективнее. Плюс физическая активность, свежий воздух и очень важно — длительный полноценный ночной сон.
— Если часто болеешь, надо срочно бежать к иммунологу?
— Тут есть хорошая подсказка. Если эти частые заболевания — простые ОРВИ, то, скорее всего, грубой иммунологической патологии нет. Но если каждое ОРВИ заканчивается осложнениями, например, синуситом, гайморитом, гнойным отитом, обязательно нужно обратиться к иммунологу.
— А что такое вообще часто болеть? Есть какая-то норма?
— Данные расходятся, но если брать среднее число, то во взрослом возрасте норма — шесть ОРВИ в год, у ребенка — до десяти-двенадцати. Ребенок, который ходит в детский сад, в принципе, может болеть раз в месяц. Но тут важна не цифра, а как именно болеет человек: насколько тяжело, есть ли осложнения, насколько эффективна терапия, как он выздоравливает. Если это ОРВИ с насморком, подкашливанием и болью в горле, но при обильном питье и промывании носа сразу приходит самостоятельное выздоровление, например, к концу недели, тогда никаких проблем нет.
по теме
Лечение
Как устроен иммунитет: Объясняем по пунктам
— Что нужно делать, чтобы иммунитет не ослабевал? А чего точно не нужно делать?
— Нужно создать условия, чтобы иммунитет мог спокойно работать, но не стоит вмешиваться в его работу. Не надо пытаться искусственно его стимулировать — это небезопасно. Условия, при которых иммунной системе будет комфортно выполнять свою функцию, достаточно просты: здоровый образ жизни.
Я понимаю, что все хотят волшебных препаратов, но нужно принять этот факт — спать по ночам и высыпаться, потому что именно ночью во сне образуются клетки иммунной системы. Еще раз скажу про полноценное питание, которое становится строительным материалом для клеток иммунной системы. Кроме того, обязательно должна быть физическая активность для нормальной циркуляции клеток иммунной системы по организму. И, конечно, стараться избегать стрессов, потому что это — один из факторов подавления иммунитета.
— А закаливание на самом деле полезно и работает?
Причина, конечно, в вирусе, но холод в этом случае был провоцирующим фактором. Если организм привык к холоду, испытывал закаливание на себе, для него выйти на улицу зимой — не стресс. Его сосуды и слизистые оболочки не будут так ярко реагировать на холод, а значит, иммунная система в этом месте может спокойно выполнять свою функцию. Таким образом, закаливание вместе с иммунитетом защищают нас от инфекции.
— Давайте вернемся к иммунодефицитам? Что это? Откуда они берутся?
— Иммунодефициты бывают разные. Они могут быть первичными и вторичными. Первичные обусловлены генетически. То есть ребенок рождается с определенной генетической мутацией, которую либо унаследовал от родителей, либо она произошла спонтанно, и какая-то из функций иммунной системы выпала. Следовательно, он не может бороться с инфекциями или с определенными их типами.
Вторичный иммунодефицит — это большая группа заболеваний, которые возникают в результате внутренних или внешних факторов, и у них совсем другие подходы в диагностике, лечении и так далее. Например, это пациенты после тяжелейших инфекционных заболеваний, обширных оперативных вмешательств, ожогов, пациенты с ВИЧ. В некоторых случаях мы можем повлиять на него, убрав провоцирующий фактор, и тогда иммунная система восстанавливается и все хорошо. В частности, так происходит у пациентов после химиотерапии — пока они ее получают, у них есть иммунодефицит, а когда прекращают — система восстанавливается.
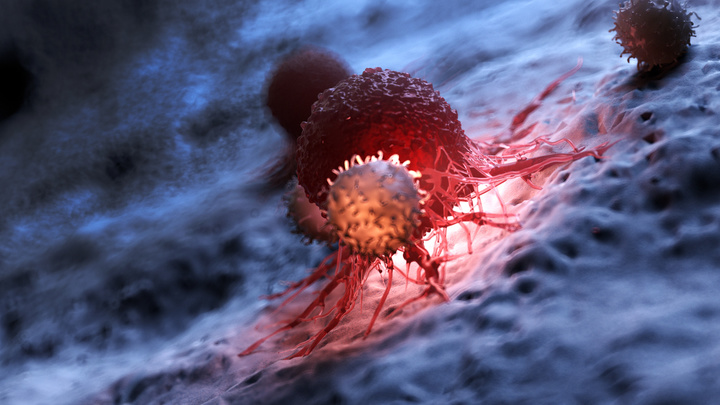
Т-лимфоциты атакуют раковую клетку.
К сожалению, в случае с ВИЧ повлиять на это мы не можем. Как я уже говорила, распознать иммунодефицит можно, когда заболевание протекает нетипично, не поддается стандартной терапии, например, антибактериальной, ОРВИ заканчивается гнойным осложнением. Все это повод обратиться к иммунологу для выяснения причин.
Что касается первичных иммунодефицитов, тут все намного проще. Разработан список настораживающих факторов, которые могут встречаться у детей и взрослых. Если у пациента есть два и более из них, то мы должны думать об иммунодефиците и исключать его лабораторно. Помощь такому пациенту нужно обязательно оказывать.
— Как ВИЧ влияет на иммунитет?
— Когда вирус заражает клетку иммунной системы, она дает сигнал о том, что она инфицирована. В результате инфицирования запускается серьезная работа иммунной системы, направленная на борьбу с вирусом. Нам известно, что ВИЧ поражает клетки с рецептором на поверхности СD4+. И в первую очередь это клетки Т-хелперы, одни из важнейших клеток иммунной системы, без которых невозможно формирование иммунного ответа. Естественно, на такое вторжение организм обязан ответить. Делает он это с помощью другого вида лимфоцитов — Т-киллеров, или цитотоксических Т-лимфоцитов. Тех самых, которые в иммунограмме обозначаются как СD8+. Именно они главные в борьбе с любыми вирусами. Так вот, Т-киллеры разрушают (подвергают апоптозу) Т-хелперы, не давая вирусу размножаться.
Есть исследования, которые говорят, что для пациентов с большим количеством Т-киллеров характерно медленное прогрессирование заболевания. То есть этот механизм достаточно эффективно работает, защищая нас от вирусных инфекций. Но с ВИЧ он имеет временный эффект, связанный с изменением вируса, его ускользанием от механизмов защиты.
Еще одной негативной стороной на более поздних стадиях является то, что киллеры могут уничтожать и здоровые Т-хелперы, способствуя иммунодефициту и усугубляя его. Стадии этого процесса можно отследить благодаря показателям CD4+ (Т-хелпер), CD8+ (Т-киллер) и ИРИ (иммунорегуляторный индекс). Фактически ИРИ — это отношение количества Т-хелперов к Т-киллерам. У пациентов с ВИЧ он снижается. Изначально благодаря высокому уровню CD8+, что как раз и говорит о противовирусной активации иммунной системы. А в более поздних стадиях ИРИ снижается за счет уменьшения количества Т-хелперов.
— Как можно повысить иммунитет, если у меня ВИЧ? Что для этого надо делать? Или рекомендации точно такие же, как и для всех остальных?
— С рекомендациями ситуация неоднозначная. Конечно, пациенту с ВИЧ нужно соблюдать все те же правила здорового образа жизни, что будет благоприятно влиять на иммунитет. Что касается четких рекомендаций, назначения иммуномодуляторов и так далее, нужно быть очень осторожным. В процессе ВИЧ есть разные стадии. На одних стадиях можно применять медикаментозную поддержку, на других — нет.
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
по теме

Мнение
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.

по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
На вопрос, что такое иммунная система, самый частый ответ звучит так: это защитная система организма, задачей которой является противостоять внешним факторам. В первую очередь инфекциям.
Но на самом деле, если вдаваться в подробности, окажется, что все устроено немного сложнее. Иммунология — наука об иммунитете — появилась не так давно. Ей на сегодняшний день всего лишь около 100 лет, и большинство открытий здесь пришлись на вторую половину ХХ века. Именно тогда у нас появилось более-менее адекватное понимание того, как иммунитет работает, что это такое и как он устроен.
Изначально считалось, что клетки иммунной системы — это клетки, которые обладают некими питательными свойствами, то есть выполняют функцию практически обратную той, что в действительности.
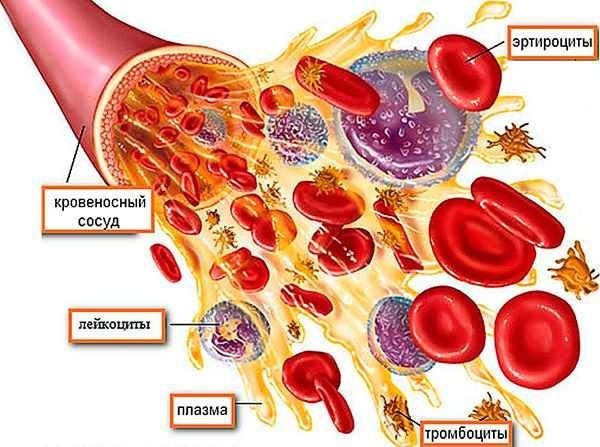
Из чего состоит кровь? Виды кровяных клеток: тромбоциты, красные - эритроцыты, белые (на картинке синие) - лейкоциты и плазма.
Если формулировать корректно, иммунная система борется со всем генетически чужеродным материалом в организме. Этим материалом может быть не только вирус или инфекция, но любые чужие, инородные вещества, которые оказались в организме. Паразиты, бактерии, наши собственные клетки, которые под воздействием неких внутренних факторов поменяли свою генетическую природу. Например, раковые. Одну из последних Нобелевских премий по медицине, кстати сказать, дали именно иммунологам, которые занимаются противоопухолевым иммунитетом.
Каждый день в нашем организме образуются сотни и тысячи новых клеток. Часть из них — неправильные, опухолевые, но их появление не приводит к возникновению очага. Почему?
Обратной стороной такой бурной деятельности нашего иммунитета являются так называемые аутоиммунные заболевания: артриты, волчанка, рассеянный склероз. Иногда иммунная система начинает бороться с собственным организмом, в результате сбоя воспринимая его собственные здоровые клетки как генетически чуждые. Но причины таких сбоев — тема для отдельной беседы.
Если попытаться перечислить все органы, ткани и клетки, которые составляют нашу иммунную систему, то, безусловно, начать придется с костного мозга. Кости — это не просто опорно-двигательный аппарат, внутри них спрятан целый мир, который обладает крайне важной функцией — гемопоэтической. Все клетки, которые вы видите в общем анализе крови, — эритроциты, тромбоциты, лейкоциты — образуются именно здесь, в костном мозге.
Что там происходит? Внутри костного мозга расположены знаменитые стволовые клетки. Стволовая клетка крови — это та клетка, которая в процессе своего развития может стать кем угодно. Она может развиться в эритроцит, лейкоцит (в том числе лимфоцит), или например тромбоцит. Если у нас в организме снижается количество каких-то конкретных клеток, в костный мозг поступает соответствующий сигнал, и он начинает производить из имеющихся у него стволовых именно те, что необходимы нам в данный конкретный момент.
Эта невероятная фабрика работает 24 часа в сутки. Но наиболее интенсивно по ночам, когда человек спит. Именно поэтому, если мы с вами не высыпаемся, наш иммунитет ослабевает. Организму не хватает покоя и той энергии, которую он экономит за счет сна, она нужна ему, чтобы произвести кровяные клетки, в том числе клетки иммунитета, в нужном количестве.
по теме

Лечение
Аллергия как проклятие большого города. Интервью с врачом
Попав из костного мозга в тимус, лимфоциты проходят все круги ада, из каждых 100 пришедших выходят, как правило, только 5, но зато суперпрофессиональных клеток. О которых мы поговорим чуть ниже.
Тимус, несмотря на то, что крайне важен, не функционирует всю нашу жизнь. Основная работа его сосредоточена до подросткового возраста или максимум до 20 лет. По достижении которых этот орган начинает уменьшаться в размерах и где-то за грудиной у нас остается совсем маленьким до конца наших дней.
Кроме того, существуют периферические органы иммунной системы — селезенка. Она находится слева, и когда мы бегаем, дает о себе знать. Сюда приходит кровь, и если крови приходит слишком много (как во время кросса), она увеличивается и не помещается в своей капсуле, отчего мы чувствуем неприятные ощущения.
Расположение тимуса в человеческом теле.
Кроме лимфоузлов в организме присутствует так называемая лимфоидная ткань — это почти то же самое, что лимфоузел, с той лишь разницей, что она не собрана в какой-то определенный шарик с капсулой, как узлы. Это наши миндалины, аденоиды между носом и ротоглоткой. Кроме того, у нас сеть лимфоидная ткань кишечника, поэтому о кишечнике также часто говорят в рамках иммунитета. Особенно ее много в аппендиксе.
На этом обзор-ревизию нашей иммунной системы можно закончить и посмотреть, как она все-таки работает.
Киллеры и хелперы
Все клетки иммунитета можно разделить на несколько классов.
Нейтрофилы — это те, что борются с бактериями. Когда в общем анализе крови врач видит, что у нас очень-очень много нейтрофилов, он назначает антибиотики. Это адекватно. Раз много нейтрофилов, значит, речь идет о бактериальной инфекции.
Эозинофилы — клетки-братья нейтрофилов, достаточно похожие на них по строению — борются с паразитами. На YouTube можно посмотреть, как какого-нибудь гельминта разрывают на части и съедают эти кровожадные ребята.
Базофилы — иначе их называют тучными клетками — тоже борются с паразитарной инфекцией и участвуют в аллергическом воспалении.
Моноциты — уничтожают клетки организма, пораженные вирусом. То есть они борются с инфекциями вирусными.
Натуральные киллеры — осуществляют противоопухолевый иммунитет.
B-лимфоциты — клетки, которые распознают инородные белковые структуры (антигены) и вырабатывают направленные против них антитела.
T-лимфоциты, в том числе Т-киллеры, Т-супрессоры и Т-хелперы.
Как только чужеродный белок попадает в организм, клетки врожденного иммунитета (так называемые дендритные клетки) несут сигнал о его появлении в ближайший лимфоузел.
по теме

Лечение
Плесень Флеминга: существует ли аллергия на пенициллин?
Что они умеют делать профессионально? Убивать. Это и есть так называемые лимфоциты-киллеры.
Как только армия создана, они выходят из лимфоузла и отправляются в ту часть организма, где был обнаружен неприятель.
Клетка-хелпер, всем нам известная тем, что именно ее поражает вирус иммунодефицита человека (ВИЧ), в свою очередь является своеобразным постовым в лимфоузле, который перенимает информацию, принесенную дендритами. Без нее иммунный ответ невозможен, хотя сама она никого и не убивает.
Регуляторы, которые следят за хелперами и киллерами, тормозя их работу, чтобы хелперы с киллерами не слишком расходились и не погромили лишнего, называются супрессорами.
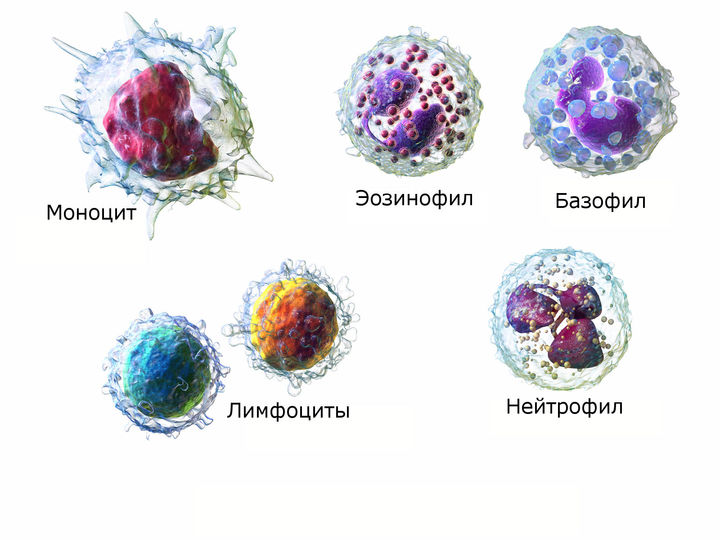
Так случилось, что иммунный ответ на паразитов и иммунный ответ на аллерген, если у вас есть аллергия, происходят совершенно идентично.
Иммуноглобулины и аллергия
Как мы уже сказали, при помощи B-лимфоцитов в ответ на появление в нашем организме инородного агента (антигена) вырабатываются антитела. Другое их название, этих антител, слышали практически все: иммуноглобулины.
Всего иммуноглобулинов существует 5 классов.
Иммуноглобулины М и G — направлены против инфекций.
G — это то, что синтезирует клетка памяти. М — вырабатывается в ответ на острую инфекцию. Бывают ситуации, когда вас направляют на анализ, и вы видите, что М у вас ноль, а G высокий. Иногда даже в 10 раз выше нормы. Но пугаться таких результатов не стоит, поскольку это значит, что инфекция прошла, но ваша клетка памяти по-прежнему синтезирует много соответствующего иммуноглобулина.
Иммуноглобулин А — занимается защитой слизистых. Он образуется у нас в подслизистом слое и защищает полость носа, ротовую полость, весь желудочно-кишечный и урогенитальный тракты. В определенной концентрации он присутствует в организме всегда. Единственная его особенность — как правило, он очень низкий у детей дошкольного возраста, поэтому, когда дети ходят в сад, они бесконечно болеют.
Антитела атакующие кишечную инфекцию.
Мы моем руки, везде Мирамистин. И с этим связана одна из теорий, почему у современного человека так часто бывает аллергия. Аллергия — это результат побочного, неправильного поведения соответствующих иммуноглобулинов.
В соответствии с этой теорией, иммуноглобулин Е просто не знает, чем себя занять, и начинает реагировать на определенные белковые факторы, или аллергены, не представляющие для организма опасности: пыльцу, эпителий домашних животных, какие-то пищевые продукты.
Аллергеном может быть любой белок, то есть аминокислота. Поэтому не существует аллергии на сахар, сахар — это углевод. А вот на овощи, фрукты, в том числе сладкие — вполне может быть.
по теме

Лечение
А это поможет? Насколько безопасен секс с антисептиками
Аллергологи нередко шутят, что перед тем, как планировать беременность или завести ребенка, стоит заранее завести корову, утку, собаку, кошку или просто уехать в деревню, пить там непастеризованное коровье молоко. Это единственный метод профилактики аллергии.
Никакой диеты во время беременности: женщина должна есть все что угодно и знакомить ребенка с продуктами через кровь. Равно как и во время грудного вскармливания.
Вместо заключения
Врачи все патологии иммунной системы подразделяют на гиперреакции и гипореакции. Аллергия — это гиперреакция. По сути, у аллергика иммунитет работает не просто хорошо, а слишком хорошо. Гипореакация, как правило, связана с обратной ситуацией, она бывает только тогда, когда пациент имеет, например, первичный иммунодефицит.
Такое бывает, если от рождения у человека в тимусе не происходят соответствующие процессы или тимуса у него вовсе нет. Или у него в принципе не образуются клетки хелперы. Таким детям проводят трансплантацию костного мозга, и только тогда они получают шанс на здоровую, долгую и полноценную жизнь.
Помочь сохранить иммунитет, поддерживать его правильную работу помогает — как ни странно — здоровый образ жизни.

То же касается и взрослых. Второй важный вопрос: потребление достаточного количества белка. Для того чтобы стволовым клеткам, с которых мы начали наш рассказ, делиться, дифференцироваться, нужен белок. То есть строительный материал. Именно поэтому нужно полноценно питаться. Для того чтобы кишечник, где много лимфоидной ткани, нормально работал, чтобы там была адекватная флора, необходимая для иммунной системы, нужно есть очень много клетчатки, и она должна составлять большую часть рациона человека.
Что такое клетчатка? Овощи, фрукты в большом количестве. Последний пункт: больше двигаться. 10 тысяч шагов в день необходимо пройти, чтобы у вас была правильная циркуляция крови в организме. А кровь — это в том числе и лимфа — то, посредствам чего клетки иммунной системы достигают всех уголков нашего организма.
Чего делать не стоит, так это пить иммуностимуляторы и иммуномодуляторы. Если даже они работают, мы не знаем, безопасны ли они. Иммунитет — это суперклассная и очень сложно устроенная система. Ни одна инструкция к иммуностимуляторам не дает ответа на вопрос: на каком уровне они в эту систему вмешиваются? А главное — как.
Если там написано, что препарат усиливает фагоцитоз, стоит задаться вопросом: что такое фагоцитоз? Это процесс, когда клетки пожирают бактерии. Мы с вами как минимум два вида сегодня знаем таких клеток — нейтрофилы и макрофаги. Где они это делают? В тканях, в крови.

Неспецифическая защита
Существует два типа иммунитета: врожденный и приобретенный, каждый из которых по-разному реагирует на патогены и создает таким образом двухступенчатую систему защиты.
Врожденный иммунитет, как следует из названия, выдается нам с рождения и унаследован человеком от далеких предков. Комплекс реакций врожденного иммунитета сформировался в результате миллионов лет эволюции и сосуществования человека и патогенов. Но реакция эта — стандартная, одинаковая, вне зависимости от того, какой именно антиген попал в наш организм. За это его еще называют неспецифическим.
Система врожденного иммунитета (клетки иммунной системы и интерфероны) защищает организм от большинства возбудителей, например, гриппа и сезонных ОРВИ. Если она реагирует своевременно и правильно, то заболевание может не наступить вовсе.
Приобретенный иммунитет
Иногда происходит так, что при всех усилиях врожденного иммунитета заболевание все-таки наступает. Это значит, что высокопатогенному микроорганизму все же удалось обойти систему защиты человека и начать размножаться. Человек реагирует на это повышением температуры, кашлем, насморком и другими болезненными симптомами. При всей неприятности повышение температуры тела также направлено на борьбу с вирусом, что в конечном итоге приводит к его уничтожению. Кроме того, через несколько дней после заражения на помощь врожденному приходит приобретенный иммунитет. Реагирует он гораздо медленнее, зато уже знает, с чем имеет дело, — атакует попавший в организм антиген специфическими, предназначенными именно для него антителами, или иммуноглобулинами, — особыми белковыми молекулами.
Таким образом, чтобы в организме развился приобретенный иммунитет к какому-либо патогену, необходимо перенести заболевание. Причем, по словам врачей, чем сложнее человек переносит заболевание, тем более сильный иммунитет у него сформируется. Ко многим болезням приобретенный иммунитет сохраняется практически бессрочно. Например, так называемыми детскими болезнями — ветрянкой, краснухой, корью — человек чаще всего болеет один раз. После этого даже через много лет в крови переболевшего можно выявить антитела к этим вирусам.

В случае тяжелого течения болезни, например, того же коронавируса, нагрузка на организм многократно возрастает. На борьбу с заболеванием организм тратит ресурсы и силы, для него это существенный стресс, который может привести к нарушениям в работе систем. В такой ситуации формируется приобретенный иммунитет к конкретной болезни, но из-за стресса повышается вероятность других заболеваний, растет уровень восприимчивости к ним. Тут вновь подспорьем могут быть индукторы интерферона, которые помогут снизить риски в этот непростой для организма период.
Более приятная альтернатива болезни — вакцинация, при которой в организме также вырабатываются антитела к распространенным и опасным инфекциям. Но вакцины, к сожалению, существуют не от всех болезней. Например, по словам врачей, создавать вакцины от многочисленных вирусов, вызывающих сезонные ОРВИ, — бессмысленно. С одной стороны, эти заболевания не настолько опасны, с другой — сезонные вирусы постоянно мутируют, что делает создание вакцины бесполезным и экономически невыгодным, ведь ее пришлось бы обновлять каждый год. Именно так, кстати, поступают с вакциной от гриппа, но тут речь идет только об одном типе вируса.
Исключение — новая коронавирусная инфекция, вакцины от которой в ускоренном порядке разрабатываются, тестируются или уже массово применяются в разных странах мира. Кстати, на этом актуальном примере можно наглядно разобрать работу приобретенного иммунитета.

Фото: Brittany Colette / Unsplash
Какие антитела важнее
Для борьбы с коронавирусом организм синтезирует три класса антител: иммуноглобулины A (IgA, вырабатываются первыми в острой фазе заболевания, но обладают низкой специфичностью), M (IgM, вырабатываются чуть позже, активно борются с вирусом и сохраняются в крови примерно месяц) и G (IgG, появляются через 3-4 недели после выздоровления и обеспечивают долгосрочный иммунитет, который, впрочем, в случае COVID-19 сохраняется всего 3-4 месяца).
IgG, как и антитела других классов, вырабатываются к различным частям (антигенам) оболочки вируса. Из всего объема выработанных антител IgG только часть способна блокировать расположенный на шипах вируса S-белок и препятствовать тем самым проникновению вируса в клетку. Именно эти антитела больше всего интересуют врачей.

Фото: Kelly Sikkema / Unsplash
Нейтрализовать вирус
На основе частей S-белка созданы все первые вакцины против коронавируса, в том числе и российская Sputnik V, разработанная центром имени Н. Ф. Гамалеи. При вакцинации организм начинает вырабатывать не все подряд антитела, а только те, которые наиболее эффективно защищают от вируса. Их называют вируснейтрализующими. По прогнозам, в результате вакцинации они сохранятся в организме до двух лет.

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Читайте также:

