Как лечат туберкулез в японии
Обновлено: 19.04.2024
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
Туберкулез в Японии. Суперинфекция туберкулеза.
В сущности такую же закономерность можно установить на материалах Schimao и соавт. (1973). При многолетнем регулярном наблюдении за медицинским персоналом ряда противотуберкулезных учреждений Японии авторы отметили, что до 1955 г. заболеваемость активным туберкулезом легких лиц, ранее уже инфицированных, составляла в первые 5 лет их работы 1%, а с 1965 г. она снизилась до 0,1%. По мере увеличения стажа работы опасность заражения и заболевания туберкулезом уменьшалась. Тем не менее и в последние годы (1965—1972) сотрудники лабораторий, имеющие наибольший контакт с инфекционным материалом, заболевают туберкулезом в 4 раза чаще, чем врачи, медицинские сестры, хозяйственный персонал и др.
Приведенные данные свидетельствуют о том, что суперинфекция, особенно длительная, массивная и в определенном возрасте, не утратила своего патогенного значения и в период спада туберкулезной эндемии. Каков механизм ее действия?
Ряд прежних и современных патологов и клиницистов, в частности Canetti (1972), признают возможным образование новых очагов в результате повторного заражения. Вероятность такого генеза процесса становится более достоверной в тех случаях, когда свежие очаги образуются в подключичных зонах или в средних и нижних отделах легких и в то же время отсутствуют явные признаки обострения преформированных очагов. В пользу этой гипотезы отчасти свидетельствует прогрессирующая с возрастом частота образования специфических очагов в легких у клинически здоровых людей, в особенности в условиях длительного соприкосновения с бацилловыделителями.
За последнее время веским аргументом в защиту роли экзогенной суперинфекции стало обнаружение в мокроте микобактерий туберкулеза, устойчивых к различным туберкулостатическим препаратам у впервые заболевших туберкулезом людей, которые раньше не лечились этими медикаментами.
Следовательно, образование новых туберкулезных очагов в органах дыхания в результате повторного заражения вероятно. И действительно, если микобактерий, поступающие даже в незначительном количестве из обострившихся старых очагов, в состоянии вызвать специфические изменения в легочной паренхиме и бронхиальной системе, то нет оснований отвергать такую возможность при многократном поступлении инфекции извне. Относительный иммунитет, приобретаемый после первичного заражения или вакцинации БЦЖ, отнюдь не всегда предохраняет от такого влияния массивной экзогенной суперинфекции.
Эти факты позволяют усматривать основную причину патогенного действия повторного заражения в сенсибилизирующем влиянии микобактерий туберкулеза и продуктов их распада на организм людей, длительно подвергающихся интенсивной суперинфекции. При этом повышается местная чувствительность прежде всего в зонах гиперсенсибилизации, т. е. в тех участках легочной ткани и вокруг лимфатических узлов, где в результате ранее перенесенной первичной инфекции длительно сохраняется аллергическая настроенность тканей. В таких случаях возникает перифокальное воспаление вокруг старых очагов и создаются условия для распространения инфекции в организме.
Вместе с тем со всей очевидностью выступает ведущая роль сидогенной суперинфекции, или, как ее называл Koch, аутоинфекции, в патогенезе туберкулеза различных органов. Об этом убедительно свидетельствуют многочисленные факты.
Как показывают наблюдения ряда авторов и материалы, систематически изучаемые нами на протяжении многих лет, внутрисемейный, квартирный или производственный контакт с бацилловыделителями отмечается лишь у меньшей части заболевших. В подавляющем большинстве случаев больные, ранее не лечившиеся туберкулостатическими препаратами, выделяют лекарственночувствительные микобактерии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Советы при туберкулезе
1. Как лечить туберкулез?
Туберкулез лечится в основном медикаментозным путем. Для проведения кожной пробы на конверсию очищенного от белка туберкулина (ППД) требуется 6-месячный курс лечения изониазидом (ГИНК). При таком лечении почти всегда можно предотвратить развитие активной стадии заболевания.
Лечение активной стадии заключается в 6-месячном курсе приема ППД и рифампина и 2-месячном курсе приема пиразинамида. Вследствие высокой токсичности этих препаратов, больные зачастую стараются уклониться от их приема. Несоблюдение больным режима лечения может привести к развитию у пего микроорганизмов, резистентных к антибиотикам.
Поэтому для предотвращения осложнений все чаще применяется лечение больного в стационаре. (Чтобы больные принимали таблетки, необходимо следить за ними, как за детьми.)
2. Сколько людей во всем мире ежегодно умирает от туберкулеза?
3 000 000 человек.
3. Что является наиболее частым показанием для хирургического лечения больных туберкулезом в США?
Когда инфицирующие микроорганизмы резистентны и к ГИНК, и к рифампину, можно говорить о полирезистентном туберкулезе. Зачастую эти микроорганизмы резистентны и к другим основным препаратам (стрептомицину, этамбутолу, пиразинамиду). Больным с полирезистентным туберкулезом и значительным полостным поражением или разрушением легкого с положительными результатами теста на мокроту или без такового требуется хирургическое вмешательство.
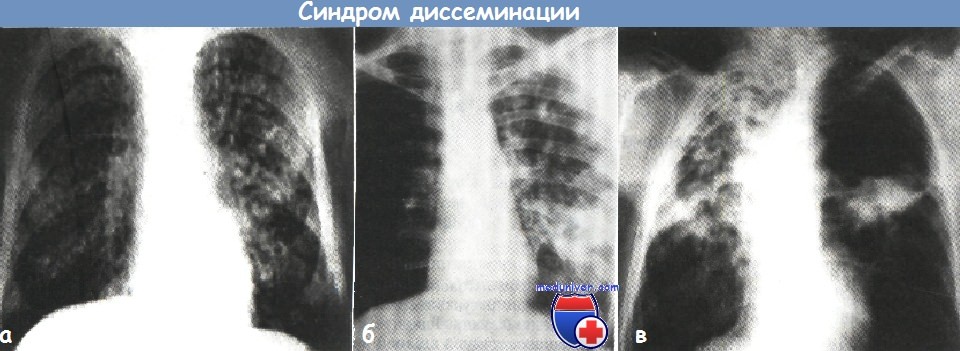
а - синдром выраженной гематогенной диссеминации очагов при диссеминированном туберкулезе легких (рентгенограмма органов грудной клетки в прямой проекции)
б - синдром лимфогенной диссеминации очагов в верхней доле правого легкого (рентгенограмма органов грудной клетки в прямой проекции).
в - синдром бронхогенной диссеминации в правое легкое при фиброзно-кавернозном туберкулезе (рентгенограмма органов грудной клетки в прямой проекции).
4. Назовите другие показания для операции у больных туберкулезом.
Это серьезное кровохарканье (> 600 мл крови в течение 24 часов), бронхостеноз, бронхоплевральный свищ, остановка движений легкого при отсутствии рака.
5. Предрасположены ли больные с полирезистентным туберкулезом к разрушению одного легкого?
По неустановленным причинам у 75% больных с полирезистентным туберкулезом и разрушением только одного легкого разрушается левое легкое.
6. Существуют ли другие легочные инфекции, вызываемые микобактериями?
Нетипичные микобактериальные инфекции, нетуберкулезные микобактериальные инфекции и инфицирование нетуберкулезными микобактериями (МОТТ) — это все синонимы. Наиболее часто среди этих микроорганизмов встречается комплекс Mycobacterium avium (MAC). Среди других можно назвать М. chelonae и абсцессы М. kansaii, М. fortuitum, и М. xenopi. Эти инфекции протекают менее остро, нежели туберкулез.
7. Исчезает ли после операции при микобактериальных инфекциях необходимость в медикаментозном лечении?
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аутоинфекции туберкулеза. Эндогенный туберкулез.
Весьма важным доказательством патогенетического значения аутоинфекции является уже давно установленный и вновь подтвержденный в последние годы факт: сравнительно высокий риск заболевания вторичным туберкулезом клинически здоровых людей, носителей различных рентгенологически определяемых изменений в легких и внутригрудных лимфатических узлах.
По нашим прежним наблюдениям, а также по данным В. Р. Левина (1971), Н. С. Страхова (1969), Dankova (1972), Edwards (1972) и др., такие лица заболевают активным туберкулезом чаще, чем не имеющие этих патологических изменений. Steinbruck (1972) указывает, что из общего числа заболевших туберкулезом в последнее время в ГДР 42,7 % рекрутировались из 760 000 человек с рентгенологическими изменениями в легких, а 57,3% — из остального населения страны (16,7 млн. человек).
А. Г. Хоменко (1973 г.) на XXII Международной конференции по туберкулезу, состоявшейся в Токио, сообщил, что из большой группы лиц без рентгенологически определяемых изменений в легких заболело 0,005%, а при наличии таковых — 0,2%, причем частота заболеваемости возрастала параллельно степени выраженности очаговых, рубцовых и других патологических изменений в органах дыхания: она составляла, например, 0,1% при минимальных тканевых повреждениях и 0,9% — при более значительных. При этом определенную роль играют их патологоанатомический характер и наличие или отсутствие в них микобактерии. Уже давно установлено, что чаще и скорее обостряются не вполне зажившие казеозные очаги в легких и во внутригрудных лимфатических узлах, в которых обычно в большом количестве находятся высоковирулентные микобактерии туберкулеза. Значительно реже обостряются старые омело-творенные очаги, которые окружены плотной фиброзной капсулой и в которых реже находят микобактерии.
Как показал еще М. Г. Курлов (1888), а позже подтвердили Г. Р. Рубинштейн и М. В. Триус (1933), в старых фиброзных рубцах, в которых нет специфической грануляционной ткани и элементов творожистого некроза, обычно отсутствует и микробная флора, поэтому прививка такого материала лабораторным животным не вызывает у них специфических изменений во внутренних органах. О весьма важном значении эндогенного пути развития вторичного туберкулеза легких свидетельствуют и другие факты: образование очагов диссеминации в результате аденобронхогенного распространения процесса из внутригрудных лимфатических узлов, обнаружение тетрады Эрлиха в мокроте у впервые выявленных больных, возникновение рецидива туберкулеза обычно в зоне ранее образовавшихся очагов и рубцов в легких и т. д.
В то же время при профилактическом приеме изониазида в 65—96% случаев удается предупредить такую эволюцию процесса. Об этом убедительно свидетельствуют сообщенные на XXII Международной конференции по туберкулезу в 1973 г. в Токио результаты коллективного наблюдения над 28 594 взрослыми носителями старых фиброзных изменений в легких, проводившегося в 1969—1972 гг. в 7 странах (Венгрия, ГДР, Польша, Румыния, Финляндия, Чехословакия и Югославия).
Среди принимавших плацебо на 1-м году наблюдения рецидивы туберкулеза с бацилловыделением наступали в 4,4% случаев, между тем как у получавших изониазид в течение 3 мес — в 1,1%, а при приеме его в течение 6—12 мес — лишь в 0,2% случаев. При этом у нелечившихся такое явление отмечалось тем чаще, чем больше были выражены остаточные изменения в легких (Ferebee-Woolpert, 1974).
Таким образом, ведущая роль эндогенной реактивации в патогенезе вторичного туберкулеза на современном этапе — бесспорный факт. Но на этом основании было бы ошибкой игнорировать значение и экзогенной суперинфекции. Так, у 24% от общего числа заболевших в Голландии туберкулезом в возрасте 40—59 лет заболевание возникло в результате первичного заражения, у 38% — в связи с эндогенной реактивацией очагов первичного периода и столь же часто — под влиянием суперинфекции, способствовавшей обострению старых специфических изменений в результате сенсибилизации организма, образования перифокального воспаления вокруг преформированных очагов или лимфо-гематогенной диссеминации (Sutherland, 1972, и др.).
Таким образом, вопрос об эндогенном или экзогенном пути развития вторичного туберкулеза и раньше не решался и теперь не может быть разрешен как альтернатива. Его можно решить только на основе диалек-тическо-материалистического понимания происхождения болезни.
Вместе с тем следует подчеркнуть, что реализация в организме как эндогенной, так и экзогенной суперинфекции возможна лишь при определенных условиях. Весьма важную роль играют при этом естественная (врожденная) устойчивость организма и приобретенный в результате заражения или вакцинации БЦЖ иммунитет. Однако они относительны и изменяются под влиянием различных факторов внешней среды и внутренних свойств организма.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Туберкулез – это бактериальная инфекция. В первую очередь поражаются легкие, однако инфекция может распространяться и на другие органы.
Возбудитель заболевания, Mycobacterium tuberculosis, распространяется от человека к человеку воздушно-капельным путем, – с частицами слюны, которые выделяются в пространство при кашле или чихании. При проникновении в организм здорового человека инфекция может развиваться очень по-разному, в зависимости от иммунного отклика со стороны организма-хозяина.
Достоверно известно, что люди болеют туберкулезом на протяжении тысячелетий, но он по-прежнему остается одной из наиболее летальных инфекционных болезней на земном шаре. По оценкам Всемирной организации здравоохранения (ВОЗ), ежедневно от туберкулеза умирает около четырех тысяч человек; из того же источника известно, что в 2019 году эта болезнь унесла более 1.4 миллиона жизней.
Согласно материалам ВОЗ, глобальная заболеваемость в период с 2015 по 2019 гг снижалась примерно на 2% в год. Вместе с тем, большую тревогу вызывает тенденция к формированию у патогена лекарственной мультирезистентности. Иными словами, предстоит пройти еще долгий и непростой путь, прежде чем человечество сможет искоренить эту опасную инфекцию, – при том, что она является излечимой и поддается профилактике.
На сегодняшний день каждый четвертый человек на земном шаре заражен туберкулезной микобактерией. Однако лишь у 5-15% процентов инфицированных развивается клинически значимая симптоматика; остальные остаются латентными, бессимптомными носителями.
Любой человек с туберкулезом заразен.
Инфицированный человек становится контагиозным (заразным) только в том случае, если у него активно развивается клиническая симптоматика. Это означает, что латентное, пассивное носительство микобактерии исключает передачу туберкулеза. Кроме того, воздушно-капельная передача возможна лишь тогда, когда микобактерия активизируется в легких или носоглотке. Если же процесс развивается активно, но в других органах, таких как почки или позвоночник, передача инфекции очень маловероятна.
Обычно больные туберкулезом перестают быть контагиозными спустя 2-3 недели после начала адекватного лечения.
Туберкулез передается по наследству
Даже в нашу эпоху, когда любая базовая медицинская информация находится в открытом доступе, многие люди продолжают верить в то, что туберкулез передается от родителей детям. Это миф.
Данное заблуждение возникло очень давно; связано оно с тем, что люди, проживавшие в одном доме, часто заболевали одними и теми же болезнями. Но сейчас мы знаем, что микобактерия распространяется иным, не связанным с наследственностью путем, и можем предпринять все необходимые меры предосторожности даже при постоянном тесном контакте с больным.
Возможно, кто-то следит за новостями медицины и читал о том, что последние научные данные не исключают роль генетического фактора. Но проявляется она совсем в другом: присутствие определенного гена может повлиять на то, перейдет ли инфекция в активную форму или останется латентной. А наследование туберкулеза невозможно.
Туберкулез не лечится
Это ложь. Туберкулез успешно лечится и излечивается. Стандартным лечением латентной туберкулезной инфекции в настоящее время остается антибиотик изониазид, который обычно принимается по одной таблетке в день на протяжении 6-9 месяцев.
Больным с активным инфекционным процессом назначается, как правило, комбинация антибактериальных препаратов сроком на 6-12 месяцев. В большинстве случаев изониазид назначают в сочетании с рифампином (рифампицином), пиразинамидом и этамбутолом. Согласно материалам Центров контроля и профилактики заболеваний (CDC), в Соединенных Штатах одобрено к применению и доступно на рынке 10 противотуберкулезных препаратов.
В случаях, когда микобактерия обнаруживает лекарственную мультирезистентность, для эрадикации инфекции может понадобиться комбинация по меньшей мере из шести противотуберкулезных средств.
Туберкулезом болеют только в беднейших странах
Нет, это тоже миф. Туберкулезом болеют повсюду, в том числе и в странах с очень высоким уровнем жизни. Просто в одних регионах мира туберкулез распространен меньше, в других больше.
Туберкулезом можно заразиться через рукопожатие
Туберкулез – заболевание серьезное, и вполне естественно, что люди обеспокоены возможными путями заражения. Эта тревога порождает и некоторые мифы. Но на самом деле, как неоднократно разъясняли CDC, туберкулез НЕ передается через:
— совместное потребление пищи или напитков;
— постельное белье или сиденье унитаза;
— общую зубную щетку.
Туберкулез МОЖЕТ распространяться только в тех случаях, когда человек с активным процессом в легких или горле:
Туберкулез всегда смертелен
Нет, конечно. Туберкулез приводит к летальному исходу только в отсутствие лечения. Современная медицина, квалифицированные врачи-фтизиатры успешно излечивают это заболевание.
Выдающийся микробиолог, Нобелевский лауреат доктор Роберт Кох объявил 24 марта 1882 года, что им идентифицирован возбудитель туберкулеза. Это открытие открыло путь к разработке методов диагностики и лечения опасной инфекции. Сегодня, почти 140 лет спустя, эпидемиологические, клинические, прогностические аспекты проблемы туберкулеза изменились кардинально. И тем не менее, борьба продолжается.
Читайте также:

