Как методом определяют стрептококки
Обновлено: 11.05.2024
При изучении антибиотикограмм сопутствующей микрофлоры стрептококковых инфекций выявлен антибиотик, обладающий бактерицидным действием на сопутствующую микрофлору, но не снижающий репродуктивную активность стрептококков. На основании проведенных исследований предложен способ получения изолированных колоний стрептококков, заключающийся в следующем: для выделения аэробных стрептококков проводят посев исследуемого материала на 5% кровяной МПА, а затем на поверхность питательной среды с посевом наносят диски с гентамицином в количестве 8–9 штук. Через 18–20 часов роста бактерий при температуре 37°С на поверхности плотной питательной среды вокруг дисков с гентамицином наблюдается рост изолированных колоний стрептококков. Для выделения стрептококков, обладающих анаэробными свойствами, предварительно делали посев исследуемого материала на печеночный бульон Китта-Тароцци, а затем через 18–20 часов проводили пересев на 5% кровяной МПА для получения изолированных колоний стрептококков. Предложенный способ позволяет повысить процент выделения стрептококков из исследуемого материала, сократить время проведения микробиологических исследований по выделению изолированных колоний стрептококков.

2. Клиническая лабораторная аналитика. Т. IV. Частные аналитические технологии в клинической лаборатории / под ред. В.В. Меньшикова. – М.: Медицинское информационное агентство, 2004. – 691 с.
3. Лабинская А.С.. Микробиология с техникой микробиологических исследований. – М.: Медицина, 1978. – 394 с.
4. Медицинская микробиология / под ред. В.И. Покровского, О.К. Поздеева. – М.: ГЭОТАР Медицина, 1999. – 1200 с.
6. Медицинская микробиология, вирусология и иммунология / под ред. А.А. Воробьева. – М.: Медицинское информационное агентство, 2004. – 691 с.
7. Национальная концепция профилактики инфекций, связанных с оказанием медицинской помощи. – М.: Минздрав России, 2011. – 22 с.
Стрептококковые инфекции продолжают оставаться в числе наиболее острых проблем здравоохранения во всех странах мира. Бактерии рода Streptococcus классифицируют по антигенным свойствам (на основании имеющихся полисахаридов), выделяя серогруппы, изучают биохимические и гемолитические свойства. Наиболее патогенным для человека является Streptococcus pyogenes группы А, вызывающий у человека гнойно-воспалительные и инфекционно-аллергические заболевания. Диагностика стрептококковых инфекций включает использование бактериоскопического метода, определение стрептококковых антигенов в патологическом материале с помощью ИФА или латекс-агглютинации, бактериологического метода идентификации возбудителей инфекции и серологического метода по определению антител к стрептококкам группы А. В последнее время широко распространен метод ПЦР, позволяющий установить диагноз заболевания в 3 раза чаще по сравнению с классическими бактериологическими методами исследований [1, 2, 4]. Эти данные свидетельствуют о необходимости совершенствования микробиологической диагностики стрептококковых инфекций. Стрептококки колонизируют кожные покровы, слизистые оболочки, носоглотку, желудочно-кишечный тракт и влагалище [5]. Для возбудителей инфекции характерна множественность механизмов и факторов передачи, но наиболее характерен воздушно-капельный механизм передачи. У школьников в холодный сезон года носительство стрептококков в носоглотке достигает 25% [6].
В большинстве случаев возникновение стрептококковых инфекций связано с оказанием медицинской помощи (ИСМП). Причинами роста заболеваемости гнойно-воспалительными стрептококковыми инфекциями являются селекция и формирование госпитальных штаммов, обладающих высокой вирулентностью и множественной лекарственной устойчивостью, что требует совершенствования систем надзора и контроля за ИСМП [7].
Описан общепринятый способ получения чистой культуры стрептококков [6], который имеет следующие недостатки: изолированные колонии можно получить только на 3-й день микробиологического исследования, в процессе культивирования бактерий не удаляется посторонняя сопутствующая микрофлора слизистых оболочек зева и миндалин, на 2-й день пересева материала на кровяной мясопептонный агар (МПА) не всегда удается определить микробы, подозрительные на стрептококк, и поэтому приходится делать пересев на кровяной МПА бактерий, не относящихся к стрептококкам, что требует большего расхода питательных сред для выделения изолированной колонии стрептококков. Известно также, что гемолитические свойства стрептококков не являются диагностическим тестом для выявления патогенных стрептококков. Патогенные стрептококки под влиянием антибиотиков и факторов внешней среды могут утратить гемолитическую активность, что существенно затрудняет выделение стрептококков из исследуемого материала.
Итак, сложность лабораторной диагностики и эпидемиологические предпосылки циркуляции стрептококков в лечебно-профилактических учреждениях (ЛПУ) дают основания для совершенствования методов лабораторной диагностики стрептококковых инфекций.
Цель исследования - повышение эффективности выделения возбудителей стрептококковых инфекций из исследуемого материала при возникновении ИСМП.
Задача исследования. На основании изучения антибиотикограмм сопутствующей микрофлоры стрептококковым инфекциям выявить антибиотик, обладающий бактерицидным действием на сопутствующую микрофлору, но не влияющим на снижение репродуктивной активности стрептококков. Добавление данного антибиотика в питательную среду для роста стрептококков позволит разработать способ получения изолированных колоний стрептококков.
Материал и методы исследования
В период с 1997 по 2011 г. обследовано 5300 больных. В содержимом из зева выделена сопутствующая микрофлора стрептококковой инфекции. Для определения чувствительности выделенной сопутствующей микрофлоры к антибиотикам использовали диско-диффузионный метод. В опытах использовано 16-20 часовых культур бактерий. Концентрацию бактерий доводили по стандарту мутности до 0,5 ед. по McFarland на физиологическом растворе хлорида натрия (рН 7,2-7,4). Приготовленную взвесь вносили на чашки Петри с 5% кровяным МПА в количестве 0,2 мл и равномерно распределяли на поверхности питательной среды. Через 15 минут на поверхность питательной среды наносили диски с антибиотиками. Посевы инкубировали при 37°С в течение 24 часов с последующим определением задержки роста бактерий вокруг дисков с антибиотиками. Использовали следующие диски с антибиотиками: стрептомицин, эритромицин, гентамицин, амикацин, линкомицин, бензилпенициллин, олеандомицин, цефаклор, цефуроксим, цефатоксим, цефалексин.
Предложенный способ получения изолированных колоний стрептококков поясняется графическим материалом. На рисунке представлена схема получения изолированных колоний стрептококков.

Схема получения изолированных колоний стрептококков. Обозначения: 1 - сбор исследуемого материала от больного (слизь из зева и с миндалин), 2-5% кровяной МПА, 3 - среда Кита-Тароцци для выращивания бактерий с анаэробным типом дыхания, 4 - диски с гентамицином, 5 - выросшие изолированные колонии стрептококков на кровяном МПА, обладающих аэробными и анаэробными свойствами
Результаты исследований и их обсуждение
По сравнению с традиционными методами микробиологической диагностики стрептококковых инфекций предложенный способ позволяет уменьшить расход питательных сред, повысить процент выделения стрептококков из исследуемого материала, что позволяет своевременно и в более полном объеме проводить противоэпидемическое расследование и осуществлять мероприятия, направленные на предупреждение возникновения ИСМП стрептококковой этиологии.
Следует отметить, что сложность и низкая эффективность выделения стрептококков из исследуемого материала при диагностике инфекционных заболеваний связана с тем, что сопутствующая микрофлора по сравнению со стрептококками более устойчива во внешней среде, неприхотлива к питательным средам, как правило, обладает антагонистическими свойствами и поэтому при инфекционных заболеваниях выделенную микрофлору от больных часто выделяют и идентифицируют преимущественно из группы условно-патогенной сопутствующей микрофлоры. При обследовании ожоговых больных в популяциях сопутствующей микрофлоры наиболее часто определялся эпидермальный стафилококк.
Итак, стрептококки, в отличие от условно-патогенной микрофлоры и стафилококков, менее устойчивы во внешней среде, часто обладали анаэробными свойствами и медленнее размножались на питательных средах. Поэтому не всегда удается выделять чистую культуру стрептококков традиционными микробиологическими методами.
Предложенный способ позволил повысить процент выделения стрептококков из исследуемого материала, сократить время проведения микробиологических исследований по выделению изолированных колоний стрептококков, уменьшить количество ложноотрицательных результатов исследований и снизить расход питательных сред в процессе лабораторной диагностики стрептококковых инфекций. Сокращение сроков проведения лабораторных исследований позволяет в ранние сроки и в более полном объеме проводить противоэпидемические мероприятия при возникновении ИСМП, вызываемых стрептококками.
Стрептококки группы А. Streptococcus pyogenes. Пиогенные стрептококки. Инфекции вызываемые стрептококками. Эпидемиология стрептококков. Патогенез поражений стрептококками.
Эпидемиология стрептококков
Стрептококки группы А обнаруживают повсеместно. Они часто колонизируют кожные покровы и слизистые оболочки человека, а в холодный сезон частота носительства в носоглотке у школьников может достигать 25%. Резервуаром служит больной человек или носитель; основные пути передачи — контактный (с заносом в рот грязными руками) и воздушно-капельный, а также через инфицированные пищевые продукты, хранящиеся при комнатной температуре (например, молоко).

Инфекции вызываемые стрептококками
Патогенез поражений стрептококками
Первый этап инфекционного процесса — адгезия микроорганизма к эпителию слизистых оболочек. Основные адгезины — липотейхоевые кислоты, покрывающие поверхностные фимбрии. Не менее важную роль в прикреплении к субстратам играют гиалуронидаза, стрептокиназа и стрептодорназа.
Белок М стрептококков [от англ. mucoid, слизистый, так как колонии штаммов-продуцентов имеют слизистую консистенцию] по структуре напоминает фимбрии грамотрицательных бактерий. Белок М— основной фактор вирулентности и типоспецифтеский Аг. AT к нему обеспечивают длительную невосприимчивость к повторному заражению, однако выделяют более 80 сероваров белка М, что значительно снижает эффективность гуморальных защитных реакций. Белок М ингиби-рует фагоцитарные реакции, непосредственно действуя на фагоциты либо маскируя рецепторы для компонентов комплемента и опсонинов, адсорбируя на своей поверхности фибриноген, фибрин и продукты его деградации. Белок также проявляет свойства суперантигена, вызывая поликлональную активацию лимфоцитов и образование AT с низким аффинитетом. Подобные свойства играют существекную роль в нарушении толерантности к тканевым изоантигенам и развитии аутоиммунной патологии.
Капсула стрептококков — второй по значимости фактор вирулентности. Она защищает бактерии от антимикробного потенциала фагоцитов и облегчает адгезию к эпителию. Капсула образована гиалуроновой кислотой, аналогичной входящей в состав соединительной ткани. Соответственно капсула проявляет минимальную иммуногенную активность и не распознаётся как чужеродный агент. Интерес представляет способность бактерий самостоятельно разрушать капсулу при инвазии в ткани за счёт синтеза гиалуронидазы. Роль гиалуронидазы в патогенезе поражений изучена плохо: с одной стороны, она участвует в разрушении соединительнотканной стро-мы, с другой — имеет сходство со многими аутоантигенами и, возможно, участвует в запуске аутоиммунных реакций.
С5а-пептидаза стрептококков — третий фактор патогенности, подавляющий активность фагоцитов. Фермент расщепляет и инактивирует С5а компонент комплемента, выступающий мощным хемо-аттрактантом.
Стрептолизин О стрептококков[от англ. oxygen sensitive, чувствительный к кислороду] проявляет свойства гемолизина, разрушая эритроциты в анаэробных условиях. Проявляет иммуногенные свойства, титры AT к нему имеют прогностическое значение. Стрептолизин S [от англ. stable, устойчивый] резистентен к кислороду, не несёт антигенной нагрузки и вызывает поверхностный гемолиз на кровяных средах. Оба фермента разрушают не только эритроциты, но и другие клетки; например, стрептолизин О вызывает повреждение кардиомиоцитов, а стрептолизин S — фагоцитов, поглотивших бактерии.
Эритрогенные (пирогенные) токсины стрептококков весьма схожи с токсинами стафилококков. Имму-нологически их разделяют на три типа (А, В и С); способность к образованию токсинов детерминирована заражением бактериальной клетки умеренным фагом, несущим ген токсинообразо-вания. Эритрогенные токсины проявляют свойства суперантигенов: оказывают митогенное действие на Т-клетки, а также стимулируют секрецию макрофагами ИЛ-1 и ФНО.
Кардиогепатический токсин стрептококков синтезируют некоторые штаммы стрептококков группы А. Он вызывает поражения миокарда и диафрагмы, а также образование гигантоклеточных гранулём в печени.
Прочие экзоферменты стрептококков. Стрептокиназа (фибринолизин) активирует плазминоген, что приводит к образованию плазмина и растворению фибриновых волокон (фермент не проявляет прямой фибринолитической активности). Гиалуронидаза облегчает перемещение бактерий по соединительной ткани. Роль ДНКазы (стрептодорназа) и НАДаз изучена плохо, но выявление AT к стрептодорназе В используют в диагностике различных осложнений, вызванных стрептококками группы А. Медицинское применение нашла очищенная смесь стрептокиназы, стрепто-дорназы и других протеолитических ферментов стрептококков (стрсптокиназа-стрептодорназа), используемая для рассасывания тромбов, фибринозных и гнойных экссудатов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Микробиологическая диагностика стрептококка. Диагностика стрептококковой инфекции. Выявление стрептококка. Выделение стрептококка.
Основу микробиологической диагностики стрептококковой инфекции составляют выделение и идентификация возбудителя. При этом обычно биохимические характеристики изолятов не изучают. Прочие методы диагностики стрептококковой инфекции имеют различные ограничения.
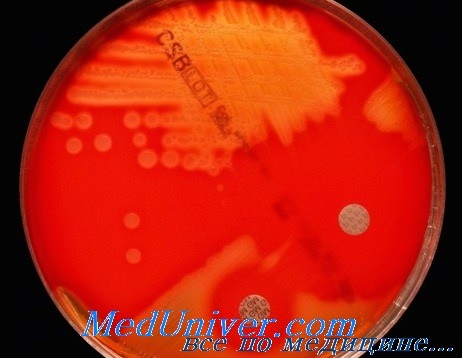
Через 24 ч на КА стрептококки группы А образуют блестящие вязкие колонии (рис. 2, см. цветную вклейку). В жидких средах бактерии дают придонный, иногда поднимающийся вверх рост. Весьма информативные методы раннего выявления стрептококков — определение чувствительности к антимикробным агентам методом дисков.
Наиболее часто их используют для идентификации стрептококков в мазках из зева. Для дифференцировки стрептококков группы А от прочих b-гемолитических стрептококков применяют тест чувствительности к бацитрацину. Более чем в 99% случаев изоляты стрептококков группы А чувствительны к бацитрацину, тогда как представители других серогрупп обычно устойчивы (рис. 12-8). Также можно применить тест чувствительности к триметоприм-сульфаметоксазолу.

Стрептококки групп А и В обычно чувствительны к действию антимикробного агента.
По сравнению с чувствительностью к бацитрацину более специфичен тест гидролиза пиррол идонил-b-нафтиламида (ПИР-тест). S. pyogenes — единственный стрептококк, дающий положительную реакцию. Для этого в пробирки вносят полоски фильтровальной бумаги, пропитанные ПИР. Под действием бактериальных пептидаз ПИР расщепляется до b-нафтиламида, и после внесения 0,01% раствора p-диметиламиноциннамальальдегида полоски окрашиваются в вишнёво-красный цвет.
Стрептококки группы А легко можно выявить в мазках из зева, используя коммерческие наборы; групповой А-Аг экстрагируют химическими реагентами или ферментами и идентифицируют в реакциях латекс-агглютинации, коагглютинации или ИФА. Для экспресс-диагностики ревматического процесса и гломерулонефрита можно определять AT к стрептолизину О или стрептодорназе; серологические исследования также позволяют выявить носителей. Следует помнить, что AT к стрептолизину О не образуются при кожных инфекциях, вызываемых стрептококками группы А.
Лечение стрептококковой инфекции
Основу лечения стрептококковой инфекции составляет адекватная антибактериальная химиотерапия. Лечение ревматизма проводят пенициллинами короткого действия, профилактику — пенициллинами длительного действия (бициллин-5), причём антибиотикопрофилактику предпочтительно проводить круглогодично.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стрептококковые инфекции вызванные Streptococcus pyogenes: диагностика, лечение, профилактика
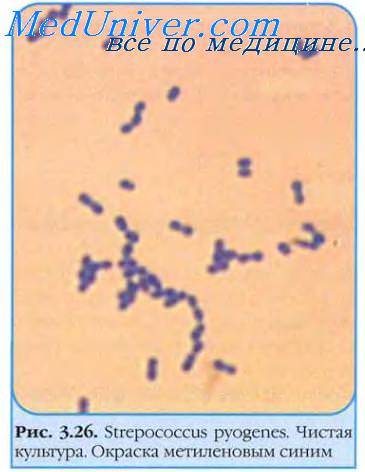
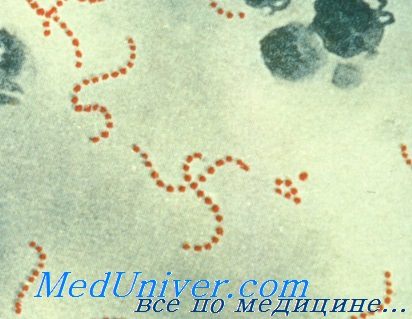
Стрептококки — грамположительные кокки, располагающиеся в микропрепарате в виде цепочки или парами. Факультативные анаэробы требовательны к питательным средам. Хорошо растут на средах с большим содержанием крови. Колонии бета-гемолитического стрептококка на кровяном агаре окружены зоной полного гемолиза, а-гемолитического стрептококка — зоной частичного гемолиза.
Дальнейшая идентификация основана на изучении биохимических и серологических (классификация Лэнсфилд) свойств возбудителя. Исследуемый материал — мазок из зева, раневое отделяемое, кровь и др.
Стрептококковые инфекции вызванные Streptococcus pyogenes
Носительство в глотке S. pyogenes протекает бессимптомно примерно у 5—30% населения. Передача инфекции осуществляется посредством аэрозольного и контактного механизмов. Заражение может произойти в любом возрасте, но чаще всего инфекция возникает у детей.
Патогенез стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes имеет углеводный (полисахаридный) группоспецифический антиген А (антиген Лэнсфилд) и группоспецифический белковый М-антиген, и располагающиеся на поверхности микроорганизма М-протеином (антиген), препятствующий лейкоцитарному фагоцитозу.
Антитела к М-протеину и располагающимся на поверхности микроорганизма М-протеину (антиген) формируют устойчивый иммунитет к последующей инфекции, вызванной микроорганизмами с такими же типами М-протеина. Кроме того, S. pyogenes продуцируют несколько токсинов: эритрогенный токсин (вызывает сыпь при скарлатине) и пирогенные экзотоксины А, В и С. Адгезию обеспечивают рецепторы к фибронектину.
Возбудители способны долгое время персистировать внутри клеток эпителия зева, а потому некоторые антибиотики (не проникающие внутриклеточно) не избавляют пациента от носительства.
Клинические признаки стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes входит в число десяти самых смертоносных возбудителей в мире. Он вызывает три вида патологических состояний:
• Инфекционное заболевание. S. pyogenes — самая частая причина развития бактериального фарингита. Кроме того, он вызывает рожу, импетиго, целлюлит, раневые инфекции и реже некротизирующий фасцит и пневмонию. Иногда развивается септицемия, приводящая к метастазирующим инфекциям (остеомиелит). Инфекционный процесс, обусловленный S. pyogenes, характеризуется острым началом с деструкцией поражённых тканей и быстро прогрессирующим течением.
Неотъемлемой частью патогенеза, развивающегося выраженного интоксикационного синдрома, является способность S. pyogenes продуцировать токсины.
• Токсин — индуцированные синдромы, протекающие на фоне инфекционного заболевания. Инфекционное заболевание, связанное с S. pyogenes, может протекать в виде генерализованного процесса или, оставаясь локализованным, сопровождаться системными проявлениями, связанными с действием экзотоксинов.
Например, действие эритрогенного токсина обусловливает возникновение сыпи при скарлатине, а пирогенные токсины становятся причиной стрептококкового шока, часто приводящего к смерти пациента вследствие полиорганной патологии. • Постинфекционные аутоиммунные заболевания. Перекрёстное взаимодействие антител к антигенам бактерии и структурным компонентам собственных тканей организма иногда приводит к развитию аутоиммунных заболеваний: ревматической лихорадке, гломерулонефриту или узловатой эритеме.
Достаточно редкая в странах с развитой рыночной экономикой ревматическая лихорадка — частая причина смерти и инвалидизации населения в регионах с низким уровнем жизни и нищетой.
Профилактика стрептококковых инфекций вызванных Streptococcus pyogenes
Распространение S. pyogenes в хирургических отделениях и родильных домах происходит достаточно быстро. Именно поэтому больных и носителей стрептококковой инфекции нужно немедленно изолировать в отдельные боксы на срок не менее 48 ч от начала проведения эффективной антибиотикотерапии. Своевременное полноценное лечение позволяет избежать развития вторичных аутоиммунных заболеваний (ревматическая лихорадка).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

