Как описторхоз влияет на волосы
Обновлено: 26.04.2024
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).

20.01.2020
Признаки того, что у вас может быть описторхоз
Сезонные обострения заболеваний желудочно-кишечного тракта вещь неприятная, но только ли они представляют серьезную опасность здоровью?
Симптомы при описторхозе очень легко принять за гастрит, а точный диагноз можно установить только в специальных лечебных учреждениях, в том числе в инфекционных больницах Новосибирска. Однако в нынешних условиях это практически невозможно и небезопасно. Еще более небезопасно заниматься самодиагностикой и самолечением. В нашем медицинском центре разработана специальная программа диагностики и лечения описторхоза, рассчитана она на три дня пребывания в комфортных условиях нашего дневного стационара.
Чем опасен описторхоз?
Паразитируя в желчном пузыре и желчных протоках, двуустка кошачья пожирает слизистую оболочку органов. Постепенно у больного разлаживается нормальный пищеварительный процесс. А дальше – по нарастающей:
- затрудняется отток желчи, формируются сгустки и как следствие – камни;
- начинаются аллергические высыпания непонятно на что;
- воспаляются органы пищеварения, прилегающие к желчному пузырю.
Паразиты оказывают угнетающее действие на развитие плода во время беременности, физическое и умственное развитие ребёнка. Самые страшные вероятные осложнения описторхоза – рак печени, желчного пузыря, поджелудочной железы.
Какие органы и системы больше всего страдают при описторхозе?
Помимо всех органов ЖКТ страдают сердце и сосуды, обмен веществ, нервная система.
Сердце и сосуды: вегето-сосудистая дистония.
Нервная система: тремор конечностей, век, бессонница, нервозность.
Эндокринная система: снижение аппетита, потеря веса, изменение пищевого поведения.
Репродуктивная система: изменение менструального цикла, болезненные месячные.
Яркие клинические проявления бывают при остром описторхозе. Но есть еще и хронический. Как правило, в Сибири описторхоз протекает по первично-хроническому варианту. У жителей Новосибирска клиника обычно крайне скудная, иногда даже отсутствует вообще, и только внимательный врач видит косвенные признаки болезни. Это — кожные проявления, которые то исчезают, то появляются, непонятная слабость без видимой причины, летучие боли в суставах, периодически — дискомфорт в правом подреберье, повышенное количество эозинофилов в общем анализе крови.
Бывает, что человек страдает бронхиальной астмой, аллергическим риносинуситом, полипозом носа, непонятной аллергией, кожными болезнями, болезнями суставов — и даже понятия не имеет, что причина всего этого — паразиты.
Как быстро проявляется описторхоз?
Заражение происходит, когда описторхи попадают в организм человека с пищей. Инкубационный период болезни – до 20 дней. На этой стадии симптомы могут не проявляться, но резко снижается иммунитет. Человек может чувствовать слабость, недомогание, учащенное сердцебиение, повышение температуры тела, сильное потоотделение.
Через 20-30 дней болезнь переходит в стадию хронической. Симптомы при этом схожи с проявлениями хронического холецистита, гастродуоденита, панкреатита, гепатита. Беспокоят приступы боли в правом подреберье, схожие с желчными коликами. Появляется нервозность, нарушения сна, хроническая усталость, часты аллергические высыпания на коже, дрожат руки, веки.
Яркие клинические проявления бывают при остром описторхозе. Период острого этапа заболевания – от нескольких дней до 3 месяцев, иногда дольше. Часто к симптомам присоединяются проявления легочных заболеваний, признаки астматического бронхита. Острый описторхоз у больных часто проявляется увеличением печени, гастроскопия может выявить эрозии и язвы слизистых оболочек и тканей желудка, двенадцатиперстной кишки. Симптомы при описторхозе часто путают с проявлениями других заболеваний, потому процесс постановки правильного диагноза затягивается. Важно вовремя пройти обследования и начать лечение болезни.
Как быть, если есть подозрения на описторхоз?
- Не заниматься самодиагностикой и самолечением. Как можно скорее попасть на приём к гастроэнтерологу!
- По назначению врача сдать необходимые анализы и пройти дуоденальное зондирование.
- Если диагноз подтвержден, пройти курс лечения от описторхоза строго под контролем врача.
Как долго лечат описторхоз?
В течение 3 дней под контролем врача вы будете принимать лекарство для выведения описторхов, внутривенно - лекарства для печени, физиопроцедуры на правое подреберье, а также вам будет предложено специальное лечебное питание, поскольку в клинике нужно будет присутствовать неотрывно в течение дня.
ПРОГРАММА ЛЕЧЕНИЯ ОПИСТОРХОЗА
Вам необходимо иметь при себе результаты этих обследований:
общий анализ крови;
общий анализ мочи;
биохимические анализы крови: АЛТ, АСТ, щелочная фосфатаза, ГГТП, креатинин, глюкоза;
УЗИ органов брюшной полости;
дуоденальное зондирование, либо исследование кала, где выявлен описторхоз (давность не более 1 месяца);
ЭКГ (для пациентов старше 40 лет).
ДЕНЬ 1
8:00 – 20:00
ДЕНЬ 2
8:00 – 12:00
ДЕНЬ 3
8:00 – 12:00
Сдача анализов: общий анализ крови, биохимический анализ крови
Дуоденальное зондирование с промыванием желчных протоков
Физиолечение: ДДТ на область правого подреберья
Физиолечение: ДДТ на область правого подреберья
Внутривенное введение препаратов для печени
Внутривенное введение препаратов для печени
Внутривенное введение препаратов для печени
Выдача заключения и врачебных рекомендаций
Завтрак, обед и ужин
Вас ждут внимательное отношение персонала, тщательное и эффективное лечение, подробное медицинское заключение и важные рекомендации лечащего врача.
Имеются противопоказания. Требуется консультация специалиста
После курса лечения будет сделано контрольное дуоденальное зондирование, вы получите полное медицинское заключение и рекомендации врача, которых нужно придерживаться в течение всей жизни.
В нашей клинике делается все возможное для безопасности наших пациентов: с начала пандемии введен масочный режим, соблюдается социальная дистанция между пациентами, каждый час обрабатываются все рабочие поверхности, наши пациенты могут воспользоваться дезинфектором для обработки рук, проводится термометрия, не принимаются пациенты с симптомами ОРВИ.
Что такое очаговая алопеция? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ерёмина Т. А., дерматолога со стажем в 14 лет.
Над статьей доктора Ерёмина Т. А. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Выпадение волос (алопеция) — это патология, которая характеризуется воспалением в волосяных фолликулах и иногда ногтевых пластинах, а также стойкой или временной нерубцовой потерей волос.
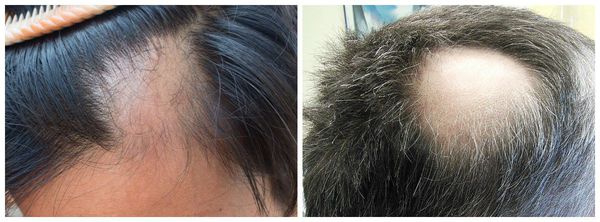
Алопеция по актуальности не уступает многим дерматологическим проблемам. Волосы — придаток кожи, они придают человеку определённый эстетический вид, из-за отсутствия волос возникает косметический дефект, который влечёт за собой снижение качества жизни пациента и проблемы с социальной адаптацией.
Выпадение волос бывает врождённым и приобретённым. Наиболее часто регистрируется приобретённая форма выпадения волос — очаговая, или гнёздная, алопеция (ГА). Гнёздная алопеция также известна как частичное или точечное облысение, волосы могут выпадать не только на голове, но и на теле, бровях и ресницах [1] . Как правило, она возникает спонтанно на фоне полного здоровья.

Алопеция развивается у обоих полов. Определённая роль в развитии патологии отводится факторам риска, к ним относятся:
- заболевания пищеварительного тракта: синдром нарушенного кишечного всасывания, хронический гастрит, ассоциированный с бактерией Helicobacter pylori ;
- инфекции: ОРВИ, грипп, кишечные инфекции и т. д.;
- приём медикаментов: антибиотиков, противовирусных препаратов, нестероидных противовоспалительных препаратов, витаминов группы В и т. д.);
- наследственность, хронические патологии (хронический синусит, тонзиллит, гайморит, хронический кариес и т. д.);
- вредные привычки, недостаток витаминов и микроэлементов (цинка, селена, меди, железа, молибдена и т. д);
- стрессы, депрессия, изменение в мочеполовой системе (воспалительные гинекологические заболевания, приводящие к изменению гормонального обмена): эндометриоз, поликистоз яичников, мультифолликулярные яичники;
- плохое питание, аутоиммунные заболевания (эутериоз, аутоиммунный токсический зоб, заболевания соединительной ткани) [2] .
Очаговая алопеция не заразна. Семейные случаи возможны, если у кого-то из первой линии родства было данное заболевание [6] . Убедительные доказательства взаимосвязи генетики и повышенного риска развития генёздной алопеции были найдены при изучении семей, где двое или более родственников страдали от выпадения волос. Это исследование выявило, по крайней мере, четыре области в геноме, которые, вероятно, содержат эти гены [7] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы очаговой алопеции
Клиническая картина специфична и имеет непосредственную связь с клиническими разновидностями форм очаговой алопеции. Типичными первыми симптомами являются небольшие залысины в виде одного или нескольких чётко очерченных очагов, которые чаще появляются в затылочной области. Количество очагов и их величина могут быть самыми различными (от одного небольшого очага до полной потери волос). На поредевших участках кожа не повреждена и внешне выглядит здоровой. Пятна могут быть различной формы, обычно они круглые или овальные [8] .
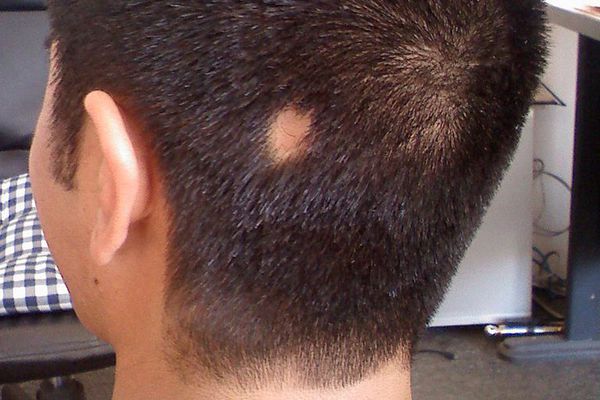
Следующие очаги возникают в отдалении от первого и нередко носят симметричный характер. Они имеют склонность к периферическому росту (увеличению очага по краям), очаги сливаются и образуют большие участки облысения. Выпадение чаще всего наблюдается на коже головы и бороды, но может возникать на любой части тела с волосами [9] .
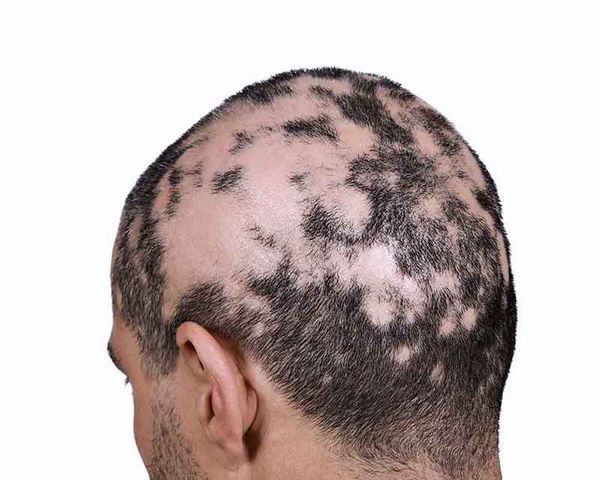
Область выпадения волос иногда сопровождается субъективными симптомами: покалыванием или болезненностью [10] . Волосы обычно выпадают в течение короткого периода времени, причём обычно с одной стороны выпадает больше волос, чем с другой. В очагах часто присутствуют так называемые "конические волоски" с более узким стержнем у корня, этот трихоскопический симптом еще называют "восклицательный знак" [9] . Такие волосы очень короткие (3-4 мм) и могут находиться вокруг проплешин [10] .
Болезнь может перейти в ремиссию на некоторое время или может быть постоянной. Патология имеет доброкачественное волнообразное течение (обратимый характер), волосы, как правило, отрастают на фоне лечения. Но при длительном существовании очагов без терапии волосяные фолликулы (луковицы) атрофируются и процесс приобретает злокачественную затяжную форму (необратимый характер). Зачастую выпадение волос появляется в тандеме с дистрофическими изменениями ногтевых пластин и носит название "трахионихия".
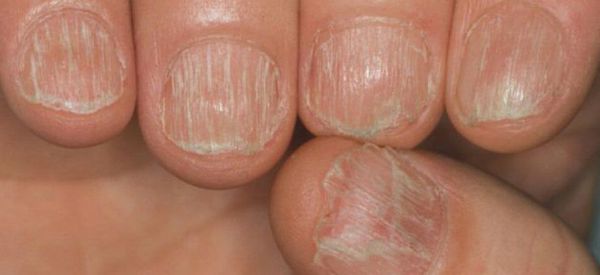
Патогенез очаговой алопеции
Основной механизм патогенеза очаговой алопеции включает разрушение луковиц волоса собственными иммунными клетками [2] . Организм ошибочно атакует собственные анагенные (находящиеся в фазе роста) волосяные фолликулы и подавляет или останавливает рост волос [9] . Например, Т-клеточные лимфоциты (клетки, отвечающие за защитную функцию организма) скапливаются вокруг поражённых фолликулов и в дерме, вызывая воспаление и последующее выпадение волос.
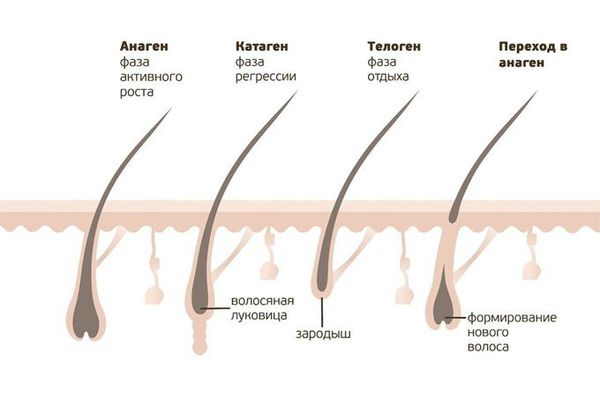
Запускается каскад цепных реакций: нарушение процессов кератинизации (шелушения), деструкция и гибель стержней волос, истощение репаративного (восстановительного) потенциала, затем при длительном течении алопеции (более двух лет) процесс репарации волосяного фолликула сопровождается его атрофией с развитием склеротических изменений (заменой нормальной ткани на соединительную) и склерозированием микрососудов. Было высказано предположение, что волосяные фолликулы в здоровом состоянии защищены от иммунной системы так называемой "иммунной привилегией" [4] [19] .
Развитие алопеции также связано с нарушением усвоения организмом серосодержащих соединений, которые изменяют процесс кератинизации волос и приводят к патологическим изменениям в их структуре [11] .
Классификация и стадии развития очаговой алопеции
Как правило, гнёздная потеря волос включает в себя следующие клинические разновидности:
- Локальная (ограниченная) форма описывает облысение только в одном месте [9][12] . Это может произойти на любом участке волосистой части головы.
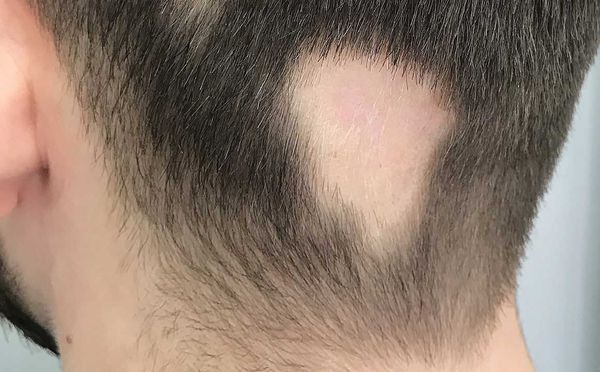
- Субтотальная форма — на голове отсутствует более 40 % волос. При офиазисе (отсутствии волос полностью по краевой зоне роста волос) очаги имеют лентовидную форму, затрагивают всю краевую зону роста волос в затылочных и височных областях по форме волны. При инверсном офиазисе очаги лентовидной формы распространяются на лобно-теменную и затылочные области.
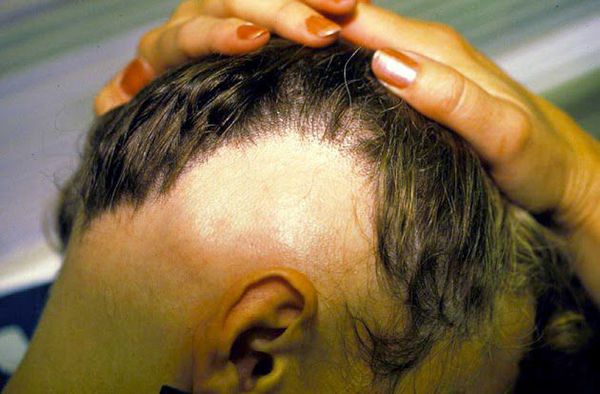
- Диффузная алопеция — волосы выпадают более рассеянно, рассредоточено по всей коже головы [9] .
- Alopecia areata barbae — форма заболевания, при которой выпадение волос ограничивается только бородой [9] .

- Тотальная алопеция (areata totalis, или облысение) — характеризуется полной потерей терминальных (тёмных, жёстких и длинных) волос на волосистой части головы [2] .

- Alopecia areata universalis (универсальная) — такой диагноз ставится, если выпадают все волосы на теле, включая лобковые волосы [2] .
Тотальная и универсальная формы встречаются редко [13] .
Заболевание имеет несколько стадий.
- Активная стадия (проградиентная, прогрессирующая). Во время активной стадии типичные очаги поредения представляют собой участки нерубцового облысения округлой или овальной формы с неизменённым цветом кожи. Для оценки состояния волос проводится тест на натяжение волос. Н еобходимо захватить небольшой пучок волос (50-60 волос) между большим и указательным пальцами и с некоторым усилием, но не очень резко, потянуть волосы. Если в руках остаётся больше 10 % волос (более 6 волос), тест свидетельствует о наличии патологического выпадения волос (положительный тест). Меньшее количество извлечённых волос (до 2 шт.) свидетельствует о физиологическом выпадении волос. Процедуру следует провести в 4 зонах: в теменной области слева и справа, в лобной и затылочной области. В активной фазе заболевания на границах поражений тест на натяжение волос может быть положительным — это зона "расшатанных волос" . На начальном этапе выпадение не затрагивает седые волосы.
- Стационарная стадия — просуществовав 4–6 месяцев, процесс слияния мелких очагов в крупные приостанавливается.
- Стадия регресса — в очагах облысения восстанавливается нормальный рост волос.
Осложнения очаговой алопеции
На сегодняшний день гнёздная алопеция имеет доброкачественное течение. Она не влечёт за собой потерю работоспособности, нарушения общего состояния, инвалидизацию, не требует длительного нахождения в стационарах, но значительно сказывается на качестве жизни и психоэмоциональном состоянии пациентов. Необходимо понимать, что процесс обратим, так как волосяные фолликулы остаются жизнеспособными [15] .
Чаще всего врач трихолог-дерматолог сталкивается с нозогенными реакциями (психогенными расстройствами) своих пациентов: людей с алопецией беспокоит изменение своего внешнего вида и потеря собственной привлекательности, жалость в глазах окружающих; пациенты часто страдают депрессивными, тревожными, социофобическими расстройствами и сенситивными (фобическими) идеями. Чаще всего депрессивные расстройства у пациентов с алопецией проявляются лёгкими формами. Кроме того, у больных могут наблюдаться тревожные расстройства с опасениями возможного прогрессирования облысения и суицидальными наклонностями [16] . Все эти состояния не зависят напрямую от степени выраженности облысения, однако они заслуживают внимания специалистов.
Диагностика очаговой алопеции
Очаговая алопеция обычно диагностируется на основании клинических признаков.
Трихоскопия (исследование волос при помощи трихоскопа, который многократно увеличивает волосы) является основным методом установления данного диагноза. Трихоскопия показывает регулярно распределённые "жёлтые точки" (гиперкератотические пробки), небольшие "восклицательные знаки" и "чёрные точки" (поражённые волоски в отверстии волосяного фолликула) [17] . Для клинической диагностики ГА часто достаточно клинических проявлений в виде очагов выпадения волос и наличия волос, обломанных по типу "восклицательных знаков". Иногда в области облысения может появиться покраснение кожи (эритема) [5] . При эффективном лечении и возобновлении роста волос появляются пушковые волосы.

В редких случаях для постановки диагноза и помощи в лечении облысения требуется биопсия. Она применяется в спорных ситуациях для дифференциальной диагностики с другими заболеваниями и когда лечение не приносит результата. Биопсия позволяет определиться с тактикой лечения и прогнозом заболевания.
Результаты гистологических исследований показывают наличие перибульбарного лимфоцитарного инфильтрата (скопления лимфоцитов) по типу "рой пчёл". Иногда в неактивных зонах облысения воспалительные инфильтраты не обнаруживаются. Ещё одним характерным признаком является недержание пигмента в луковице волоса и фолликулярных стелах (анатомической структуре волосяного фолликула), а также сдвиг в соотношении анаген-телоген в сторону телогена (стадии выпадения волос).
Определённая роль отводится клиническим лабораторным и инструментальным методам исследования. Клинический минимум должен содержать:
- Общий анализ мочи.
- Биохимический анализ крови (АЛТ, АСТ, ГГТ, щелочная фосфатаза, глюкоза, билирубин общий, билирубин прямой, общий белок, холестерин (ЛПВН, ЛПНП), триглецириды, мочевина, креатинин, мочевая кислота, коэфициент атерогенности, гликированный гемоглобин, С-реактивный белок, ревматоидный фактор, С-пептид).
- Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека.
- Определение антигена HBsAg (позволяет выявить гепатит Б).
- Определение антител классов M, G к вирусу гепатита С.
- Проведение реакции Вассермана (анализ крови на сифилис).
- Анализ крови на волчаночный антикоагулянт (специфический маркер такого заболевания, как дискоидная красная волчанка).
- Определение антинуклеарных антител.
- Анализ крови на железо, ферритин, трансферрин, гомоцистеин, фолиевую кислоту, цинк, селен, медь, магний, витамин В12, витамин Д.
- Анализ крови на гормоны: инсулин, гормоны щитовидной железы (ТТГ, Т3 свободный, Т4 свободный, антитела к тиреопераксидазе, антитела к тиреоглобулину).
Такой большой список показателей нужен для того, чтобы разобраться, что именно вызывает потерю волос. Необходимо исследовать каждый обмен веществ: липидный, углеводный, гормональный, белковый и исключить все метаболические нарушения.
По показаниям проводятся:
- Трихологический генетический тест (делается соскоб эпителиальных клеток слизистой полости рта с области щеки в специальную пробирку, где анализируется геном).
- Спектральный анализ волоса на микроэлементы (производится забор волоса с области затылка и отправляется в лабораторию на исследование нехватки или переизбытка микроэлементов).
- Соскоб на грибы с кожи волосистой части головы.
- УЗИ щитовидной железы.
- УЗИ сосудов шеи.
- МРТ головного мозга.
По мере необходимости для исключения очагов хронической инфекции пациент направляется на консультации к смежным специалистам [14] .
Лечение очаговой алопеции
При отсутствии на голове более 25 % волос необходимо осматривать состояние волосяного покрова на туловище и конечностях. Если в данных областях тоже наблюдается выпадение, это необходимо учитывать при выборе метода лечения. Также выбор терапии формируется с учётом формы, стадии, длительности процесса и возраста больного.
Сложность патологии в том, что ни один из существующих терапевтических вариантов не является на 100 % эффективным [18] , но если назначена адекватная терапия, то волосы во многих случаях могут самопроизвольно отрасти.
В некоторых случаях выпадения волос успеха можно достичь при помощи стероидных препаратов (кортикостероидов) в виде крема, мази, лосьона клобетазол, мометазон фуроат и инъекций кортикостероидов. Применение только кортикостероидных кремов на коже в области выпадения не так эффективно и требует больше времени для получения результатов. Стероидные вещества топического (местного) применения обычно используются на небольших зонах выпадения волос. Раствор биматопроста 0,03 % применяется только для бровей и ресниц. Препарат хорошо переносятся, он безопасен и эффективен при выпадении бровей и ресниц [20] [21] .
У применения кортикостероидов есть и недостатки: они часто не могут проникнуть в кожу достаточно глубоко, чтобы повлиять на луковицы волоса [7] . Пероральные кортикостероиды могут уменьшить выпадение волос, но только на период, в течение которого они принимаются, кроме того, эти препараты могут вызвать серьёзные побочные эффекты [7] .
При выпадении волос применяют также миноксидил, различные раздражители (пентоксифиллин, раствор никотиовой кислоты, красный перец), пептидные комплексы, средства стимулирующие рост волос, но только не в прогрессирующую стадию. В более тяжёлых случаях и при отсутствии эффективности лечения топическими стероидами назначают иммунотерапию циклоспорином и/или метотрексатом, иногда их применяют в различных комбинациях.
Физиотерапевтические методы лечения имеют определённую роль в лечении гнёздной алопеции, их применяют для лучшего проникновения лекарственных препаратов к волосяному сосочку. С этой целью назначают электрофорез (лечение микротоками), лазерную терапию, узкополосную фототерапию (лечение узкополосным светом).
Необходимо отметить, что ни одно лечение не является эффективным во всех случаях, и иногда ответа на лечение вообще может не быть. С чем это связано неизвестно.
Прогноз. Профилактика
В большинстве случаев, когда болезнь начинается с небольшого количества участков выпадения волос, волосы отрастают через несколько месяцев, иногда в течение года [8] . Если поражения более обширные, волосы либо отрастают в ответ на лечение, либо продолжают выпадать, вплоть до тотальной или, в редких случаях, универсальной алопеции [8] .
Особенность патологии в том, что спустя какое-то время после успешного лечения, волосы снова могут выпадать. У 85 % больных отмечается более одного эпизода заболевания, периоды ремиссии различны. Эпизоды очаговой алопеции до наступления полового созревания предрасполагают к хроническому течению заболевания [7] . Алопеция иногда становится причиной психологического стресса. Поскольку выпадение волос может привести к значительным изменениям во внешности, люди могут испытывать социальную фобию, тревогу и депрессию. Пациенты с выпадением волос требуют немедленного назначения лечения.
Специфической профилактики алопеции не существует. Рекомендуется вести здоровый образ жизни, правильно питаться, своевременно лечить хронические заболевания. По показаниям следует принимать витаминно-минеральные комплексы. Важно подобрать качественные средства для ухода за волосами, также в качестве метода профилактики можно посоветовать отказаться от плетения тугих косичек.
Какие факторы приводят к нарушению роста волос? Обратима ли алопеция, вызванная токсическим действием лекарственных препаратов? Возможно ли лечение медикаментозной алопеции? Воснове нарушения роста волос (их поредения различной степени выра
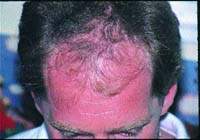 |
Какие факторы приводят к нарушению роста волос?
Обратима ли алопеция, вызванная токсическим действием лекарственных препаратов?
Возможно ли лечение медикаментозной алопеции?
Воснове нарушения роста волос (их поредения различной степени выраженности), а также (реже) развития гипертрихоза лежат многочисленные эндогенные и экзогенные факторы. Среди последних немалую роль играет применение различных медикаментозных средств. При этом выпадение волос может наблюдаться не сразу, а через несколько недель или месяцев после начала приема лекарственного препарата или же начаться (либо стать) более выраженным после его отмены. Обычно при длительном применении того или иного препарата развивается диффузная алопеция, причем в патологический процесс вовлекается почти исключительно волосистая часть головы. Лишь в крайне редких случаях возможно развитие универсального облысения, что, в частности, наблюдается при приеме цитотоксических препаратов, например используемых при наличии у пациента опухолевого процесса.
Однако не во всех случаях выпадение волос определяется длительностью приема какого-либо лекарственного средства. Некоторые препараты, например непрямые антикоагулянты, дают такой эффект только в достаточно высоких дозах, а продолжительность терапии в развитии облысения не имеет существенного значения.
Механизм развития алопеции вследствие проведения какой-либо медикаментозной терапии в настоящее время до конца не ясен. Предполагается [5], что в его основе лежит взаимодействие активных субстанций лекарственных веществ с различными клетками, ответственными за рост волос, а именно фолликулярными кератиноцитами, клетками волосяного матрикса, а также соединительнотканными клетками, окружающими волосяную луковицу и перифолликулярные кровеносные сосуды. Наиболее часто мишенью для токсических эффектов лекарственных веществ становятся кератиноциты волосяных фолликулов. Это, как принято считать, обусловлено тем, что около 90% волосяных фолликулов находятся в фазе анагена, или фазе быстрого роста, а кроме того, интенсивный кровоток в кровеносных сосудах дермы, в частности в зоне волосяного сосочка, способствует повышению биодоступности и в ряде случаев токсичности активных ингредиентов [7, 14].
Помимо этого, кератиноциты волосяных фолликулов обладают выраженной способностью (значительно большей, чем кератиноциты эпидермиса) метаболизировать различные вещества, в первую очередь экзогенной природы [13]. Это обусловлено наличием в волосяных фолликулах различных ферментных систем, в частности цитохрома Р-450, локализованного в наружной мембране митохондрий, мембранах ядра и эндоплазматической сети и осуществляющего окисление неполярных органических соединений путем воздействия молекулярного кислорода. По мнению Boyd et al., 1983 [1], для того, чтобы проявился токсический эффект тех или иных веществ, последние должны взаимодействовать с различными клетками-мишенями после прохождения определенного метаболического пути.
Таким образом, кератиноциты волосяных фолликулов, обладая, с одной стороны, механизмами защиты от повреждающего действия экзогенных веществ и системой их элиминации, с другой стороны, в определенной степени способствуют проявлению токсического эффекта определенных лекарств. Вероятнее всего, что в большинстве случаев имеет место как непосредственное влияние активных субстанций лекарственных средств на митотически активные структуры волосяных фолликулов, замедление скорости кровотока в сосудах дермы и соответственно в волосяном сосочке, так и снижение концентрации в сыворотке крови и тканях липидов и белков и изменение их метаболических путей, а также микроэлементов, необходимых для нормального роста волос, вследствие образования хелатных комплексов, в первую очередь с ионами цинка и меди.
Однако одно и то же химическое соединение (лекарственное вещество) не во всех случаях вызывает развитие алопеции, и степень ее выраженности не всегда одинакова. Возможно, что это связано с особенностями взаимодействия между эндогенными и экзогенными факторами [11, 12].
Диффузная алопеция, обусловленная воздействием лекарственных препаратов, как правило, развивается не внезапно, а в течение нескольких месяцев после определенного латентного периода. В этот период отмечается постепенное уменьшение диаметра волосяной луковицы, замедление скорости роста волос. Развиваются дистрофические изменения волосяного стержня вследствие нарушения биосинтеза протеинов, характерным признаком которого является наличие у отрастающих волос заостренного кончика (по типу писчего пера). При анализе трихограммы у таких пациентов отмечается значительное повышение количества волос, фолликулы которых находятся в фазе телогена (30% и более). Однако провести дифференциальный диагноз между диффузной алопецией, индуцированной лекарственным воздействием на волосяной сосочек, и идиопатическим анагеновым или телогеновым выпадением волос очень трудно, так как данные трихограммы и гистологического исследования неспецифичны. В этих случаях правильной диагностике способствует анамнез. Кроме того, поставить верный диагноз может помочь возобновившееся выпадение волос при повторном назначении лекарственного средства, предположительно являющегося этиологическим фактором.
В большинстве случаев выпадение волос, вызванное применением того или иного лекарственного препарата, обратимо. Как правило, восстановление роста волос отмечается через несколько месяцев после прекращения воздействия этиологического фактора и зависит от степени выраженности изменений в волосяном фолликуле. Несмотря на то что обычно рост волос возобновляется самопроизвольно, по нашему мнению, целесообразно проводить соответствующую терапию, направленную на стимуляцию митотической активности клеток волосяной луковицы, синтез кератина и глобулярных протеинов межфибриллярного матрикса.
Лекарственные средства, прием которых может приводить к развитию облысения, широко используются в клинической практике дерматологов, кардиологов, гинекологов, терапевтов, психиатров и врачей других специальностей. Вообще, алопеция может возникнуть в результате применения любого лекарственного средства. Но было выявлено, что чаще всего усиленное выпадение волос наблюдается на фоне приема следующих групп препаратов [4, 6, 10]: витамин А и его производные; блокаторы бета-адренорецепторов (селективные и неселективные); блокаторы ангиотензин-конвертирующего фермента; антибактериальные препараты; нестероидные противовоспалительные средства; антикоагулянты; производные 6-аминохинолина; тиреостатические препараты; блокаторы гистаминовых Н2-рецепторов; нестероидные антиэстрогенные средства; препараты a-интерферона; производные имидазола; антидепрессанты; противосудорожные препараты; нейролептики; противопаркинсонические препараты; производные гидроксихлорохина; производные триазола; кетоконазол; урикостатические препараты; урикозурические препараты; пероральные контрацептивы; цитостатики; антигельминтные препараты; препараты лития; противогерпетические препараты; допаминомиметики (бромокриптин); депилятории (особенно в случае частого их использования на больных поверхностях); борная кислота.
При этом было отмечено, что из вышеуказанных препаратов значительно чаще диффузная алопеция развивается под влиянием противосудорожных препаратов, антидепрессантов, нейролептиков, витамина А и его синтетических производных, цитостатиков, b-блокаторов.
Так, цитостатические препараты, особенно при назначении их в больших дозах, приводят к практически полному прекращению митотического деления клеток волосяной луковицы.
Антибиотики, противогерпетические и другие средства могут нарушать связь матрикса и волосяного сосочка, что резко уменьшает продолжительность фазы анагена, и, следовательно, волосы значительно быстрее, чем в норме, переходят в фазу катагена, а затем в фазу телогена, что приводит к их интенсивному выпадению. В ряде случаев волосяные фолликулы не вступают в фазы катагена и телогена, а волосы выпадают в фазе анагена [2, 14]. Этот механизм, обусловливающий развитие состояния, называемого анагеновым выпадением волос, точно установлен для антикоагулянтов, препаратов, содержащих литий и борную кислоту. С помощью световой микроскопии по определенным признакам (длине корневой части волоса, наличию внутреннего и наружного корневых влагалищ, наличию или отсутствию пигмента в области волосяной колбы и др.) можно определить, на какой стадии произошло нарушение цикла развития волосяного фолликула.
Уменьшают продолжительность фазы роста (фазы анагена) пероральные контрацептивы [3]. Кроме повышения количества телогеновых волос в трихограмме, появления дистрофических волосяных фолликулов, возможно также изменение формы волосяного стержня (волнистые волосы становятся прямыми). В настоящее время причина этого не выяснена. Можно предположить, что так как форма волосяного стержня определяется наличием дисульфидных связей, образованных между прилежащими друг к другу серосодержащими аминокислотными остатками (в первую очередь цистеина и метионина) в полипептидах, входящих в структуру кератина, то изменение формы волоса происходит в результате полного или частичного разрушения этих связей. Это возможно, в частности, при изменении последовательности аминокислотных остатков, или, иными словами, первичной структуры кератина. Тот факт, что после отмены препаратов этой группы волосы не возвращаются к своему исходному состоянию в течение длительного периода времени (четырех и более лет), позволяет предположить развитие мутации в кератиновых генах. Кроме того, по данным клинических наблюдений, подобные нарушения формы волосяного стержня в основном отмечаются в лобно-теменной области, в то время как в затылочной области волосы сохраняют свой первоначальный вид. Как известно, при андрогенетической алопеции изменения волос (постепенное уменьшение размера волосянного фолликула и диаметра волосяного стержня с последующей заменой жесткого волоса на пушковый) наблюдаются также в лобно-теменной области, а затылочная остается интактной. Можно предположить, что в результате применения пероральных контрацептивов происходят изменения в рецепторном аппарате волосяного фолликула. Изменяется его чувствительность к действию гормонов, как и при андрогенетический алопеции, когда подобные изменения рецепторов детерминированы генетически.
Кроме того, пероральные контрацептивы способствуют снижению концентрации витамина В12 в сыворотке крови [8], что также ухудшает состояние волос.
Прием некоторых препаратов может вызвать избыточный рост волос, вначале пушковых, которые с течением времени трансформируются в жесткие. Этот эффект, который наиболее часто выражен в тех случаях, когда препарат назначается в значительных дозах и длительно, объясняется, вероятно, более быстрым переходом фазы телогена в фазу анагена. К ним относятся: кортикостероиды, миноксидил, циклоспорин А, D-пеницилламин, дифенилгидантоин, псорален.
Побочное действие этих препаратов давало возможность терапии некоторых форм алопеции, однако достигнутый эффект в подавляющем большинстве случаев оказывается нестойким, рецидив заболевания отмечается в среднем через три-четыре месяца после прекращения лечения. Кроме того, следует учитывать, что риск развития тяжелых побочных эффектов, которые наблюдаются практически у всех пациентов, в первую очередь у принимающих такие препараты, как системные кортикостероиды (а также местные при использовании их на больших поверхностях кожи) и циклоспорин А (в том числе и при локальном его применении), значительно превосходит положительное воздействие на течение алопеции.
Читайте также:

