Как отличить глпс от лептоспироза
Обновлено: 22.04.2024
Цель данного обзора состоит в представлении анализа отечественных и иностранных литературных источников, опубликованных за последние 15 лет и посвященных эколого-эпидемиологическим особенностям формирования и функционирования сочетанных очагов циркуляции возбудителей двух социально значимых зоонозных инфекций: лептоспироза и геморрагической лихорадки с почечным синдромом (ГЛПС). В статье большое внимание уделяется экологии возбудителей данных инфекций, акцент сделан на наличие сочетанной инфекции в очагах природного и городского типов, в которых основным резервуаром ортохантавирусов, лептоспир и других важных патогенов человека являются мелкие мышевидные грызуны, в частности в городском очаге такие синантропные грызуны, как серая крыса (Rattus norvegicus). Сходство клинических симптомов лептоспироза и геморрагической лихорадки с почечным синдромом на всех этапах заболевания, наличие атипичных, неклассических форм затрудняют дифференциальный диагноз в очаге одновременной циркуляции ортохантавирусов и лептоспир, что зачастую делает жизненно важным выявление специфических маркеров инфекций. Таким образом, для профилактики этих социально значимых инфекций одним из ведущих решений являются дератизационные мероприятия в местах скопления грызунов с последующей дезинфекцией внеорганизменной популяции патогенов.

1. Лучшев В.И., Лебедев В.В., Жаров С.Н., Бурова С.В. Лептоспирозы // Российский медицинский журнал. – 2009. – № 4. – С. 47–49.
2. Актуальные проблемы геморрагической лихорадки с почечным синдромом / Е.А.Ткаченко [и др.] // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2013. – № 1. – С. 51–58.
3. Manigold T., Vial P. Human hantavirus infections: epidemiology, clinical features, pathogenesis and immunology //Swiss Med. Wkly. – 2014. – № 144: w13937. DOI: 10.4414/smw.2014.13937.
4. International Committee on Taxonomy of Viruses. 2016. Create a new order, Bunyavirales to accommodate nine families (eight new, one renamed) comprising thirteen genera. ICTV online. Code assigned: 2016.030a-vM: 5, 13.
5. Хантавирус Seewis (SWSV) и его природные носители на территории Сибири / Л.Н. Яшина [и др.] // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. – 2012. – № 5. – С. 351–355.
6. Hantavirus reservoirs: current status with an emphasis on data from Brazil / C.R. De Oliveira [et al.] // Viruses. – 2014. – № 5. – P. 1929–1973. DOI: 10.3390/v6051929.
7. Levett Р.N. Leptospirosis // Clin. Microbiol. Rev. – 2001. – № 14 (2). –P. 296–326. DOI: 10.1128/CMR.14.2.296-326.2001.
8. Romero Е.C., Bernardo C.C., Yasuda P.H. Human leptospirosis: a twenty-nine-year serological study in Sao Paulo, Brazil // Rev. Inst. Med. Trop. Sao Paulo. – 2003. – № 45 (5). – P.245–248.
9. Athanazio D.A., Silva E., Santos C.S. Rattus norvegicus as a model for persistent renal colonization by pathogenic Leptospira interrogans // Acta Trop. – 2008. – № 105 (2). – P. 176–180. DOI: 10.1016/j.actatropica.2007.10.012.
10. Цвирко Л.С., Нараленков В.А. Роль мышевидных грызунов и насекомоядных в поддержании лептоспирозной инфекции в очагах Припятского полесья и сопредельных к нему землях // Здоровье для всех. – 2009. – № 2. – С. 31–35.
11. Ramsden C., Holmes E.C., Charleston M.A. Hantavirus evolution in relation to its rodent and insectivore hosts: no evidence for codivergence // Mol. Biol. Evol. – 2009. – № 26 (1). – P. 143–153. DOI: 10.1093/molbev/msn234.
12. Divergent lineage of a novel hantavirus in the banana pipistrelle (Neoromicia nanus) in Cote d’Ivoire. / L. Sumibcay [et al.] // Virol. J. – 2012. – № 9 (34). – P. 1–7. DOI: 10.1186/1743-422X-9-34.
13. Hantavirus in bat, Sierra Leone / S. Weiss [et al.] // Emerg. Infect. Dis. – 2012. – № 18 (1). – P. 159–161. DOI: 10.3201/eid1801.111026.
14. Novel hantavirus identified in black-bearded tomb bats, China / L. Xu [et al.] // Infect. Genet. Evol. –2015. – № 31. – P. 158–60. Doi: 10.1016/j.meegid.2015.01.018.
15. Leptospirosis: a zoonotic disease of global importance / A.R. Bharti [et al.] // Lancet Infect. Dis. – 2003. – № 3 (12). – P.757–771.
16. Schlegel M., Klempa B., Auste B., Bemmann M. Dobrava-Belgrade virus spillover infections, Germany // Emerg. Infect. Dis. – 2009. – № 15 (12). – P. 2017–2020. DOI: 10.3201/eid1512.090923.
17. Reservoir host expansion of hantavirus, China / L.Z. Fang [et al.] // Emerg. Infect. Dis. – 2015. – № 21 (1). – P. 170–171. DOI: 10.3201/eid2101.140960.
18. The hantaviral load in tissues of naturally infected rodents / M. Korva [et al.] // Microbes Infect. – 2009. – № 11 (3). – P. 344–351. DOI: 10.1016/j.micinf.2008.12.016.
19. Life-long shedding of Puumala hantavirus in wild bank voles (Myodes glareolus) / L. Voutilainen [et al.] // J. Gen. Virol. – 2015. –№ 96 (6). – P. 1238–1247. DOI: 10.1099/vir.0.000076.
20. Comparison of mucosal, subcutaneous and intraperitoneal routes of rat Leptospira infection / A.L. Zilber [et al.] // PLoS. Negl. Trop. Dis. – 2016. – № 10 (3). – P. 1–14. Doi: 10.1371/journal.pntd.0004569.
21. Infections by Leptospira interrogans, Seoul virus, and Bartonella spp. among norway rats (Rattus norvegicus) from the urban slum environment in Brazil / F. Costa [et al.] // Vector Borne Zoonotic Dis. – 2014. – № 14 (1). – P. 33–40. DOI: 10.1089/vbz.2013.1378.
22. Prolonged survival of Puumala hantavirus outside the host: evidence for indirect transmission via the environment / E.R. Kallio [et al.] // J. Gen. Virol. – 2006. – № 87 (8). – P. 2127–2134. DOI: 10.1099/vir.0.81643-0.
23. Сочетанность природных очагов туляремии, лептоспироза и хантавирусной инфекции в экосистемах Приморского края / А.В. Алленов [и др.] // Тихоокеанский медицинский журнал. – 2008. – № 2. – С. 40–43.
24. Боровская Н.А., Иванис В.А., Слонова Р.А. Сочетанный очаг лептоспироза и хантавирусной инфекции в Приморском крае // Дальневосточный журнал инфекционной патологии. – 2008. – № 13. – С. 189–190.
25. Multiple co-infections of rodents with hantaviruses, leptospira, and babesia in Croatia / A. Tadin [et al.] // Vector-Borne Zoonotic Dis. – 2012. – № 12 (5). – P. 388–392. DOI: 10.1089/vbz.2011.0632.
26. Leptospirosis versus hantavirus infections in the Netherlands and in Belgium, 2000 to 2014 / J. Clement [et al.] // Euro Surveill. – 2014. – № 19 (38). – P. 1–2. DOI: 10.2807/1560-7917.ES2014.19.38.20912.
27. Concomitant leptospirosis-hantavirus co-infection in acute patients hospitalized in Sri Lanka: implications for a potentially worldwide underestimated problem / N.P. Sunil-Chandra [et al.] // Epidemiol. Infect. – 2015. – № 143 (10). – P. 2081–2093. DOI 10.1017/S0950268814003707.
28. Vector-borne infections, Mali / D. Safronetz [et al.] // Emerg. Infect. Dis. – 2016. – № 22 (2). – P. 340–342. DOI: 10.3201/eid2202.150688.
29. Acute kidney injury and thrombocytopenic fever-consider the infrequent causes / C.S. Haas [et al.] // Am. J. Emerg. Med. – 2013. – № 31 (2). – P. 441.e5-441.е9. DOI: 10.1016/j.ajem.2012.04.007.
30. Hantavirus infection mimicking leptospirosis: how long are we going to rely on clinical suspicion / N.J. Dahanayaka [et al.] // J. Infect. Dev. Ctries. – 2014. – № 8 (8). – P. 1072–1075. DOI 10.3855/jidc.4115
31. Gamage C.D., Sarathkumara Y.D. Chronic kidney disease of uncertain etiology in Sri Lanka: are leptospirosis and Hantaviral infection likely causes // Med. Hypotheses. – 2016. – № 91. – P. 16–19. DOI: 10.1016/j.mehy.2016.04.009.
32. Особенности клинических проявлений геморрагической лихорадки с почечным синдромом (ГЛПС) в Приморском крае / В.И. Афанасьева [и др.] // Дезинфекционное дело. – 2011. – № 2. – С. 22–25.
33. Leptospirosis presenting as acute respiratory distress syndrome (ARDS) in sub-Himalayan region / V. Chauhan [et al.] // J. Assoc.Physicians India. – 2010. – № 58. – P. 390–391.
34. Himsworth C.G., Parsons K.L., Jardine C., Patrick D.M. Rats, cities, people, and pathogens: a systematic review and narrative synthesis of literature regarding the ecology of rat-associated zoonoses in urban centers // Vector-Borne Zoonotic Dis. – 2013. – № 13 (6). – P. 349–359. DOI: 10.1089/vbz.2012.1195.
35. Urban epidemic of severe leptospirosis in Brazil. Salvador Leptospirosis Study Group / A.I. Ko [et al.] // Lancet. – 1999. – № 354. – P. 820–825.
36. Coinfection with four genera of bacteria (Borrelia, Bartonella, Anaplasma, and Ehrlichia) / J. Sun [et al.] // Vector Borne Zoonotic Dis. – 2008. – № 8 (6). – P. 791–795. DOI: 10.1089/vbz.2008.0005.
37. Вопросы организации мониторинга природных очагов инфекций, опасных для человека, планирование, проведение и анализ результатов полевых наблюдений / Д.В. Транквилевский [и др.] // Здоровье населения и среда обитания. – 2014. – № 8. – С. 38–44.
Геморрагическая лихорадка (ГЛПС) и лептоспироз (ЛС) относятся к нетрансмиссивным зоонозным болезням человека, и социально-экономическая значимость этих инфекций определяется, прежде всего, появлением новых и активностью уже существующих очагов, отсутствием тенденции к снижению заболеваемости и периодически регистрируемыми вспышками, а также сложностью ранней дифференциальной диагностики и отсутствием эффективных способов профилактики. Высокий социально-экономический ущерб, наносимый этими заболеваниями, обусловлен развитием тяжелых осложнений, длительной потерей трудоспособности и высокой стоимостью госпитального лечения [1, 2].
Возбудители ГЛПС, ортохантавирусы – оболочечные вирусы, содержащие отрицательно заряженную одиночную цепь РНК, составляют род Ortohantavirus в семействе Hantaviridae, порядок Bunyavirales [3, 4]. Основными резервуарными хозяевами хантавирусов в природных очагах являются мелкие млекопитающие разных видов: 51 вид грызунов отряда Rodentia (мыши, полевки, крысы, хомяки и т.д.), 20 видов насекомоядных землероек и кротов (отряд Soricomorpha), 7 видов летучих мышей (отряд Chiroptera). Во всем мире генетически идентифицировано более 80 ортохантавирусов, 41 для 25 из них доказана роль в патологии человека [2, 5, 6]. В синантропных очагах ортохантавирусной инфекции во всем мире и в России ведущая роль резервуара возбудителя принадлежит серой крысе Rattus norvegicus (отряд Rodentia, семейство Muridae, род Rattus, Berkenhout, 1769).
Лептоспиры принадлежат к роду Leptospira семейства Leptospiraceae, в зависимости от резервуара, в котором они обитают, выделяют вид патогенных лептоспир (interrogans), паразитирующих у животных - носителей, и сапрофитический вид (biflexa) – свободноживущие особи. По антигенной структуре патогенные лептоспиры делят на серологические группы – серовары, описано более 300 сероваров, патогенных для человека лептоспир. Как и для ортохантавирусов, основным резервуаром лептоспир являются дикие грызуны, включая серую крысу, которая, как полагают, является основным источником инфекции для людей и других, в том числе домашних животных, например собак [7–9]. В природных очагах инфекции среди мышевидных грызунов лептоспиры чаще всего обнаруживаются у желтогорлой мыши (9,74 %), рыжей полевки (6,51 %), полевки-экономки (5,31 %), полевки обыкновенной (5,08 %) и мыши лесной (4,96 %). Среди насекомоядных животных высокий процент (7,09 %) инфицированности отмечен у бурозубки обыкновенной. Доминирующей серогруппой лептоспир, выделяемой от диких и синантропных грызунов, является icterohaemorrhagiae (39,3 %) [10].
Несмотря на широкий спектр хозяев и ортохантавирусам и патогенным лептоспирам свойственна гостальная специфичность. Возбудители отдельных серотипов/сероваров циркулируют преимущественно в популяциях животных одного вида или ограниченного круга видов, являющихся основными резервуарами инфекции: каждый тип ортохантавируса в процессе коэволюции адаптировался к уникальному виду природного хозяина [11–14]. Также показана специфическая ассоциация крыс и лептоспир серогруппы icterohaemorrhagiae, наиболее частого возбудителя инфекции у людей, кроме того, серовар copenhageni встречается чаще у серой крысы, hardjo у крупного рогатого скота (КРС), canicola у собак, tarassovi у свиней и КРС, grippotyphosa – у серых полевок, КРС [15].
Еще одним немаловажным фактом является то, что и ортохантавирусы и лептоспиры вызывают у своих природных хозяев – грызунов бессимптомную инфекцию, характеризующуюся длительным выделением возбудителя в среду. Процесс непрерывной циркуляции патогенных лептоспир в природе обеспечивается их способностью к колонизации эпителия извитых канальцев коркового слоя почек теплокровных хозяев, у которых формируется хроническое, часто пожизненное лептоспироносительство, сопровождаемое выделением лептоспир с мочой [15]. Ортохантавирусная инфекция у грызунов протекает также в виде пожизненной, латентной персистентной инфекции, с постоянным выделением вируса с калом, мочой и слюной в окружающую среду. Однако в отличие от лептоспир основными клетками мишенями размножения ортохантавируса является эндотелий сосудов разных органов и тканей, в том числе и почек [18, 19].
Заражение ортохантавирусом людей и грызунов происходит, в основном при вдыхании аэрозолированных экскретов, контаминированных вирусом, у грызунов второстепенную роль играет прямой контакт (в том числе через раны при выражении агрессии). Инфицирование лептоспирами людей и животных также происходит при непрямом контакте с контаминированными субстратами окружающей среды. Кроме того, распространение лептоспир в популяциях крыс также может происходить и при прямом контакте (конъюнктивальный, подкожный, накожный, внутрикожный) [20], хотя проникновение лептоспир через слизистую при проглатывании контаминированной воды считается наиболее эффективным путем заражения. Данные Costa et al. [21] об инфицировании лептоспирами более молодых серых крыс и с меньшей массой тела, по сравнению с особями, инфицированными ортохантавирусом Seoul и Bartonella spp., предполагают различия в динамике передачи этих патогенов.
Очень важно, что лептоспиры и ортохантавирусы сохраняют свою жизнеспособность в течение определенного периода времени в окружающей среде [15, 22], и, хотя для выживания обоих патогенов оптимальными показателями являются высокая влажность и нейтральный показатель рН среды, для лептоспир благоприятными считаются высокие температуры, а для ортохантавирусов, как и для большинства вирусов – низкие. Поэтому большая часть случаев лептоспироза регистрируется преимущественно в тропических и субтропических регионах, а ортохантавирусная инфекция более распространена в умеренных широтах.
Однако в связи с быстрой урбанизацией, глобальным потеплением и экстремальными климатическими событиями (наводнения) увеличение активности сочетанных (природных или городских) очагов лептоспироза и ортохантавирусной инфекции приобретает актуальность и для регионов с более умеренным климатом.
Так сочетанные природные очаги лептоспирозной и ортохантавирусной инфекции выявлены на Дальнем Востоке России, где основными носителями обоих возбудителей являются полевая мышь – носитель патогенного для человека ортохантавируса Hantaan и дальневосточная полевка Microtus fortis (отряд Rodentia, семейство Cricetidae, род Microtus, Buchner 1889), резервуар ортохантавируса Fusong, вируса с пока не выясненной для человека патогенностью [23, 24].
Очаг одновременной циркуляции ортохантавирусной инфекции и лептоспироза в популяциях диких грызунов выявлен в Хорватии: 46 % исследованных особей желтогорлой мыши Apodemus flavicolis (отряд Rodentia, семейство Muridae, подсемейство Murinae, род Apodemus, Melchior, 1834) были инфицированы лептоспирами и 71 % ортохантавирусами, причем у 14 % исследованных грызунов обнаружена одновременная инфекция ортохантавирусом Dobrava и лептоспирами серогрупп australis и grippotyphosa [25].
Как при многих инфекциях, большая часть случаев ГЛПС и лептоспироза протекает субклинически или очень легко, так что за медицинской помощью обращаются только лица со среднетяжелой и тяжелой формами. Частыми симптомами, наблюдающимися у 80 % пациентов при обеих инфекциях, являются лихорадка, миалгия, головная боль, реже встречаются тошнота, рвота, артралгии, боль в области живота. Типичные формы с проявлением желтушного синдрома встречаются примерно у 5 % больных с лептоспирозом [7] и сопровождаются умеренным повышением уровней трансаминаз и щелочной фосфатазы. В то же время по данным В.И. Верхотуровой [32] при ортохантавирусной инфекции, вызванной вирусами Seoul или Hantaan, синдром гепатита (желтушный синдром, гипербилирубинемия) выявлен у 25 %, а гепатомегалия у 60 % – 80 % обследованных пациентов. Другим общим для лептоспироза и ГЛПС синдромом является острая почечная недостаточность. Как и при ГЛПС, при лептоспирозе может наблюдаться петехиальная сыпь и описаны случаи лептоспироза у путешественников, вернувшихся из Африки, с клиническими симптомами, напоминающими вирусные геморрагические лихорадки [7]. Еще одним фактором, затрудняющим клиническую дифференциацию этих двух инфекций, является вовлечение дыхательной системы разной степени тяжести, вплоть до острого респираторного дистресс-синдрома взрослых [3, 33].
Учитывая глобальное распространение серых крыс – носителей патогенных для человека ортохантавируса Seoul и лептоспир и других важных, в том числе особо опасных патогенов, таких как бактерии (Yersina pestis, Rickettsia typhi, Bartonella spp., Streptobacillus moniliformis) и паразиты (Angiostrongylus cantonensis, Chen, 1935) [34], а также концентрацию грызунов этого вида на ограниченных территориях крупных, в том числе портовых городов [35], такие очаги – это наиболее важные с точки зрения возможности наличия микст-инфекций территории.
Данные о наличии ко-инфекций возбудителей зоонозов у животных – резервуаров и их векторов многочисленны. Особенно это касается клещевых инфекций, одним из примеров многочисленных микст-инфекций является выявление в клещах Ixodes sinensis в Китае бактерий четырех родов Borrelia, Bartonella, Anaplasma и Ehrlichia) [36]. В сочетанных очагах имеют место и многообразные взаимодействия возбудителей, которые не препятствуют совместному развитию эпизоотических процессов, а общая паразитарная система обеспечивает сохранение в природе возбудителей лептоспироза и ортохантавирусов в очагах такого типа [37].
Таким образом, наличие природных и городских очагов, характеризующихся одновременной циркуляцией возбудителей таких опасных заболеваний, как геморрагическая лихорадка с почечным синдромом и лептоспироз, общность источника – природного резервуара, путей передачи возбудителя, значительное сходство клинических симптомов существенно затрудняет дифференциальную диагностику этих природно-очаговых инфекций, без лабораторного подтверждения специфической природы заболевания. Использование истребительных мероприятий, позволяющих снизить популяцию грызунов – носителей разных возбудителей инфекций, в совокупности с мерами дезинфекции, уничтожающими внеорганизменную популяцию патогенов, может существенно снизить уровни заболеваемости как вирусными, так и бактериальными зоонозами.
Еще один феномен, не рассматриваемый в данном обзоре, но чрезвычайно интересный: взаимодействие разных патогенов на организменном и/или популяционном уровне хозяев при одновременной инфекции, степень воздействия и влияние на состояние пациентов остается неизученным и требует проведения дальнейших экспериментальных исследований.
Что такое лептоспироз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Лептоспироз (болезнь Васильева — Вейля, водная лихорадка, нанукаями) — острое инфекционное заболевание, вызываемое патогенными бактериями рода Leptospira, поражающими печень, почки, мышцы, лёгкие, центральную нервную системы (ЦНС), селезёнку и другие органы.
Клинически характеризуется синдромом общей инфекционной интоксикации, увеличением печени и селезёнки, распадом мышечной ткани и почечными синдромами. Летальность составляет (даже в случае своевременно начатого лечения) до 40%.
Этиология
Виды — L. interrogans (около 200 серотипов) и L. biflexa (сапрофит)
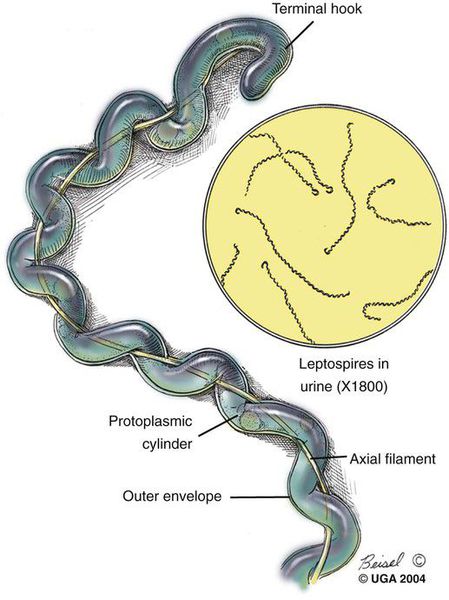
Возбудитель лептоспироза — грамм-отрицательная бактерия-спирохета, которая имеет спиралевидную форму, концы закручены в виде крючков, количество завитков зависит от длины (в среднем 20). Обладают многообразной подвижностью (тип движения — вращательно-поступательный), с которой связана их высокая инвазионная способность (внедрение в организм через клеточные и тканевые барьеры). Способны быстро перемещаться в направлении более вязкой среды.
Факторы патогенности
Бактерии рода Leptospira углеводы не ферментируют. Имеется эндотоксин, а также некоторые факторы патогенности: гиалуронидаза, фибринолизин, гемолизин и другие.
Содержит антигены: белковый соматический (определяет видовую специфичность) и поверхностный полисахаридный (определяет группы и серовары).
Выращиваются на средах, включающих сыворотку крови. Строгие аэробы, то есть существуют только в условиях кислородной среды. Являются гидрофилами: важное условие для жизни — повышенная влажность окружающей среды. Растут медленно (5-8 дней). При серебрении приобретают коричневый или чёрный цвет, по Романовскому — Гимзе окрашиваются в розовый или красноватый цвет.
Относительно неустойчивы во внешней среде, при кипячении или подсушивании погибают мгновенно, под воздействием дезинфектантов — в течении 10 минут. При низких температурах, например, в замороженном мясе сохраняются до 10 суток, летом в пресноводных водоёмах — до одного месяца, во влажной почве — до 270 суток, в молоке — до одного дня, в почках животных при разделке и охлаждении (0-4°C) — до одного месяца. [2] [3]
Жизненный цикл лептоспиры:

Эпидемиология
Зоонозное заболевание. Очень распространён (убиквитарен).
Источник инфекции — дикие грызуны и насекомоядные животные (инфекция протекает бессимптомно), лисицы, домашние животные (коровы, овцы, козы, собаки, лошади, свиньи, являющиеся антропургическими очагами, у которых инфекция может протекать в различных клинических формах, в том числе носительства), выделяющие лептоспир при мочеиспускании в природную среду. Больной человек теоретически может быть заразен.
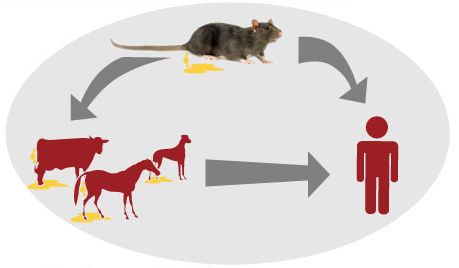
Как передаётся лептоспироз
Механизм передачи: фекально-оральный (алиментарный, водный, контактно-бытовой) и контактный (разделка мяса, купание, хождение босиком по влажной почве), иногда инфекция передаётся аспирационным путём (правильнее говорить — воздушно-пылевым). Случаи трансмиссивной передачи, т. е. через укусы кровососущих насекомых, не описаны, хотя при повреждении кожи риск заражения повышается.
Водная лихорадка имеет профессиональный характер, болеют преимущественно дератизаторы (специалисты по уничтожению грызунов), доярки, фермеры, пастухи, лесники, охотники, ветеринары, шахтёры, а также купальщики в лесных и луговых водоёмах.
Характерна летне-осенняя сезонность.
Иммунитет стойкий, типоспецифический. [1] [3]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы лептоспироза
Инкубационный период — от 4 до 14 дней. Начало острое.
- синдром общей инфекционной интоксикации (с лихорадкой постоянного типа);
- гепатолиенальный синдром (увеличение печени и селезёнки);
- синдром рабдомиолиза (разрушение и гибель клеток скелетной мышечной ткани);
- синдром поражения почек (ведущий синдром заболевания);
- менингеальный синдром (вовлечение в патологический процесс мозговых оболочек);
- синдром нарушения пигментного обмена (желтуха) — с его появлением состояние ухудшается;
- геморрагический (в том числе с лёгочным кровотечением);
- экзантемы (кожные высыпания);
- поражения дыхательной системы (пневмония);
- поражения сердечно-сосудистой системы (миокардит).
Начало заболевания характеризуется внезапным повышением температуры тела до 39-40°C (продолжительность до 10 дней), сопровождающееся потрясающим ознобом, нарастающей головной болью, бессоницей, нарушением аппетита, тошнотой и выраженной жаждой. Появляются боли в мышцах (преимущественно в икроножных), позже присоединяется желтушность кожи и слизистых оболочек, высыпания на коже различного характера.
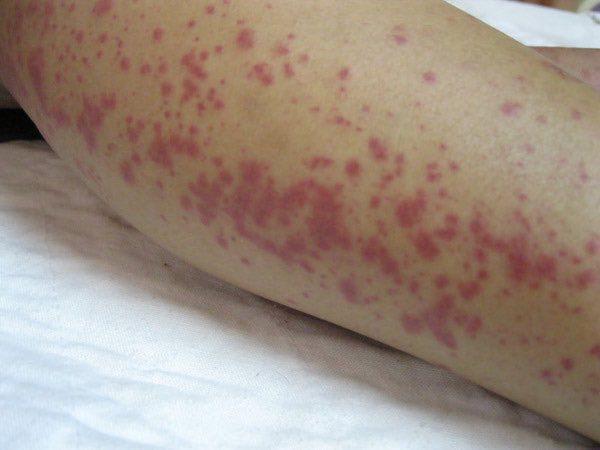
На 3-6 сутки появляются высыпания на туловище и конечностях (сыпь различного характера – пятнисто-папулёзная, мелкопятнистая, мелкоточечная, петехиальная, эритематозная с тенденцией к слиянию; после разрешения оставляет шелушение).
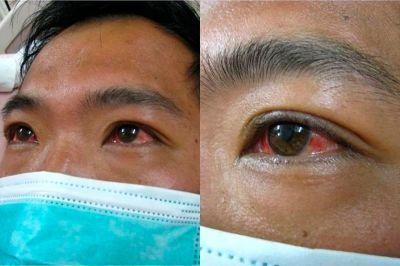
При развитии желтухи на 3-5 день появляется желтушное окрашивание кожи различной интенсивности, иктеричность (желтушность) склер, темнеет моча.
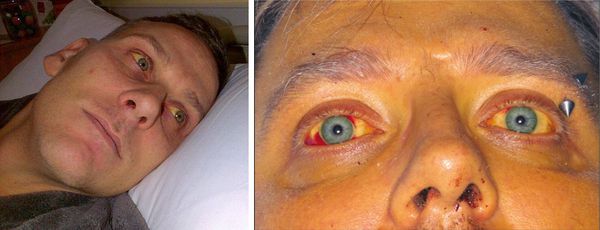
Характерным признаком является выраженная болезненность икроножных мышц, особенно при надавливании на них, а также ограничение подвижности больного из-за боли. Периферические лимфоузлы не изменяются. Со стороны сердечно-сосудистой системы наблюдается тахикардия, понижение артериального давления, глухость сердечных тонов. Возможно развитие ринофарингита и пневмонии.
К 3-4 дню увеличиваются размеры печени и селезёнки, из-за кровоизлияний появляются боли в животе. При фарингоскопии наблюдается умеренная гиперемия слизистой оболочки ротоглотки, иногда энантема (сыпь на слизистых оболочках), язык сухой, покрыт жёлто-коричневым налётом. Характерна олигоанурия (снижение количества выделяемой мочи), тёмная моча, болезненность при поколачивании по поясничной области.
Для заболевания при отсутствии адекватного лечения характеры рецидивы (через 2-7 дней нормальной температуры тела возобновление клинических проявлений) и обострения (на фоне течения заболевания усиление клинической симптоматики).
После болезни характерна длительная астения (нервно-психическая истощённость), мышечная слабость (резидуальные явления), возможно формирование хронической почечной недостаточности.
Лептоспироз при беременности
Лептоспироз у беременных протекает крайне тяжело: возникает высокий риск выкидыша, острой почечной недостаточности, ДВС-синдрома и смертельного исхода. [1] [2] [4]
Патогенез лептоспироза
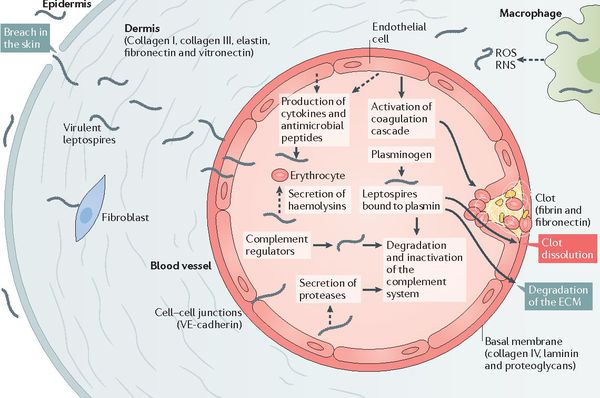
После мнимого благополучия происходит вторичный выброс лептоспир и их токсинов в кровь (при разрушении первичным звеном иммунной системы), что обуславливает начало клинических проявлений заболевания. Яды и продукты жизнедеятельности лептоспир воздействуют на стенку капилляров, что повышает их проницаемость и нарушает функционирование. Глобальный капилляротоксикоз ведёт к возникновению геморрагического синдрома (избыточной кровоточивости). Возникают кровоизлияния в надпочечники, что ведёт к острой надпочечниковой недостаточности.
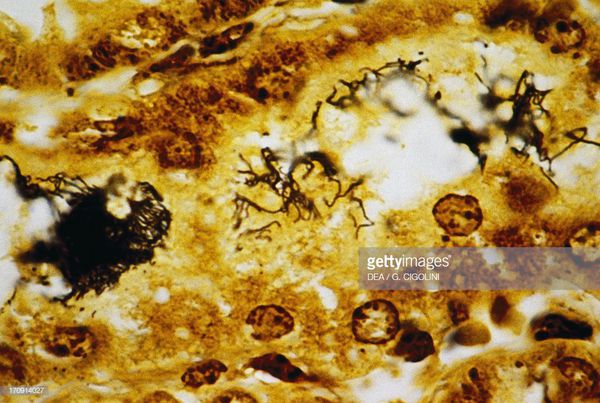
Появление желтухи обусловлено отёком, деструктивно-некротическими поражениями паренхимы (ткани печени) и распадом эритроцитов посредством гемолизинов. В почках повреждается эпителий почечных канальцев и всех структурных слоёв, что проявляется нарушением образования и экскреции мочи, доходя до стадии острой почечной недостаточности. Иногда происходит проникновение лептоспир через гематоэнцефалический барьер и развитие бактериального поражения оболочек мозга (формирование менингита). Поражаются скелетные мышцы (рабдомиолизис), особенно икроножные. Через 4-6 недель при благоприятном течении формируется иммунная защита и происходит элиминация (устранение) возбудителя. Хронизация инфекции не характерна. [2] [4]
Классификация и стадии развития лептоспироза
По степени тяжести:
- тяжелый (выраженная желтушное окрашивание кожи, тромбогеморрагический синдром, острая почечная и надпочечниковая недостаточность, менингит, часто так называемый синдром Вайля — лептоспироз с сильной лихорадкой, выраженным синдромом общей инфекционной интоксикации, снижением гемоглобина и синдромом нарушения пигментного обмена);
- средней тяжести;
- лёгкой степени тяжести.
По клинической форме:
- типичная;
- геморрагическая;
- желтушная;
- ренальная (почечная);
- менингеальная;
- смешанная.
Классификация по МКБ-10:
- А27.0 Лептоспироз желтушно-геморрагический;
- А27.8 Другие формы лептоспироза;
- А27.9 Лептоспироз неуточнённый.
По наличию осложнений:
- без осложнений;
- с осложнениями (инфекционно-токсический шок, острая почечная недостаточность, острая надпочечниковая недостаточность, ДВС-синдром и другие). [1][5]
Осложнения лептоспироза
- острая почечная недостаточность (олигоурия, анурия, рост уровня креатинина); , менингоэнцефалит, полиневрит;
- миокардит; ;
- ирит, увеит, иридоциклит (глазные осложнения);
- отит (воспаление уха);
- у детей может наблюдаться повышение артериального давления, холецистит и панкреатит;
- синдром Кавасаки (развитие миокардита, сопровождающегося водянкой желчного пузыря, экзантемой, покраснением и припухлостью ладоней и подошв с последующей десквамацией кожи). [1][2]
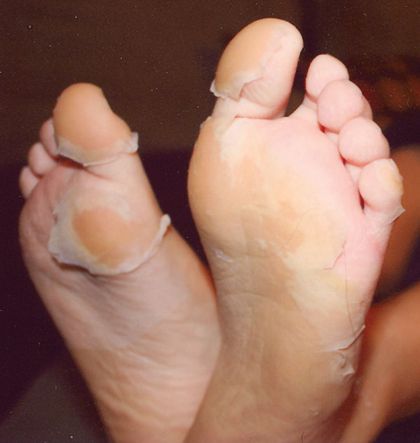
Диагностика лептоспироза
- клинический анализ крови (нейтрофильный лейкоцитоз со сдвигом влево, лимфопения, анэозинофилия, повышение СОЭ, анемия, тромбоцитопения);
- общий анализ мочи (анурия, протеинурия, цилиндрурия, лейкоцитурия, эритроцитурия);
- биохимический анализ крови (билирубинемия преимущественно за счёт непрямой фракции, снижение протромбинового индекса, повышение АЛТ, АСТ, КФК-ММ, ЛДГ общ, ЩФ, креатинина, СРБ);
- люмбальная пункция при менингите (цитоз до 500 кл в 1 мкл, нейтрофильный плеоцитоз, повышение белка);
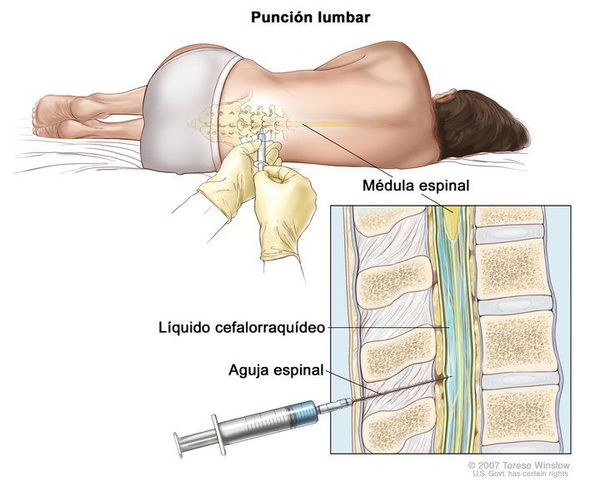
- бактериальный посев на листерии (материал — кровь, моча, ликвор на среды с добавлением 5 мл воды и 0,5 мл сыворотки кролика — среда Терского);
- пассажи на животных;
- серологические иммунологические реакции (РСК, РНГА, РНИФ, РМА, ИФА и другие);
- ПЦР диагностика;
- микроскопия в тёмном поле (материал — кровь, ликвор, моча);
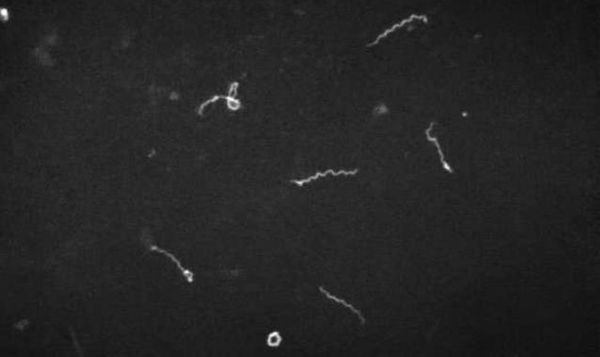
- биопсия икроножных мышц с последующим серебрением биоптата;
- ЭКГ (диффузные поражения). [2][4]
Лечение лептоспироза
Место лечения — инфекционное отделение больницы, отделение реанимации и интенсивной терапии (ОРИТ).
Режим и диета
Режим — палатный, постельный. Диета № 7 или № 2 по Певзнеру (с ограниченим Na+ и контролем жидкости).
Медикаментозное лечение
В виду выраженной аллергизации, полиорганного характера патологии незамедлительно показано введение стандартных доз глюкокортикоидов и последующая незамедлительная антибиотикотерапия (наиболее эффективна в первые трое суток заболевания). Могут быть применены препараты пенициллина, тетрациклиновая группа, фторхинолоны. Этиотропное лечение вначале должно проводиться под непрерывным контролем медицинского персонала, так как возможно развитие реакции Яриша — Герксгеймера (массивный бактериолизис и, как следствие, инфекционно-токсический шок).
При отсутствии антибиотиков возможно введение специфического гамма-глобулина на фоне десенсибилизации.
Патогенетически обосновано назначение глюкокортикостероидов, переливание плазмы, гепаринотерапия (при развитии ДВС-синдрома), сердечных гликозидов, вазопрессоров, гипербарической оксигенации, мочегонных энтеросорбентов. При ухудшении состояния больной переводится в ОРИТ, проводиться перитонеальный диализ.
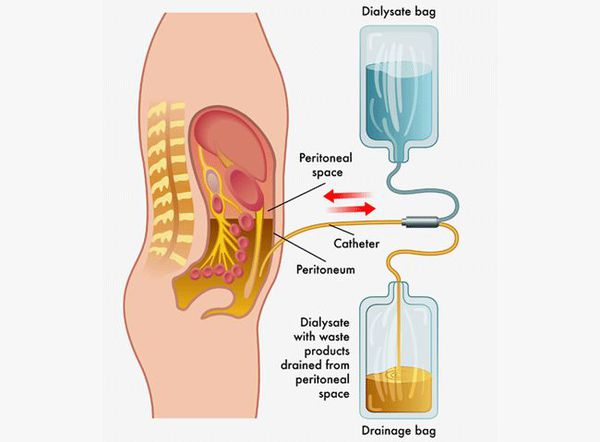
Детоксикация при лептоспирозе
Детоксикация проводится при тяжёлом течении болезни.
К детоксикации относятся:
- перитонеальный диализ — удаление токсинов, воды и электролитов через брюшину;
- гемофильтрация — метод очищения крови с помощью фильтрации через искусственные высокопроницаемые мембраны с одновременным замещением удаляемого фильтрата специальным раствором ;
- гемодиализ — кровь пациента поступает в специальный аппарат и проходит через фильтр (диализатор), затем уже очищенная кровь возвращается в организм.
Плазмаферез
Плазмаферез — это удаление части плазмы, содержащей токсины, и замещение её различными растворами, например физиологическим и раствором альбумина. При этом из организма выводятся антитела, антигены, циркулирующие иммунные комплексы, продукты распада тканей и клеток, бактерии и их токсины, медиаторы воспаления и другие вещества. При плазмаферезе пациенту в вену на руке вводится пластиковый катетер, который соединяется системой трубок с плазмофильтром. Внутри плазмофильтра располагаются разные фильтры, насосы, мембраны и центрифуги. После включения программы происходит автоматический забор крови внутрь аппарата, где она разделяется на фракции и очищается, а затем возвращается обратно в организм.
Специфическая сыворотка против лептоспироза
В первые дни болезни могут применяться специфические гамма-глобулины и плазма с высоким содержанием противолептоспирозных антител, однако этот метод слабо распространён.
Выписка из стационара осуществляется после нормализации температуры тела, клинического состояния и лабораторных показателей. За реконвалесцентами осуществляется динамическое наблюдение в течении шести месяцев с периодическими (раз в два месяца) осмотрами врачом-инфекционистом и лабораторным обследованием. [1] [3]
Прогноз. Профилактика
Прогноз при своевременно начатой терапии в случаях средней и лёгкой степени тяжести относительно благоприятный, при развитии тяжёлого течения заболевания и осложнений возможен летальный исход.
Профилактика лептоспироза
Меры профилактики и противоэпидемические мероприятия:
- проведение борьбы с грызунами (дератизация);
- вакцинация восприимчивых домашних животных, спец. работников;
- соблюдение рекомендаций по купанию, использование защитной одежды;
- контроль за объектами централизованного водоснабжения;
- санитарно-гигиеническое просвещение населения. [1][4]
При отдыхе на природе не рекомендуется ходить босиком по влажной почве и купаться в водоёмах, которые могут быть заражены мочой животных. Следует избегать контакта с потенциальными переносчиками болезни (например, лисицами) и не пить сырую воду из водоёмов. Если на коже есть раны, то поездку на природу лучше отложить.
Соблюдение мер предосторожности на рабочем месте: фермеры и работники мясокомбинатов должны своевременно проводить плановую иммунизацию скоту, выявлять и лечить больных животных, использовать спецодежду, бытовые дезинфектанты для уборки, уничтожать грызунов.
Вакцина против лептоспироза
Профилактическая прививка от лептоспироза проводится домашним животным. Людей вакцинируют по эпидемическим показаниям, например при работе на специализированных производствах. Инактивированную вакцину применяют однократно с ревакцинацией через год.
Чернобровый В.Ф. Федоровых Л.П. Довгалюк Т.И. Шибачева Н.Н. Федосеева Е.С. Лебедев С.Е. Гущин Д.Н. Лаврух И.Ф. Листопадов М.С.

Зоонозы все еще имеют место в перечне инфекционных заболеваний человека. Они представляют опасность не только в виде спорандической заболеваемости, но и нередко - эпидемиологических вспышек. Любое появление вспышечной заболеваемости зоонозами среди людей нуждается в изучении особенностей эпидемиологии и клиники этих заболеваний.
Целью настоящей работы было дать сравнительную характеристику больных лептоспирозом и геморрагической лихорадкой с почечным синдромом (ГЛПС).
Под наблюдением находилось 40 больных (20 человек с лептоспирозом и 20 - с ГЛПС). У всех диагноз подтвержден специфическими серологическими методами исследования (ГЛПС в, диагностический титр1:; лептоспироз в диагностический титр 1:).
ГЛПС поражает людей чаще в возрасте старше 30 лет (85%), причем преимущественно мужчин (83%); в этих возрастных группах наибольший процент заболевших приходится на возраст 30 - 50 лет, т.е. трудоспособное население. Причиной этого, по-видимому, является большой процент занятости в сельском хозяйстве, работа на приусадебных участках, посещение леса.
Поступление больных в стационар начиналось в летние месяцы, причем 35% больных ГЛПС поступили в июне-июле и 65% в сентябре, в то время как 95% больных лептоспирозом поступили в сентябре. Догоспитальная диагностика этих болезней была весьма затруднительна, т.к. начальные симптомы напоминают ОРВИ, грипп, энтеровирусную инфекцию, пиелонефрит и т.д., что и находило свое отражение в направлениях в стационар.
Ведущим фактором заражения ГЛПС, равно как и лептоспирозом, является употребление некипяченой воды (50 и 60% соответственно).
Средние сроки пребывания больных в стационаре составили при ГЛПС 19 койко-дней, при лептоспирозе - 20. В целом лептоспирозом болеют несколько дольше, чем ГЛПС, хотя разница несущественна.
Такие симптомы, как лихорадка, слабость, головная боль, снижение аппетита с одинаковой частотой отмечались у всех больных. Специфическими для ГЛПС были следующие симптомы: боли в суставах, нарушение зрения, более учащенное мочеиспускание в полиурическом периоде, увеличение печени, гиперемия кожных покровов, боли в пояснице (нередко с иррадиацией в брюшную полость), экзантема; в это время при лептоспирозе чаще отмечались тошнота, рвота, боли в эпигастрии, жидкий стул, уреженное мочеиспускание, потливость, боли в правом подреберье, боли в мышцах.
Оба этих заболевания, кроме общих симптомов интоксикации, характеризует выраженная органная патология, проявлением которой были не только клинические признаки, но и изменения лабораторных показателей.
Для лептоспироза было более характерно превалирование поражения печени над изменениями в почках, что находило отражение в высоких показателях билирубина и АЛТ по сравнению с нормой. При ГЛПС, наоборот, на фоне умеренно повышенной активности АЛТ, показатели мочевины и креатинина превышали таковые по сравнению с больными лептоспирозом, что отражало более выраженное поражение почек.
При лептоспирозе протенурия встречается в 85% случаев, а средний уровень белка составляет 0,65 г/л, лейкоцитурия встречается в 70%, гематурия - в 35%, гипостенурия наблюдается в 20%, а тенденция к гипостенурии имеется в 40%. У больных ГЛПС протеинурия отмечена в 95% случаев со средним уровнем белка 0,9 г/л, лейкоцитурия наблюдалась в 85% случаев, гематурия - в 30%, гипостенурия в 35%, а тенденция к развитию гипостенурии имелась в 30% случаев.
В общем анализе крови присутствовали изменения, характерные для воспалительного инфекционного процесса, однако при лептоспирозе они были более выражены.
Для оценки эффективности лечения нами были проанализированы лабораторные данные больных ГЛПС и лептоспирозом. Средние значения основных показателей биохимического анализа крови больных пришли в норму, но в 15% случаев наблюдался повышенный уровень мочевины, в 10% - креатинина, в 37% - АЛТ при лептоспирозе, а при ГЛПС в 10% случаев сохранялся повышенный уровень креатинина, в 75% случаев - АЛТ.
Протеинурия при ГЛПС сохранялась при выписке в 30% случаев при среднем уровне белка 0,044г/л, лейкоцитурия в 45% случаев, гипостенурия - в 55%, а тенденция к гипостенурии - в 25% случаев. При лептоспирозе протенурия отмечалась чаще 80% случаев со средним уровнем белка 0,54 г/л, лейкоцитурия в 60% случаев, гематурия - в 10%, гипостенурия - в 55%, а тенденция к гипостенурии - в 15% случаев.
При оценке данных при выписке общего анализа крови больных лептоспирозом выявлено отклонение основных показателей от нормы в 90% случаев, у больных ГЛП - в 78% случаев.
Таким образом, в общем анализе крови и мочи у больных лептоспирозом после проведенного лечения сохраняются более выраженные изменения, чем при ГЛПС, где отмечается превалирующий уровень гиперферментемии.
Приведенные выше данные выявляют различия в клинических симптомах ГЛПС и лептоспироза. При ГЛПС обращает на себя внимание преобладающее поражение почек, в то время как при лептоспирозе отмечается полиорганность поражения. Восстановительный период при лептоспирозе более продолжительный по сравнению с ГЛПС, на что указывают изменения в лабораторных показателях, отражающих состояние почек и печени.
Геморрагические лихорадки - группа острых арбовирусных инфекций, общей чертой которых является вазотропность возбудителя. Объединенные в эту группу болезни патогенетически характеризуются развитием универсального васкулита с последующим поражением различных органов и систем. Для геморрагических лихорадок свойственно развитие выраженной температурной реакции и интоксикации, на фоне которых развивается геморрагический синдром. Геморрагические лихорадки являются природно-очаговыми заболеваниями. Резервуаром вирусов в природе служат различные млекопитающие, в основном грызуны.
К арбовирусным инфекциям, распространенным в России, относится геморрагическая лихорадка с почечным синдромом (ГЛПС).
Введение
В соответствии с характером передачи человеку инфекции выделяют 3 группы геморрагических лихорадок: клещевые, комариные и контагиозные. К настоящему времени описано 16 форм геморрагических лихорадок.
Классификация геморрагических лихорадок
(М.Чумаков, 1977, с дополнениями)
I. Контагиозные геморрагические лихорадки:
1) геморрагическая лихорадка с почечным синдромом;
2) боливийская геморрагическая лихорадка;
3) аргентинская геморрагическая лихорадка;
4) лихорадка Ласа;
5) лихорадка Марбурга;
6) лихорадка Эбола;
7) бразильская лихорадка;
8) венесуэльская лихорадка.
II. Клещевые лихорадки:
1) крымская геморрагическая лихорадка;
2) омская геморрагическая лихорадка;
3) кьясанурского леса болезнь.
III. Комариные лихорадки:
1) лихорадка Денге;
2) желтая лихорадка;
3) лихорадка Чикунгунья;
4) лихорадка долины Рифт;
5) карельская лихорадка.
В России официальной регистрации подлежат три нозологические формы: геморрагическая лихорадка с почечным синдромом, крымская и омская геморрагические лихорадки. Наибольшее распространение в нашей стране имеет ГЛПС, которая регистрируется на 61 из 88 административных территорий. Наиболее активные очаги находятся на Урале и в Поволжье.
Геморрагическая лихорадка с почечным синдромом - это острая арбовирусная природно-очаговая болезнь, протекающая с лихорадкой, интоксикацией, геморрагическим и почечным синдромами.
Этиология
В 1944 г. А.Смородинцев установил вирусную природу ГЛПС. В 1976 г. южнокорейский вирусолог Хо Ван Ли выделил из легочной ткани мышей вирус Hantaan (по названию реки на корейском полуострове). В дальнейшем сходные вирусы выделены в Финляндии, США, России и других странах. Возбудители ГЛПС - сферические РНК-содержащие хантавирусы, d = 85-110 нм. Известно около 20 серотипов хантавирусов, среди них 4 вызывают ГЛПС у человека (семейство: Bunyaviridae; род: Hantavirus; серотипы: Hantaan, Puumala, Dubrava, Seoul).
Вирус Hantaan циркулирует в природных очагах Дальнего Востока России, Кореи, Китая, Японии.
Вирус Puumala обнаружен в европейской части России, Финляндии, Швеции, Франции, Бельгии.
Вирус Dubrava встречается на Балканах.
Вирус Seoul распространен повсеместно.
Интересно отметить, что с 1990 г. в США регистрируется заболевание, вызываемое хантавирусами, в местах обитания оленьих хомячков. Болезнь известна под названием "хантавирусный кардиопульмональный синдром". Основные клинические признаки - лихорадка, пневмония, слабовыраженные геморрагический и почечный синдромы. Летальность достигает 60%. Основная причина смерти - кардиогенный шок. Возбудителем болезни является вирус Каньона Муэрто из семейства Bunyaviridae, рода Hantavirus.
Хантавирусы относительно устойчивы во внешней среде. Длительно сохраняются при низких температурах. Быстро инактивируются при t > 370C и pH < 5,0.
Эпидемиология
ГЛПС - типичный зооноз.
Источник инфекции - около 80 видов млекопитающих, в основном мышевидные грызуны, которые обычно переносят инфекцию в латентной форме. При этом они выделяют вирус с мочой и фекалиями во внешнюю среду. Передача инфекции от грызуна грызуну осуществляется гамазовыми клещами, блохами. Очаги инфекции локализуются в долинах рек; на берегах озер; в зонах смешанных и таежных лесов, перемежающихся с вырубками и болотами. Основные резервуары инфекции на Дальнем Востоке: полевая мышь, рыжая полевка, лесная азиатская мышь, в Сибири - сибирский лемех, рыжая полевка, в Европейской части России - рыжая полевка.
Пути передачи инфекции: воздушно-пылевой (основной), контактный, алиментарный. У здоровых лиц далее ротовой полости вирус не должен распространяться, так как возбудитель инактивируется при pH < 5. Алиментарный путь заражения возможен у лиц со сниженной кислотностью желудочного сока (хронический анацидный гастрит, хронический алкоголизм и др.).
Восприимчивы к ГЛПС люди любого возраста, но чаще болеют мужчины 20-50 лет. Горожане в последние годы составляют 50-70% среди заболевших. Заражение часто происходит при посещении леса, работе на садово-огородном участке. К группе риска относятся лесозаготовители, охотники, геологи.
Характерна летне-осенняя сезонность. Более половины случаев регистрируется с июня по декабрь. Многолетними наблюдениями установлена 3-4-летняя цикличность эпидемического процесса. Это связано с репродукцией грызунов и развитием среди них эпизоотий (рис.1).
Распространенность инфекции на территории Российской Федерации определяется климатогеографическими зонами (хвойные и лиственные леса). Наибольшее число случаев ГЛПС регистрируется в зоне широколиственных лесов Поволжья и Урала. Локализованные в них природные очаги инфекции характеризуются наиболее высоким уровнем инфицированности населения к хантавирусам (от 4 до 12%). Более низкий уровень естественного иммунитета (2-4%) выявляется на территориях, занятых сосновыми и дубово-липовыми лесами. К таким областям относятся Московская, Тверская, Ярославская и другие. Минимальные показатели иммунной прослойки зафиксированы в зоне лесостепей с березовыми и осиновыми лесами (Восточная Сибирь), что объясняется ее крайне скудным кормовым материалом для грызунов, являющихся природным резервуаром хантавирусов.
Патогенез
Основными входными воротами инфекции является легочная ткань. Цитопатическим действием вирусы не обладают. Затем вирусы выходят в кровяное русло, развивается вирусемия, что клинически проявляется общетоксическими явлениями и лихорадкой.
Вирусы тропны к эндотелию сосудов. Наблюдается системное поражение артериол, капилляров, венул с развитием воспалительных и деструктивно-некробиотических процессов во всех оболочках сосудов (см. схему). Кроме прямого деструктивного действия на стенку сосудов, вирусы вызывают повышение активности гиалуронидазы с деполяризацией основного вещества сосудистой стенки, что является одной из важных причин повышения проницаемости сосудов. Вирусы оказывают влияние и на обмен серотонина, вызывая значительное уменьшение его концентрации в крови. Это сопровождается расслаблением гладкой мускулатуры периферических сосудов и, следовательно, снижением артериального давления. Низкое содержание серотонина в крови больных сочетается с высоким уровнем гистамина. Это усиливает депрессорный эффект серотонина. Высвобождение гистамина способствует также повышению проницаемости сосудов. В результате повреждения сосудистой стенки развивается плазморея, уменьшается объем циркулирующей крови, повышается ее вязкость, что приводит к тромбообразованию. Повышение капиллярной проницаемости в сочетании с ДВС-синдромом ведет к геморрагическому синдрому.
Наибольшие изменения развиваются в почках, надпочечниках и гипофизе, где обнаруживаются отечно-деструктивные процессы в сосудах всех калибров. Наблюдаются кровоизлияния и очаги некроза вокруг тромбированных мелких сосудов в гипоталамусе и гипофизе. Поражение сосудов диэнцефальной области проявляется гипофизарно-ренальным синдромом. В почках происходит сдавление отеком канальцев и собирательных трубочек, - развивается десквамативный нефроз.
В патогенезе кровоточивости играет роль и резкое угнетение фибринолиза. Повышение уровня антифибринолизинов в крови обусловлено как возбуждением парасимпатической нервной системы, так и относительным увеличением эритроцитов в результате сгущения крови. Известно, что эритроциты, как интактные, так особенно и разрушенные выделяют антифибринолизины.
Итак, морфологическая основа патологического действия вирусов при ГЛПС - это поражение стенки мелких сосудов, снижение их тонуса, повышение проницаемости, вследствие чего развивается серозно-геморрагический отек межуточной ткани в различных органах и тканях.
Клиника
В олигурический период геморрагический синдром достигает максимальных проявлений. Отмечаются носовые кровотечения и образования гематом в местах инъекций. Петехиальная сыпь чаще появляется в подмышечных областях, верхней части груди, в тяжелых случаях - на нижних конечностях. Следует отметить, что, несмотря на снижение температуры тела, в период разгара состояние больных ухудшается. Появляются или усиливаются боли в пояснице и животе, снижается диурез. Однако отеки не развиваются. Может быть гепатомегалия.
С 10-12-го дня болезни в большинстве случаев развивается полиурический период. Суточный диурез может достигать 5-6 л. Выявляется гипоизостенурия.
Период реконвалесценции начинается с 20-22-го дня болезни и продолжается в среднем 6 месяцев. Общее состояние больных улучшается, диурез нормализуется. При легкой степени тяжести заболевания трудоспособность восстанавливается через месяц, среднетяжелой - через 6 месяцев, тяжелой - астенизация может отмечаться в течение всей жизни.
Критерий тяжести болезни - выраженность интоксикационного, геморрагического, почечного синдромов.
Легкая степень: температура повышается до 380С в течение 3-4 дней, характерны умеренная головная боль, кратковременные нарушения зрения, единичные геморрагии, тромбоцитопения не ниже 150х109/л, снижение диуреза до 700 мл, протеинурия до 1 г/л, мочевина повышена до 10 ммоль/л, креатинин - до 0,2 ммоль/л.
Среднетяжелая степень: лихорадка (39-400С) в течение 5-6 дней, выраженная головная боль, нечастая рвота, возможны признаки инфекционно-токсического шока 1-й степени, множественные геморрагии на слизистых и коже, олигурия до 4-5 дней, протеинурия - 1-3 г/л, мочевина - 10-15 ммоль/л, креатинин - 0,2-0,7 ммоль/л.
Тяжелая степень: высокая лихорадка в течение 7 дней и более, отмечаются интенсивная головная боль, частая рвота, шок 2-3-й степени, множественные кровоизлияния и кровотечения, тромбоцитопения - менее 100х109/л, мочевина крови - более 15 ммоль/л, креатинин - свыше 0,7 ммоль/л.
Клинические особенности заболевания в зависимости от возбудителя
Западный вариант хантавируса (Puumala) вызывает относительно доброкачественное течение болезни. Тяжелые формы не превышают 10%. Геморрагический синдром и олигоанурия выявляются примерно у 1/3 заболевших. Летальность - около 1%. Вирус Puumala преимущественно распространен в Европейской части России.
Заболевание, вызываемое восточным вариантом вируса (Hantaan) характеризуется развитием тяжелых форм болезни в 40% случаев, развитием у большинства больных геморрагического синдрома и острой почечной недостаточности с летальностью до 8%. Вирус Hantaan встречается в основном в сельских районах Дальнего Востока и обусловливает развитие более тяжелых форм болезни по сравнению с Puumala.
Серотип Seoul вызывает патологический процесс, характеризующийся ацикличностью, атипизмом, преобладанием легких (до 40%) и среднетяжелых форм, развитием респираторного синдрома и гепатита у большинства больных. Данный вариант хантавируса чаще выявляется у горожан Дальнего Востока.
Диагностика
При диагностике ГЛПС необходимо учитывать следующее:
1. Эпиданамнез: возможность контакта с грызунами в течение месяца (посещение леса, работа в саду и т.д.).
2. Клинические данные: острое начало. Высокая температура в течение недели, гиперемия кожи лица и шеи, геморрагический синдром. Появление симптомов острой почечной недостаточности на фоне снижения температуры тела.
3. Общеклинические лабораторные данные:
а) общий анализ крови - лейкопения (лихорадочный период) с последующим нейтрофильным лейкоцитозом, тромбоцитопенией и появлением плазматических клеток (олигурический период);
б) общий анализ мочи - преходящая протеинурия, стойкая гипоизостенурия.
4. Серологические исследования: РНИФ, РИА, РПГА в парных сыворотках.
Антитела появляются в конце 1-й недели заболевания, достигают максимальных концентраций к концу 2-й недели и циркулируют в крови в течение 5-7 лет и более.
Дифференциальная диагностика
Наиболее часто ГЛПС приходится дифференцировать с лептоспирозом, гриппом и другими ОРВИ, энтеровирусной инфекцией, клещевым энцефалитом, острым пиелонефритом, острым гломерулонефритом, геморрагическим васкулитом.
ГЛПС и лептоспироз являются природно-очаговыми заболеваниями. Проведение дифференциального диагноза между этими двумя нозологиями нередко представляет большие трудности. Общие признаки: сходный эпиданамнез, острое начало с озноба и гипертермии, гиперемия кожи лица и шеи, миалгии, боли в пояснице, почечный и геморрагический синдромы. Однако при ГЛПС почечная патология развивается при снижении температуры тела на 4-7-й дни болезни. При лептоспирозе симптомы поражения почек появляются с первых дней болезни. При ГЛПС по мере нарастания диуреза относительная плотность мочи снижается до 1002-1004 и остается на этих цифрах длительное время, что нетипично для лептоспироза. При ГЛПС сыпь геморрагическая, при лептоспирозе возможно развитие не только петехиальной, но и точечной, розеолезной, эритематозной экзантемы. Для ГЛПС в отличие от лептоспироза не характерно развитие желтухи. При ГЛПС имеет место двухфазное изменение общего анализа крови, при лептоспирозе на протяжении всего заболевания выявляется нейтрофильный лейкоцитоз.
Клинический пример ГЛПС с первоначальным диагнозом ОРВИ.
Больной Б., 49 лет (житель Кирово-Чепецка), заболел остро. Температура повысилась до 380С, появились боли в горле, сухой кашель, головная боль. Вызвал участкового врача, который поставил диагноз "ОРВИ". Больной получал симптоматическое лечение. На 6-й день болезни состояние пациента ухудшилось: t 390С, тошнота, двукратная рвота, сильная головная боль, судорожная готовность, гиперемия слизистых оболочек мягкого нёба и дужек. С диагнозом "ОРВИ, тяжелая форма" больной госпитализируется в инфекционное отделение центральной районной больницы. На 9-й день болезни температура тела снижается, но состояние больного остается тяжелым. Выявляется положительный симптом поколачивания в поясничной области с обеих сторон, олигурия. Присоединяются рвота, судороги. Ставится диагноз "ГЛПС, олигурический период, тяжелая форма". Осложнение: отек мозга. Проводится интенсивная терапия, однако на 10-й день болезни пациент умирает. Диагноз ГЛПС подтвержден серологически (РНИФ) на 9-й день болезни.
Следует обратить внимание на следующие ошибки, допущенные при ведении больного: 1) не было настороженности врачей в отношении ГЛПС, 2) ни участковым терапевтом, ни врачом стационара не собран эпиданамнез (за 25 дней до заболевания пациент ездил в лес за грибами), 3) неполный осмотр больного участковым врачом (в амбулаторной карте кожные покровы не описаны, живот и область почек не осмотрены), 4) плохое знание врачом поликлиники и ординатором районной больницы симптомов отека мозга, которые появились на 6-й день болезни: сильная головная боль, тошнота, рвота, судорожная готовность.
Таким образом, поздняя госпитализация, несмотря на раннее обращение больного за медицинской помощью (1-й день болезни), привела к поздней адекватной терапии, развитию осложнения (отек головного мозга) и летальному исходу на 10-й день болезни.
Клинический пример, демонстрирующий необходимость проведения дифференциального диагноза ГЛПС с острым пиелонефритом, паранефритом.
В данном случае причинами летального исхода следует считать позднее обращение больного, развитие тяжелой формы с первых дней болезни, отсутствие адекватного лечения в первые 10 дней заболевания.
Лечение
Все больные подлежат госпитализации. Постельный режим назначается на периоды лихорадки и олигурии. Показан стол № 4. В олигурический период ограничиваются мясные и рыбные блюда.
Этиотропная терапия.
1. Рибамидил 0,2 г per os 4 раза в сутки в течение первых 5 дней болезни. Рибавирин ингибирует синтез нуклеиновых кислот, избирательно накапливаясь в печени и почках.
2. Человеческий иммуноглобулин против ГЛПС: 6-3-3 мл в/м в течение 3 дней.
3. Препараты альфа-интерферона для парентерального (реаферон 2-3 млн МЕ/сут п/к в течение 5 дней) и ректального (виферон 1 млн МЕ per rectum 2 раза в сутки в течение 5 дней) применения.
4. Индукторы интерферона:
амиксин - 0,125 г/сут per os в течение 5 суток,
йодантипирин - 0,2 г per os 3 раза в день в течение 5 суток.
Этиотропная терапия наиболее эффективна в первые 5 дней заболевания. Она показана при среднетяжелой и тяжелой форме болезни.
Патогенетическая терапия.
1. Дезинтоксикационная терапия осуществляется введением 5-10% раствора глюкозы, полиионных растворов, коллоидов. Необходимо избегать чрезмерной регидратации. Объем вводимой жидкости не должен превышать количество суточной мочи более чем на 500 мл.
2. Нормализация проницаемости сосудистой стенки: перорально или внутривенно назначают аскорбиновую кислоту, препараты кальция, дицинон и др.
3. Улучшение микроциркуляции и почечного кровотока достигается введением внутривенно эуфиллина, внутримышечно дипиридамола, папаверина и т.д.
4. Лечение ДВС-синдрома: гепарин, свежезамороженная плазма.
5. Обязательно проводится десенсибилизирующая терапия: дифенгидрамин, клемастин, прометазин и др.
6. Мочегонные средства: осмотические диуретики, салуретики (при наличии ответного диуреза).
7. Коррекция водно-электролитного баланса и кислотно-основного состояния.
Симптоматическая терапия включает в себя в основном мероприятия, направленные на купирование болевого синдрома, рвоты, бессонницы, нарушения деятельности сердечно-сосудистой системы.
Если для лечения легких форм достаточно назначения постельного режима на 7-10 дней, пероральной дезинтоксикации (регидрон, оралит и др. до 1,5 л/сут), аскорутина, клемастина, то при тяжелых формах необходима интенсивная терапия ДВС-синдрома, острой почечной недостаточности. Показаниями для проведения экстракорпорального гемодиализа являются: анурия в течение суток, калий крови > 6,0 ммоль/л, мочевина > 30 ммоль/л, креатинин > 0,7 ммоль/л.
Исходы
2. Резидуальные явления (наблюдаются в течение 6 месяцев у 50-80% реконвалесцентов):
а) постинфекционная астения;
б) почечные проявления (боли в пояснице, полиурия, пастозность лица, гипертония, сухость во рту);
в) поражения нервной и эндокринной системы (моно-, полиневриты, гипофизарная недостаточность);
г) постинфекционная кардиомиопатия (слабость, одышка, боли в сердце, тахикардия, глухость тонов, изменения на ЭКГ - снижение вольтажа, расщепление комплекса QRS).
Отдаленным последствием ГЛПС у больных, перенесших тяжелую форму болезни, может быть развитие хронического пиелонефрита.
Диспансеризация
Диспансерное наблюдение проводится в течение года. Ежеквартально осуществляется клиническое наблюдение с функционально-морфологическим исследованием почек (общий анализ мочи, анализ мочи по Нечипоренко), осмотром окулиста, нефролога.
Читайте также:

